
中国临床肿瘤学会非小细胞肺癌专业委员会. 肺癌骨转移临床诊疗路径专家共识(2025版)[J]. 中华肿瘤杂志, 2025, 47(12): 1152-1165. DOI: 10.3760/cma.j.cn112152-20250623-00286
肺癌骨转移是晚期肺癌患者常见的并发症之一,可导致病理性骨折、脊髓压迫、骨手术和骨放疗等骨相关事件,严重影响患者的生活质量和预后。中国临床肿瘤学会非小细胞肺癌专业委员会组织呼吸科、肿瘤科、骨科、放疗、核医学科、影像科及口腔颌面外科医师,结合国内外循证医学证据及临床实践经验,反复磋商和充分讨论制定,从肺癌骨转移筛查、诊断、治疗策略、骨靶向药物治疗策略及不良反应管理、局部治疗、疗效评估等6个角度提出了9条共识建议,供相关医务人员参考使用。共识的制定将为临床医师提供科学、实用的诊疗参考,以期改善患者的生存质量和预后。
【关键词】 肺肿瘤;骨转移;筛查;诊断;治疗;诊疗路径;专家共识
骨骼是肺癌远处转移主要部位之一,骨转移发生率约30%~40%。随着晚期肺癌患者生存时间的延长,骨转移发生风险亦随之增高。肺癌骨转移的常见部位包括脊柱、骨盆、肋骨和四肢长骨。其中,脊柱是最易受累的部位,约有40%~50%的骨转移发生在脊柱,导致脊髓压迫、神经损伤的风险显著增加。晚期肺癌患者一旦发生骨转移可导致病理性骨折、脊髓压迫、骨手术和骨放疗等骨相关事件(skeletal related events, SREs),严重影响患者的生活质量和预后。为进一步规范肺癌骨转移的诊疗流程,改善患者预后,中国临床肿瘤学会非小细胞肺癌专业委员会组织多学科专家,结合国内外循证医学证据及临床实践经验,经过反复磋商和充分讨论,形成本临床诊疗路径专家共识,旨在为各级临床医师提供兼顾科学性、实用性与普适性的诊疗参考。
本共识由中国临床肿瘤学会非小细胞肺癌专委会发起和组织撰写,参加共识制定的专家组成员包括呼吸科、肿瘤科、骨科、放疗、核医学科、影像科及口腔颌面等多学科专家。通过专家组组长与执笔作者讨论汇总肺癌骨转移诊疗临床实践中面临的重要问题,进行全面的文献检索并梳理已发表的临床研究证据,专家组成员对共识内容经过充分讨论以及对关键问题进行投票,汇总专家意见及投票结果,最终形成共识推荐内容。
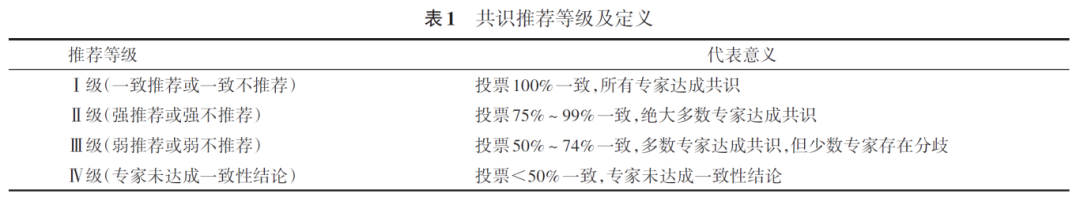
本共识的文献检索数据库包括Pubmed、Web of Science、中国知网、万方数据知识服务平台中英文数据库,英文检索词包括“lung cancer”“bone metastasis”“diagnosis”“treatment”;中文检索词以“肺癌”“骨转移”“诊断”“治疗”为主。检索时间段为建库至2025年2月10日。本共识根据专家组投票的一致性将推荐等级分为Ⅰ~Ⅳ级,推荐等级见表1。
1. 生存预后: 骨转移会引起SREs,包括病理性骨折、脊髓压迫、骨手术和骨放疗,严重影响患者的生活质量,与较差的生存预后相关,尤其当患者出现承重骨病理性骨折、高钙血症或脊髓压迫等严重并发症时,造成患者活动能力受限或因承重骨(如脊柱、股骨等)病理性骨折导致长期卧床,增加坠积性肺炎、肺部感染、深静脉血栓和肺栓塞风险,最终导致患者死亡加速。晚期肺癌患者一旦发生骨转移显著影响患者生存。国内一项大型回顾性流行病学调查研究发现,肺癌骨转移患者中位生存时间仅为11.53个月,1、2和5年的生存率分别为51%、17%和8%。因此,在肺癌初诊时及治疗随访期应全程关注骨转移筛查,以期早发现早治疗,从而改善患者生活质量和延长生存时间。
2. 发病机制: 恶性肿瘤骨转移按病变特征可分为溶骨性、成骨性和混合性。肺癌的骨转移大部分为溶骨性,属于发生SREs风险较高的骨转移类型。其发生机制中,RANK与RANKL信号通路起重要作用,肿瘤细胞分泌甲状旁腺激素相关肽,促进成骨细胞表达过量RANKL,与破骨细胞前体细胞上的受体RANK结合,激活破骨细胞的分化、成熟和活化,促进骨质破坏和溶解;骨质溶解释放出促进肿瘤生长的因子,形成恶性循环。即使是成骨性骨转移,也存在RANK-RANKL通路的过度活跃,且成骨性骨转移形成的病理性成骨结构紊乱、力学性能差,仍有发生SREs的风险,也需要进行积极的骨靶向药物治疗。
肺癌骨转移的诊断对准确分期和指导治疗至关重要。肺癌发病隐匿,确诊时往往已进展至晚期,肺癌患者出现骨转移的平均时间为9个月,因此需要密切关注肺癌患者的骨转移风险,尽早筛查骨转移,及时启用骨靶向药物治疗,从而延迟或降低SREs的发生,提高患者的预后生存。
(一)影像学诊断
1. 放射性核素骨显像(emission computed tomography , ECT ): ECT通常被称为骨扫描,原理是利用示踪剂如锝标记的亚甲基二膦酸盐[technetium( 99m Tc) methylene diphosphonate, 99m Tc-MDP]在成骨细胞活性增加的部位蓄积的特性,反映骨代谢变化,进而提示肺癌骨转移的早期存在,特别是对发现成骨性转移具有独特的优势,具有灵敏度高、全身成像不易漏诊的优点。由于除骨转移瘤之外的其他骨病变也可出现核素浓聚,呈现假阳性结果,因此ECT诊断骨转移的特异度较低,推荐其作为肺癌骨转移的优选初筛检测,特别是有骨转移高危因素的人群(如骨痛、高钙血症、高碱性磷酸酶、脊髓压迫症状、病理性骨折等)。在确诊肺癌时的分期检查建议包含ECT,之后每年行至少1次骨扫描监测,动态对比对于临床决策具有重要意义。
单光子发射计算机断层成像术(single-photon emission computed tomography, SPECT)/CT技术将SPECT的功能代谢显像和CT的形态解剖显像融合互补,在对病灶进行准确定位的同时对骨折、炎性病变等容易造成SPECT检查假阳性的病变进行鉴别,减少假阳性;同时还能检出低放射性浓聚骨转移病灶,减少假阴性,提升了检查的准确性,SPECT/CT是对常规骨扫描的有效补充。
2. X 线: X线检查由于空间分辨率高、操作简单、费用低廉、辐射较小、有一定特异性,临床上常用于骨痛患者的初步影像学检查。骨病灶在X线摄影上可能表现为低骨密度或无骨密度区(骨溶解),骨小梁结构破坏或缺失,或者硬化性病变或边缘。一般认为骨质破坏须达到一定程度(骨密度降低30%~75%),才能在X线片上出现明显病变,因此X线平片相比ECT,对早期骨转移瘤的诊断往往特异度较高而灵敏度较低,在骨髓内转移未累及骨皮质时,易被高密度皮质掩盖而漏诊,因此常比ECT显示骨转移灶晚3~6个月,大多用于对有临床症状的部位或其他影像学检查发现的异常进行补充评估,或作为随访的基本手段。
3. CT : CT在检测骨转移瘤方面,相较于传统的X线平片,具有更高的灵敏度,实现骨皮质的高分辨率显像,对骨质破坏及其周围软组织肿块的识别更精准。通过调整CT窗宽和窗位,可以优化不同组织结构的显像效果。一般可分为肺窗、软组织窗(也称纵隔窗)和骨窗。骨窗是用于观察骨病灶最佳的CT窗,而肺窗和软组织窗不能用于检查骨病灶。胸部CT常规的肺窗和纵隔窗很难发现骨转移瘤,特别是骨转移早期、肋骨轻度破坏、无软组织肿块时更易漏诊。CT骨窗能清晰显示骨质破坏(溶骨性病变)、骨质形成(成骨性病变)及骨小梁改变,特别适用于早期发现微小病灶及评估骨质结构的损伤程度。而增强CT则进一步有助于展示骨转移瘤的血供特征,以及病变与周围神经、血管结构的关系。对于全身骨显像检查结果阳性但X线平片未能发现异常、有局部症状、疑似骨转移或存在MRI检查禁忌的患者,CT检查显得尤为有价值。
4. MRI : MRI对于骨转移的诊断有较高的灵敏度,但特异度不高,能通过多平面、多序列成像观察,更准确地显示转移侵犯部位、范围以及周围软组织侵犯及脊髓压迫情况;增强MRI通过造影剂在血管和组织中的分布差异增强病变对比度,可更好地动态观察病灶的血供特点(如早期强化、延迟强化),有利于判断肿瘤活性。MRI敏感性优于全身骨显像,尤其是对骨髓腔内的早期转移灶而言,是评价骨转移骨髓内浸润的首选检查方式。近年来,全身MRI扫描技术可弥补常规MRI扫描范围局限的不足,其诊断骨转移的灵敏度同正电子发射计算机断层扫描(positron emission tomography-computed tomography, PET-CT)。
5. PET -CT 和PET -MRI : PET-CT对于骨转移的灵敏度(62%~100%)、特异度(96%~100%)高, 18 F-脱氧葡萄糖( 18 F-fluorodeoxy glucose, 18 F-FDG) PET-CT对于溶骨性转移及骨髓转移最为敏感,不仅可检测骨转移灶,还可用于肺癌全身分期与治疗评估,是目前肺癌骨转移临床诊疗中应用最广的PET成像方式,其缺点是价格相对昂贵。 18 F-氟化钠 PET-CT 对成骨性病灶更敏感,但其显像剂制备复杂、成本高昂,国内普及率有限,因此不推荐作为常规检查手段,主要适用于疑难病例的鉴别诊断或临床研究场景。
新型融合型显像设备PET-MRI集成了PET及多参数MRI的多重优势,相比PET-CT可发现更早、更小、更多的骨转移病灶,但价格昂贵、临床普及性差,临床应用效价比有待进一步观察。
(二)病理学检查
绝大多数有明确肺癌病史伴有典型的骨转移影像学表现的患者可直接诊断为骨转移。骨活检仍是诊断骨转移的金标准,以下情形应考虑行骨活检:(1)以骨科症状为首发表现,肺内病灶不易取材;(2)肺癌诊断明确,但仅出现孤立性骨破坏病灶,应积极进行活检,因为15%~18%的新发骨病变可能是其他新发肿瘤或非肿瘤病变;(3)骨病变的确诊对治疗策略的制定有决定性影响;(4)由于肿瘤异质性,有时仍需活检明确组织及分子病理,以指导个体化治疗。
骨活检注意事项:穿刺活检前应尽量行增强CT或MRI扫描,避开坏死区域取材、且尽可能选取溶骨性区域取材,以满足常规病理及分子病理学诊断的要求;有条件推荐使用SPECT/CT或PET-CT引导定位,可结合代谢与结构信息,提高靶点选择的准确性及活检成功率。为了明确诊断的骨活检应在任何治疗前进行;通常情况下,穿刺活检不会引起病理性骨折事件的发生;骨转移病灶的活检应遵循肌肉骨骼系统肿瘤活检取材的原则。
(三)骨代谢生物标志物
骨代谢生物标志物可反映骨转移过程中骨吸收和形成的速度,提示骨破坏和修复程度,是潜在可用于诊断及监控疾病病情的新技术,相关研究对生物标志物的临床应用仍在探索阶段。反映骨吸收的生物标志物包括Ⅰ型胶原交联N-末端肽(type Ⅰ collagen amino-terminal peptide, NTX)、Ⅰ型胶原交联C-末端肽(type I collagen carboxy-terminal peptide,CTX)、抗酒石酸酸性磷酸酶等;反映骨形成的生物标志物包括骨特异性碱性磷酸酶(bone specific alkaline phosphatase, BALP)、Ⅰ型前胶原羧基末端肽、I型前胶原氨基末端肽等。目前临床认可的骨代谢生物标志物包括NTX、CTX和BALP等。
(四)诊断流程
肺癌初诊时需要筛查骨转移以明确分期,随访期间当肺癌患者合并骨转移高危因素或肿瘤疾病进展时,应及时进行ECT筛查。如ECT阳性,则推荐行CT、MRI、PET-CT或骨活检进一步明确骨转移的诊断;如ECT阴性,建议根据是否出现骨转移高危因素进行合理的筛查及诊断,其中生化指标高危因素包括碱性磷酸酶升高、未发现病灶进展但肿瘤标志物持续升高及高钙血症;临床症状高危因素包括骨痛、脊髓压迫及病理性骨折等。骨转移诊断流程见图1。
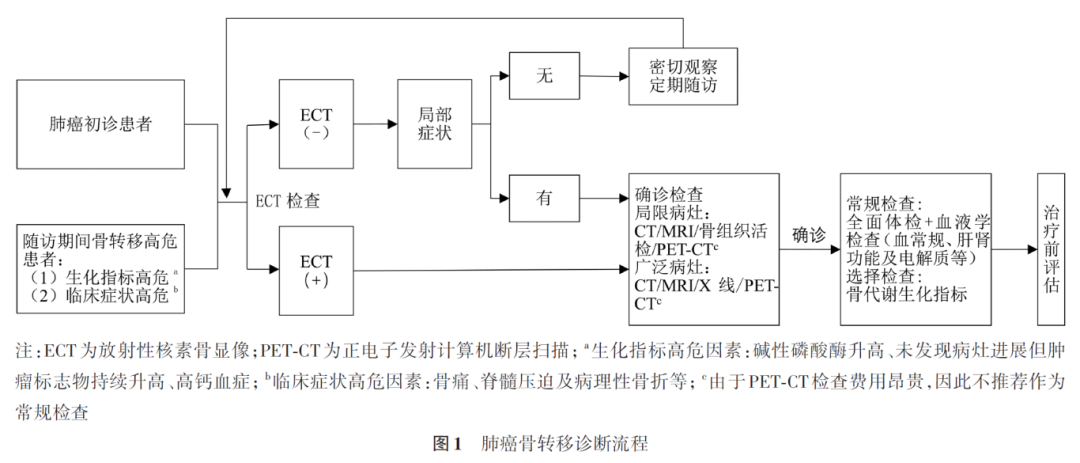
肺癌患者随访期间如出现骨转移相关临床症状高危因素,建议及时进行骨转移筛查及诊断;如患者出现骨转移生化指标高危因素,建议每2个月复查指标,如连续2次升高,建议及时进行骨转移筛查及诊断。如未发现骨转移高危因素则每12个月进行1次ECT筛查( 推荐等级:Ⅱ级 )。
影像学检查是发现和诊断骨转移的主要方法,结合肺癌病史和骨转移的典型影像学表现,可明确诊断肺癌骨转移。ECT主要用于筛查,有一定的假阳性率。X线检查灵敏度低,可辅助诊断骨转移。CT是骨转移诊断的重要方法,推荐结合骨窗发现和诊断骨转移病灶。MRI适用于观察骨转移的软组织浸润、脊髓受累以及骨髓内浸润,通过调整不同参数可更早期发现骨转移灶。PET-CT诊断骨转移的灵敏度和特异度较高,但价格昂贵。骨活检主要用于孤立骨破坏病灶的取材和明确诊断( 推荐等级:Ⅰ级 )。
(一)治疗原则
由于绝大多数肺癌骨转移患者处于肺癌晚期,常多发骨转移灶,肺癌骨转移的治疗应遵循多学科综合治疗(multi-disciplinary treatment, MDT)模式制定个体化方案,由呼吸/肿瘤内科、骨科、放疗、核医学科、影像科等多个学科领域协同参与。推荐以肺癌的全身治疗为主,同时联合双膦酸盐或地舒单抗等骨靶向药物(同时检测血钙,及时补充钙剂及维生素D),对于可能发生SREs的病灶尽早给予局部放疗或者手术干预,通过积极的骨转移治疗,缓解症状,控制或修复骨病灶,延缓或减少SREs的发生,从而改善患者的生活质量,最终延长患者生存期,必要时还应进行心理干预。
(二)骨靶向药物
肺癌骨转移确诊后无论是否有症状应立即进行骨靶向药物治疗,临床常用的骨靶向药物为双膦酸盐类和地舒单抗。
1. 双膦酸盐
双膦酸盐通过抑制破骨细胞的活性,减少骨吸收,降低骨转移引起的骨质破坏。它们通过抑制法尼醇焦磷酸合酶影响破骨细胞的存活,从而防止骨质流失。有研究显示,唑来膦酸可延迟晚期实体瘤骨转移包括肺癌骨转移患者SREs的发生并降低SREs发生风险。即使在应用双膦酸盐治疗过程中发生SREs,仍建议继续用药,如在用药过程中出现明确与双膦酸盐治疗相关的严重不良反应或临床医师认为继续用药患者不能获益时,应考虑换用另一类骨靶向药物。同时,双膦酸盐可增加患者肾功能负担,虽然大多数均为轻症,但在应用前应综合评估患者肾功能,对于肾功能重度不全患者应减量或延长输注时间。
2. 地舒单抗
地舒单抗是一种人IgG2单克隆抗体,通过靶向结合RANKL,抑制破骨细胞的形成、功能和存活,给药方式为皮下注射。IgG2亚型的单克隆抗体引起的抗体依赖性细胞介导的细胞毒作用、补体依赖的细胞毒性效应较少。地舒单抗不经过肾脏代谢及排泄,不增加患者的肾功能损害。肾功能受损程度对地舒单抗的药代动力学和药效学无影响。
在地舒单抗Ⅲ期临床244研究中,纳入实体瘤(除乳腺癌和前列腺癌)与多发性骨髓瘤的骨转移患者,在接受常规抗肿瘤治疗的基础上,比较地舒单抗与唑来膦酸预防SREs的疗效。244研究的实体瘤亚组( n =1597,其中肺癌患者811例)分析结果显示,地舒单抗组较唑来膦酸组首次发生SREs的时间显著延迟6个月(21.4和15.4个月),多次SREs发生风险相较于使用唑来膦酸减少了15%( HR =0.85,95% CI :0.72~1.00, P =0.048)。在针对肺癌(包含小细胞肺癌与非小细胞肺癌)的亚组分析结果中,地舒单抗组患者较唑来膦酸组总生存时间显著延长1.2个月(8.9和7.7个月, HR =0.80,95% CI :0.67~0.95, P =0.01)。
上述研究中的两组患者虽然总体不良事件发生率差异无统计学意义,但在某些不良反应的发生率上存在差异。其中,急性期反应,地舒单抗组和唑来膦酸组发生率分别为7%和15%;肾脏相关的不良事件,地舒单抗组和唑来膦酸组发生率分别为7%和10%;3级或4级低钙血症,地舒单抗组和唑来膦酸组发生率分别为4%和2%,其中多数患者无症状。截止至首次数据分析日期,地舒单抗组和唑来膦酸组分别有6例(0.8%)患者和9例(1.1%)患者出现颌骨坏死,差异无统计学意义( P =0.45)。
确诊肺癌骨转移患者,建议MDT模式以个体化制定综合治疗方案。推荐在治疗肺癌原发肿瘤基础上,同时联合骨靶向药物治疗。骨靶向药物主要有双膦酸盐和地舒单抗。地舒单抗相比双膦酸盐不良反应低,对肾功能无不良影响,注射便捷,可明显延迟SREs的发生( 推荐等级:Ⅰ级 )。
3. 骨靶向药物规范使用
(1 )治疗时机: 对于确诊的肺癌骨转移患者,早期使用骨靶向药物治疗是关键。一项美国回顾性研究纳入1423例使用骨靶向药物的肺癌骨转移患者,根据确诊后开始骨靶向药物治疗的时间分组,确诊后立刻开始骨靶向药物治疗相比延迟治疗(≥60 d)可以显著降低患者骨折风险( P =0.0017)。另一项中国骨转移性疾病临床特征和治疗的多中心回顾性流行病学调查中,纳入诊断为实体瘤合并骨转移且已接受双膦酸盐治疗的多癌种骨转移共2994例患者,使用回顾性问卷收集患者的临床数据,以及有关骨转移诊断和管理的信息,记录他们确诊骨转移后启动骨靶向药物治疗的时间,结果显示,3个月内治疗组的SREs频率显著低于未治疗组(4.0%和42.3%, P <0.05)。因此尽早使用双膦酸盐或地舒单抗可以显著降低SREs的发生率,提高患者的生活质量。
(2 )治疗时长及间隔: 关于治疗的持续时间,目前没有统一的共识。欧洲肿瘤内科学会骨健康指南建议,除骨寡转移病情缓解的患者外,整个抗肿瘤治疗病程均应持续应用骨靶向药物。因此建议根据患者的病情和耐受性,在抗肿瘤治疗全程持续使用骨靶向药物。此外,ZOOM研究与OPTIMIZE-2研究已证实,使用唑来膦酸每4周1次满1年的乳腺癌骨转移患者,第2年使用每12周1次能达到同样的预防SREs的效果。但地舒单抗每4周1次用药方案是维持疗效的必要条件,现有证据暂不支持延长用药间隔,可能与地舒单抗的体内半衰期显著短于双膦酸盐有关。
(3 )药物转换: 2019年一项纳入230例实体瘤骨转移患者的回顾性队列研究中,探索了100例在使用双膦酸盐后疗效不佳患者的用药策略,其中40例患者从双膦酸盐切换至地舒单抗,28例出现骨转移病灶的进展(肿瘤体积变大,病灶数量增加等); 12例发生了首次SRE。与继续使用双膦酸盐相比,可以进一步延长SRE发生时间( HR =0.47, 95% CI :0.25~0.88, P =0.019)。因此,在双膦酸盐耐药或不可耐受的不良反应情况下,地舒单抗可作为优化治疗选择。
对确诊肺癌骨转移患者,如无禁忌证,应在确诊后3个月内尽早使用地舒单抗或双膦酸盐等骨靶向药物治疗。应在疾病的整个病程中持续使用骨靶向治疗。双膦酸盐用药满1年后,可考虑将用药间隔延长到每3~6月1次;地舒单抗仍需保持每4周1次,不建议延长用药间隔( 推荐等级:Ⅱ级 )。
正在使用双膦酸盐的患者,如发生骨转移病情进展或不可耐受不良反应,可以考虑换用地舒单抗或其他骨靶向药物( 推荐等级:Ⅰ级 )。
4. 骨靶向药物不良反应管理
(1 )低钙血症: 低钙血症是骨靶向药物使用需要注意的事项,使用双膦酸盐或地舒单抗期间都需要补充钙和维生素D。
在开始地舒单抗治疗前应纠正原先存在的低钙血症。整个地舒单抗治疗期间应监测血钙水平,尤其是开始治疗的最初数周内,并且需给予钙和维生素D。与其他能降低血钙水平的药物同时使用时,应更频繁地监测血钙水平。
地舒单抗关键临床研究过程中建议患者每天补充钙和维生素D的剂量分别为≥500 mg和≥400 IU。地舒单抗与唑来膦酸在使用过程中均会导致低钙血症的发生。使用地舒单抗治疗期间,进行钙和维生素D的补充相较于未进行钙和维生素D补充的患者低钙血症风险下降40%( HR =0.60,95% CI :0.45~0.81, P =0.0007)。
(2 )肾不良反应: 肾功能不全是双膦酸盐的常见不良反应之一。目前认为,双膦酸盐肾不良反应发生的可能致病机制:①双膦酸盐类药物对包括钙离子在内的金属离子有较强的吸引力,它们倾向于与金属离子形成复合物和聚合体,尤其是当快速注入大量药物时更易形成,这些聚合物可被阻滞在肾内并导致肾损伤;②第三代双膦酸盐类药物引发的肾不良反应部分与双膦酸盐抑制肾小球和肾小管上皮细胞的甲羟戊酸途径并诱导凋亡有关;③肾功能受损的危险因素包括合并糖尿病、高血压、老龄(>65岁)等;④对于肿瘤患者需要特别注意,顺铂等抗肿瘤药物、非甾体类抗炎药物等都对肾功能有损伤。选择骨靶向药物时,更需要避免联合使用对肾功能损伤加重的药物;⑤地舒单抗是大分子单抗类药物,不会从肾脏以原型形式排泄。因此,对有肾功能损伤患者用药过程中无需调整剂量。双膦酸盐类药物通过肾脏排泄,在轻、中度肾功能不全[肌酐清除率(creatinine clearance, CrCl)>30 ml/min]的患者需调整剂量使用,对于严重肾功能不全(CrCl≤30 ml/min)的患者应先评估治疗的风险与利益(表2)。
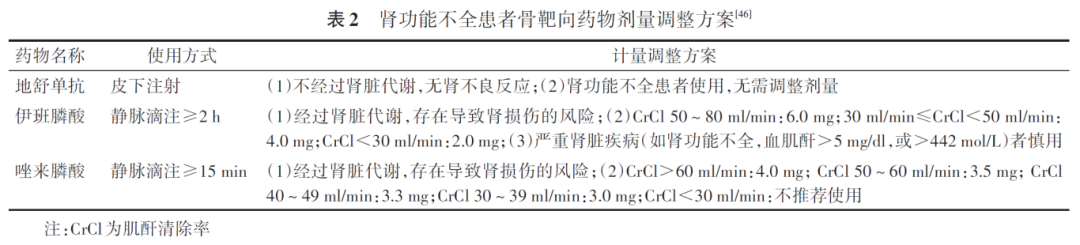
骨靶向药物治疗过程中,需要定期监测血清钙,同时需要每日补充钙剂和维生素D。双膦酸盐会导致肾功能不全的发生,应谨慎用于肾功能不全患者;使用过程中应定期监测肾功能生化指标,并避免与加重肾损伤药物同时使用。地舒单抗对肾功能无影响,可用于肾功能不全患者( 推荐等级:Ⅰ级 )。
(3 )颌骨坏死: 目前药物相关性颌骨坏死的机制没有完全明了,可能与颌骨部位骨代谢旺盛,下颌骨部位血液供应差有关。颌骨坏死发生的危险因素包括骨靶向药物(双膦酸盐,地舒单抗)、免疫抑制剂、血管生成抑制剂、糖皮质激素的应用、糖尿病、牙周或牙根感染、侵袭性牙科手术等。使用骨靶向药物可能导致了骨代谢受抑制,口腔长期磨损带来的损伤细胞或感染导致的坏死细胞无法及时被清除,进而引发颌骨坏死,这种风险与用药时长正相关而保持口腔健康可有效预防颌骨坏死的发生。
5732例实体瘤或多发性骨髓瘤患者治疗期间颌骨坏死的发病率如下:唑来膦酸组37例(1.3%),地舒单抗组52例(1.8%),两组间累积发病率差异无统计学意义( P =0.13);颌骨坏死随患者骨保护剂药物使用时间的延长,发生率略有升高。发生颌骨坏死的患者中有36%痊愈,其中唑来膦酸组29.7%,地舒单抗组40.4%,地舒单抗组痊愈率更高。地舒单抗组痊愈率高的原因可能为:双膦酸盐能与骨基质结合,随骨吸收过程被释放,诱导颌骨坏死发生,其效应在停药后仍可持续长达10年;地舒单抗不与骨质结合,平均半衰期为28 d,停止治疗后对药物残留影响可能较小。
在开始进行骨靶向药物治疗之前,推荐进行口腔检查,如需要进行有颌骨创伤的牙科治疗(主要为拔牙),需要等治疗结束后至少1个月或伤口初步愈合后才能启动骨靶向药物治疗。治疗期间建议每6个月进行口腔检查,并给以适当的预防性牙科护理。患者在治疗期间应尽量避免进行侵入性的牙科手术,如果必须进行可考虑暂停骨靶向药物治疗,总的原则是优先考虑肿瘤的控制。
已经出现的颌骨坏死,对于大部分患者建议最开始采用保守治疗(使用抗菌含漱剂、全身使用抗生素,以及激光等),对于晚期的颌骨颌骨坏死,如身体允许建议彻底的手术治疗。由于地舒单抗平均半衰期更短,药物残留对口腔影响可能更小,因此对于颌骨坏死愈合后的患者,建议选择地舒单抗作为重新启动骨靶向药物治疗的选择。
骨靶向药物使用前,应进行口腔检查,待有创牙科治疗初步愈合后再启动骨靶向药物治疗,以降低颌骨坏死风险。骨靶向药物使用期间,建议每6个月进行口腔检查。一旦出现颌骨坏死,可转口腔颌面外科处理。由于颌骨坏死的治疗周期长,如果肿瘤控制情况允许,可考虑暂停骨靶向药物治疗,待颌骨坏死牙科治疗愈合后,可重新启动地舒单抗治疗,双膦酸盐重启治疗需谨慎( 推荐等级:Ⅱ级 )。
(三)放射治疗
放射治疗是肺癌骨转移有效的局部治疗方法之一,能够减轻或消除患者疼痛症状,预防病理性骨折和脊髓压迫的发生及缓解脊髓压迫症状,从而改善生活质量、延长生存时间。
1. 外照射放射治疗
外照射放射治疗适用于症状性肺癌骨转移、高风险病理性骨折或已发生骨折需稳定骨骼者、脊髓压迫或神经压迫风险较高者。单次8 Gy照射或常规分割方案(3 Gy×10次)常被采用。对于单纯骨转移,单次8 Gy方案可提供与常规分割放疗相同的疼痛缓解效果,但维持的时间短于常规分割模式,对于活动不便患者,采用单次8 Gy方案可减少患者搬动次数,同时也可以降低治疗负担。
立体定向放射治疗适用于预期生存时间较长(>6个月)、美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体能状态为0~2分且无神经系统症状患者,尤其在脊柱和非脊柱骨转移中用于缓解疼痛。立体定向放射治疗具有高精度和高剂量聚焦的特点,可提高疼痛缓解率和局部控制率,同时降低局部复发风险,但需严格评估患者适应证同时要配合图像引导放疗技术,注意脊髓和其他重要组织的剂量限制,以避免严重不良反应。
(1 )禁忌证: 对于预期生存时间短(≤3个月),但无明显症状的患者,不建议预防性放疗。广泛多发骨转移但无症状的患者,全身治疗通常比放疗更适合,不推荐单独放疗。
患者如已经出现严重感染或合并严重骨髓抑制,需优先处理感染和血象异常,待稳定后再评估是否适合放疗。
(2 )注意事项: ①剂量控制与照射范围:放疗前需通过影像学评估准确界定肿瘤和转移范围,确保照射剂量和范围恰当,避免不必要的正常组织暴露。②放疗不良反应管理:放疗可能导致急性(主要包括恶心、呕吐、疲劳以及放疗诱导的疼痛加重)和长期(如辐射性骨髓抑制、放射性脊髓炎和放射性骨折等)不良反应,需密切监控并及时处理。
2. 放射性核素治疗
放射性核素治疗是一种以缓解骨转移相关疼痛为主要目标的系统性微创治疗手段,适用于肺癌多发骨转移所致的广泛性或难治性骨痛患者。常用药物为锶-89( 89 Sr),该药物为亲骨性放射性核素,通过静脉注射后选择性沉积于成骨活跃的骨转移灶处,释放β粒子实现局部照射,从而减轻骨痛。 89 Sr适应证包括:(1)影像学检查(如ECT或SPECT)提示广泛性成骨性或混合性骨转移灶,放射性浓聚明显;(2)骨痛程度中至重度,影响生活质量,且常规镇痛、骨靶向药物或局部放疗效果不佳;(3)治疗前1周内的骨髓功能相对良好(血红蛋白>90 g/L,中性粒细胞≥3.5×10⁹/L,血小板≥80×10⁹/L),无严重肝肾功能障碍。
由于 89 Sr可能引起可逆性骨髓抑制,尤其在接受过系统治疗患者中,应特别关注血常规变化。治疗前须经MDT综合评估,严格掌握适应证,权衡治疗获益与潜在不良反应后个体化应用。
(四)手术治疗
1. 适用人群
手术治疗主要适用于以下几类肺癌骨转移患者:(1)病理性骨折或预期高风险骨折的患者:手术干预可以通过金属内固定或假体置换来恢复和加强骨骼的稳定性、减轻疼痛并改善功能。特别是对于负重骨(如股骨、脊柱、骨盆)的病变,手术可以显著提高生活质量。(2)脊髓压迫症状:脊柱转移可引起脊髓压迫,导致神经功能障碍甚至瘫痪。对于神经压迫明显的患者,手术减压可有效解除压迫,恢复神经功能,并结合术后放疗以减少肿瘤复发风险。对于因脊柱转移瘤导致机械性不稳定和疼痛的患者,典型表现为活动后疼痛加重、卧床休息后缓解(即机械性疼痛)。若接受放疗、镇痛药物或支具固定后,胸腰背部疼痛仍无法有效控制,则可考虑手术干预。手术的核心目标在于缓解疼痛、重建脊柱稳定性,并显著改善患者的生活质量。(3)局部骨转移病灶且局部控制有望:对于病灶局限且预期生存期较长的患者,手术切除局部转移病灶可以实现较长时间的局部控制,尤其是在联合全身性治疗(如化疗或靶向治疗)的情况下。
2. 手术方法
(1 )内固定术: 适用于发生病理性骨折或面临骨折风险的长骨转移患者,通过手术稳定骨骼结构,预防或修复病理性骨折;对于脊柱病理性骨折脊柱不稳产生明显机械性不稳疼痛的患者,钉棒系统内固定可以有效恢复脊柱稳定性、快速缓解疼痛、并能尽快使患者下地行走,显著改善生活质量。
(2 )骨重建与假体置换术: 适用于骨质广泛破坏或功能严重受限的患者,尤其是髋骨、股骨或骨盆部位的转移。
(3 )减压手术: 适用于脊髓压迫引起的神经功能障碍,尤其是运动功能、感觉功能丧失或括约肌功能受损的患者。
(4 )肿瘤局部切除术: 适用于单一骨转移病灶且全身状况良好、预期生存期较长的患者。
3. 禁忌证
(1 )全身状态不佳的患者: 如存活期较短,或病情进展迅速,手术治疗可能带来较高的风险,效果有限。
(2 )广泛性骨转移: 对于多发骨转移且难以局限于某一区域的患者,手术意义有限。
(3 )严重凝血功能障碍或感染: 手术治疗应慎重,避免导致术后出血或感染风险。
4. 注意事项
(1 )术前评估: 手术前需进行全面的评估,包括影像学检查(如X线、CT、MRI)以明确病变范围,并评估患者的全身健康状态和麻醉耐受性。
(2 )术后康复与功能恢复: 术后应尽早进行功能康复训练,特别是在四肢功能受影响的患者中,联合物理治疗可以防止长期功能障碍。疼痛管理也应贯穿整个康复过程,避免术后疼痛干扰康复进程。
(3 )术后联合放疗和全身治疗: 手术后的局部控制常需联合放疗以及全身治疗(如化疗、靶向治疗),以减少肿瘤残留和防止进一步的转移。
(4 )骨靶向药物的使用: 术后患者特别是骨结构不稳定者,建议使用双膦酸盐或地舒单抗等药物,以减少SREs的发生(如骨折、骨痛等)。
(5 )并发症管理: 手术后的并发症如感染、假体松动、伤口愈合不良等应及时处理,以防止术后并发症影响患者的康复和预后。
5. 介入治疗
介入治疗在肺癌骨转移的局部控制、疼痛缓解及骨稳定性重建中日益发挥重要作用。常见方法包括消融治疗(射频、微波、冷冻消融等)和经皮骨成形术,此外放射性粒子植入也显示了良好的疗效及安全性。
(1 )消融治疗: 局部消融可用于缓解症状或肿瘤局部控制。消融常用于治疗下列患者的疼痛性骨转移瘤:病情已经进展的患者,放疗后仍有疼痛的患者,或者拒绝放疗的患者;患者应有至少中度疼痛、疼痛归因于数量有限(通常1~3个)且成像可见的转移,而且靶病灶远离正常关键结构(或可以与之分开)。姑息性治疗中也可使用骨转移瘤消融治疗代替手术,以保留承重骨的功能或防止其发生病理性骨折,此时通常联合使用骨水泥注入,即骨水泥成形术或椎体成形术。对于存在局限性骨转移瘤的患者,可用热消融治疗获得局部控制,部分患者甚至可见病灶消退。临床上常用的消融治疗包括射频消融、微波消融、冷冻消融以及聚焦超声等。
(2 )骨成形术: 骨成形术是一种影像引导下的经皮微创骨稳定技术,主要用于治疗因骨转移导致的骨质破坏、骨疼痛及结构不稳等问题,尤其适用于无法耐受手术或病灶位于负重骨区域的患者。该技术通过经皮注射聚甲基丙烯酸甲酯骨水泥至受累骨结构内,以增强骨稳定性、缓解疼痛并降低骨折风险。在椎体成形术之外,骨成形术亦适用于骨盆、髂骨、股骨远端、胫骨平台等扁平骨结构的巩固治疗,且具有操作简便、起效迅速和住院时间短等优势。文献显示,骨成形术在恶性椎体压缩骨折中能实现75%~85%的显著疼痛缓解,且并发症发生率较低。需要注意的是,聚甲基丙烯酸甲酯骨水泥对压缩力具有良好的抵抗力,但对扭转力的抵抗性有限,故对于长骨干骺端病变的巩固应慎重选择,仅限于不宜手术的患者,为降低继发骨折风险,可考虑与经皮螺钉固定等技术联合应用。
放射治疗是缓解骨转移局部症状的有效方法,也是骨寡转移治疗的重要手段。手术治疗可有效改善骨转移症状,预防和治疗严重SREs发生。依据患者情况选择不同手术方式。局部治疗的同时需多学科团队合作共同制定方案,做好不良反应的管理( 推荐等级:Ⅰ级 )。
6. 姑息治疗
(1 )镇痛治疗
① 适用人群
镇痛治疗适用于伴有中重度疼痛的肺癌骨转移患者。常见的疼痛类型包括由骨质破坏、肿瘤侵袭骨膜、病理性骨折等引起的疼痛。这类患者往往需要多模式镇痛方案,以提高生活质量。
② 药物治疗
根据国际癌症疼痛管理指南,镇痛治疗的药物管理遵循WHO提出的三阶梯疼痛管理原则。
(a )镇痛药物: 依据患者疼痛的严重程度,药物的选择通常如下。非阿片类镇痛药:常用于轻度疼痛。这类药物包括对乙酰氨基酚、非甾体抗炎药如布洛芬、双氯芬酸等,适合早期骨痛的管理。弱阿片类药物:用于中度疼痛,常用药物如可待因和曲马多。这类药物可与非阿片类药物联合使用,提供更强的镇痛效果。强阿片类药物:适用于重度疼痛患者。常见药物包括吗啡、羟考酮、芬太尼等。这类药物能够显著缓解难以控制的剧烈骨痛,并在必要时与非阿片类药物联合使用。辅助镇痛药:包括抗抑郁药(如阿米替林)和抗癫痫药(如加巴喷丁),通常用于伴有神经性疼痛的患者。此类药物通过作用于中枢神经系统,减轻由神经受损引发的慢性疼痛。此外,骨靶向药物如双膦酸盐和地舒单抗的应用可改善肿瘤骨组织的破坏,恢复正常的骨组织结构,并减少镇痛药的使用量。
(b )禁忌证: 存在胃肠道溃疡、消化道出血、严重肾功能不全的患者不宜使用非甾体抗炎药。对于有严重呼吸抑制、急性中枢神经抑制或已知阿片过敏的患者,需避免使用强效阿片类药物。如加巴喷丁和阿米替林,在有癫痫、严重心脏病或对这些药物有过敏史的患者中应慎重使用辅助镇痛药物。
③ 注意事项
(a )阿片类药物依赖与耐药性: 长期使用阿片类药物可导致药物依赖性和耐药性增加,因此应定期评估患者的药物需求,并根据病情调整药物剂量。
(b )不良反应监测: 阿片类药物的常见不良反应包括便秘、恶心、嗜睡及呼吸抑制,需及时进行不良反应的预防和管理。
(c )个体化治疗: 镇痛治疗应个体化,根据患者疼痛类型、严重程度以及药物的耐受性进行动态调整。除药物治疗外,可通过结合局部治疗等手段对疼痛进行缓解。
(2 )静脉血栓栓塞症预防与治疗
肿瘤相关静脉血栓栓塞症,主要包括深静脉血栓形成(deep vein thrombosis, DVT)和肺血栓栓塞症(pulmonary embolism, PE),是恶性肿瘤患者常见的并发症,也是除肿瘤进展外患者的首要死亡原因。应进行全面详细的病史采集及检验以评估静脉血栓栓塞症风险。采用多种评估量表识别高危人群,如Khorana评分、Caprini风险评估模型和Padua风险评估模型。
① 预防性抗凝治疗
对于血栓风险高的患者,如Khorana评分≥2分,可选择利伐沙班、阿哌沙班或低分子肝素预防至少6个月。对于伴有急性疾病或活动能力下降的患者,推荐使用普通肝素或低分子肝素等。对于行大手术治疗的肿瘤患者,尤其是腹盆腔手术或风险评分最高危组的患者,推荐围术期应用普通肝素或低分子肝素至少7~10 d;伴有高危因素的患者,低分子肝素可延长至4周。
② 诊断及治疗
(a )静脉血栓栓塞症诊断: 若在临床实践中怀疑DVT,应即刻进行静脉加压超声检查(compression venous ultrasonography, CUS),且需要在首次检查后1周复查CUS结果,2次结果均为阴性方可排除DVT。对于可疑PE患者,应立即识别高危PE人群;对可疑非高危PE患者,首先根据 PE-WELLS 评估临床可能性,之后进行肺动脉CT血管造影等诊断性检查,应用临床预后风险评分进行危险度分层。
(b )治疗原则: 抗凝治疗是肿瘤相关静脉血栓栓塞症的核心治疗措施。对于无抗凝禁忌的DVT和PE患者,建议进行至少6个月的抗凝治疗。抗凝治疗药物包括普通肝素、低分子肝素、磺达肝癸钠、利伐沙班、艾多沙班、阿哌沙班或华法林。
(3 )心理支持治疗
有研究显示,在恶性肿瘤患者中,肺癌患者的心理痛苦患病率及抑郁患病率最高。根据骨转移姑息治疗的基本原则,需建立肿瘤临床医师与心理精神科医师组成的多学科合作团队,对患者心理精神症状评估后,针对达到临床诊断意义心理痛苦的患者,由精神心理医师进行诊疗;未达临床诊断意义的患者,由临床医护人员给予心理支持和患者教育。心理社会干预如支持性治疗、认知-行为治疗、家庭治疗以及癌症疾病管理与有意义地生活治疗,能有效缓解心理痛苦、改善生活质量。对于轻到中度焦虑抑郁障碍患者,可选择心理治疗等;重度焦虑抑郁障碍则首选药物治疗,多数情况可联合治疗。
在实体肿瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)1.1版中,骨转移通常不可测量,仅溶骨性或混合性病灶伴有明确软组织成分时,方可作为可测量病灶。因此,RECIST 1.1并不适用于骨转移的疗效评价。目前国际上常用的骨转移疗效评估标准为美国安德森癌症中心(MD Anderson Cancer Center, MDA)标准(表3),于2004年发布补充,除X线平片和ECT外,CT和MRI也纳入其中。CT骨窗能显示骨转移灶大小、位置、骨皮质病变情况,是目前临床上能够反映成骨和溶骨变化最准确、简便、经济的检查手段。MRI对脂肪和水为主的软组织具有很高的分辨率,可在骨皮质破坏之前发现髓质转移,也可显示软组织的浸润范围,便于勾画放疗靶区,避免病灶的遗漏,还可以判断转移的椎体有无脊髓压迫。而基于PET-CT的实体肿瘤疗效PET-CT评价标准,在无解剖学变化的情况下,可通过肿瘤代谢活性变化为骨转移疗效评估提供参考。
骨转移疗效评价需同时评估肿瘤负荷和骨结构变化。骨转移早期微病灶在治疗前可能还不足以形成影像学上可见的ECT摄取、CT密度或MRI信号改变,经有效治疗后,出现成骨性修复,继而导致成骨新病灶出现或原有骨转移病灶周边成骨性修复的发生导致“骨转移病灶增大”,此时为治疗有效的表现,需谨慎评估骨转移进展,避免过早停止有效治疗方案对临床结局产生不利影响。如出现新的溶骨性病灶或原有溶骨性病灶的扩大,或原有成骨性病灶向溶骨性病灶转变,骨转移处致密性降低,此时一般为骨进展或进展前奏,则需密切随访、及时调整方案,以优化患者获益。

建议肺癌骨转移患者定期接受骨转移评估,同时评估肿瘤负荷及骨结构改变。溶骨性骨转移患者出现成骨新病灶或原病灶成骨性修复扩大时,通常是治疗有效的表现,需谨慎评估骨转移进展。可采用MDA标准评估骨转移病灶疗效,通过合理评估与规范诊疗,让患者获得更佳获益( 推荐等级:Ⅰ级 )。
肺癌骨转移患者的随访是优化治疗、评估疾病进展、管理SREs和提高生活质量的重要步骤。有效的随访不仅能及时发现并发症,还能帮助调整治疗方案。随访频率和方法需根据治疗阶段、患者病情稳定性以及预期生存期进行个性化制定。
(一)随访频率
骨转移患者早期通常每3~6个月随访1次,初期着重关注治疗后药物不良反应、局部治疗并发症,了解患者功能恢复和生活质量改善情况,后续了解患者的指标变化及复发情况。病情稳定的患者,在一定时间后随访间隔可以适当延长。第1年:每3个月随访1次,重点监测原发灶及转移灶情况、并发症。第2年:每6个月随访,重点监测相关指标稳定性、疾病复发与转移。第3年及以上:每年随访1次,适用于长期存活且病情稳定的患者。
(二)随访内容
1. 症状评估: 定期评估患者的骨痛、活动受限及生活质量。通过疼痛评分工具和功能状态评分(如ECOG)量化病情。
2. 影像学检查: CT、MRI或PET-CT用于监测骨转移及全身病情,必要时进行骨扫描。可使用MDA标准进行骨转移病灶评估。
3. 生化指标: 定期检测血钙和骨代谢标志物(如NTX、CTX等),预防低钙血症,早期识别高钙血症并评估骨代谢情况。












 苏公网安备32059002004080号
苏公网安备32059002004080号


