在表皮生长因子受体突变(EGFRm)晚期非小细胞肺癌(NSCLC)的治疗领域,MARIPOSA研究具有里程碑式的意义。作为首个在一线联合治疗中相较奥希替尼取得总生存期(OS)阳性结果的III期临床研究,其无进展生存期(PFS)及OS数据已两度荣登医学顶刊《新英格兰医学杂志》(NEJM),标志着EGFRm NSCLC的治疗已正式由单药时代跨入联合治疗新时代。继MARIPOSA亚洲亚组PFS数据在2023年ESMO Asia大会公布后,2025年ESMO Asia大会终于迎来了备受瞩目的MARIPOSA亚洲亚组OS数据的正式发布。基于此,【肿瘤资讯】特邀MARIPOSA研究的首席研究者上海交通大学医学院附属胸科医院陆舜教授对这一突破性数据进行解读,以期为亚洲人群联合治疗策略的临床决策提供更多参考。
上海交通大学医学院附属胸科医院终身教授,上海市肺部肿瘤临床医学中心主任
国家卫生健康突出贡献中青年专家,上海市领军人才,上海市优秀学术带头人,享受国务院特殊津贴 ,第四届国之名医(卓越建树)
2024,2025年科睿唯安“全球高被引科学家名单”
美国斯坦福大学和爱思唯尔数据库全球前2%顶尖科学家
中国抗癌协会常务理事,临床肿瘤免疫专业委员会主任委员
中国临床肿瘤学会(CSCO)常务理事 ,希斯科基金会副理事长
DIA中国区顾问委员会前任主席
美国临床肿瘤协会(ASCO)亚洲事务委员
中华医学会肿瘤学会常委,肺癌专家委员会主任委员
日本临床肿瘤协会(JSMO)国际事务委员
国际肺癌研究会官方杂志Journal of Thoracic Oncology,Lung Cancer副主编。
第一负责人主持科技部国家慢病重点专项,国际合作课题;国家新药创新重大专项,863重大课题子课题2项;国家自然基金重点项目和面上项目
第一负责人获上海市科技进步一等奖。中国抗癌协会科技奖一等奖;中华医学科技奖二等奖,华夏医学科技奖二等奖;上海市医学科技奖一等奖; 2021获上海交通大学校长奖; “药明康德生命化学研究奖”,2024获“DIA全球卓越奖”,仁心医者上海市杰出专科医师奖
革新机制:双抗联合TKI的多维协同,力求满足亚洲EGFRm NSCLC治疗未尽之需
Q1:EGFR突变是亚洲NSCLC患者的主要突变类型,能否请您阐述EGFR突变NSCLC在亚洲人群中的流行病学特征如何?目前针对该亚型患者的标准诊疗模式与挑战是什么?
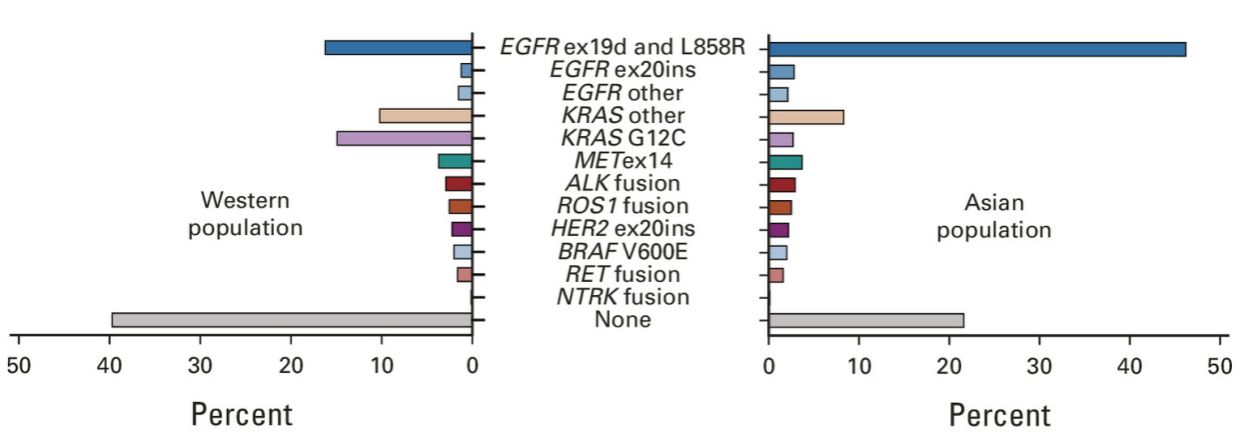
肺癌是亚洲地区负担最重的恶性肿瘤之一。流行病学数据显示,亚洲人群中EGFR突变率显著高于西方人群,约占NSCLC患者的40%-50%(图1)[1]。尽管第三代EGFR酪氨酸激酶抑制剂(TKI)单药已成为一线标准治疗,但在真实世界中,由于疾病进展迅速、体能状态恶化或医疗资源限制,约25%-40%的患者在疾病进展后无法获得二线治疗机会[2,3]。这意味着,一线治疗的疗效很大程度上决定了患者的长期生存结局。因此,探索更高效的一线治疗方案,以延缓耐药发生、最大化一线治疗获益,是当前临床亟待解决的关键问题。
MARIPOSA研究采用的埃万妥单抗联合兰泽替尼方案,代表了一种革新的“去化疗”一线治疗策略。埃万妥单抗是一款针对EGFR和MET靶点的全人源双特异性抗体,具有“一药双靶三机制”的独特作用。“双靶”指埃万妥单抗可同时覆盖EGFR和MET两个关键驱动通路,从源头上抑制潜在的耐药机制,“三机制”即指埃万妥单抗的3种潜在的作用机制激发其抗肿瘤活性:配体阻断、受体降解和免疫细胞导向活性(图2)[4]。
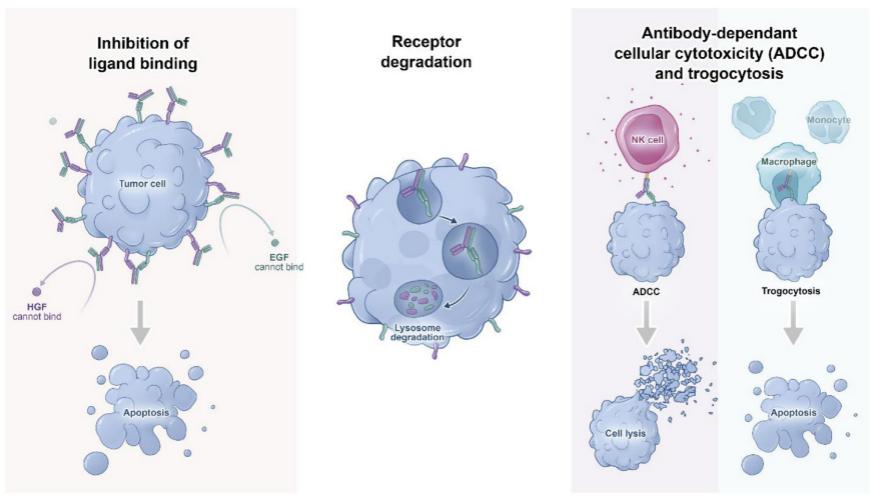
兰泽替尼则是一种高选择性的第三代EGFR-TKI。两药联合实现了胞内胞外的双重抑制,不仅能协同增效,还能通过降低EGFR继发突变和MET扩增的发生率,有效延缓耐药,从而为延长患者总生存奠定生物学基础。
生存突破:MARIPOSA研究亚洲亚组OS获益进一步印证“去化疗”创新疗法在一线治疗中的重要价值
Q2:MARIPOSA研究公布的PFS和OS数据在全球人群与亚洲亚组中的表现具体如何?此次在ESMO Asia会议上首次公布的MARIPOSA研究亚洲人群OS数据对临床实践具有哪些重要意义或指导价值?
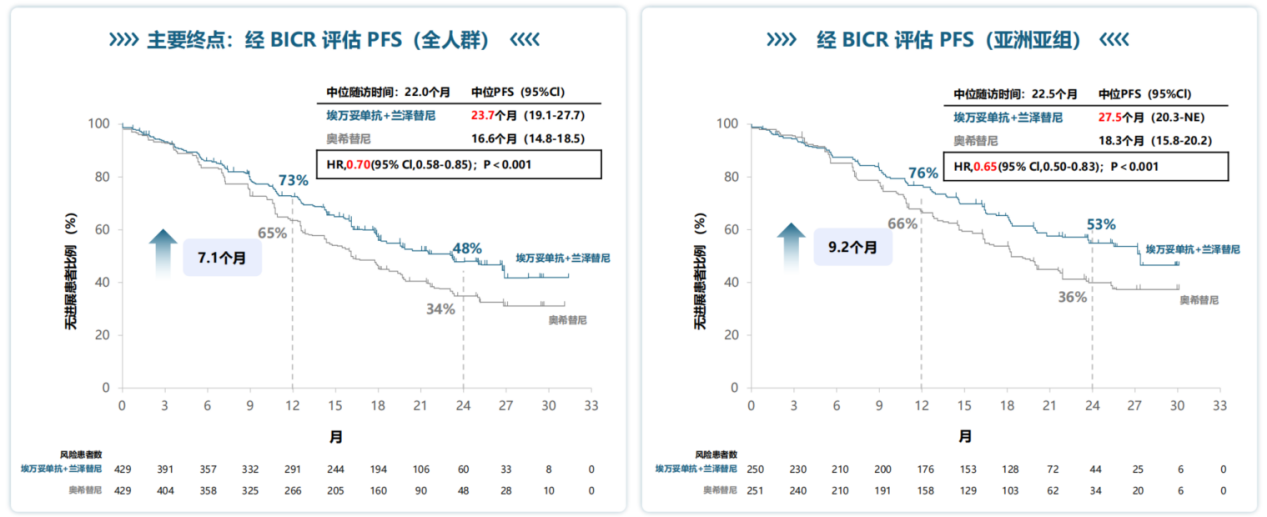
MARIPOSA研究(NCT04487080)是一项全球多中心、随机、III期临床试验。其主要终点分析显示,在中位随访22.0个月时,埃万妥单抗联合兰泽替尼组的中位PFS达到23.7个月,显著优于奥希替尼单药组的16.6个月(HR 0.70; P<0.001)[5]。凭借PFS的优异数据,MARIPOSA研究的相关研究结果于2024年6月重磅刊发在NEJM(图3),我作为本篇文章的共同第一作者,也非常荣幸见证了这一里程碑事件。

同时,MARIPOSA研究作为一项全球多中心的大型III期临床研究,其在全球人群中的成功经验是否能在亚洲乃至中国人群复现是至关重要的。基于这一初衷,我带领团队继续深入挖掘了MARIPOSA研究中亚洲亚组的相关数据。在MARIPOSA亚洲亚组分析中(n=629),埃万妥单抗联合兰泽替尼在数值上展现出了更为显著的优势。数据显示,联合治疗组的中位PFS长达27.5个月,较奥希替尼组的18.3个月延长了9.2个月,疾病进展或死亡风险降低了35%(HR 0.65; P<0.001)(图4)[6]。此外,在客观缓解率(ORR)和缓解持续时间(DoR)方面,联合治疗组也显示出更优的缓解深度和持久性。这一结果显示,亚洲人群能够从这种强效的联合治疗模式中获得与全球人群一致甚至更佳的生存获益。
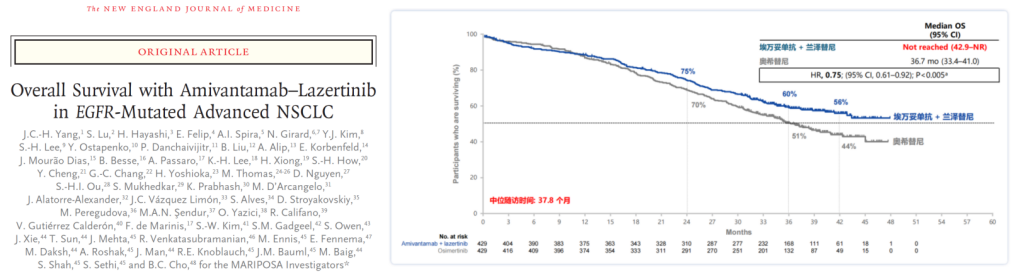
总生存期(OS)是评估肿瘤治疗疗效的金标准。在2025年ELCC大会上,MARIPOSA研究公布了最终OS分析结果[7]。在中位随访37.8个月时,与奥希替尼组相比,埃万妥单抗联合兰泽替尼组实现了显著的OS获益,死亡风险降低了25%(HR 0.75; 95% CI, 0.61-0.92; P=0.005)。相较于奥希替尼组中位OS为36.7个月,埃万妥单抗联合兰泽替尼的中位OS尚未达到,改善预计超过一年(图5)。3年OS率在联合治疗组达到了60%,而奥希替尼组为51%。这一重磅研究成果在今年9月正式发表在NEJM上(图5),我同样也是作为共同第一作者。随着MARIPOSA研究二度登上国际医学顶刊,再度引发全球热议[8]。
在2025 ESMO Asia大会上,备受期待的MARIPOSA亚洲亚组OS数据正式揭晓[9]。研究结果显示,中位随访38.7个月时,埃万妥单抗联合兰泽替尼组和奥希替尼组的中位OS分别为NR和38.4个月,可显著降低死亡风险26%(nominal P=0.026)。联合治疗组OS曲线早期分离且随时间推移持续变宽,预计较奥希替尼组中位OS改善超过1年,具有显著的临床意义(图6)。值得注意的是,埃万妥单抗联合兰泽替尼组和奥希替尼组在进展后接受后续治疗的比例相近,分别为71%和75%,且联合治疗组的3年icPFS率是奥希替尼组的两倍(36% vs 18%),icDoR更长(NR vs 27.4个月)。
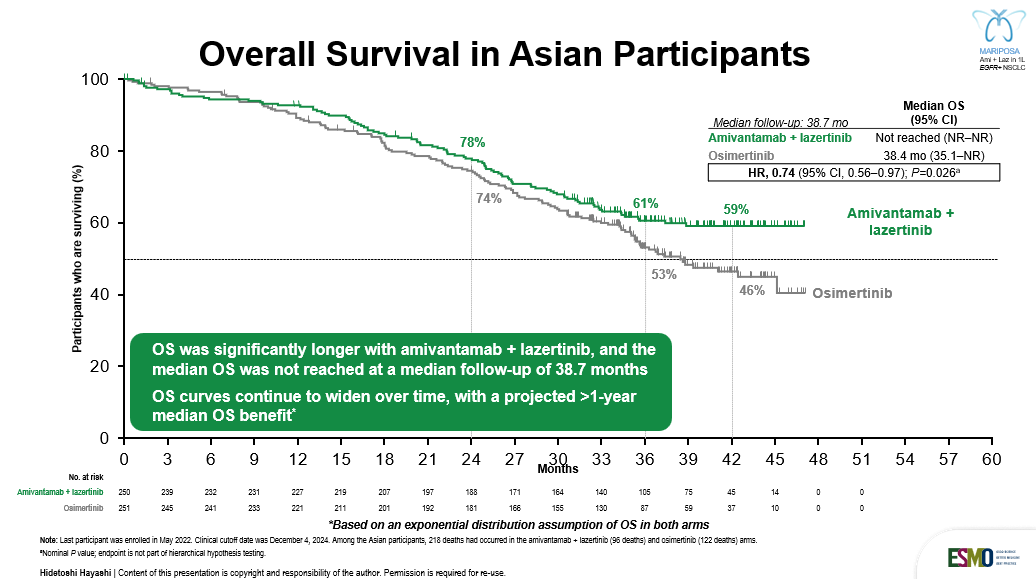
MARIPOSA是首个在EGFR经典突变NSCLC亚洲患者的一线治疗中相较奥希替尼有总生存显著获益的方案,“鱼尾形”曲线再次证实埃万妥单抗的免疫细胞导向活性带来的长拖尾效应。这一数据的发布进一步印证了“去化疗”的埃万妥单抗联合兰泽替尼创新疗法在亚洲EGFR突变NSCLC一线治疗中的核心地位,有望为更多亚洲患者带来实质性的总生存获益。
安全管理:埃万妥单抗联合兰泽替尼方案的不良反应可预测、可管理、可耐受,亚洲人群经长期随访未发现新的安全性信号
Q3:埃万妥单抗联合兰泽替尼方案的总体安全性及耐受性如何?在临床实践中,应如何有效管理该联合方案常见的不良反应(AEs)?
随着埃万妥单抗联合兰泽替尼一线治疗的广泛应用,其安全性管理日益受到重视。MARIPOSA研究显示,埃万妥单抗联合兰泽替尼的不良事件谱特征明确,主要表现为EGFR和MET相关毒性(如皮疹、甲沟炎、低白蛋白血症)、输注相关反应(IRR)以及静脉血栓栓塞(VTE)。同时需注意的是,埃万妥单抗联合兰泽替尼的治疗相关不良事件(TRAE)导致所有治疗终止发生率低,仅为10%[5]。并且长期随访数据表明,不良事件多为1-2级,主要不良事件可通过主动管理进行干预,且主要发生在联合用药的前4个月[7]。MARIPOSA亚洲亚组的安全性结果显示,亚洲亚组的AE发生率与MARIPOSA研究中观察到的总体发生率相当[6]。此次公布的MARIPOSA亚洲亚组的安全性结果更新显示[9],亚洲人群的安全性特征与既往报告的全球人群数据保持一致,AE多为1-2级。基线时仅有3%的患者接受了抗凝治疗,埃万妥单抗联合兰泽替尼组和奥希替尼组VTE的发生率分别为34%和7%,在延长随访时间后,未观察到VTE的发生率出现有意义的增加。这一结果更进一步证实,埃万妥单抗联合兰泽替尼在亚洲人群中未发现新的安全性信号,通过规范化的预防和管理,绝大多数AE可防可控,患者能够耐受长期治疗。
为进一步提升患者的治疗体验,目前针对埃万妥单抗联合兰泽替尼主要TRAE的全方位预防性管理策略(CAPS)(图7)已取得显著成效,为患者的全程规范化管理提供了有力保障。在皮肤相关不良反应的管理中,COCOON研究结果证实了早期使用润肤霜、四环素类抗生素等预防性措施可显著降低皮疹和甲沟炎的发生率及严重程度[10]。在VTE的预防管理方面,PALOMA-2研究证实了在联合治疗的前4个月建议进行预防性抗凝处理,可有效降低血栓风险[11]。在IRR的管理方面,SKIPPirr研究已证实地塞米松的预处理用药可显著减少患者的IRR[12]。总之,在围绕埃万妥单抗联合兰泽替尼方案制定的CAPS策略下,不仅患者的体验和耐受性可得到进一步保障,其临床获益也将得到进一步的提升。

总结
MARIPOSA研究亚洲亚组OS数据的发布,是EGFRm晚期NSCLC治疗史上的又一重要里程碑。埃万妥单抗联合兰泽替尼方案凭借其独特的作用机制,在亚洲人群中证实了显著的PFS及OS双重获益,且安全性可控,这为以EGFR突变为主要可靶向的驱动基因的亚洲NSCLC患者提供了非常重要的临床治疗决策的借鉴。加之近期埃万妥单抗皮下注射制剂即将在国内获批,埃万妥单抗联合兰泽替尼方案的便捷性与安全性将进一步提升。总之,这一创新疗法有望重塑EGFR突变NSCLC的一线治疗格局,切实改善患者的治疗体验,帮助更多患者实现“活得更长、活得更好”的生存目标。
1.Aaron C. Tan et al. Targeted Therapies for Lung Cancer Patients With Oncogenic Driver Molecular Alterations. J Clin Oncol 40, 611-625(2022).
2. Lee, J.Y. et al. EP08.02-082 Treatment Patterns and Outcomes of First-line Osimertinib-treated Advanced EGFR Mutated NSCLC Patients: A Real-world Study. Journal of Thoracic Oncology, Volume 17, Issue 9, S440
3. Girard N, Leighl N, Ohe Y, et al. Mortality among EGFR-mutated advanced NSCLC patients after frontline osimertinib treatment: a real-world, US attrition analysis. J Thorac Oncol. 2023;18(4S):S51-S52.
4. Cho BC, Simi A, Sabari J, Vijayaraghavan S, Moores S, Spira A. Amivantamab, an Epidermal Growth Factor Receptor (EGFR) and Mesenchymal-epithelial Transition Factor (MET) Bispecific Antibody, Designed to Enable Multiple Mechanisms of Action and Broad Clinical Applications. Clin Lung Cancer. 2023 Mar;24(2):89-97.
5. Cho BC, Lu S, Felip E, et al. Amivantamab plus Lazertinib in Previously Untreated EGFR-Mutated Advanced NSCLC. N Engl J Med. 2024;391(16):1486-1498.
6. Cho BC, Hayashi H, Lee JS, et al. Amivantamab plus lazertinib versus osimertinib as first-line treatment in EGFR-mutated advanced non-small cell lung cancer: MARIPOSA Asian subset. Lung Cancer. 2025;204:108496.
7. Yang JC-H, et al. Amivantamab Plus Lazertinib vs Osimertinib in First-line EGFR-mutant Advanced NSCLC: Final Overall Survival from the Phase 3 MARIPOSA Study. 2025 ELCC 4O.
8. Yang JC-H, Lu S, Hayashi H, et al. Overall Survival with Amivantamab-Lazertinib in EGFR-Mutated Advanced NSCLC. N Engl J Med. 2025.
9. Hayashi H, et al. Overall Survival for Amivantamab Plus Lazertinib vs Osimertinib in Asian Participants With First-line EGFR-mutant Advanced NSCLC: MARIPOSA Subgroup Analysis. ESMO Asia 2025 972O.
10. Jill Feldman. Dermatologic prophylaxis and impact on patient-reported outcomes in first-line EGFR-mutant advanced NSCLC treated with amivantamab plus lazertinib: Results from the phase 2 COCOON trial. 2025 ASCO 8641.
11. Sun Min Lim et al. Subcutaneous amivantamab and lazertinib as first-line treatment in patients with EGFR-mutated, advanced non-small cell lung cancer (NSCLC): Results from the phase 2 PALOMA-2 study. 2024 ASCO LBA 8612.
12. G. Lopes, et al. Preventing Infusion-Related Reactions with Intravenous Amivantamab: Primary Results from SKIPPirr, a Phase 2 Study. 2024 WCLC MA12.08.
CRC Code:EM-195338
Approved Date:2025/12/6
排版编辑:肿瘤资讯-TJ
✅ “本资料仅用于医学、科学交流,可能涉及尚未在中国获批的产品和适应症。强生创新制药不支持、不鼓励任何未被批准的药品/适应症使用。”
✅“本材料中涉及的AE/SS/PQC已按照强生创新制药的要求上报”(适用于含AE/SS/PQC的资料)











 苏公网安备32059002004080号
苏公网安备32059002004080号


