神经内分泌肿瘤是一大类具有高度异质性的肿瘤,其中约10%的病例与遗传因素密切相关,进而形成特定的遗传综合征。这些遗传性综合征不仅临床表现多样、累及多器官,且具有家族聚集性,给患者的诊断、治疗带来了巨大挑战。本文为复旦大学附属肿瘤医院陈洁教授对遗传性神经内分泌肿瘤的诊治进行了系统的讲解,强调了提高临床警惕性、规范基因检测及推行多学科个体化治疗的重要性。
遗传性神经内分泌肿瘤概述
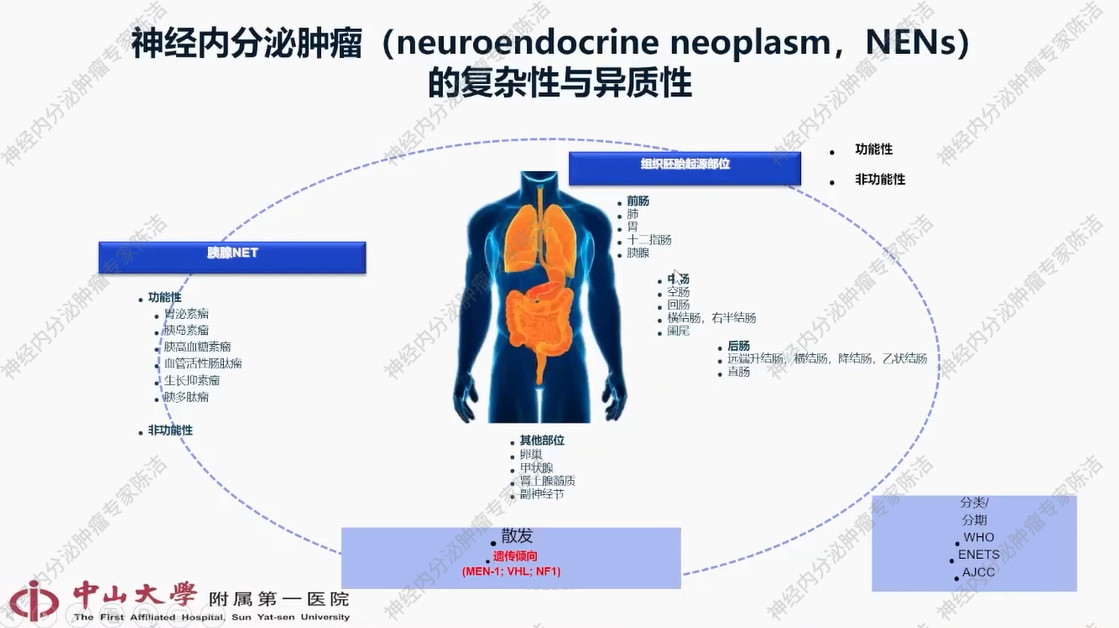
神经内分泌肿瘤的复杂性与异质性
神经内分泌肿瘤是泛指所有起源于肽能神经元和神经内分泌细胞的一大类高度异质性的肿瘤。神经内分泌肿瘤可分为功能性与非功能性肿瘤,其区分依据为是否分泌激素并引起相应症状或综合征。此外,依据组织胚胎起源部位,神经内分泌肿瘤可分为前肠、中肠和后肠肿瘤。神经内分泌肿瘤既可生长于内分泌器官内部,也可广泛分布于副神经节、皮肤以及消化道和呼吸道黏膜,实际上是一种可在全身分布的肿瘤。临床上遵循世界卫生组织(WHO)针对不同部位制定的分类标准,并参考欧美已趋于统一的TNM分期系统。在神经内分泌肿瘤中,约90%为散发性,无特定致病性遗传基因;然而,约10%的神经内分泌肿瘤具有明确的遗传性,即存在明确胚系基因致病突变。
遗传性神经内分泌肿瘤的复杂性
在2017年第四版世界卫生组织(WHO)内分泌器官肿瘤分类标准中,WHO用了长达40页的篇幅,系统介绍了16种常染色体显性遗传综合征。
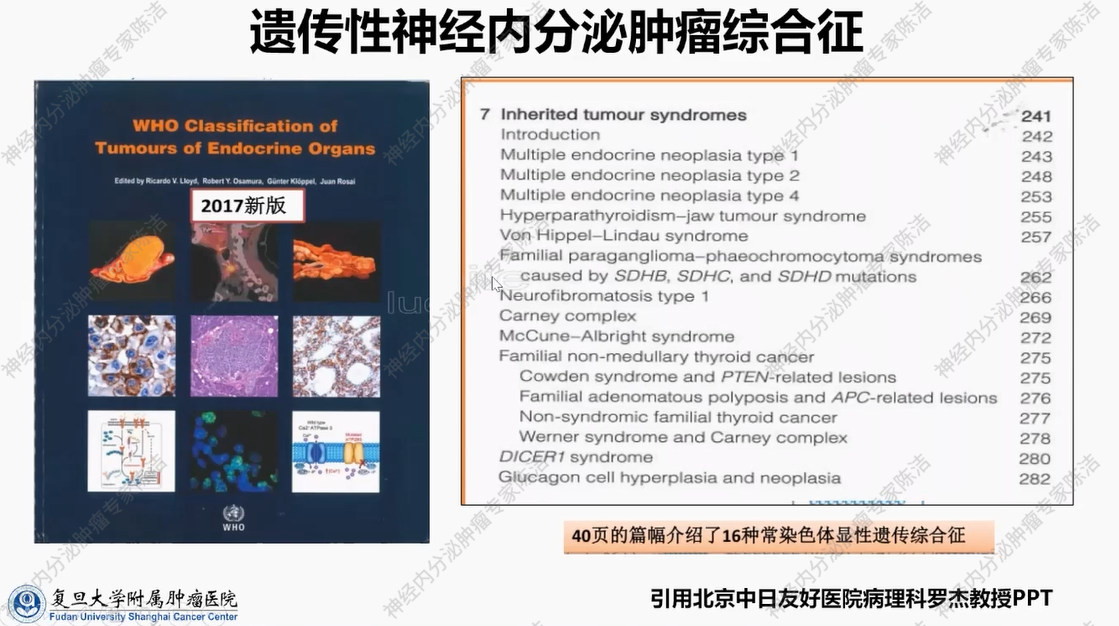
遗传性神经内分泌肿瘤综合征涉及8个内分泌器官和超过20种不同的胚系基因致病突变。各类神经内分泌肿瘤相关的遗传综合征及其大致遗传比例如下:垂体腺瘤,遗传性占比约5%;胰腺神经内分泌肿瘤,遗传性占比约10%;嗜铬细胞瘤/副神经节瘤,遗传性约占30%;甲状腺髓样癌(MTC),遗传性占比同样高达30%。与其他人类实体肿瘤相比,内分泌系统肿瘤的遗传易感性表现得更为常见和多变。由于该疾病涉及多个基因突变,且临床综合征较为复杂,目前对其认识尚浅。然而,此类遗传性肿瘤在临床、病理和遗传学领域,对于深化相关疾病认知具有重要意义。

遗传性神经内分泌肿瘤的临床表现
神经内分泌肿瘤总体发病率呈上升趋势,无论其是否与遗传相关。其中,遗传性神经内分泌肿瘤约占10%。此类遗传性神经内分泌肿瘤以全身多部位肿瘤形成为特征,临床表现具有高度多样性,涉及多个学科领域。不同类型的遗传性神经内分泌肿瘤通常具有各自独特的致病基因,且多数致病基因为常染色体显性遗传,即不分性别地以50%的概率逐代遗传。这些遗传性神经内分泌肿瘤包括多发性内分泌腺瘤病1/2/4型、Von Hippel-Lindau综合征、1型神经纤维瘤病、结节性硬化、遗传性副神经节瘤/嗜铬细胞瘤、遗传性甲状旁腺功能亢进2型等。此外,同一器官的神经内分泌肿瘤也可能由不同的致病遗传基因所致。

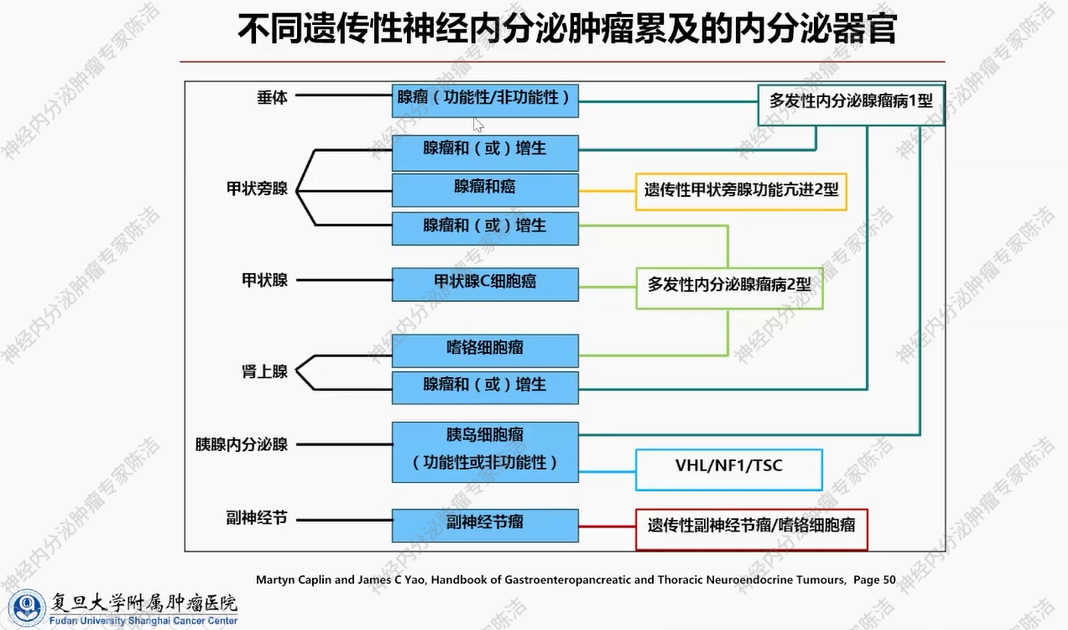
不同遗传性神经内分泌肿瘤累及的内分泌器官有所区别。如下图所示,最为常见的多发性内分泌腺瘤病1型,可累及垂体、甲状旁腺、胰腺及肾上腺等多个内分泌腺体;而多发性内分泌腺瘤病2型,主要累及甲状腺,部分患者还会累及甲状旁腺与肾上腺。
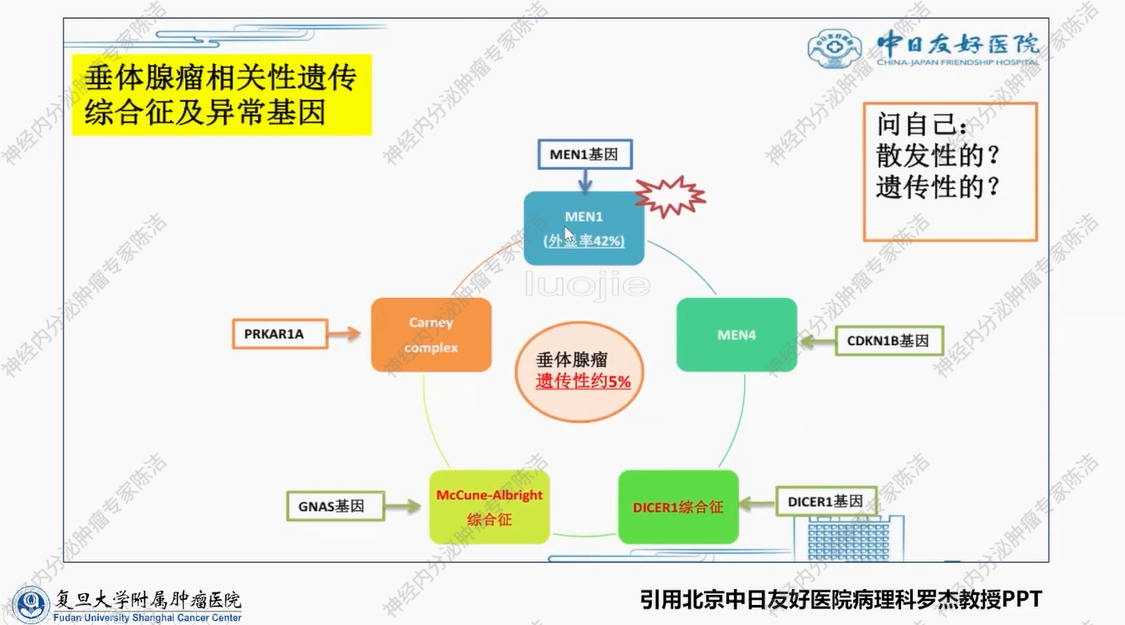
同一内分泌器官的肿瘤,亦可能由不同致病遗传基因引发。以垂体腺瘤(现称垂体神经内分泌肿瘤)为例,遗传性约5%。其中,MEN1基因突变可导致垂体腺瘤,MEN4基因相关综合征同样能够引发垂体腺瘤。由此可见,该类肿瘤涉及不同致病基因。因此,临床面对此类患者时,除对其临床表现进行鉴别外,还需考虑对遗传基因的致病突变进行筛查。
胰腺神经内分泌肿瘤与遗传相关的比例约10%,最常见的是多发性内分泌腺瘤病1型(MEN1)。此外,结节性硬化症患者的胰腺也可能长出神经内分泌肿瘤,Von Hippel-Lindau综合征、NF1综合征等情况也会引发胰腺神经内分泌肿瘤。
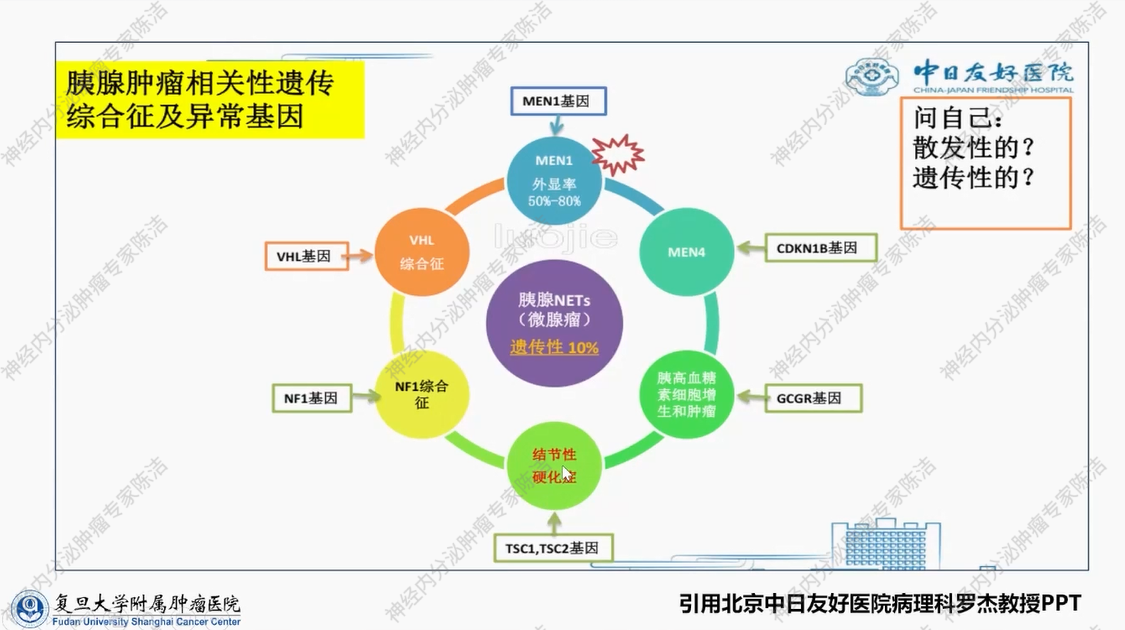
嗜铬细胞瘤和副神经节瘤具有高达30%的遗传特性。此类遗传性肿瘤受累的基因更为多样,有7个及以上基因的致病突变或片段缺失,均可引发嗜铬细胞瘤或副神经节瘤。不同的致病基因,除了引发嗜铬细胞瘤这一相同结果外,其临床表现亦存在差异。例如,由VHL基因突变引发的嗜铬细胞瘤与由RET基因突变引发的嗜铬细胞瘤,二者临床表现不同。这要求我们熟悉这类由遗传因素因此的嗜铬细胞瘤/副神经节瘤的临床表现,以避免误诊、漏诊。
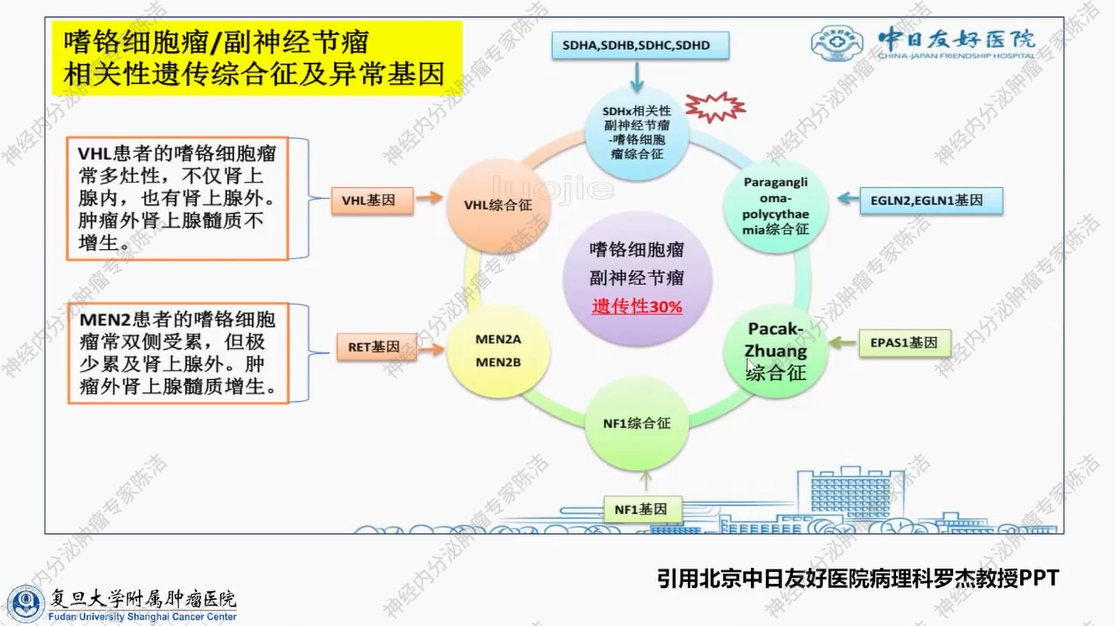
下图所示为原发性甲状旁腺功能亢进或微腺瘤病所涉及的相关遗传基因。
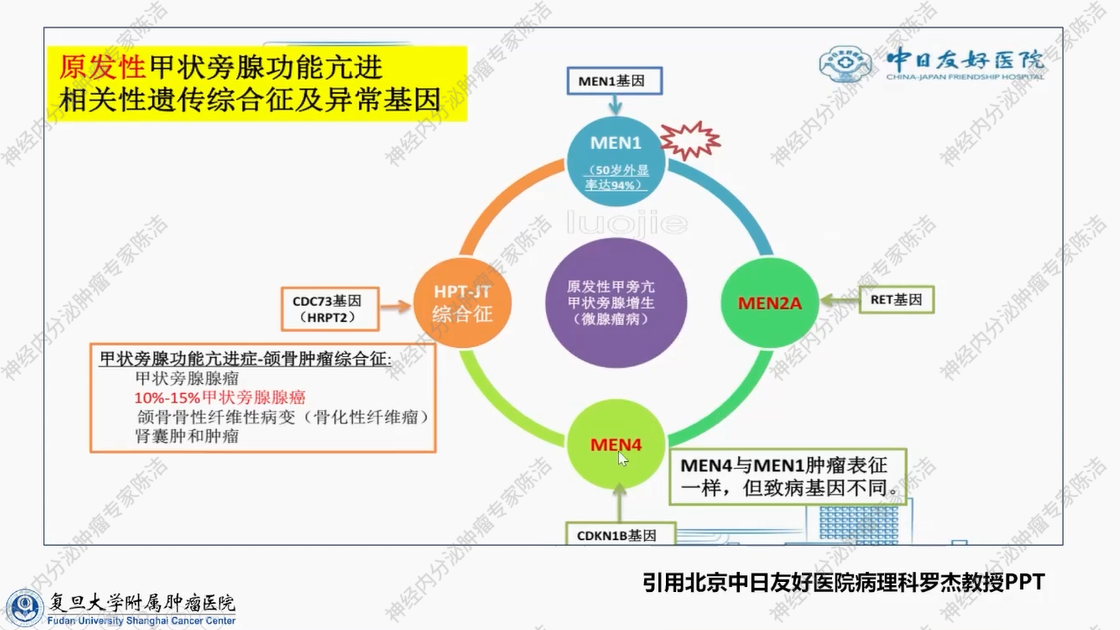
以上内容聚焦于同一内分泌器官所发生的肿瘤,需考虑其可能涉及不同致病基因的突变。
常见遗传性神经内分泌肿瘤综合征解析与病例分享
多发性内分泌腺瘤病1型(MEN1)
多发性内分泌腺瘤病1型是一种常染色体显性遗传病,男女发病率大致相同,其主要遗传学基础为MEN1基因的突变。MEN1基因本质上是一种抑癌基因,该基因编码产生的menin蛋白质具有多种功能。当MEN1基因发生突变后,患者临床表现中最为常见的是原发性甲状旁腺功能亢进症,进而导致高钙血症、低磷血症、骨质疏松、肾结石等,部分患者以这些症状作为首诊表现,通过进一步检查发现其患有遗传相关的神经内分泌肿瘤。第二常见的临床表现是胰腺或十二指肠区出现神经内分泌肿瘤。该部位的神经内分泌肿瘤中,胃泌素瘤最为常见,其次为胰岛素瘤,临床上可表现为卓艾综合征或 Whipple三联征。此外,垂体前叶内分泌肿瘤也较为常见,其中泌乳素瘤最为多见,女性患者可出现泌乳和闭经等症状。同时,还可能出现肾上腺皮质增生、肿瘤及前肠神经内分泌肿瘤,包括胸腺或支气管类癌、非典型类癌等情况。

以下为多发性内分泌腺瘤病1型的诊断标准,事实上,该诊断标准在多种遗传相关性神经内分泌肿瘤中大致相似。其一,出现两个或以上部位的MEN1相关内分泌肿瘤。若仅一个部位存在内分泌肿瘤,但一级亲属已确诊为多发性内分泌腺瘤病1型,亦可诊断。或者,若不满足前两项条件,而是通过家系筛查发现存在MEN1基因的胚系致病突变,同样可确诊。治疗原则方面,手术仍是主要治疗方式,特别是针对一些功能性神经内分泌肿瘤,以及引发明显占位症状的情况。当患者存在甲状旁腺功能亢进时,需优先处理甲状旁腺腺瘤。因为甲状旁腺腺瘤所致的严重高钙血症会影响其他部位手术的麻醉及手术治疗,高钙血症本身是一种危险状况。对于无法进行手术切除或存在远处转移的神经内分泌肿瘤,可选择药物治疗,包括生物靶向治疗和化疗等。垂体神经内分泌肿瘤根据分泌激素的不同,有不同的药物治疗方案。最常见的泌乳素瘤,主要药物为溴隐亭。

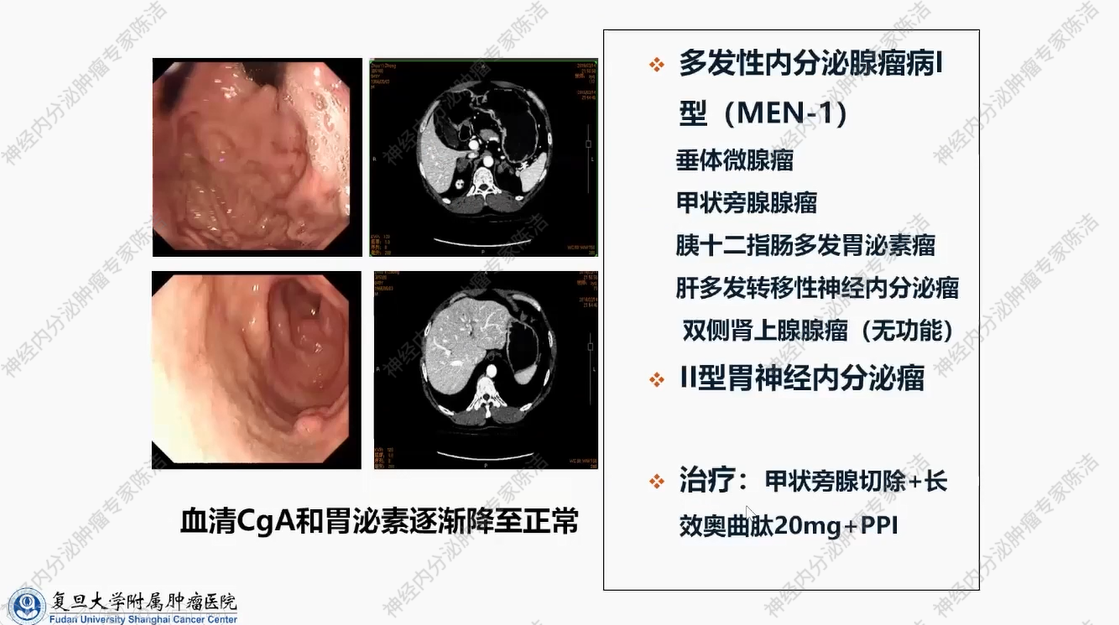
患者为男性,50岁。主因反复腹泻、伴反酸、烧心7年余,PPI治疗后可明显缓解而就诊。实验室检查:空腹血清胃泌素高达3403.29 pg/ml,CgA高达4258.92 ng/ml,甲状旁腺素717.00 pg/ml,血钙3.50 mmol/L,均显著升高。全身CT提示垂体右侧微小腺瘤;双侧甲状旁腺腺瘤;胃窦部、十二指肠降部、肝脏S2、7及胰体尾部多发强化结节,胃体-胃窦、十二指肠水平部、空肠不规则增厚;双侧肾上腺多发结节;双肾多发结石。病理提示胃及十二指肠神经内分泌肿瘤,G1,其中十二指肠肿瘤Gastrin染色阳性;胚系基因检测:MEN1基因杂合突变。
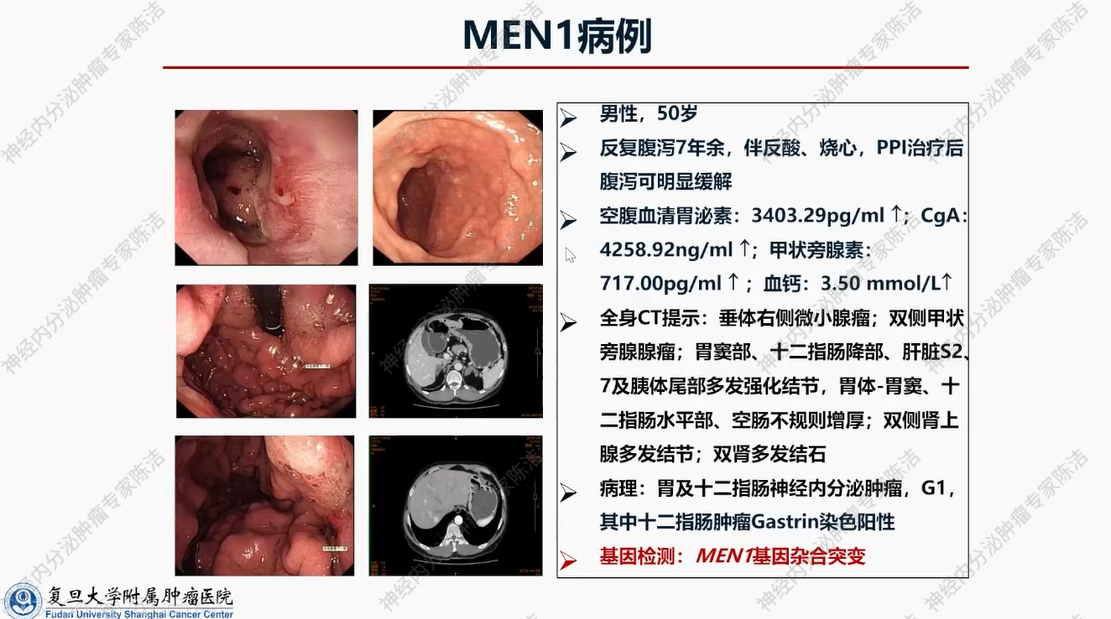
此为一例极具代表性的病例,患者诊断为多发性内分泌腺瘤病1型,累及垂体、甲状旁腺以及胰十二指肠多发胃泌素瘤,且已发生肝转移,双侧肾上腺存在无功能性腺瘤。此外,因胃泌素瘤的影响,患者胃部出现2型胃神经内分泌肿瘤。尽管该病例诊断较为复杂,但其治疗方式相对简单。首先,优先处理甲状旁腺,采取手术切除的方式,纠正高血钙问题。此后,针对患者其他部位的肿瘤,采用20mg长效奥曲肽进行治疗,该治疗方案目前已持续8年。在此期间,患者体内所有肿瘤均处于稳定或消退状态,尤其是胃部的2型胃神经内分泌肿瘤,经此治疗后逐渐自行消退。
多发性内分泌腺瘤病2型(MEN2)
多发性内分泌腺瘤病2型是一种罕见的常染色体显性遗传病,由位于10号染色体(10q11.21)区域的RET原癌基因的胚系激活突变所导致。RET原癌基因发生突变后,在临床上可引发甲状腺髓样癌,该疾病几乎在所有多发性内分泌腺瘤病2型患者中出现。此外,肾上腺嗜铬细胞瘤和甲状旁腺瘤也较为常见。MEN2可进一步分为三个临床亚型,不同临床亚型具有不同的临床表现,这三个临床亚型包括 MEN2A、MEN2B以及家族性甲状腺髓样癌(FMTC)。MEN2A还可表现有甲状旁腺功能亢进,皮肤呈现典型的苔藓样淀粉样变,也可能出现先天性巨结肠;MEN2B患者还可以表现为特殊面容,马凡综合征体型,具有较高的辨识度,舌部常出现舌黏膜神经瘤,肠道可出现神经节瘤等;FMTC基本仅表现为甲状腺髓样癌,较少发生其他肿瘤及病变。

MEN2的诊断仍需结合临床表现、实验室检查以及家族史,RET基因测序是确诊的重要手段。由于MEN2患者绝大多数会出现甲状腺髓样癌,因此甲状腺髓样癌的标志物,如血清降钙素和癌胚抗原,是最为关键的标志物。针对甲状腺及其他受累部位,需开展包括B超、CT及各类功能影像学检查等一系列检查,以对肿瘤进行全面诊断。MEN2患者所患嗜铬细胞瘤通常为双侧性。若其具有激素分泌功能,需关注血、尿儿茶酚胺水平的检测。手术是MEN2的主要治疗方式。MEN2所涉及的甲状腺髓样癌或嗜铬细胞瘤,临床上恶性程度相对更高,尤其是甲状腺髓样癌,其病灶一般呈双侧多发,且RET基因存在不同的突变位点,导致甲状腺髓样癌的恶性程度各异。其中,有一种M918T的突变,属于极高危突变。一般而言,携带此类突变的患者,若出生时经基因检测确诊存在该基因突变,应立即施行预防性全甲状腺切除术。因为这类患者日后100%会罹患高度恶性的甲状腺髓样癌。这体现了该基因突变位点与临床表现之间的关联。此外,必须重视嗜铬细胞瘤的存在,若MEN2患者伴有嗜铬细胞瘤,在手术顺序上应优先处理嗜铬细胞瘤。否则,严重高血压会增加其他部位肿瘤手术的风险。对于少数合并甲状旁腺肿瘤的患者,则需进行甲状旁腺次全切除术。对于转移性甲状腺髓样癌,可采用一系列针对RET基因突变的靶向药物治疗。在化疗方面,目前相关证据较少,主要是以达卡巴嗪为基础的化疗方案。另外,对于高肿瘤突变负荷的患者,可尝试PD-1抗体治疗。

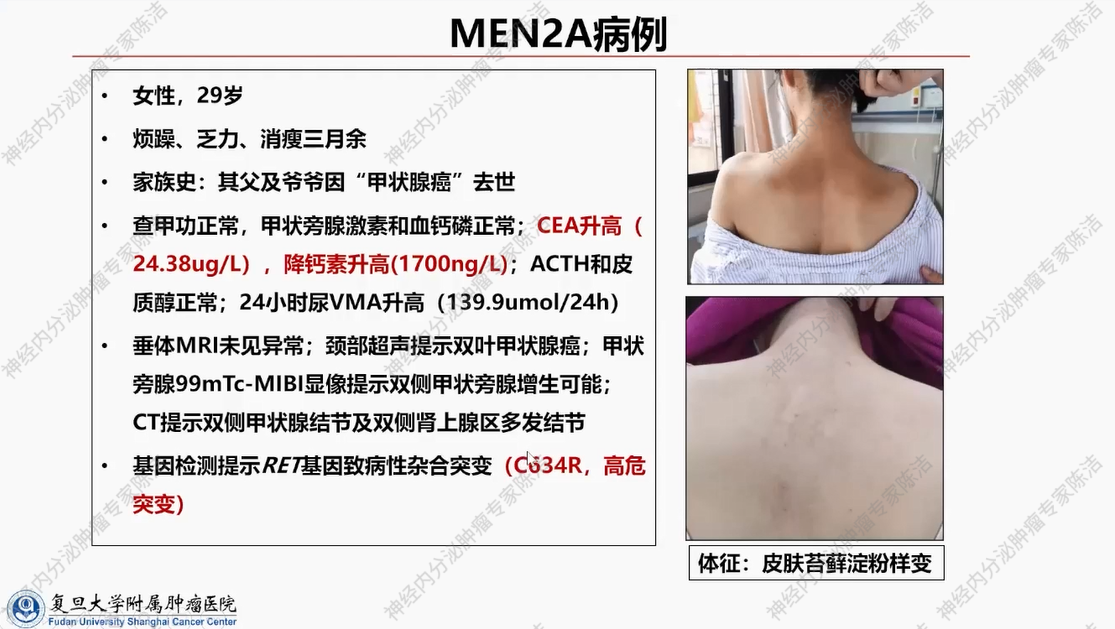
患者为29岁女性。主诉“烦躁、乏力、消瘦3月余”。有甲状腺癌的家族史。外院检查发现血清CEA和降钙素水平显著升高。影像学检查提示双侧甲状腺和双侧肾上腺存在病变。此外,患者具有典型的皮肤体征,表现为苔藓样淀粉样变。对该患者进行基因检测,结果显示其RET基因存在致病性杂合突变,具体为C634R突变,此突变属于RET基因的高危突变。
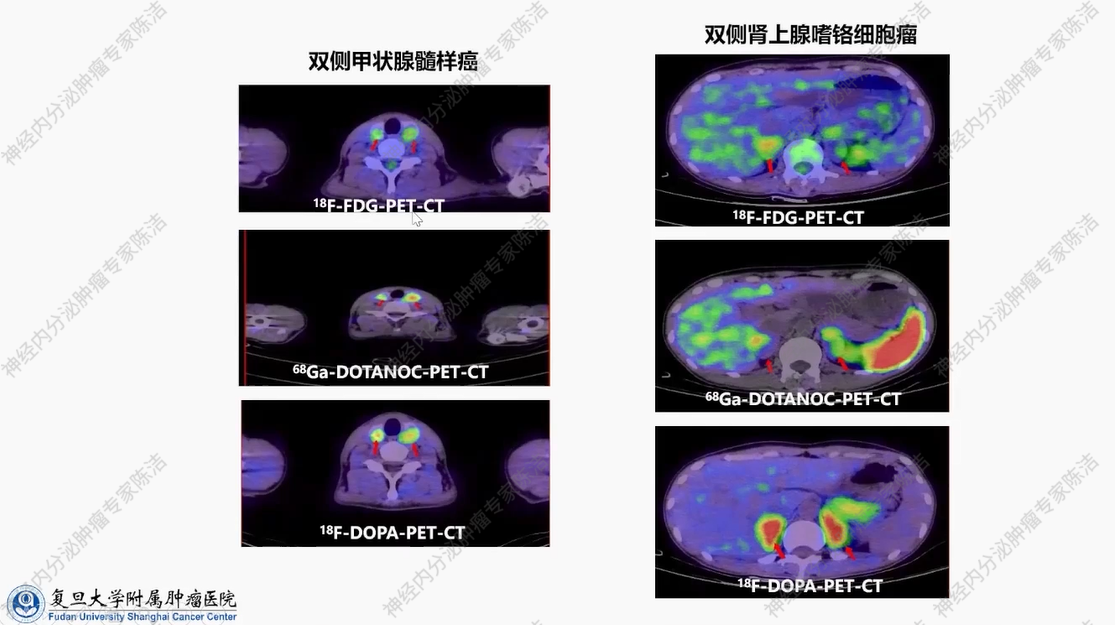
18F-FDG-PET-CT、68Ga-DOTANOC-PET-CT、18F-DOPA-PET-CT三种PET-CT检查均证实双侧甲状腺髓样癌及双侧肾上腺嗜铬细胞瘤的存在。
治疗上先行腹腔镜下左肾上腺嗜铬细胞瘤切除术,右侧肾上腺次全切除术。待病情稳定后,再行甲状腺全切+双侧中央区淋巴结清扫。术后病理确诊为肾上腺嗜铬细胞瘤及甲状腺髓样癌。患者目前定期复查并接受甲状腺激素替代治疗。

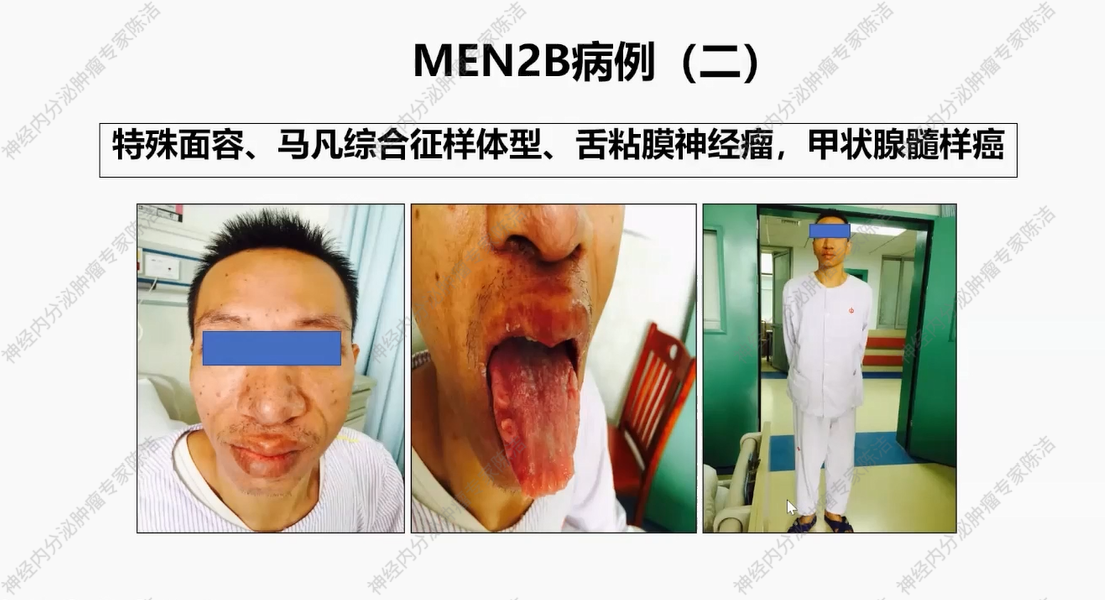
患者为21岁男性。主诉自3岁起出现进行性排便困难。在患者就诊时,可见嘴唇增厚,舌面多发结节,肛周肿物,几乎将肛门完全堵塞。实验室检查显示,患者降钙素及CEA水平显著升高。CT提示双侧甲状腺低密度灶、肛周肿块,并发现肠道壁弥漫性增厚,符合胃肠道神经节瘤病表现。结合其特殊面容,对其进行RET基因突变检测,结果发现为M918T突变,是最高风险级别的突变。进一步检查发现,该患者父母均未携带致病突变基因,此患者为新发突变病例。该患者最终被诊断为多发性内分泌腺瘤病2B型(MEN2B)。遗憾的是,由于患者成年后才被发现存在该级别突变,确诊时甲状腺髓样癌已出现肛周广泛转移,且双侧甲状腺均受累及。患者入院后,接受了一系列综合治疗,从确诊至最终离世,生存期约为两年。此病例凸显了MEN2B型的高度恶性及早期诊断的重要性。
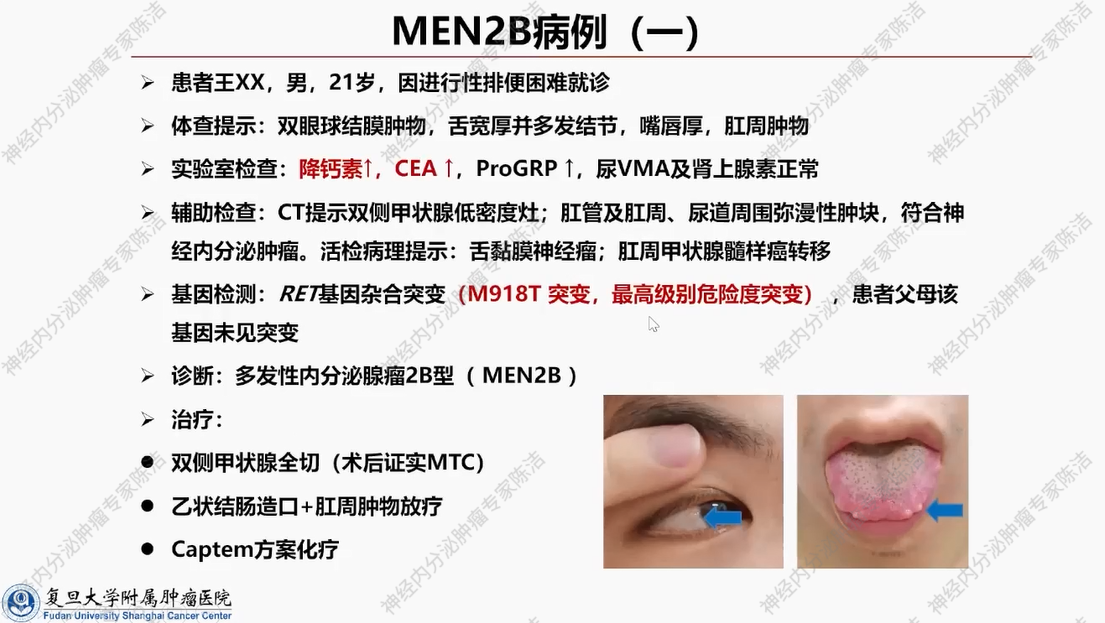
MEN2B患者具有极为特殊的体貌特征,如下图所示,可见患者嘴唇通常较厚,体型呈现出马凡综合征样特征。舌部常伴有黏膜神经瘤。甲状腺髓样癌在MEN2B患者中的发生率近乎100%。鉴于此,临床上一旦观察到具有上述典型体貌特征的患者,即便未进行基因检测,也应高度怀疑其为MEN2B患者。
多发性内分泌腺瘤病4型(MEN4)
多发性内分泌腺瘤病4型是一种常染色体显性遗传疾病,临床表现与MEN1类似,主要区别在于无MEN1基因突变,而是CDKN1B基因发生突变,不同的基因突变导致了相同的临床表型。多发性内分泌腺瘤病4型(MEN4)极为罕见,在临床治疗中,主要参考MEN1的治疗原则。
(补充:CDKN1A及CDKN1C突变亦可能引起MEN4)

Von Hippel-Lindau(VHL)综合征
林道综合征是一种相对常见的遗传相关性神经内分泌肿瘤,由VHL基因突变所致。VHL基因作为一种抑癌基因,是缺氧诱导因子信号通路关键的基因。其基因突变形式包括错义突变、基因删除或截断。临床上,依据不同的基因异常表现,该综合征呈现出不同表型,主要分为Ⅰ型和Ⅱ型,其中Ⅱ型又可细分为A、B、C三种。不同的基因异常类型对应着不同的临床表型,临床上可表现为血管母细胞瘤、肾透明细胞癌、胰腺神经内分泌肿瘤以及嗜铬细胞瘤。当患者出现上述临床表现时,应考虑是否为VHL综合征。

VHL综合征的诊断如下图所示。若缺乏家族史,则需出现两个或两个以上器官受累的情况,或者直接进行VHL基因突变检测,若发现致病突变,亦可确诊。在治疗方面,由于VHL综合征相关肿瘤的总体恶性程度并非极高,临床上通常会采取相对保守的治疗方式。然而,若出现视网膜血管母细胞瘤,因其会对患者视力产生影响,甚至可能导致失明,故需尽早发现并处理。在药物治疗上,鉴于VHL综合征涉及血管形成通路的核心问题,在靶向药物的选择上,重点会选用TKI类抗血管生成靶向药物。当然,对于部分胰腺神经内分泌肿瘤或肾癌,也会使用mTOR抑制剂。这两类药物可同时用于治疗胰腺神经内分泌肿瘤和肾脏透明细胞癌,因此是优先选择的药物。
(补充:针对VHL基因突变,新药贝组替凡被证实能有效控制VHL综合征相关肾癌和胰腺神经内分泌肿瘤,已于近期在中国被批准上市)

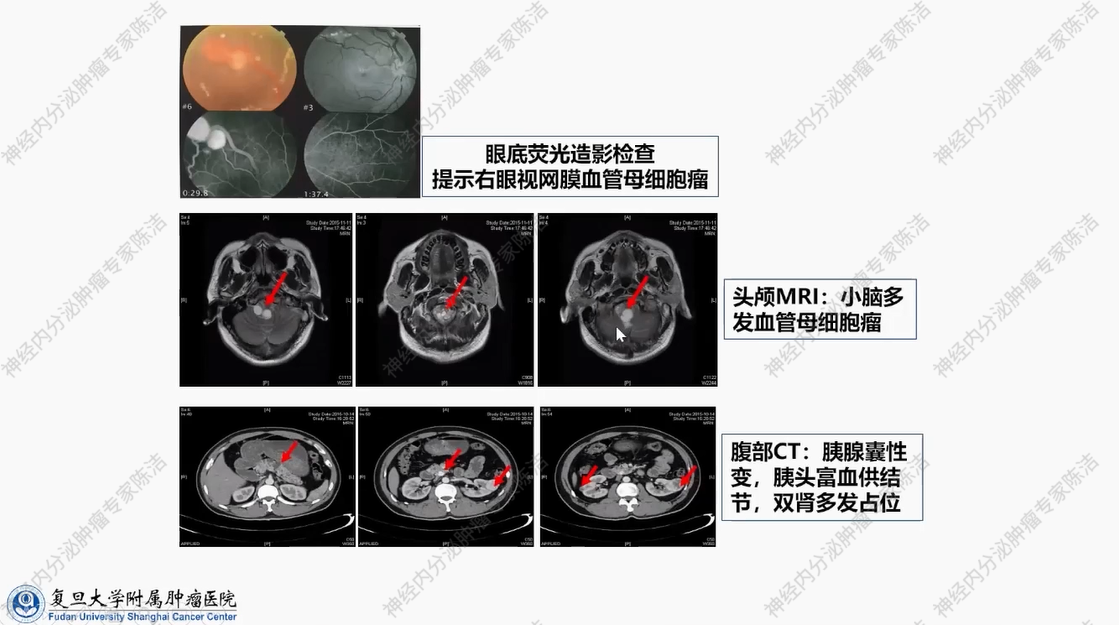
患者为42岁男性。主诉为“脐周不适伴左下肢麻木1月余”。患者既往有眼底动脉瘤病史,曾多次接受激光治疗,且有相关家族史。CT检查发现胰头和钩突富血供结节,双肾有多发占位;MRI提示小脑多发血管母细胞瘤;肾脏病理活检结果为透明细胞癌。在胰腺方面,功能影像学检查提示为神经内分泌肿瘤,基因检测发现VHL基因存在错义突变。针对该病例的治疗,主要是切除小脑的血管母细胞瘤,以缓解因脑部血管母细胞瘤占位所引发的症状。鉴于患者同时患有多发性肾癌和多发性胰腺神经内分泌肿瘤,在药物治疗上选用舒尼替尼,以期对两种肿瘤实现兼顾治疗。

该患者眼底造影提示其右眼视网膜血管母细胞瘤,同时,脑部MRI提示小脑多发血管母细胞瘤,其形态特征较为显著。此外,患者还被诊断出患有胰腺神经内分泌肿瘤和肾癌。
1型多发性神经纤维瘤病(NF1)
NF1相对少见,该疾病与抑癌基因NF1的突变相关,其临床表现较为多样,涵盖皮肤的典型病变,如多发神经纤维瘤、牛奶咖啡斑等。同时,该病可累及骨骼、心血管系统和神经系统,导致多种肿瘤的发病风险升高。在NF1基因突变的患者中,有一小部分会出现神经内分泌肿瘤,此类肿瘤通常好发于十二指肠壶腹部。临床上,患者常因壶腹部肿瘤引发黄疸、腹痛等症状前来就诊。

诊断标准如下图所示,即满足这一系列诊断标准中的两点及以上。通常情况下,皮肤神经纤维瘤无需进行特殊治疗。然而,若为丛状纤维瘤,则应尽可能实施手术切除。其他与NF1相关的肿瘤,其治疗原则仍以手术切除为主要方式。但倘若无法进行手术切除,则需依据不同部位的肿瘤开展相应的内科治疗。

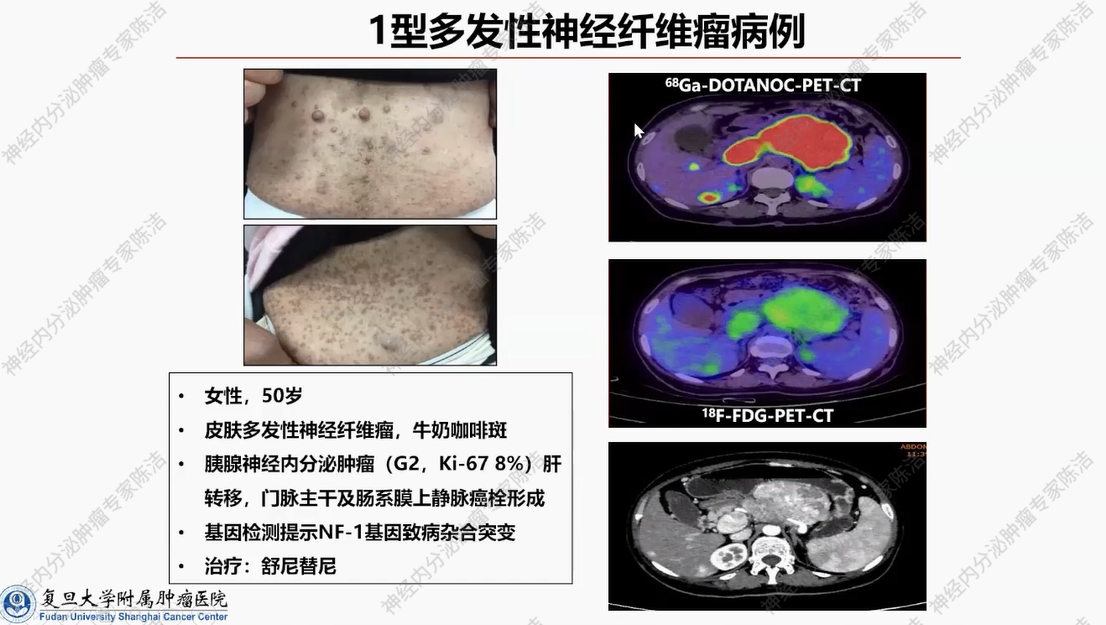
患者为50岁女性。患者体表可见明显的牛奶咖啡斑及多发性纤维瘤,呈现出极为典型的体征。患者就诊时间较晚,来院时胰腺神经内分泌肿瘤已发展至较大体积。随后,对其进行了NF1基因的突变检测。经检测发现,存在NF1基因胚系杂合突变。目前,患者采用舒尼替尼抗血管生成靶向药物治疗。
结节性硬化症(TSC)
TSC在神经内分泌肿瘤领域相对较为罕见,不过在神经内科的出现频率可能稍高。它是由TSC基因突变(TSC1或TSC2基因)导致的临床上以全身多器官形成错构瘤为特征的临床综合征。TSC基因突变的情况较少,约1%~5%的患者会出现胰腺神经内分泌肿瘤,包括胃泌素瘤、胰岛素瘤以及无功能胰腺神经内分泌肿瘤,其他神经内分泌肿瘤则相对罕见。

由于TSC诊断标准存在较多条目,难以全部记忆,可参考图中相应标准。手术是部分患者适合的治疗方式,例如当患者出现中枢神经系统受累时,可能需要切除中枢神经系统的错构瘤。若胰腺神经内分泌肿瘤体积足够大,也需进行手术治疗。若患者无法接受手术,鉴于mTOR受体信号通路是TSC的关键靶点,以依维莫司为代表的mTOR抑制剂是治疗TSC相关性的皮肤病变及肿瘤的有效药物。

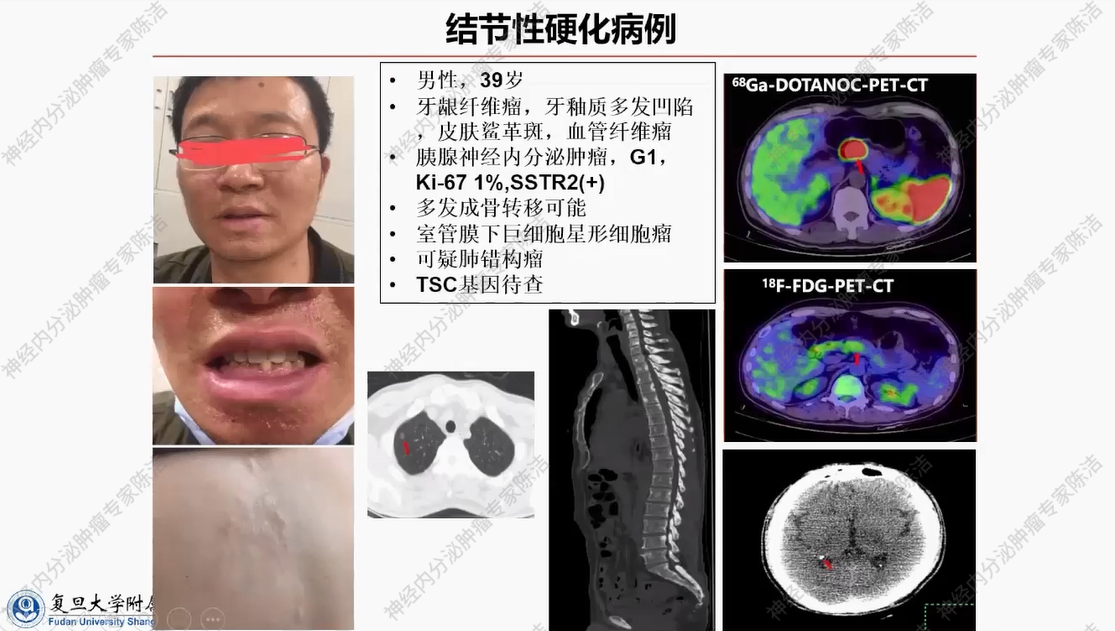
患者为39岁男性。临床表现为牙龈纤维瘤,牙釉质呈现多发凹陷,皮肤可见鲨革斑及血管纤维瘤。此外,胰腺存在体积较小、生长抑素受体呈阳性表达的神经内分泌肿瘤,中枢神经系统有室管膜下巨细胞星形细胞瘤,肺部还存在可疑囊腔。上述多部位受累表现均符合TSC的特征。基于临床表现,该患者可临床诊断TSC,但患者拒绝进行TSC基因检测。在治疗方面,患者拒绝接受胰腺神经内分泌肿瘤的手术治疗,目前仅给予生长抑素类似物进行维持治疗。
遗传性副神经节瘤/嗜铬细胞瘤
遗传性副节瘤/嗜铬细胞瘤多由一系列琥珀酸脱氢酶(SDH)抑癌基因突变引发,是一类常染色体显性遗传病。在临床上,主要表现为多部位副神经节瘤和(或)嗜铬细胞瘤。副神经节瘤或嗜铬细胞瘤可为无功能性或功能性,若为功能性,患者早期常出现因儿茶酚胺过量分泌导致的高血压等症状。此类患者发生肾癌、胃肠道间质瘤或垂体肿瘤的风险高于普通人群。手术是主要治疗方式,但需注意,若存在儿茶酚胺分泌,术前需使用α受体拮抗剂稳定血压。晚期患者的治疗手段有限,生长抑素受体表达阳性者可尝试生长抑素类似物或PRRT治疗,疾病进展或生长抑素受体表达阴性者,可以采用CVD化疗方案,或以替莫唑胺等烷化剂为基础的化疗,也可选择131I-MIBG核素治疗(MIBI显像阳性者)。总体而言,其治疗效果较上皮型神经内分泌肿瘤欠佳。

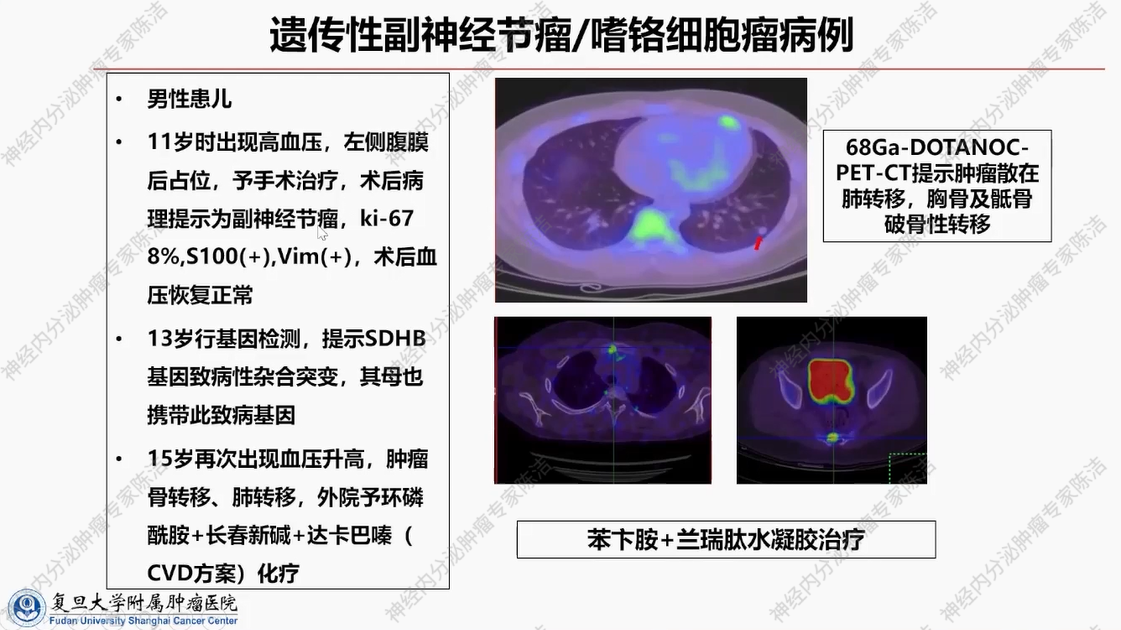
患者为男性患儿。该患者11岁时开始出现高血压症状,影像学检查提示左侧腹膜后占位性病变,经手术切除后确诊为副神经节瘤。鉴于发病年龄小,13岁时对其进行基因检测,结果显示为SDHB基因致病突变。其母亲亦携带该致病基因,表明该致病基因由母亲遗传给患者。患者15岁时,因血压升高就诊,发现存在骨转移与肺转移情况。外院采用CVD方案对其进行化疗。后患者转至我院时,经评估发现其肿瘤负荷较低,且生长抑素受体显像呈阳性。基于此情况,我院停止了副作用较大的化疗方案,仅给予苯苄胺+兰瑞肽水凝胶进行维持治疗。目前,该患者一般状况良好。
遗传性甲状旁腺功能亢进2型(HRPT2)
HRPT2较为罕见,属于常染色体显性遗传疾病,其发病与染色体1q25-31上HRPT2(又名CDC73)基因相关。以原发性甲状旁腺功能亢进、上下颌骨肿瘤形成为主要表现。部分患者可有肾囊肿和(或)尿路肿瘤,部分患者可出现甲状旁腺癌。可用于HRPT2的有效药物较少,手术治疗是HRPT2患者甲状旁腺癌的首选治疗方式。

神经内分泌肿瘤遗传风险评估标准
在遗传性神经内分泌肿瘤综合征的诊疗中,对其遗传风险进行评估至关重要。临床上存在一套评估标准,用以确定哪些患者必须接受致病突变基因检测或进行细致筛查。2021 年,NCCN指南明确提出了该评估标准(具体见下图)。在临床工作中需向患者明确说明并切实执行。

总结与展望
遗传性神经内分泌肿瘤以全身多部位肿瘤形成为特征,这些多部位肿瘤既涵盖神经内分泌肿瘤,也包括非神经内分泌肿瘤。不同的遗传性神经内分泌肿瘤具有不同的致病基因突变,进而导致不同的遗传综合征。即便同一器官的神经内分泌肿瘤,也可能由不同的致病遗传基因引发。由于此类疾病多为常染色体显性遗传,其致病基因会以50%的概率在家族中逐代遗传。在临床诊断方面,需综合运用多种实验室检查与影像学检查手段,以发现不同部位的肿瘤。其中,基因检测是确诊的重要手段。同时,要高度重视患者的家族史与家系调查。对于明确携带相关基因突变的患者及其一级亲属,应进行终身定期随访。早期发现和治疗相关肿瘤,需要采取多学科的个体化治疗策略。

临床医生需提高对遗传性神经内分泌肿瘤的警觉性,但也要避免将双原发或多原发肿瘤误诊为遗传性神经内分泌肿瘤。约20%的神经内分泌肿瘤患者存在双原发或多原发情况,且无明确的致病突变基因。因此,必须准确把握不同遗传性神经内分泌肿瘤综合征的临床表现、累及的部位与器官。对于患者而言,若临床考虑为遗传性神经内分泌肿瘤,应严格遵循医生建议进行基因检测,以明确致病基因。早期检查出相关肿瘤,患者可以获得有效的治疗。对于有生育需求的遗传性神经内分泌肿瘤患者,这一点尤为重要。随着医学的发展,第三代试管婴儿技术已较为成熟,患者可借助该技术生育不携带致病基因的健康后代,从而在这一代阻断致病基因的代际传播。综上所述,无论是临床医生还是患者,都应重视上述要点,以确保患者得到有效治疗,并实现致病基因在家族中的阻断。

更多精彩病例,可点击或复制以下链接,粘贴到浏览器查看神经内分泌肿瘤MDT云诊室-遗传性神经内分泌肿瘤专场回放:
https://doctor.liangyihui.net/#/doc/90543

本文仅供健康科普使用,不能作为诊断、治疗的依据,请谨慎参阅。











 苏公网安备32059002004080号
苏公网安备32059002004080号


