

鳞状细胞癌作为非小细胞肺癌(NSCLC)的第二大组织学亚型,占全部肺癌的25%-30%[1]。数十年来,含铂双药化疗一直是晚期肺鳞癌的标准治疗,但疗效有限,患者的中位总生存期(OS)往往难以突破一年,临床亟需破局之策。本次病例聚焦于一位老年肺鳞癌患者。该患者新辅助治疗后拒绝手术,经放化疗后获得部分缓解(PR),随后以免疫单药维持治疗,疾病保持稳定(SD)。首次进展后,临床再次启用化免联合方案,并将化疗药物优化为长春瑞滨,同时联合抗骨转移治疗。一线无进展生存期(PFS)超过11个月,疗效令人鼓舞。
特邀嘉宾
病例分享专家
汕头大学医学院附属肿瘤医院内五科
从事肿瘤内科工作多年,擅长肺癌、消化道肿瘤、乳腺癌等内科治疗
病例点评专家
汕头大学医学院附属肿瘤医院
世界中医药学会联合会癌症姑息治疗研究专业委员会理事
广东省中西医结合学会理事
广东省中西医结合学会肿瘤免疫专业委员会常委
广东省抗癌协会血液肿瘤学分会委员
广东省抗癌协会姑息委员会粤东分会委员
汕头市抗癌协会常务理事
病例介绍
患者男性,初诊年龄64岁,农民。主诉“右下肺鳞癌综合治疗29月余”。
现病史:患者2023-03-02因反复咳嗽至汕头大学医学院附属第一医院就诊,完善相关检查,CT示:右肺门肿块,约32×35×44mm,病灶侵犯右肺下叶肺动脉主干;左肺结节,肝小结节。基因检测结果示:TP53(65.7%)突变,ROS1(6.1%突变)。诊断:“右肺鳞癌cT2N0M0”。经请胸外科会诊,考虑病灶较大,建议新辅助化疗+免疫治疗后再根据病灶退缩情况评估是否行手术治疗。家属拒绝免疫治疗,2023-03-14予第1周期化疗:紫杉醇脂质体240mg+卡铂500mg。体格检查:ECOG:1分,右肺呼吸音低,心肺(-)。2023-04-24患者转诊我院继续治疗。
既往史:既往体健。
个人史及家族史:有吸烟史,40余年,平均2包/天。
辅助检查:
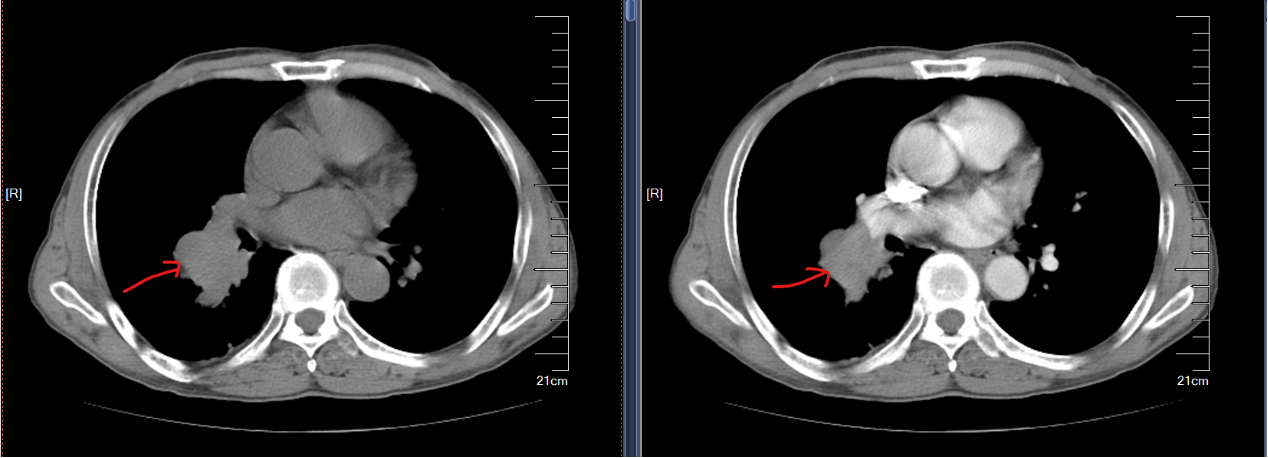
2023-04-24胸部+上腹部+盆腔平扫+增强CT示(图1):1.右肺门肿块约4.2×4.0cm,考虑中央型肺癌,较前未见明显变化;右肺下叶阻塞性炎症,右肺下叶2个结节灶,大小约0.8cm、0.5cm,右下肺内转移可能。2.纵膈、右肺门多发小淋巴结(最大短径约0.7cm)。3.左上肺斜裂旁微小结节,考虑良性可能性大。两下胸膜增厚。4.肝S8微小囊状灶,考虑囊肿可能。5.前列腺钙化。
2023-04-25颅脑MRI示:未见明显异常。
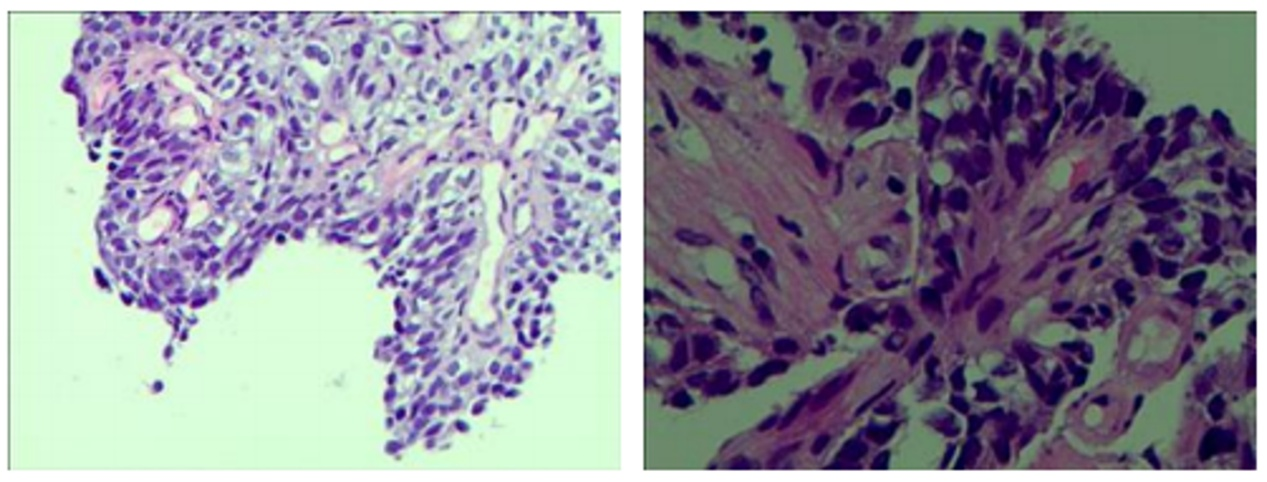
2023-04-24穿刺病理结果示(图2):镜检标本:(右)肺鳞状细胞癌。
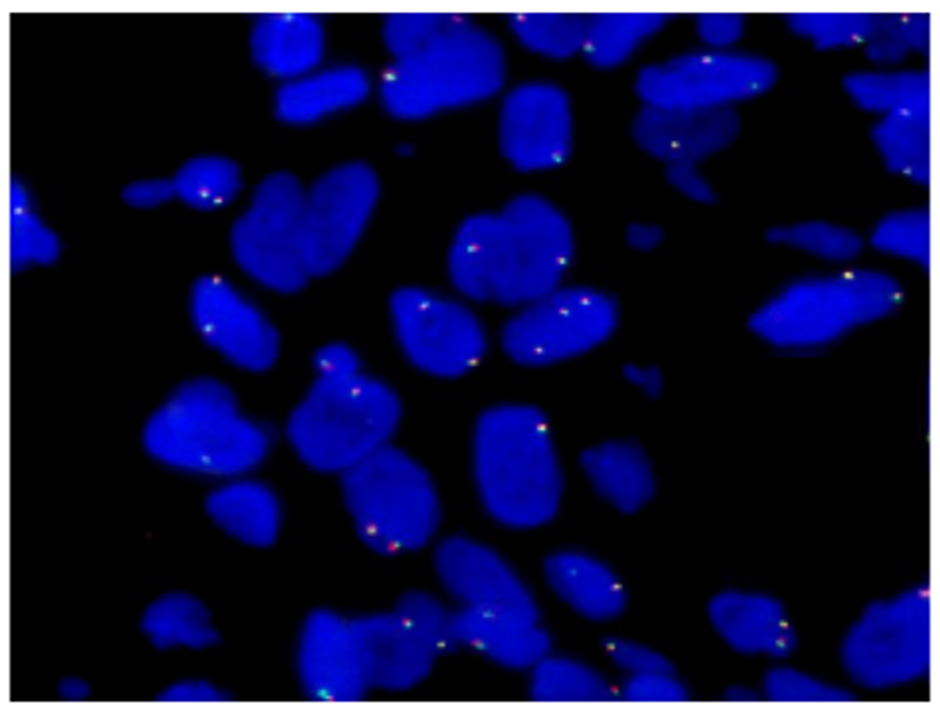
2023-04-28基因检测结果(图3):ROS-1:阴性。
实验室检查:
2023-04-24血常规:白细胞 7.57×109/L,血红蛋白 100.00 g/L,血小板 279.00×109/L,中性粒细胞绝对值 5.25×109/L;
2023-04-24生化:谷丙转氨酶 17U/L,谷草转氨酶 19U/L,白蛋白 44.1g/L,肌酐 75umol/L;
2023-04-24肝炎、HIV:乙肝表面抗原<0.0300IU/mL,Anti-HIV (初筛) 0.062S/CO,Anti-HCV 0.107S/CO,梅毒螺旋体抗体 0.020S/CO;
2023-06-28肿瘤指标:癌胚抗原 22.420ng/mL,细胞角蛋白19片段 4.760ng/mL,神经元特异性烯醇化酶 8.750ng/mL,鳞癌上皮细胞癌抗原1.330ng/ml,胃泌素释放肽前体 35.620pg/mL。
临床诊断:
右下肺鳞癌ⅢB期(cT3N2M0,伴右下肺内转移)
治疗过程及疗效评价:
新辅助治疗:
经会诊,建议患者加用免疫治疗。遂于2023-04-26、2023-05-17开始第2、3周期新辅助化免治疗,具体方案为:信迪利单抗200mg d1+白蛋白紫杉醇400mg d1+卡铂400mg d1,q3w。
治疗过程顺利,2023-06-05复查胸部+上腹部平扫+增强CT示(图4):右肺门肿块,考虑中央型肺癌,右肺下叶阻塞性炎症,较前未见明异变化;右下肺内转移较前缩小。2.纵隔、右肺门多发小淋巴结,大致同前。3.左上肺斜裂旁微小结节,考虑良性可能性大,同前。两下胸膜增厚。4.肝S8微小囊状灶,考虑囊肿可能,大致同前。
疗效评价:SD。
同步放化疗:
经肺癌多学科(MDT)团队讨论,建议:1.行手术治疗。2.若患者拒绝手术,建议行同期放化疗。患者家属拒绝手术,同意行放化疗。
2023-06-28开始放疗:6MV-X线IMRT 5野照射PTV,GTV包括为右肺原发灶、肺内转移灶+右上气管旁、隆突下残余淋巴结,CTV包括GTV外扩0.6cm+右锁骨上、两侧气管旁、隆突下淋巴引流区+GTV对应层面的肺门淋巴引流区,PTV处方剂量为:DT6000cGy/30F/6W,双肺Dmean=1829.2cGy,V20=29.8%,心脏Dmean=1016.2cGy,脊髓Dmax=3956.3cGy,PRVDmax 5058.9cGy。并于2023-06-29至2023-08-01予5周期白蛋白紫杉醇 100mg+卡铂 200mg qw化疗,过程顺利。
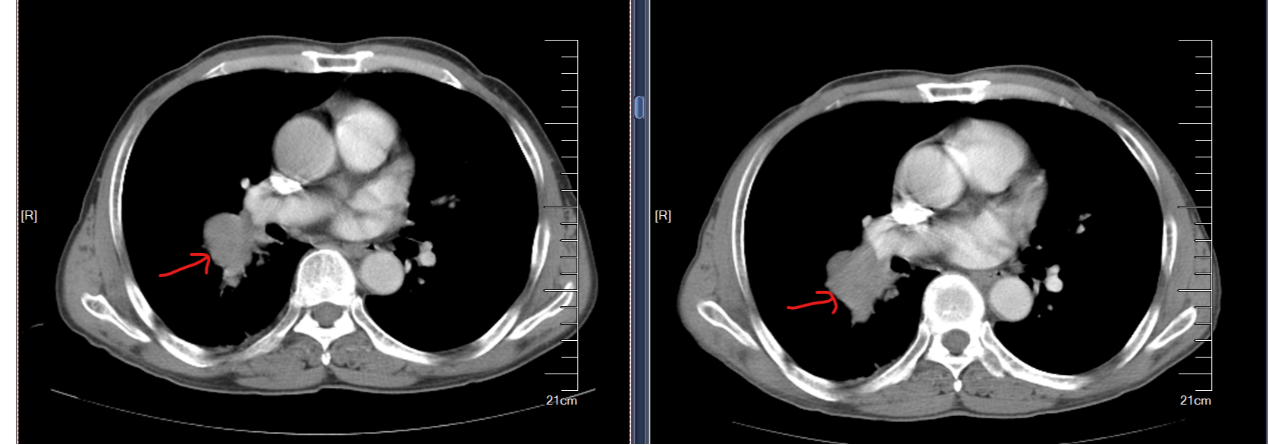
2023-09-11CT示(图5):1.右肺癌放化疗后,较前缩小;右下肺炎症,较前增多;右胸少量积液,较前新见。2.纵隔、右肺门多发小淋巴结,较前缩小。3.左上肺斜裂旁微小结节,考虑良性可能性大,同前。两下胸膜增厚。4.肝S8微小囊状灶,考虑囊肿可能,大致同前。
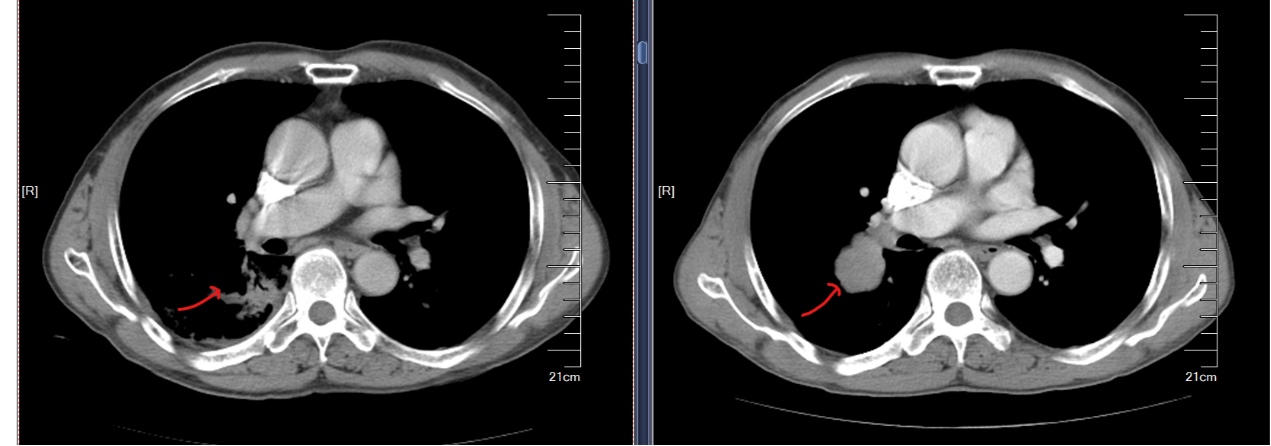
综合疗效评价:PR。
免疫单药维持治疗:
2023-09-11至2024-02-01予8周期信迪利单抗 200mg免疫治疗。2023-11-23,2024-01-30复查CT示SD。
2024-02患者出现背痛,2024-02-26查胸椎MRI示(图6):1、胸6-8所见,未排转移瘤,胸7椎体变扁。2、胸9-腰2椎体脂肪信号普遍减低,考虑骨髓纤维化或其它。
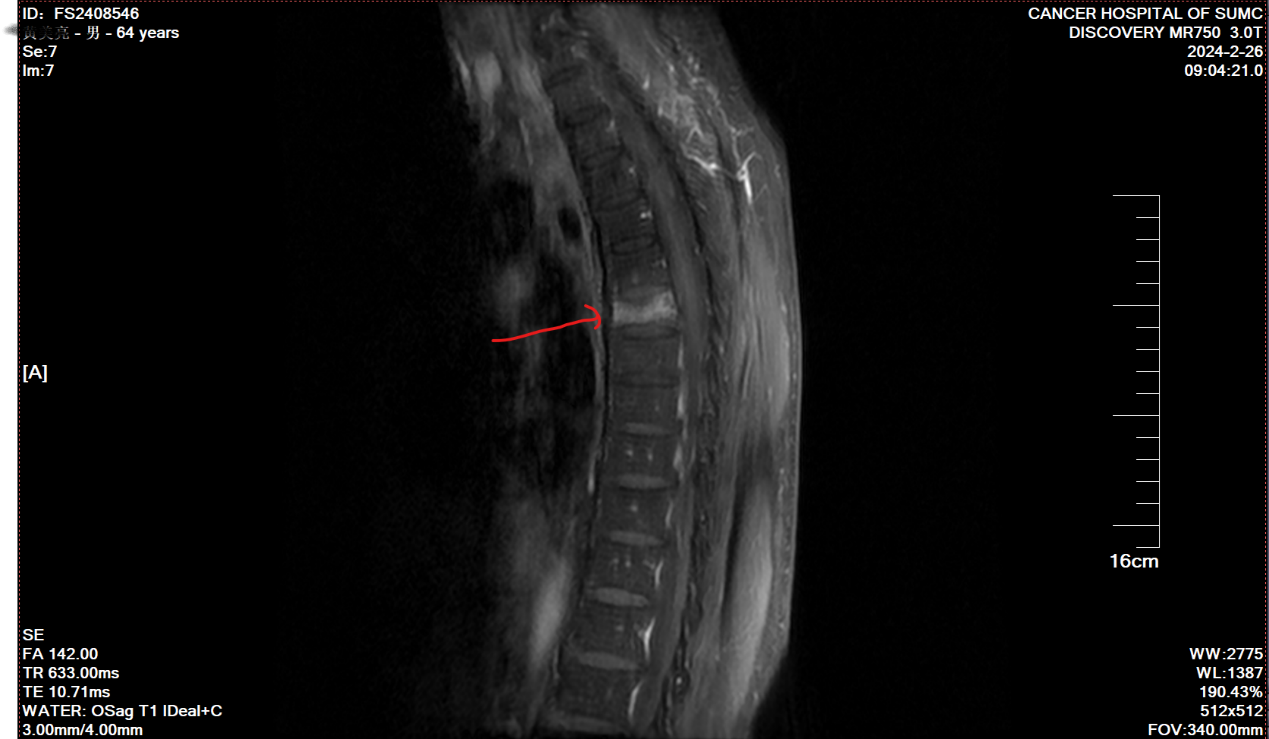
综合疗效评价:PD。
一线治疗:
2024-02-27中心医院ECT示:T7椎体代谢增高灶,请结合临床。到我院放疗科就诊,经评估患者胸椎转移灶放疗范围与2023-06-28胸部放疗靶区重叠,考虑二次放疗危险性大,不建议患者行胸椎转移瘤放疗。
2024-03-21至2025-04-01,行14周期化免治疗,并予抗骨转移治疗,具体方案为:长春瑞滨 80mg d1,8 q3w+信迪利单抗 200mg d1 q3w+地舒单抗 q28d。
2025-04-01复查CT示(图7):1.右肺癌放化疗后,右肺门软组织灶大致同前,右下肺放射性炎症,同前,右胸腔少许积液较前稍减少。2.胸7椎体骨质破坏,考虑骨转移,并病理压缩性骨折,大致同前。3.左上肺斜裂旁微小结节,考虑良性,大致同前。4.肝S8小低密度影,考虑良性,小囊肿可能,大致同前。
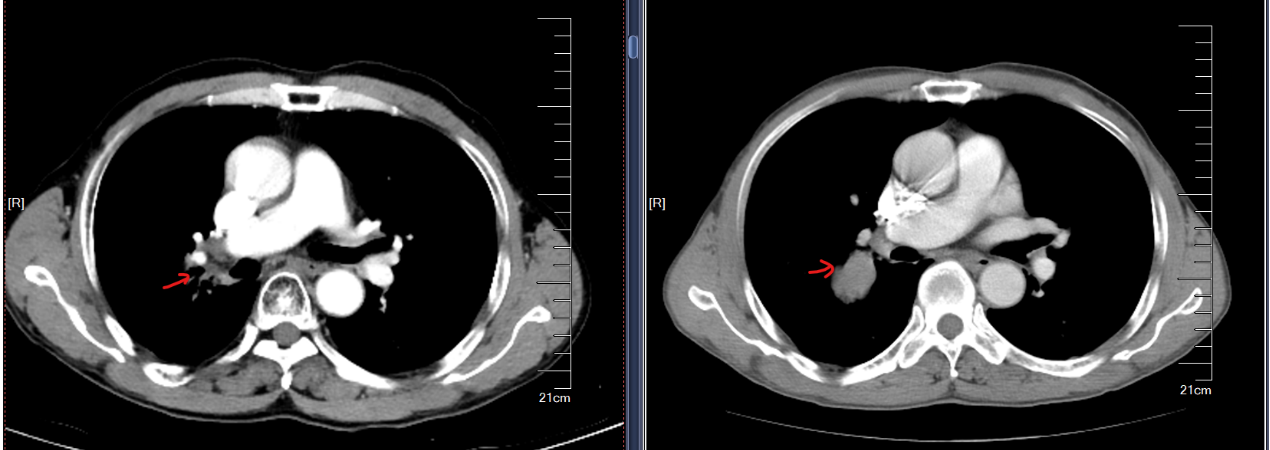
疗效评价:SD。
PFS:11月+。
病例点评
张盛奇教授:本病例为一位初诊64岁男性患者,因“右下肺鳞癌综合治疗29月余”就诊。肺鳞癌由于其独特的临床病理特点如中央型肿瘤、高龄、诊断时分期晚、合并症较多等,使其治疗充满挑战。加之EGFR突变和ALK基因重排等常见驱动基因突变在肺鳞癌中的发生率很低,仅少数鳞癌患者有机会接受EGFR-酪氨酸激酶抑制剂(TKI)或ALK抑制剂治疗[1],传统化疗一度成为唯一支柱。近年来,免疫治疗的突破性进展为肺鳞癌带来了新的希望。该患者晚期一线治疗采用长春瑞滨软胶囊联合免疫治疗,取得了超11个月的PFS,为临床治疗带来了有价值的决策参考。
在诊断方面,外院CT示右肺门肿块,约32×35×44mm,并侵犯右肺下叶肺动脉主干,初步诊断为“右肺鳞癌cT2N0M0”。后复行胸腹部增强CT示右肺门肿块,约4.2×4.0cm,考虑中央型肺癌;颅脑MRI未见转移征。会诊外院穿刺病理结果,结合实验室及影像学资料,最终明确诊断为右下肺鳞癌ⅢB期(cT3N2M0,伴右下肺内转移)。
在治疗方面,ORIENT-12研究显示[2],较于安慰剂联合顺铂/吉西他滨铂(GP),信迪利单抗联合GP方案显著延长患者的中位PFS达6.7个月(vs 4.9个月,HR=0.532,95%CI:0.419-0.674,P<0.00001)。ORIENT-3研究[3]显示,与多西他赛相比,信迪利单抗二线治疗同样显著改善了晚期肺鳞癌的临床获益。
本例患者初诊时肿瘤负荷较大,胸外科会诊建议先行新辅助化免疫治疗,再视病灶退缩情况决定是否手术。患者家属仅接受单纯化疗,拒绝免疫药物。首周期化疗后复查CT 示右肺门肿块未见明显缩小,且疑右下肺内播散,再次建议患者加用免疫治疗。完成第2、3周期化免联合治疗后,病灶达稳定状态。
随后,肺癌MDT综合评估给出“手术、同步放化疗”两条路径。患者及家属明确拒绝手术,遂行同步放化疗并达到PR。其后,继续信迪利单抗维持治疗,4月余后患者出现骨转移。因靶区二次放疗风险高,晚期一线再次启动“化免联合”方案,并同步启动抗骨转移治疗以遏制疾病进展。
化疗作为晚期肺鳞癌治疗的基石,药物遴选决定成败。长春瑞滨作为微管蛋白抑制剂,可精准锁定肿瘤细胞微管蛋白,阻断肿瘤细胞有丝分裂,直接杀伤肿瘤细胞,同时抑制肿瘤血管生成。这种双重作用机制使其对肺鳞癌细胞具有高度选择性,能有效杀伤肿瘤细胞。
既往数据亦显示,口服长春瑞滨软胶囊药代动力学稳定,不受饮食、年龄、人种等因素的影响,长期使用无累积毒性,3-4级治疗相关不良反应发生率低[4]。且口服剂型给药便捷,且能避免静脉炎等注射相关不良反应的发生,缩短住院时间,降低医疗成本,成为临床更优治疗选择[4-8]。
此外,前瞻性研究证实,口服长春瑞滨联合信迪利单抗一线治疗PS≥2或≥75岁的晚期NSCLC患者,中位PFS达9.1个月,客观缓解率(ORR)达39.6%,疾病控制率(DCR)达63.79%,肿瘤标志物水平显著降低,免疫功能得到优化——CD3+、CD4+及CD4+/CD8+升高,而CD8+下降[9]。且安全性良好,不良事件多为1-2级。
基于上述循证依据,本例患者晚期一线采用“长春瑞滨软胶囊+信迪利单抗+地舒单抗”三药联合方案,PFS1超过11个月,疗效确切且耐受性良好。后续治疗仍应动态整合患者意愿、病情变化及既往治疗轨迹,制定个体化精准治疗策略,助力患者实现生存时间与生活质量的双重获益。
[1]高鸣, 周清. 晚期肺鳞癌治疗进展[J]. 中国肺癌杂志, 2020,23(10):866-874.
[2]Zhou C, Wu L, Fan Y, et al. Sintilimab Plus Platinum and Gemcitabine as First-Line Treatment for Advanced or Metastatic Squamous NSCLC: Results From a Randomized, Double-Blind, Phase 3 Trial (ORIENT-12). J Thorac Oncol. 2021 Sep;16(9):1501-1511.
[3]SHI YK, WU L, YU XM, et al. ORIENT-3: A randomized, open-label, phase 3 study of sintilimabversus docetaxel in previously treated advanced/metastatic squamous non-small-ell lungcancer (sqNSCLC). Cancer Res, 2021, 81 (13_ Suppl): Abstract nr CT041.
[4]刘花,陈延绅,尤慧柠,等.长春瑞滨药动学及毒副作用研究进展[J].中国药房,2022,33(11):1403-1408.
[5]林金兰, 郭天兴, 潘小杰, 徐振武. 长春瑞滨软胶囊单药节拍化疗一线治疗老年非小细胞肺癌临床疗效观察[J]. 肿瘤防治研究, 2018, 45(11):909-912.
[6]Andrea Camerini , Cheti Puccetti , Sara Donati ,et al. Metronomic oral vinorelbine as first-line treatment in elderly patients with advanced non-small cell lung cancer: results of a phase II trial (MOVE trial). BMC Cancer . 2015 May 6;15:359.
[7]Yang Y, et al. A randomised, multicentre open-label phase II study to evaluate the efficacy, tolerability and pharmacokinetics of oral vinorelbine plus cisplatin versus intravenous vinorelbine plus cisplatin in Chinese patients with chemotherapy-naive unresectable or metastatic non-small cell lung cancer. J Thorac Dis. 2019;11(8):3347-3359.
[8]Gridelli C, et al. Oral vinorelbine given as monotherapy to advanced, elderly NSCLC patients: a multicentre phase II trial. Eur J Cancer. 2004;40(16):2424-31.
[9]Su W, Li J. Clinical efficacy and safety of sintilimab plus oral vinorelbine as first-line treatment for newly diagnosed stage IIIB-IV nonsmall cell lung cancer patients with performance status 2 or age ≥75 years. Anticancer Drugs. 2025 Jun 1;36(5):401-407.
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


