直肠神经内分泌肿瘤(NET)是胃肠胰神经内分泌肿瘤中最常见类型之一,尤其在中国人群中发病率较高。其临床诊疗,特别是对于直径在1~2cm的肿瘤,治疗方式的选择(内镜下切除或外科根治手术)充满了挑战。本次MDT云诊室由复旦大学附属肿瘤医院陈洁教授多学科团队分享3例具有代表性的直肠NET病例,详细介绍了病例的诊疗全过程,并邀请多位专家共同探讨,旨在梳理直肠NET在诊断、评估以及治疗决策过程中的关键考量因素,探讨内镜下治疗的边界。
病例介绍
病例1:
患者基本情况:女性,44岁。
主诉:体检肠镜发现直肠病变1月余。

诊疗经过:
2025年3月(外院):
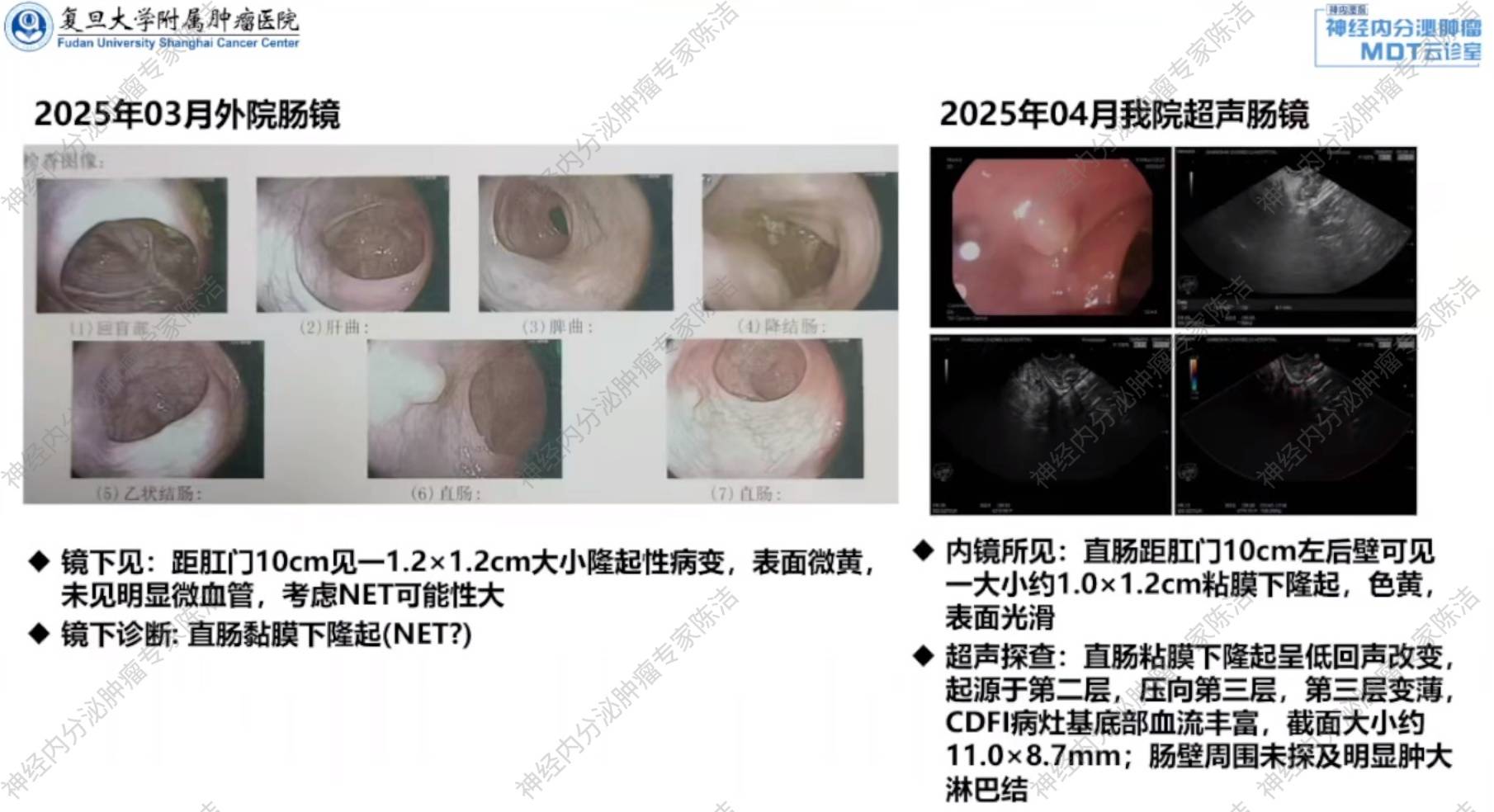
肠镜:距肛门10cm处见一1.2cm*1.2cm大小的隆起性病变,考虑NET可能性大。
腹部增强CT:直肠偏左侧壁结节影。2025年4月(我院):
超声肠镜:距肛门10cm左后壁可见1.0cm*1.2cm黏膜下隆起,呈低回声改变,起源于第二层,压向第三层,CDF病灶基底部血流丰富,未见周围肿大淋巴结。
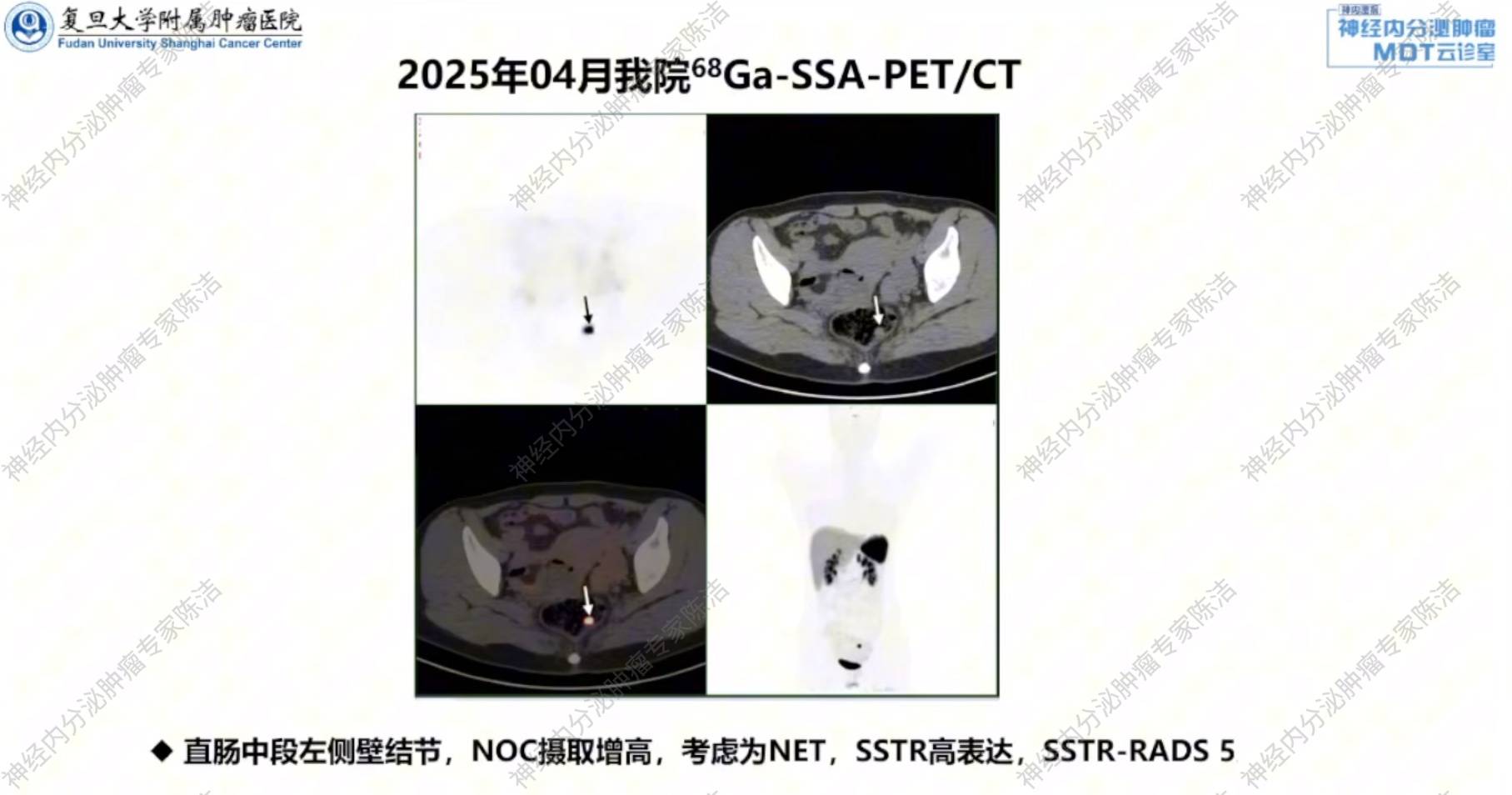
68Ga-SSA-PET/CT:直肠中段左侧壁可见生长抑素受体(SSTR)高表达结节,周围未见明确的淋巴结转移征象。
治疗:2025年4月15日于我院行直肠内镜下黏膜剥离术(ESD)。
术后病理:(距肛10cm 直肠左后壁,ESD)符合NET,G2,肿瘤位于黏膜下,大小1.4cm*1.5cm*0.6cm,脉管(-),神经(-),各切缘均(-);IHC:Syn(+),CgA(+),AE1/AE3(+),Ki-67(+3%),INSM1(+),SSTR2(3+),SSTR5(2+),MGMT(+90%,强)。

病例2
患者基本情况:男性,59岁。
主诉:发现直肠病变1个月。

诊疗经过:
2024年12月(外院):
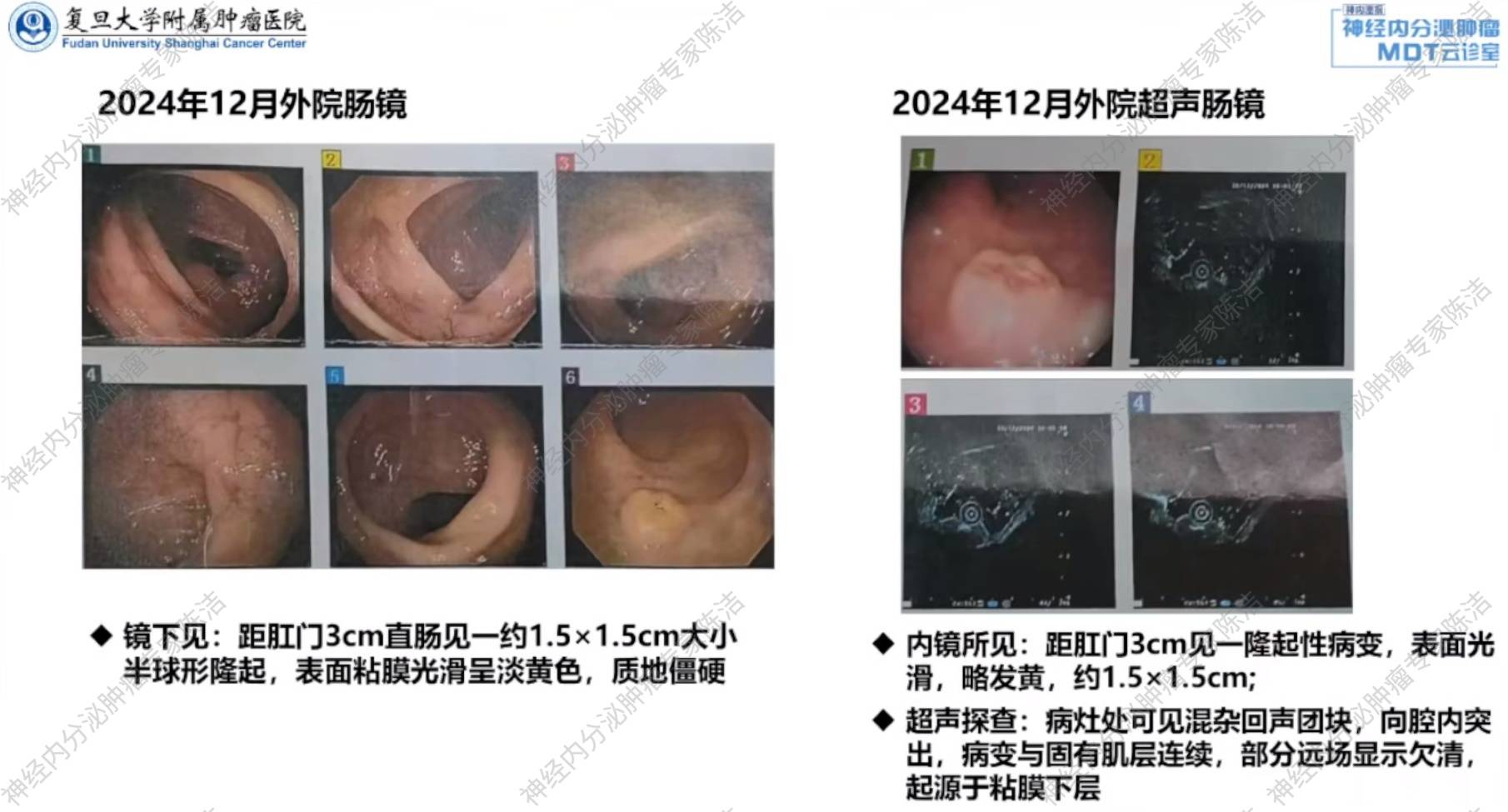
肠镜:距肛门3cm处见一1.5cm*1.5cm半球形隆起,病理提示为直肠增生性息肉。
超声肠镜:距肛门3cm隆起性病灶处可见混杂回声团块,起源于黏膜下层,与固有肌层连接。
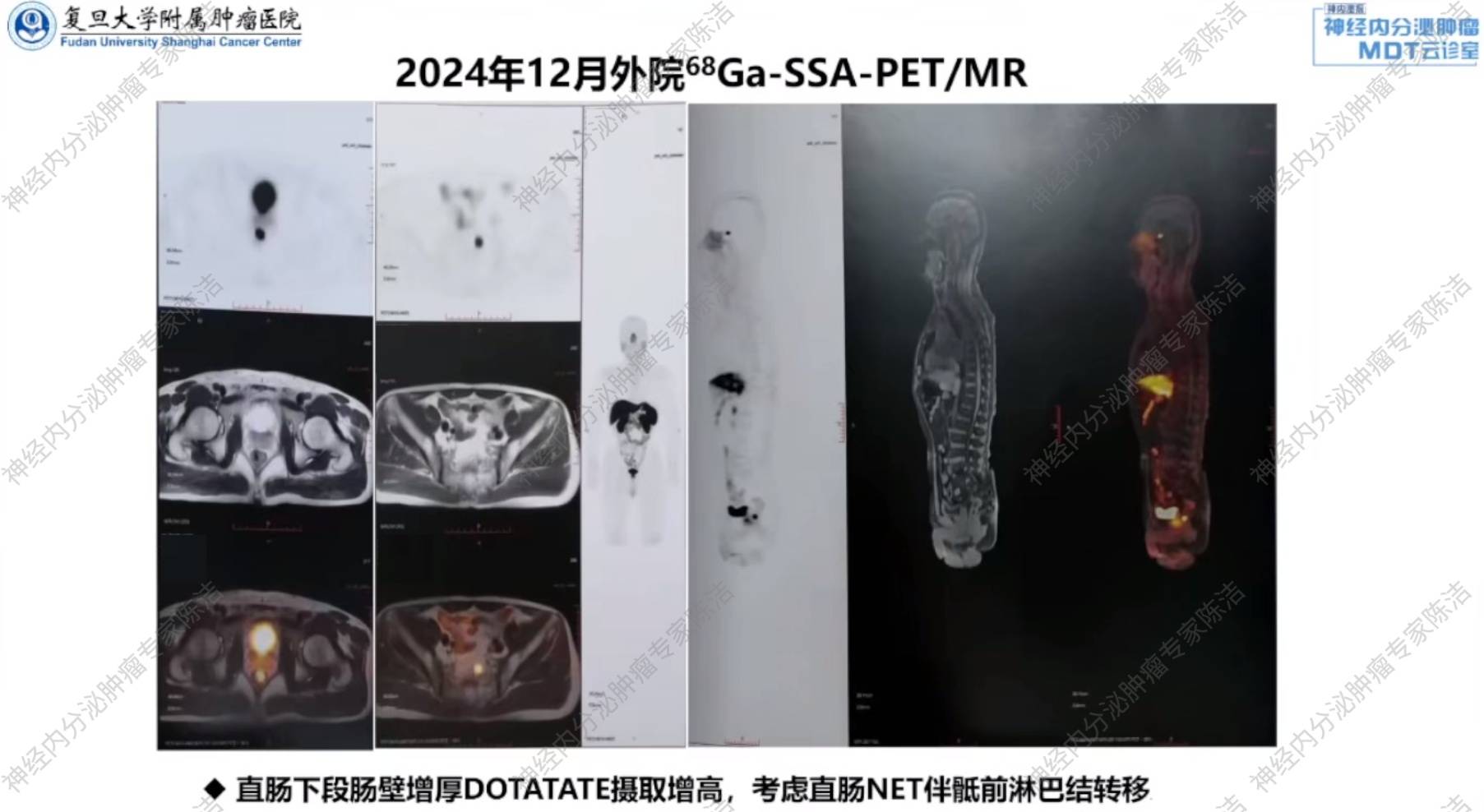
68Ga-SSA-PET/MR:直肠下段病灶DOTATATE摄取增高,考虑直肠NET,骶前亦可见淋巴结转移。
治疗:患者于2024年12月18日行直肠肿物ESD。
术后病理:NET,G1级,大小1.6cm*1.2cm*0.5cm,肿瘤组织位于黏膜肌层及黏膜下层,脉管侵犯(-),基底切缘可见烧灼的肿瘤细胞。免疫组化:CK(+),D2-40(未见瘤栓),CgA(-),Syn(+),SSTR2A(2+),CD31(未见瘤栓),RB(+),Ki-67(+<1%)。

2025年1月(我院):
病理会诊:同意NET G1诊断,确认基底切缘阳性。
盆腔增强CT:直肠ESD术后改变,骶前多发小淋巴结。
治疗:综合评估后,于2025年1月15日行“腹腔镜下直肠DIXON'S术+腹腔镜下盆腔淋巴结清扫术+乙状结肠直肠吻合术+小肠造口术”。

术后病理:切除肠段呈术后改变,未见肿瘤残留;淋巴结清扫22枚,其中2枚可见肿瘤转移(2/22);考虑转移性NET,G1级,Ki-67 1%。

复查:2025年3月盆腔增强CT提示直肠ESD术后改变;2025年5月肠镜检查提示直肠癌术后改变,吻合口炎。
病例3
患者基本情况:男性,25岁。
主诉:发现直肠病变2周。

诊疗经过:
2024年7月(外院):
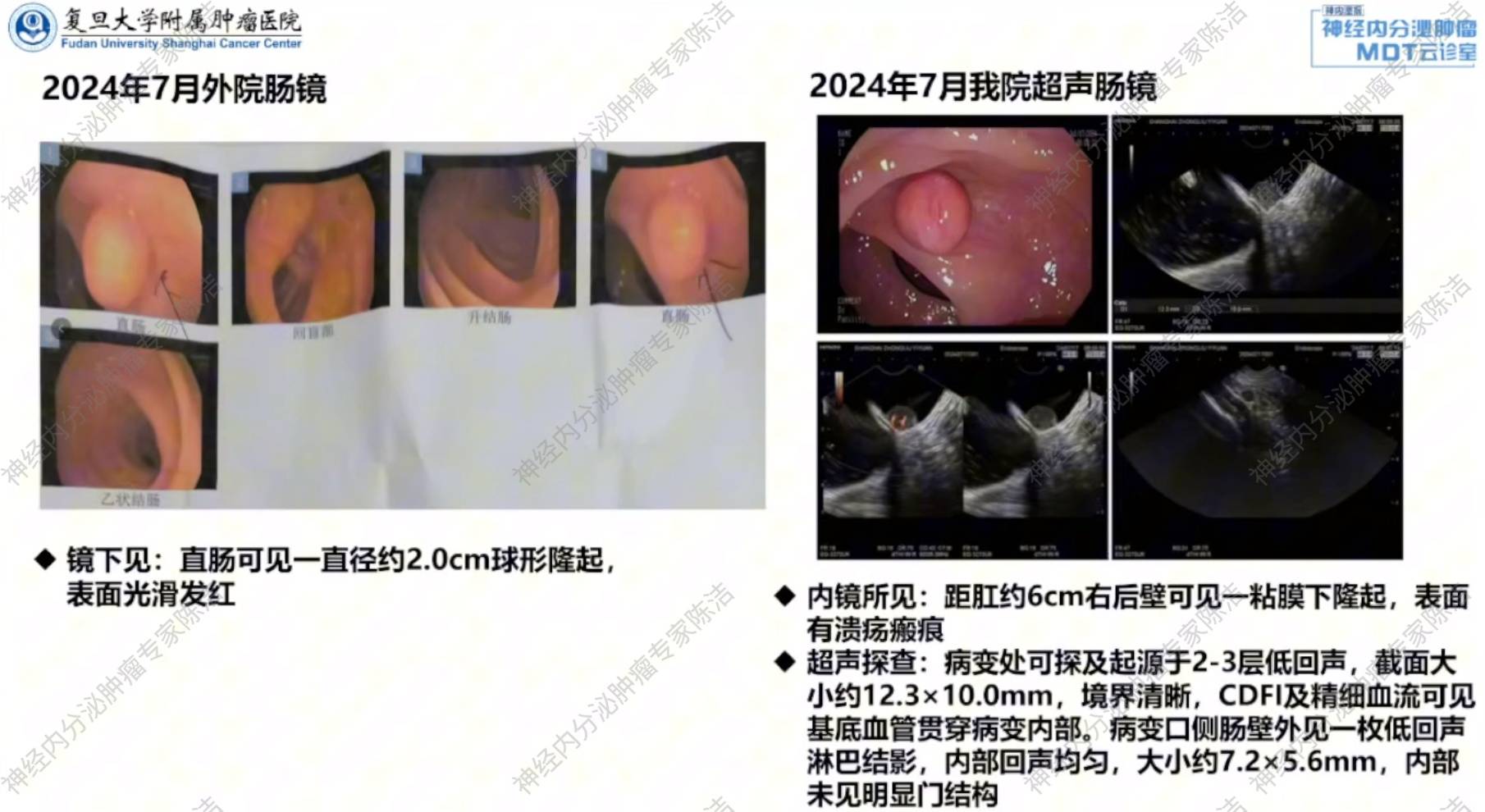
肠镜:直肠可见直径约2.0cm的球形隆起。
内镜活检病理:直肠黏膜间质见巢状、片状细胞巢,倾向于NET。2024年7月(我院):
病理会诊:NET,G1级,Ki-67 1%,SSTR2(3+)。
超声肠镜:距肛门6cm处右后壁可见一黏膜下隆起,表面可见溃疡瘢痕。EUS:病变处可探及起源于2-3层低回声,截面大小约1.23cm*1.0cm,境界清晰。CDFI及精细血流可见基底血管贯穿病变内部。病变口侧肠壁外见一枚低回声淋巴结影,内部回声均匀,内部未见明显门结构。
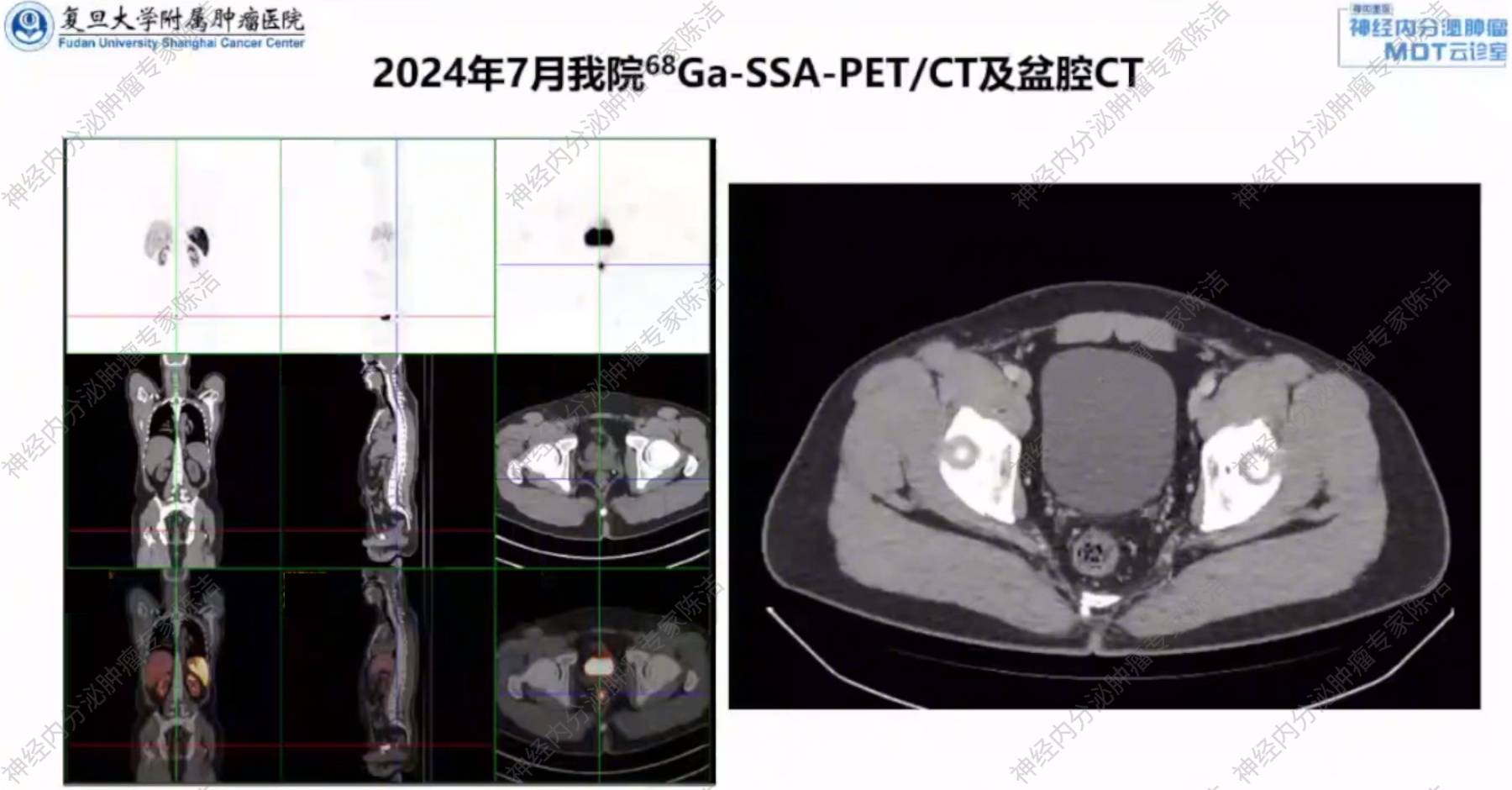
盆腔增强CT:直肠强化小结节,可符合NET。
68Ga-SSA-PET/CT:直肠下段NET,SSTR高表达。
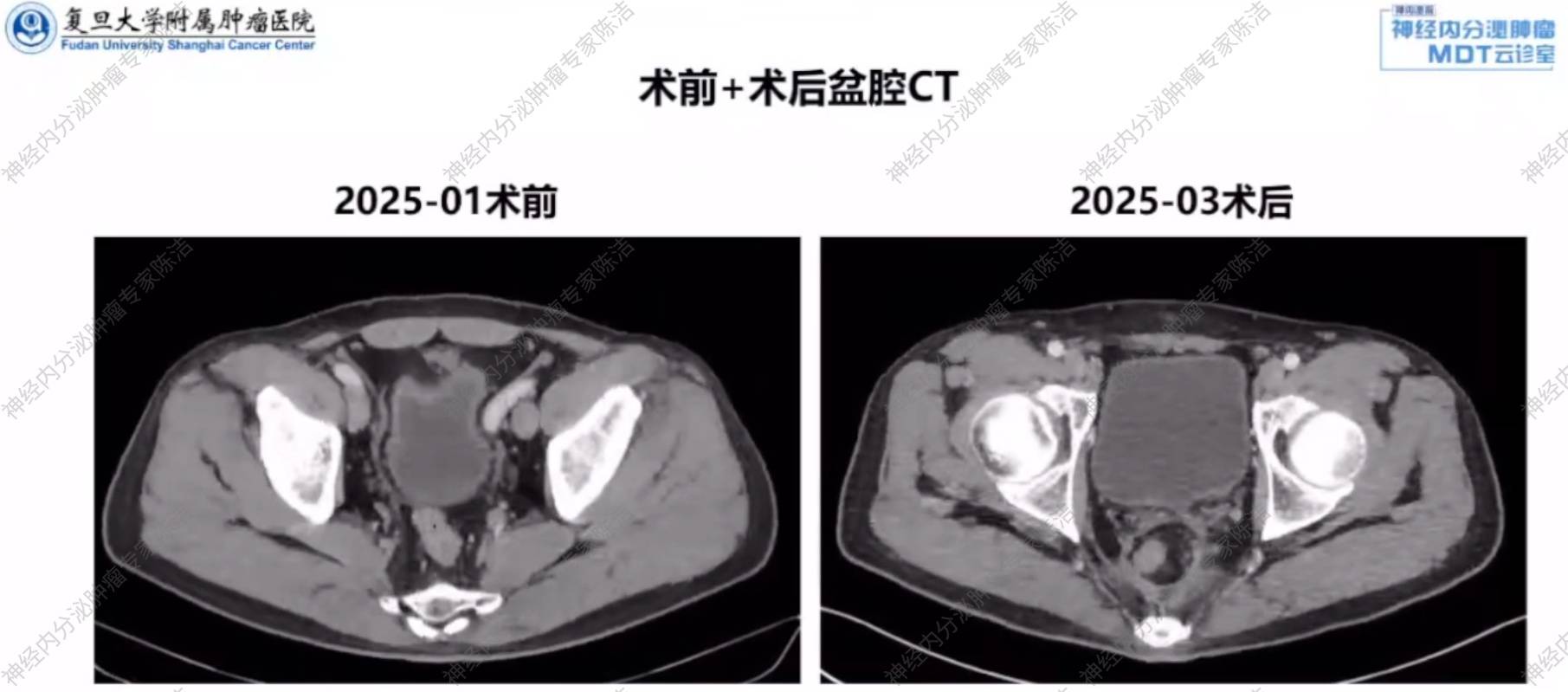
治疗:经MDT讨论,尽管PET/CT和增强CT阴性,但基于肿瘤大小(>1cm)及超声内镜高度怀疑淋巴结转移,决定行根治性手术。于2024年8月14日行“腹腔镜下直肠DIXON'S术+腹腔镜下盆腔淋巴结清扫术+乙状结肠直肠吻合术”。

术后病理:直肠NET,G2级,大小1.5cm*1.5cm,浸润至黏膜下层。脉管侵犯(+),神经侵犯(-),切缘(-);淋巴结清扫7枚,其中1枚可见肿瘤转移(1/7);Ki-67指数:3%。

多学科团队(MDT)讨论
病例1
张宁教授:肠镜下可见典型的黏膜下隆起,表面光滑,与普通腺瘤性息肉不同。超声内镜显示病变起源于黏膜下层,固有肌层完整,血供丰富,周围无明显肿大淋巴结。对于>1cm的病灶,术前充分评估至关重要。
徐俊彦教授:68Ga-SSA-PET/CT清晰显示了直肠原发灶高表达SSTR,这符合绝大多数直肠NET的特征。同时,该检查对于排除区域淋巴结及远处转移具有重要价值,此病例未见明确转移征象,为选择内镜治疗提供了关键依据。
黄丹教授:术后病理明确了NET G2的诊断。关键在于评估高危因素,此病例的脉管、神经均为阴性,且切缘干净,属于低风险的完整切除,预后良好。
病例2
张宁教授:此病例肿瘤>1cm,且表面有凹陷,提示侵袭风险和淋巴结转移风险增高。术前活检仅报告增生性息肉,是由于活检深度不够,未能取到黏膜下层的肿瘤组织,这是直肠NET活检的常见陷阱。超声内镜提示病变与固有肌层紧贴,预示着ESD要达到完整切除难度大。
徐俊彦教授:该患者外院术前的PET/CT实际上已经明确提示了骶前淋巴结转移。这是一个非常关键的术前分期信息,直接表明患者不适合进行单纯的内镜局部切除,而应选择外科根治手术。
黄丹教授:外院ESD标本的病理提示基底切缘阳性,提示内镜下切除不彻底。我院根治术后的标本中,虽然原发灶部位无肿瘤残留,但在清扫的淋巴结中发现了转移,这与术前PET/CT结果吻合,也印证了本例患者外科手术的必要性。
汤伟教授:根据影像学评估,该患者术前曾接受内镜下处理,影像中可见缝合线影,但局部肠壁仍显增厚。术后复查显示,局部病灶已被切除,可见右下腹造瘘口,肠腔周围未见明确肿大的淋巴结。综合判断,此次手术彻底,病灶已得到完全处理。
病例3
张宁教授:超声内镜在本病例中发挥了决定性作用。尽管肿瘤大小仅1.2cm,但超声内镜敏锐地发现了一个形态不佳、高度可疑的淋巴结。这种偏圆、无淋巴门结构的淋巴结需要高度怀疑转移淋巴结。
徐俊彦教授和汤伟教授:PET/CT和增强CT均未能发现此可疑淋巴结,这提示对于微小转移灶,现有影像学手段仍存在一定的局限性,可能会出现假阴性结果。
黄丹教授:最终的根治标本证实了淋巴结转移和脉管癌栓的存在,这两项都是高危因素。有趣的是,肿瘤分级从活检的G1(Ki-67 1%)上升到了手术标本的G2(Ki-67 3%),提示了肿瘤的异质性。这个病例充分说明,不能完全依赖PET/CT或CT来排除转移,临床决策需要综合所有信息,包括病灶在内镜下的表现,尤其是超声内镜发现的高危征象。
陈洁教授总结
本次分享的3例极具代表性的直肠NET病例,揭示了临床实践中的挑战和决策要点。绝大多数直肠NET在初诊时体积小(小于1cm)、分级低(G1)、分期早(Ⅰ期),因此通过内镜下切除通常即可达到根治和治愈的效果。然而,一旦肿瘤直径超过1cm,治疗决策就必须非常谨慎。我们必须在完善所有检查后,才能最终确定患者是适合接受内镜下手术,还是必须进行外科手术。
我们分享的三例病例,其肿瘤大小都在1~2cm之间。病例1中,经过我院全面的评估后,为患者进行了一次非常规范的ESD。术后病理证实为无高危因素的完整切除,切缘干净,我们认为该患者已获得治愈。
病例2中,虽然肿瘤大小也在1~2cm之间,但其在外院的术前68Ga-SSA-PET/MR已明确提示存在淋巴结转移。遗憾的是,该患者仍在外院接受了ESD切除,这可能反映了部分临床医生对术前影像评估的重要性认识不足,并且该次切除的切缘为阳性。患者转至我院后,我们经综合评估,为其实施了补救性外科根治手术,术后病理证实了淋巴结转移的存在。通过我们的补救措施,患者最终在本阶段获得了根治。
病例3中,患者术前完成了包括常规内镜、超声内镜、CT及PET-CT在内的所有影像学检查。超声内镜提示一个疑似转移的淋巴结,但因其体积过小(<1cm),后续的增强CT和PET-CT均未能证实其存在,即便肿瘤的SSTR表达为阳性。这说明,有时即便穷尽所有影像学手段,也未必能发现微小的转移淋巴结。考虑到患者肿瘤大小在1~2cm且存在可疑淋巴结,我们团队经MDT讨论后,认为其不适合内镜手术,建议并实施了外科根治手术。最终的病理结果证实了我们的决策是正确的,清扫的淋巴结中确实存在转移,从而让患者获得了根治。
总而言之,对于直径1~2cm的直肠NET,治疗决策绝不能一概而论。必须在MDT框架下,整合肠镜形态、超声内镜、增强CT/MR以及PET/CT等多模态信息进行全面评估。只有这样,我们才能明确内镜下治疗和外科手术治疗的边界,为每一位患者精准地选择最合适的治疗手段,从而实现最佳的远期预后。
更多精彩病例,可点击或复制以下链接,粘贴到浏览器查看神经内分泌肿瘤MDT云诊室-胃肠胰神经内分泌肿瘤内镜治疗专场回放:
https://doctor.liangyihui.net/#/doc/152705

本文仅供健康科普使用,不能作为诊断、治疗的依据,请谨慎参阅。











 苏公网安备32059002004080号
苏公网安备32059002004080号


