乳腺癌是女性最常见的恶性肿瘤,其发病率随着年龄的增长而增加,且内源性雌激素暴露、良性乳腺增生、乳腺密度升高和相关家族史都会增加乳腺癌的风险[1]。国际癌症研究署(International Agency for Research on Cancer,IARC)公布的来自全球185个国家/地区的女性乳腺癌统计数据(GLOBOCAN 2022)显示,我国是乳腺癌高发国家之一(中国、印度、巴西、美国、日本),且发病年龄主要集中于30~59岁[2]。我国乳腺癌年发病人数为35.72万,发病率为51.17/10万;年死亡人数7.5万,死亡率为10.86/10万[3]。尽管发病率较高,但有效的预防和干预措施可以使女性乳腺癌患者的生存率得到明显改善[4]。
磷脂酰肌醇3激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路主要由PI3K、Akt、mTOR 3个作用分子构成,可将细胞外和细胞内的信号整合起来,从而在细胞代谢和生存过程中发挥核心调控的作用[5]。PI3K/Akt/mTOR(简称“PAM”)信号通路在多种癌症中被异常激活,可增强肿瘤细胞的增殖、生长和对化疗、免疫治疗药物的抵抗[6]。约40%的激素受体阳性(hormone receptor positive,HR+)/人表皮生长因子受体2阴性(human epidermal growth factor receptor 2 negative,HER2-)乳腺癌患者携带PI3KCA突变基因,这是乳腺癌内分泌治疗失败的重要原因,而PAM抑制剂(PAM inhibitor,PAMi)的研发是HR+/HER2-晚期乳腺癌治疗的重要里程碑[7]。目前,已有多项临床前和临床研究证实了PAMi用于乳腺癌的疗效。其中,PI3K抑制剂阿培利司(alpelisib)和伊那利塞(inavolisib)、Akt抑制剂卡匹色替(capivasertib)、mTOR抑制剂依维莫司(everolimus)已被美国FDA批准用于HR+/HER2-晚期乳腺癌的临床治疗[8―11],依维莫司于2022年2月在我国获批新增乳腺癌适应证,伊那利塞和卡匹色替分别于2025年3月、4月在我国获批上市。可见,未来PAMi将为晚期乳腺癌患者提供更多临床选择。
研究显示,在当前医疗环境下,药师作为药物治疗的专业人员,在合理用药过程中发挥着重要作用,其积极干预有助于准确评估药物治疗方案、确保患者获得最佳治疗效果、提高患者的用药依从性、减少药物不良反应的发生、降低患者死亡率、减轻患者经济负担[12―14]。然而,PAMi在乳腺癌领域的临床应用尚处于起步阶段,关于如何保障用药安全、解决治疗相关问题,尚未形成明确的药物管理实施规范。为了推进PAMi临床合理使用,规范药师对应用PAMi的乳腺癌患者实施药学监护的过程,肿瘤医师与临床药师共同制定了本专家共识。
《乳腺癌靶向PI3K/Akt/mTOR抑制剂合理用药管理专家共识》编写组.乳腺癌靶向PI3K/Akt/mTOR抑制剂合理用药管理专家共识[J].中国药房,2025,36(11):1289-1300. DOI: 10.6039/j.issn.1001-0408.2025.11.01.
共识制定
本共识由中国人民解放军北部战区总医院作为牵头单位,组织国内27家三级甲等医院和高等院校的专业人员成立共识制定专家团队,包括内容专家(临床医学、药学)和方法学专家(循证医学、统计学、医学伦理学),均为副高级以上职称。专家组成员多次采用线上和线下相结合的会议形式审定修改共识初稿和讨论证据质量。共识发表前,由核心发起专家通过问卷的方式请外审专家审阅,内容遵循中国临床实践指南评价体系(AGREE-China)评分细则,对专家意见进行修改,最终形成了本共识定稿。本共识在国际实践指南注册与透明化平台完成注册(注册编号为PRERARE-2025CN047)。
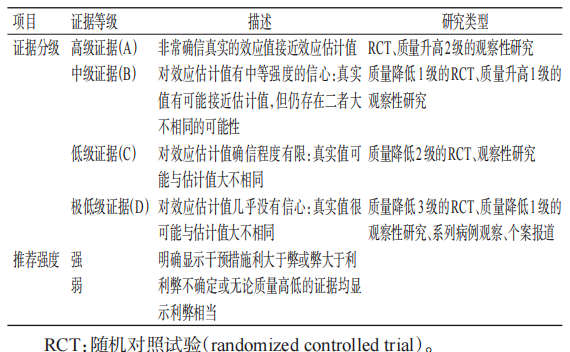
本共识以药物治疗实施过程为基本框架进行编写。针对患者治疗方案中的具体问题,编写组前期进行了系统回顾和荟萃分析[15],通过参考国内外临床研究、临床指南和专家共识,结合我国患者具体诊疗现状制定本共识,并采用GRADE(Grading of Recommendations Assessment,Development Evaluation)方法对证据质量和推荐强度进行分级,具体分级标准见表1。
表1 GRADE证据质量和推荐强度分级
本共识主要围绕乳腺癌患者治疗的关键问题,以PAMi用于乳腺癌的疗效及安全性为主要考察指标,从药师角度出发,收集患者的一般资料、疾病信息和药物治疗信息,以更精准地判断患者疗效、发现潜在用药风险并尽早提出用药指导。具体管理流程见图1,药物治疗管理记录单见图2。
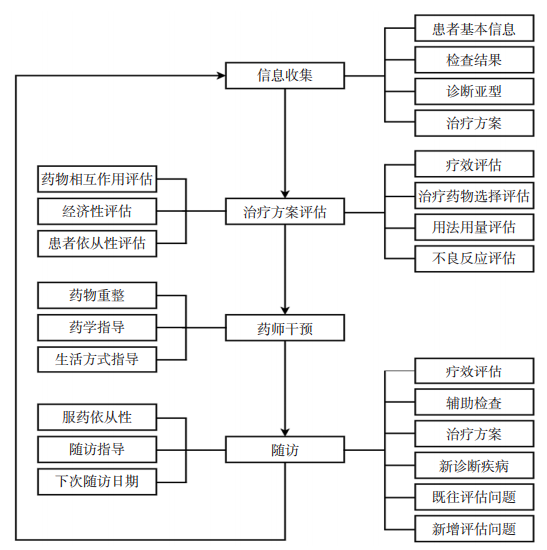
图1 乳腺癌患者药物治疗管理流程
PI3K/AKT/mTOR抑制剂药物治疗管理记录单

临床推荐意见分析
疗效评估
临床问题1:如何判断PAMi用于晚期乳腺癌患者的疗效?何时停药及调整方案?
推荐意见:基于乳腺癌相关诊疗指南的证据,对于晚期乳腺癌患者,应以影像学检查为主要依据,辅以肿瘤标志物的动态监测来判断疾病是否进展[16―17];对于骨转移等不可测量的病灶,需结合临床症状、肿瘤标志物和影像学表现进行综合评估;当肿瘤累及脏器时,需对可反映肿瘤负荷的指标(如疼痛、体重、功能状态等症状和体征)进行评估。如果肿瘤病灶没有缩小或病情没有得到控制,肿瘤标志物水平仍持续升高或没有下降至预期水平,则表明治疗不足,需要停药或及时调整抗肿瘤治疗方案[18](证据级别A,强推荐)。
疗效评价参照实体肿瘤疗效评价标准1.1(Response Evaluation Criteria in Solid Tumors 1.1,RECIST 1.1)[19]:与基线相比,(1)肿瘤缩小≥30%且在4周后重复评估确认,则达到部分缓解(partial response,PR);(2)所有靶病灶完全消失,则达到完全缓解(complete response,CR);(3)肿瘤增大≥20%或出现新发肿瘤病灶,则达到疾病进展(progressive disease,PD);(4)肿瘤缩小或增大程度介于PR和PD之间,则达到疾病控制(stable disease,SD)。肿瘤标志物包括癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原15-3(carbohydrate antigen 15-3,CA15-3)、循环肿瘤DNA(circulating tumor DNA,ctDNA)、循环肿瘤细胞(circulating tumor cells,CTC)等,均能反映肿瘤的活跃程度[20―21]。其中,ctDNA还可用于乳腺癌的早期复发监测和治疗结果预测,对晚期乳腺癌患者的预后有重要价值[22]。
临床问题2:转移性乳腺癌患者是否推荐进行ctDNA和CTC检测?
推荐意见:推荐在治疗前后进行ctDNA和CTC监测。ctDNA在转移性乳腺癌患者治疗反应和生存时间方面具有预测潜力,动态监测CTC数量有助于评估抗肿瘤治疗效果和优化治疗策略[23―24]。对于无相关检测条件的医院,可依托外部检测机构检测(证据级别A,强推荐)。
ctDNA可用于晚期乳腺癌的疗效评估,通过检测血液中的肿瘤特异性突变,帮助识别潜在的肿瘤;治疗后ctDNA浓度下降通常表示疗效良好,而浓度增加可能提示疾病进展[25]。ctDNA的检测方式主要为液体活检[26]:(1)数字聚合酶链式反应(digital polymerase chain reaction,dPCR)——通过抽取外周血进行样本收集,使用相应试剂盒提取血浆中的DNA,利用dPCR技术检测特定的肿瘤突变。(2)二代测序技术(next-generation sequen- cing,NGS)——ctDNA的NGS可用于动态评估肿瘤治疗的效果,ctDNA中肿瘤驱动基因相关变异丰度变化的监测可用于判断肿瘤治疗应答[27]。
对于晚期乳腺癌患者,CTC数量与其预后密切相关,较高的CTC数量通常预示着较差的预后[28]。CTC可帮助临床评估肿瘤的转移潜能,提供有关肿瘤生物学的信息[29]。ctDNA和CTC的检测为癌症的疗效监测和个性化治疗提供了重要工具[30]。CTC的检测方式为细胞分离技术(密度梯度离心、免疫磁珠分离、微流控技术、膜过滤法)及细胞鉴定分析(显微镜观察、流式细胞术、分子生物学分析)[31]。
治疗药物选择
乳腺癌患者PAMi的选择需充分考虑适应证评估和限制用药两个方面。若患者未满足适应证就用药,则判断为不适当用药;若患者使用PAMi时存在禁忌证或用药者为特殊人群,则判断为存在限制用药。
适应证评估
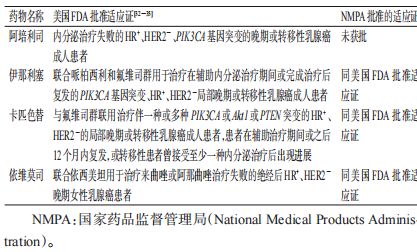
用药前,临床应充分评估患者的肿瘤及自身状况,包括肿瘤分子分型、病理学分期、组织学分级及患者既往乳腺癌治疗信息,并遵循PAMi适应证合理选择抗肿瘤药物。PAMi的国内外获批适应证见表2。
表2 PAMi的国内外获批适应证
临床问题3:哪类乳腺癌患者适用PAMi治疗?
推荐意见:PAMi适用于HR+/HER2-晚期乳腺癌患者。
(1)基于BYLieve研究结果,对于细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinases 4/6,CDK4/6)抑制剂治疗失败伴PIK3CA基因突变患者,可选择内分泌治疗联合阿培利司[36―37](证据级别A,强推荐)。
(2)根据CAPItello-291研究,对于伴或不伴Akt通路(PIK3CA、Akt1、PTEN)突变,可选择氟维司群联合卡匹色替[38](证据级别A,强推荐)。
(3)基于INAVO-120研究,对于内分泌治疗耐药伴PIK3CA基因突变患者,临床可选择伊那利塞联合哌柏西利和氟维司群[39―40](证据级别A,强推荐)。
(4)根据BOLERO-2、PrE0102研究及中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)相关指南,对于他莫昔芬治疗失败的患者,临床可选择依维莫司联合芳香化酶抑制剂(aromatase inhibitor,AI);对于非甾体类AI(来曲唑、阿那曲唑)治疗失败的患者,临床可选择依维莫司联合甾体类AI(依西美坦);对于甾体类AI(依西美坦)治疗失败的患者,临床可选择依维莫司联合氟维司群[17,41―42](证据级别A,强推荐)。
(5)当临床无更好治疗方法,需要超说明书使用PAMi时,应严格依据循证医学证据,证据采纳顺序依次为:其他国家或地区的药品说明书,国际权威组织或协会发布的诊疗指南或规范,国家级学会发布且经国家卫生健康委员会认可的诊疗指南、规范等[43](证据级别A,强推荐)。
BYLieve是一项多中心、开放性的单臂Ⅱ期临床研究,该研究共包含3个队列,其中A、B队列共纳入253例患者,分别评估了阿培利司联合氟维司群或来曲唑在既往接受内分泌联合CDK4/6抑制剂治疗失败的PIK3CA基因突变、HR+/HER2-晚期乳腺癌患者中的疗效。结果显示,A队列患者的中位无进展生存期(median progression-free survival,mPFS)、中位生存期(median overall survival,mOS)分别为8.0、27.3个月,B队列患者的mPFS、mOS分别为5.6、29.0个月,两队列患者均从阿培利司联合内分泌治疗中获益[36―37]。
CAPItello-291是一项全球性的Ⅲ期RCT,旨在评估卡匹色替联合氟维司群用于AI治疗失败的伴或不伴Akt通路(PIK3CA、Akt1、PTEN)突变的HR+/HER2-晚期乳腺癌患者的疗效。该研究共纳入708例患者,结果显示,与氟维司群单药相比,联合卡匹色替可显著延长患者的mPFS[7.2个月 vs. 3.6个月,风险比(hazard ratio,HR)=0.60,95%置信区间(confidence interval,CI)为0.51~0.71,P<0.001]。基于中国队列(134例)的亚组分析结果显示,与氟维司群单药(2.8个月)相比,联合卡匹色替可显著延长患者的mPFS至6.9个月(HR=0.51,95%CI为0.34~0.76)。中国人群与总人群具有相同的获益趋势。CAPItello-291研究的总生存期(overall survival,OS)结果尚未成熟,但已展现获益趋势[38]。
INAVO-120是一项全球性的Ⅲ期RCT,该研究共纳入325例PIK3CA基因突变、HR+/HER2-的局部晚期或转移性乳腺癌患者,其在辅助内分泌治疗期间或治疗完成后12个月内出现进展,其中亚洲人群占比38.2%。该研究评估了伊那利塞联合哌柏西利和氟维司群较哌柏西利联合氟维司群在上述人群中的疗效。结果显示,伊那利塞联合治疗可显著延长患者的mPFS(15.0个月 vs. 7.3个月,HR=0.43,95%CI为0.32~0.59,P<0.001)。亚组分析显示,伊那利塞联合治疗也可显著延长了亚洲人群组的无进展生存期(progression-free survival,PFS)。INAVO-120研究的OS结果尚未成熟,但已展现获益趋势[39―40]。
BOLERO-2是一项Ⅲ期RCT,该研究共纳入724例经非甾体类AI治疗失败的绝经后HR+/HER2-转移或局部晚期乳腺癌患者。结果表明,与依西美坦单药治疗相比,依维莫司联合依西美坦可显著延长患者的mPFS(7.8个月 vs. 3.2个月,HR=0.45,95%CI为0.38~0.54,P<0.000 1)[41]。
PrE0102是一项Ⅱ期RCT,该研究共纳入131例AI耐药的绝经后HR+/HER2-转移性乳腺癌患者。结果表明,与氟维司群单药相比,依维莫司联合氟维司群可显著延长患者的mPFS(10.3个月 vs. 5.1个月,HR=0.61,95%CI为0.40~0.92,P=0.02)[42]。
临床问题4:如何通过基因检测来指导PAMi的精准治疗?
推荐意见:对于内分泌治疗耐药的HR+/HER2-晚期乳腺癌患者,推荐尽早取血浆ctDNA或肿瘤组织样本进行PIK3CA、Akt1、PTEN突变基因检测,根据基因突变类型,合理选用PAMi(证据级别A,强推荐)。
根据SOLAR-1及真实世界研究,PIK3CA基因突变位点包括外显子7、9、20突变(E542K、C420R、Q546E/R、H1047L/R/Y、E545A/D/G/K)已明确与临床疗效相关;此外,携带PIK3CA基因突变位点R38C、Q75E、N345K、G106_108del和N345K/N1044K的患者也可能从阿培利司的治疗中获益[44―45]。因此,对于存在以上位点突变的患者,可选择阿培利司进行治疗(证据级别A,强推荐)。
基于EAY131-Y研究,Akt1基因E17K位点突变患者可从卡匹色替的治疗中获益[46]。对于此类患者,建议选择卡匹色替联合方案(证据级别A,强推荐)。
限制用药
临床问题5:特殊人群应用PAMi的注意事项有什么?
推荐意见:对于药品说明书未明确的特殊用药人群,建议临床综合评估其治疗获益与风险,并充分考虑患者治疗意愿后谨慎用药;用药时需根据患者耐受性及不良反应适当调整剂量。
(1)老年期(≥65岁):需要谨慎使用PAMi,用药期间临床需密切监护其用药安全[32―35](证据级别A,强推荐)。
研究表明,老年患者(≥65岁)使用阿培利司后3~4级高血糖发生率较<65岁患者高(44% vs. 32%),且与<75岁患者相比,≥75岁老年人群高血糖和3~4级高血糖的发生率均有所升高(74% vs. 66%;56% vs. 36%)。老年患者(≥65岁)使用伊那利塞后因不良反应而需调整剂量或中断治疗的比例高于<65岁患者(79% vs. 68%)。老年患者(≥65岁)使用卡匹色替后3~5级不良反应发生率及永久停药发生率高于<65岁患者(57% vs. 36%;23% vs. 8%)。老年患者(≥65岁)使用依维莫司导致治疗终止的比例高于<65岁患者(33% vs. 17%)[32―35]。
(2)妊娠期:PAMi具有潜在生殖毒性,建议孕妇禁用[32―35](证据级别D,强推荐)。
(3)哺乳期:PAMi可分泌至乳汁中影响母乳喂养儿童的发育,建议治疗期间以及末次给药后1~2周内不进行母乳喂养[32―35](证据级别D,强推荐)。
(4)育龄期:由于PAMi具有损害胎儿发育和患者生育能力的潜在风险,建议育龄期女性及有育龄期女性伴侣的男性患者采取有效避孕措施[32―35](证据级别D,强推荐)。哺乳期和育龄期患者用药说明见表3。
表3 哺乳期和育龄期患者用药说明

(5)肝功能不全:肝功能不全不影响阿培利司的体内暴露量,使用时无需调整剂量。伊那利塞用于轻度肝功能不全患者时,无需调整剂量;但尚无在中、重度肝功能不全患者中的使用经验,临床需谨慎使用。卡匹色替用于轻度肝功能不全患者时无需调整剂量;用于中度肝功能不全患者时,建议监测其不良反应,并根据不良反应进行剂量调整;尚无在无重度肝功能不全患者中的使用数据,临床需谨慎使用。依维莫司用于肝功能不全患者时,应按如下方式调整剂量——①轻度肝功能不全:7.5 mg,每天1次,口服;如果不能耐受,则减少至5 mg,每天1次,口服。②中度肝功能不全:5 mg,每天1次,口服;如果不能耐受,则减少至2.5 mg,每天1次,口服。③重度肝功能不全:经评估后,若患者预期获益大于风险,则按2.5 mg,每天1次,口服,但不可超过该剂量(证据级别B,强推荐)。
研究表明,与肝功能正常的患者(11例)相比,中度肝功能不全患者(6例)的阿培利司药时曲线下面积(area under curve,AUClast)降低了约27%[几何均值比(geometric mean ratio,GMR)为0.726,90%CI为0.487~1.08],达峰浓度(cmax)降低了约17%(GMR为0.833,90%CI为0.530~1.31);重度肝功能不全患者(6例)的阿培利司AUClast提高了26%(GMR为1.26,90%CI为0.845~1.87),两者cmax相当(GMR为1.00,90%CI为0.636~1.58)[32,47]。
基于INAVO120和GO39374研究,伊那利塞在轻度肝功能不全患者(111例)中的暴露量与正常患者(224例)相比,差异无统计学意义[AUC0-t、cmax和谷浓度(cmin)的GMR分别为0.986、1.010、0.970,90%CI分别为0.934~1.040、0.955~1.060、0.902~1.040]。但目前尚无该药在中、重度肝功能不全患者中的相关药动学研究[11,33]。
基于CAPItello-291和D3614C00007等研究,与肝功能正常患者(505例)相比,卡匹色替在轻度(268例)或中度(7例)肝功能不全患者中的AUCss(剂量标准化比值分别为1.05、1.17,90%CI分别为1.01~1.10、0.94~1.47)、cmax(剂量标准化比值分别为1.05、1.13,90%CI分别为1.01~1.09、0.93~1.36)的差异均无统计学意义。但目前尚无该药在重度肝功能不全患者中的相关药动学研究[10 ,34]。
基于KOVARIK等研究,与肝功能正常患者(13例)相比,轻度(6例)、中度(9例)和重度(6例)肝功能不全患者单次口服依维莫司的暴露量分别增加了1.8、3.2和3.6倍。中度肝功能不全患者(8例)与正常患者(8例)相比,单次口服2 mg的依维莫司的表观清除率降低了53%[(9.1±3.1)L/h vs. (19.4±5.8)L/h],半衰期延长了84%[(79±42)h vs. (43±18)h][35,48]。
(6)肾功能不全:轻度肾功能不全患者使用PAMi无需调整给药剂量。中度肾损伤会增加伊那利塞在体内的暴露量,建议将起始剂量调整为6 mg,每天1次,口服;其他PAMi无需调整剂量。重度肾功能不全患者可选择依维莫司,且无需调整剂量;尚无其他PAMi在重度肾功能不全患者中的使用数据,临床需谨慎使用(证据级别B,强推荐)。
基于Royer等[49]群体药动学(population pharmacokinetics,POP PK)结果,轻度或中度肾功能不全患者(117例)无需调整阿培利司的给药剂量;目前缺乏关于重度肾功能不全[肌酐清除率(creatinine clearance,CLcr)<30 mL/min]患者的相关数据,该类患者应谨慎使用阿培利司。
基于INAVO120和GO39374研究,与肾功能正常患者(185例)相比,伊那利塞在轻度肾功能不全患者(124例)中的暴露量无显著差异(AUC、cmax和cmin的GMR分别为1.10、1.11、1.11,90%CI分别为1.05~1.16、1.06~1.17、1.03~1.18);中度肾功能不全患者服用伊那利塞的AUC较正常患者高73%;此外,针对重度肾功能不全患者(CLcr<30 mL/min)的研究正在进行中(研究方案编号为GP44944)[11 ,33]。
基于CAPItello-291和D3614C00007等研究,与肾功能正常患者(424例)相比,卡匹色替在轻度(267例)、中度(85例)肾功能不全患者中的AUCss(剂量标准化比值分别为1.01、1.16,90%CI分别为0.97~1.06、1.08~1.24)、cmax(剂量标准化比值分别为1.01、1.16,90%CI分别为0.97~1.05、1.09~1.23)均无显著差异[9 ,34]。
不良反应评估
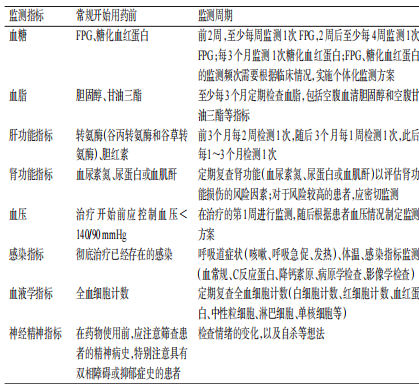
药品不良反应评估通常包括识别判断、处置措施、风险防范等。首先,应充分理解PI3K/Akt/mTOR信号通路的正常生理功能,从而准确识别PAMi使用过程中可能发生的不良反应;其次,针对已经发生的不良反应,临床应及时采取合理有效的解救措施,必要时进行多学科联合会诊。PAMi的常见不良反应的临床特征及处理措施见表4,药品安全性常规监测指标和监测周期[50―57]见表5。
表4 PAMi的常见不良反应的临床特征及处理措施

表5 PAMi不良反应管理
临床问题6:临床治疗过程中需要重点关注的PAMi特征性不良反应是什么?
临床研究中,PI3K抑制剂阿培利司相关的常见不良反应包括血糖升高、血肌酐升高、腹泻、皮疹、淋巴细胞计数下降等。其中,血糖升高最为常见,通常发生于用药后1~2个月内,可通过血糖管理措施予以控制;当阿培利司剂量降至200 mg时,可以很大程度减少高血糖的发生,且通常停药后,患者的高血糖是可逆的。伊那利塞的主要不良反应包括中性粒细胞减少、血小板减少、高血糖、口腔炎,其中高血糖和口腔炎发生率略高,但通过支持治疗和剂量调整均可管理。
Akt抑制剂卡匹色替的不良反应为腹泻、皮疹、恶心、疲劳和呕吐。其中,腹泻是最常见的,通常发生在治疗早期,患者首次出现腹泻的中位时间是8 d,通常为1~2级,只有约一半的腹泻患者需要止泻治疗。遂建议尽量避免空腹服用卡匹色替,同时进行饮食调整,避免摄入辛辣刺激的食物和饮料;如上述方式不能缓解,可进行止泻治疗。
mTOR抑制剂依维莫司常见的不良反应包括口腔黏膜炎、感染、皮疹、乏力、腹泻和食欲下降。口腔黏膜炎是该药治疗过程中需特别关注的不良反应;除此之外,还需定期监测肾功能和糖脂代谢相关指标。建议临床在开始依维莫司治疗前监测患者肾功能,包括血尿素氮、尿蛋白或血肌酐,并定期复查,特别是对于存在潜在进一步肾功能损伤风险因素的患者。
目前,PAMi不良反应数据多来源于上市前临床研究,但由于临床患者的复杂性,该类药物应用于临床后,需进一步开展关于安全性的真实世界研究。
临床问题7:血糖异常是PI3K抑制剂较为常见的不良反应,用药期间如何进行血糖管理?
推荐意见:无基础疾病的人群,建议在药物治疗前后监测血糖水平,监测指标、周期及频率详见表4;对于有糖尿病病史、糖耐量异常的高危患者,建议提前控制血糖,并根据临床情况优化降糖药物,若患者血糖控制不佳,建议应尽早请内分泌专科医师会诊,给予相应处理措施。对于PAMi相关的高血糖,降糖药物可首选二甲双胍,另外SGLT2抑制剂、噻唑烷二酮类(thiazolidine- dione,TZDs)降糖药、胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)类似物用于治疗PAMi相关高血糖也有效,必要时可使用胰岛素控制血糖(证据级别A,强推荐)。
PI3K抑制剂影响血糖的发生概率高于其他类PAMi。关于PI3K抑制剂阿培利司的SOLAR-1研究显示,患者高血糖发生率为65%,3级或4级高血糖的发生率分别为32.7%和3.9%[58]。另外一项来自美国的单中心回顾性研究报道了阿培利司相关高血糖症发生及治疗情况,结果显示,阿培利司相关高血糖症发生的中位时间为服药后16 d,所有级别的高血糖发生率为61.5%,3级为22.7%,4级为6.5%[59]。一项有关伊那利塞的Ⅲ期临床试验显示,患者高血糖发生率为58.6%,3级或4级高血糖发生率分别为5.6%和0;在体重指数(body mass index,BMI)≥30.0 kg/m2的患者中,高血糖发生率为65.5%,而在BMI<30.0 kg/m2的患者中,高血糖发生率为56.8%[38]。
Akt抑制剂卡匹色替和mTOR抑制剂依维莫司致高血糖的发生率相对较低。在CAPItello-291研究中,使用卡匹色替患者的高血糖发生率为2%,且≥3级的高血糖较为罕见[60]。一项Meta分析结果显示,依维莫司导致血糖升高不良反应的发生率与原发肿瘤类型相关,在肾细胞癌患者中发生率最高(27.2%,95%CI为22.2%~32.8%),而在乳腺癌患者中发生率最低(3.3%,95%CI为1.3%~8.2%)[61]。
相互作用评估
PAMi相互作用评估的重点是分析药物与其他药物或食物发生不良相互作用的风险,并给出相应的用药调整建议。
阿培利司
阿培利司在人体内主要经细胞色素P450 3A4酶(cytochrome P450 3A4,CYP3A4)代谢,卡马西平等CYP3A4强诱导剂可使阿培利司的体内代谢加快,血药浓度降低,进而减弱其药效学活性和临床疗效;反之,克拉霉素等CYP3A4强抑制剂会使阿培利司的血药浓度升高,引发不良反应[32 ,62]。同时,阿培利司本身会抑制CYP2C9的活性,使华法林、格列美脲等药物(经CYP2C9代谢)代谢减慢,药效活性和临床疗效减弱。此外,乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)抑制剂可通过抑制BCRP而使阿培利司的外排减少、血药浓度升高,从而导致患者中毒风险增加。相关药物及注意事项见表6。
表6 阿培利司和其他药物联合使用的注意事项
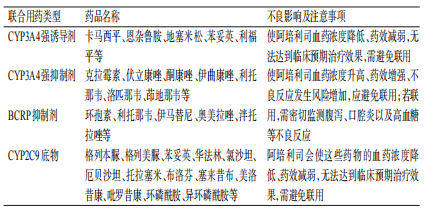
卡匹色替
卡匹色替在人体内主要经CYP3A4代谢,作为CYP3A4的作用底物,卡马西平等CYP3A4强诱导剂与酮康唑等CYP3A4强抑制剂会引起上述类似阿培利司的药动学和药效学改变,产生不良的药物相互作用[34],联用时需注意。相关药物及注意事项见表7。
表7 卡匹色替和其他药物联合使用的注意事项
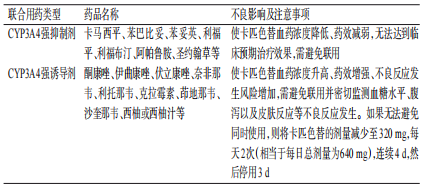
依维莫司
依维莫司在人体内主要经CYP3A4代谢,其作为CYP3A4的作用底物,与阿培利司相似,与CYP3A4强诱导剂和强抑制剂合用时可能存在同样的药动学和药效学改变。此外,如酮康唑、红霉素等部分药物,会抑制药物外排泵P糖蛋白(P-glycoprotein,P-gp),使依维莫司血药浓度升高,增加不良反应的发生风险[35],故应谨慎联用。相关药物及注意事项见表8。
表8 依维莫司和其他药物联合使用的注意事项
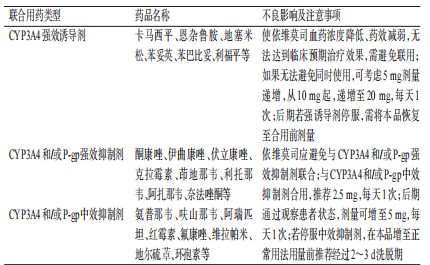
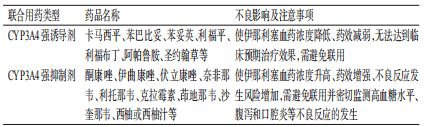
伊那利塞
伊那利塞在人体内主要经CYP3A4代谢[33],与卡匹色替类似,不建议将该药与CYP3A4强诱导剂和强抑制剂同时使用,以免出现类似的不良相互作用。相关药物及注意事项见表9。
表9 伊那利塞和其他药物联合使用的注意事项
评估建议:在进行药物相互作用评估时,当存在不适当联合用药时判断为存在不良相互作用,需避免使用或密切监测相关不良反应(强推荐)。
依从性评估
目前,已上市的PAMi为口服制剂,而口服抗肿瘤药物治疗依从性差可能会对患者的临床结局产生负面影响[63],所以临床应针对使用PAMi治疗的患者开展依从性评估。在对患者进行依从性评估时,要充分考虑患者的用药情况,可通过专业的用药依从性量表、电话访谈、书写服药日记等主观测量以及血药浓度监测(适用于依维莫司[64])、药片计数法、医疗记录查询、服药监控系统查询等客观测量进行综合评估[65],分析影响患者依从性的原因(患者自身因素、治疗相关因素等),制定个体化方案以提升患者依从性。具体实施措施[66―67]见表10。
表10 提升患者依从性的具体措施
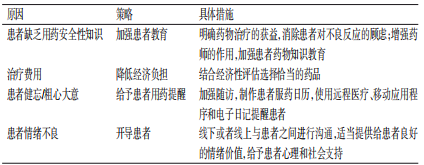
推荐意见:在对患者进行依从性评估时,要充分考虑患者的用药情况,针对患者依从性差的原因制定个体化方案,提高患者用药的依从性(证据级别A,强推荐)。
PAMi治疗相关问题的药学干预
药学干预对于提高患者用药依从性、提升药物治疗效果、减少严重药物不良反应的发生具有积极意义[68―69]。药学干预涵盖用药合理性评估、用药咨询、用药教育、用药方案调整建议等一系列专业化药学服务。
处方管理
对于晚期乳腺癌患者,药师可以提出关于营养、心理、运动、疼痛等干预意见,具体如下。
(1)营养干预:均衡饮食,保证足够的蛋白质和热量摄入,以维持体重和营养状态;对于依维莫司或阿培利司可能引起的高血糖,建议低糖饮食;对于接受内分泌治疗的患者,建议补充钙和维生素D,以预防骨质疏松和骨折风险。
(2)心理干预:提供个体化的心理关怀和支持治疗,帮助患者应对焦虑和抑郁。
(3)运动干预:适当的体力活动可以帮助管理体重和血糖水平,建议患者根据自身情况选择适宜的运动方式,如散步、瑜伽或游泳。
(4)疼痛管理:定期评估患者的疼痛程度,选择合适的镇痛药物,如非甾体抗炎药、阿片类药物或辅助镇痛药物(抗抑郁药、抗癫痫药)。
(5)姑息治疗:根据患者疾病进展和累及脏器情况制定个体化姑息治疗方案,以提高患者治疗舒适度,提高患者生活质量。
药物重整
药师应提供明确的药物重整意见,包括药物适应证与患者选择[70];评估患者是否选择合适的PAMi,根据其耐受性、不良反应以及药物间相互作用等调整PAMi的剂量;评估药物可获得性与成本-效益。
用药教育
患者用药教育应涉及药物的基本信息、服用方法、不良反应与注意事项、储存与保管要求等方面内容[71―72]。药师应整理药学指导单发放给患者。
长期随访
晚期乳腺癌患者的总体中位生存时间为2~3年,其间患者还会有心血管疾病、骨代谢异常、焦虑抑郁等伴随疾病出现,随访时需要观察其血脂变化以评估心血管疾病风险,通过骨密度检测对患者的骨质疏松风险进行评估干预,通过问卷调查评估患者心理状态并进行适当干预[73]。在此过程中,药师作为医疗团队的成员之一,应主动指导患者用药,提供持续性药学服务,提高患者生活质量。随访内容和时间建议包括:乳腺超声检查,每6个月1次;乳腺X线检查,每年1次;胸片或胸部CT检查,每年1次;腹部超声检查,每6个月1次;血常规、血液生化、乳腺癌标志物检查,每6个月1次。
结语
本共识为乳腺癌患者应用PAMi治疗提供了规范化、全程化的管理路径及临床关注要点。随着未来研究的不断深入,编写组将定期查询的高质量循证证据,每隔2~3年组织专家组评估和更新完善本共识,优化PAMi相关治疗方案的临床应用。
略











 苏公网安备32059002004080号
苏公网安备32059002004080号


