胆管癌和胰腺癌恶性程度较高,疾病进展迅速,预后通常较差 1,2 。近期,于2025年欧洲肿瘤内科学会胃肠道肿瘤研讨会(ESMO GI)上公布的重要成果为胆管癌和胰腺癌的治疗带来了新曙光。因此,本期特邀中山大学肿瘤防治中心王风华教授围绕大会的靶向治疗进展以及创新治疗方案等热点话题进行专访,深度解析2025 ESMO GI前沿研究,以飨读者。
胆管癌靶向精准治疗新突破,2025 ESMO GI前沿研究深度剖析!
胆管癌起源于胆管上皮细胞,侵袭性强且预后较差。近年来,以靶向IDH1为代表的相关探索取得诸多进展,能否请您谈谈2025 ESMO GI大会上的IDH1相关研究?
王风华教授(中山大学肿瘤防治中心肿瘤内科):
IDH1突变是胆管癌驱动基因之一,可导致细胞内2-羟基戊二酸增加,影响细胞正常分化,在胆管癌的发生发展中起重要作用3。因此,抑制IDH1突变为胆管癌的治疗提供了新的思路。目前靶向IDH1的艾伏尼布已经在美国和欧盟获批了IDH1突变胆管癌后线治疗的适应症4,5,本次大会的相关研究也再次证明了艾伏尼布在IDH1突变胆管癌患者中的精准治疗潜力。
►艾伏尼布靶向IDH1,引领胆管癌精准治疗
·2025 ESMO GI大会口头报告了一项探索艾伏尼布用于IDH1突变胆管癌患者的全球多中心IIIb期ProvIDHe研究。本次口头报告涵盖了在真实世界中接受艾伏尼布治疗mIDH1胆管癌患者的最大队列,重点分析了艾伏尼布的初步疗效。该研究截止到2025年1月17日,共纳入来自15个国家的262例患者,其中既往接受过系统治疗的中位数为2次,主要方案是吉西他滨+顺铂(40.1%)或联合免疫治疗(42%)。结果显示:5.7%的患者达到部分缓解(PR),中位缓解持续时间(DoR)为10.1个月。51.5%的患者达到疾病控制(PR+SD)。中位无进展生存期(mPFS)为4.7个月,6个月和12个月的PFS率分别为40.1%和28.2%。中位总生存期(mOS)为15.5个月,6个月和12个月的OS率分别为80.3%和60%(图1)。因此,上述发现证实了在ClarIDHy试验中观察到的疗效,进一步巩固了艾伏尼布的治疗潜力6。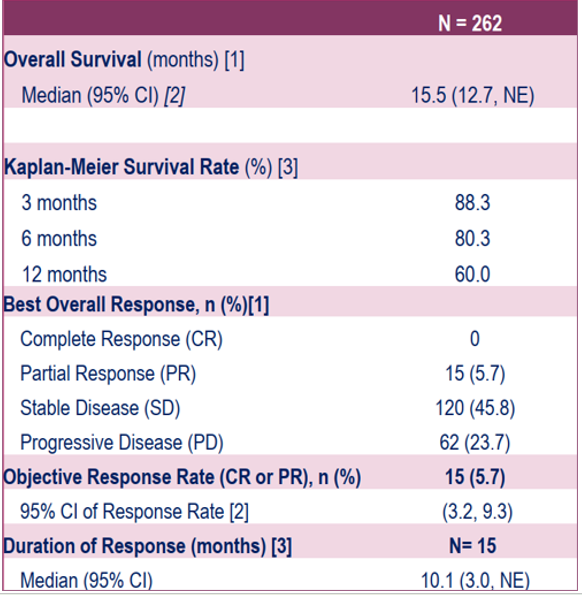
► IDH1突变胆管癌患者二线治疗艾伏尼布优于化疗
·一项欧洲多中心真实世界研究评估了艾伏尼布治疗mIDH1胆管癌患者的疗效和安全性。该研究共纳入46例转移性胆管癌患者,其中43.5%和56.5%的患者将艾伏尼布分别作为二线治疗以及≥三线治疗。研究结果显示中位随访时间为11.9个月,mPFS和mOS分别为3.7个月和11.5个月。疾病控制率(DCR)为50.0%,客观缓解率(ORR)为13.6%。8.7%的患者发生了≥3级不良事件。通过倾向评分匹配和逆概率加权法(IPTW)调整后的艾伏尼布组与FOLFOX/CAPOX组:mPFS为6.9个月 vs. 2.1个月(HR 0.36,P=0.0005);mOS为15.9个月vs 9.0个月(HR 0.47,P=0.0405)。研究表明,对于至少接受过一线标准治疗后的mIDH1胆管癌患者来说,艾伏尼布是一种有效的治疗选择7。
► 艾伏尼布在亚洲人群的获益与耐受性
·一项日本II期研究评估了艾伏尼布治疗mIDH1不可切除/转移性胆管癌患者的疗效和安全性。该研究主要终点是基于独立放射影像中心(IRC)评估的6个月PFS率,共纳入12例既往接受过1或2线治疗的患者。结果显示,根据IRC评估的数据,6个月PFS率为25%,显示出相对于无效假设(6个月PFS率≤2.6%)的统计学差异(P=0.0032),达到了主要终点;mPFS为2.7个月(图2),3个月和6个月的OS率分别为91.7%和83.3%。DCR为66.7%。该研究结果与ClarIDHy相似,患者耐受性良好,支持将艾伏尼布用于mIDH1突变不可切除/转移性胆管癌的日本患者8。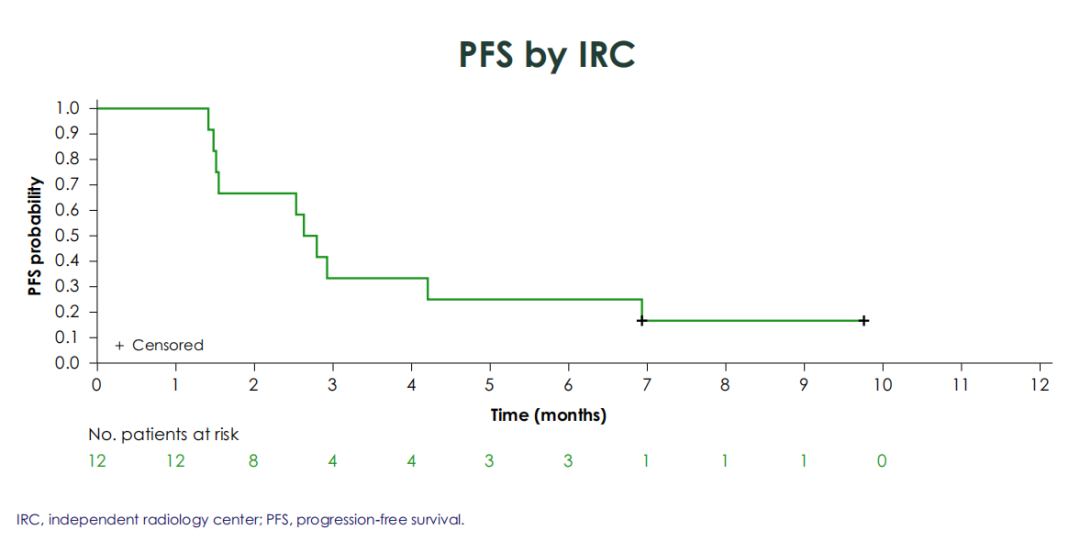
除IDH1相关进展之外,本次大会中还公布了多项胆管癌靶向治疗的研究成果,涵盖FGFR2融合或FGFR2重排、HER2表达等方向,能否请您分享这些研究成果及其对于胆管癌临床实践的影响?
王风华教授(中山大学肿瘤防治中心肿瘤内科):
除了IDH1突变外,胆管癌的诊疗还涉及其他重要生物标志物,例如FGFR2和HER2。今年大会上,相关领域的突破性研究也备受瞩目。
► FGFR抑制剂显示治疗潜力
·一项评估佩米替尼治疗FGFR2融合或FGFR2重排的不可切除或复发性胆道癌患者的日本多中心观察性研究(JON2303 B)公布了中期结果。43家机构共招募了74例患者。ORR为30.0%(1例CR和20例PR),DCR为85.7%。mOS为13.10个月,mPFS为7.00个月(图3)。这些数据支持佩米替尼对既往接受过治疗的FGFR2融合或FGFR2重排的胆道癌患者的治疗潜力9。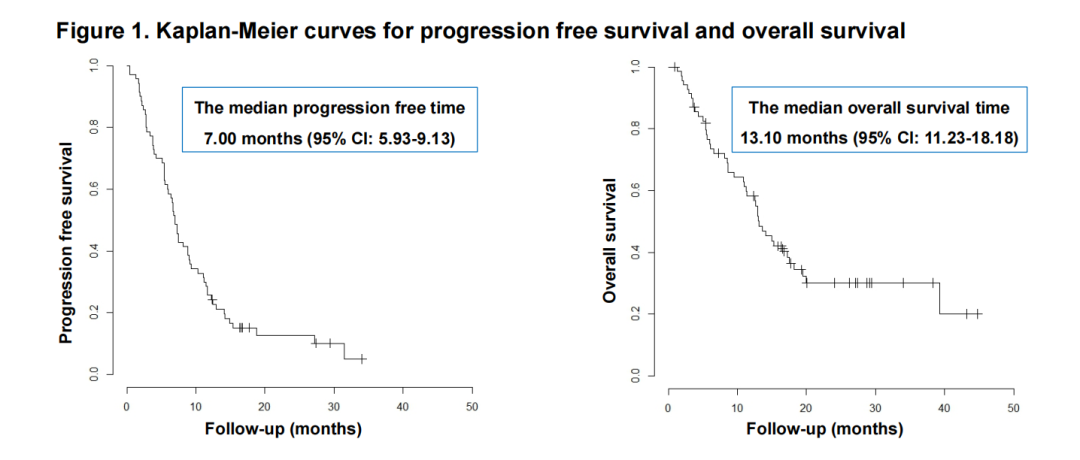
► 抗HER2一线治疗效果显著
·一项II期研究评估了泽尼达妥单抗+顺铂-吉西他滨治疗HER2表达的胆道癌患者中的抗肿瘤活性和安全性。研究共纳入15例患者,包括6例(40%)为HER2 IHC 2+/FISH+,4例(27%)为 HER2 IHC 1+/FISH+,5例(33%)为HER2 IHC 3+。研究结果显示,中位随访时间为19.0个月,在14例有反应的患者中,ORR为43%(1例CR,5例PR);不同IHC水平患者均有反应,包括IHC 1+。未达到中位DOR,DCR为86%(图4)。mPFS为9.9个月;最长PFS为26.2个月以上。mOS尚未成熟,估计18个月OS率为68%。所有患者均报告了治疗相关不良事件(TRAEs);最常见的是腹泻(60%),10名患者(67%)发生了3-4级TRAE,其中最常见的是贫血(40%)。无治疗相关死亡病例,没有患者因AE而停用泽尼达妥单抗。研究表明,泽尼达妥单抗+顺铂-吉西他滨用于HER2表达BTC患者的一线治疗,显示出有前景的初步抗肿瘤活性和良好的耐受性10。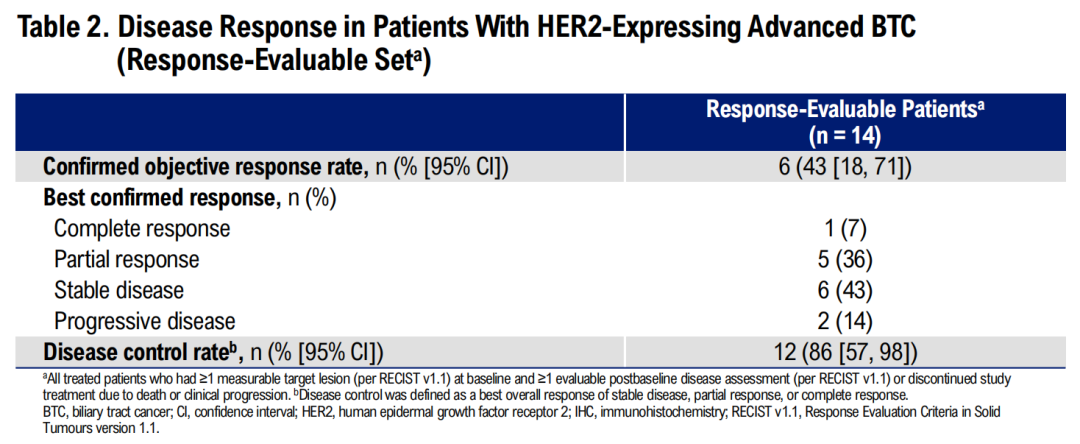
突破胰腺癌生存困局,2025 ESMO GI大会聚焦创新治疗方案!
胰腺癌被称为“癌中之王”,发病率逐年升高,死亡率居高不下,长期以来给医学界带来了巨大的挑战,胰腺癌治疗领域的研究进展备受关注,能否请您分享本次大会上的胰腺癌研究进展?
王风华教授(中山大学肿瘤防治中心肿瘤内科):
目前胰腺癌的研究进展还是以化疗为主,例如伊立替康脂质体在胰腺癌当中从后线到一线的突破,给更多患者带来了新的治疗选择。本次大会中,公布了多项胰腺癌化疗相关的研究进展。
► NALIRIFOX方案树立一线治疗新标杆
·NALIRIFOX(伊立替康脂质体+奥沙利铂+亚叶酸钙+5-氟尿嘧啶)是一种新型治疗方案,已获得FDA和EMA的批准用于转移性胰腺癌的一线治疗。本次大会公布了一项多中心回顾性研究,该研究首次对西方人群中接受NALIRIFOX治疗的转移性胰腺导管腺癌(mPDAC)患者进行真实世界分析评估。研究共纳入80例患者,70%有肝转移。NALIRIFOX组OS为11.15个月(图5);在采用NAPOLI-3研究纳入标准的亚组(n=67)分析中,观察到的mOS为12.79个月。研究者评估的缓解率为37.5%,DCR为57.5%。不良反应与之前的观察结果保持一致,未发现与治疗相关的死亡病例。这项研究证实了NALIRIFOX的疗效和耐受性,并支持将这种一线治疗方案作为一种新的治疗标准11。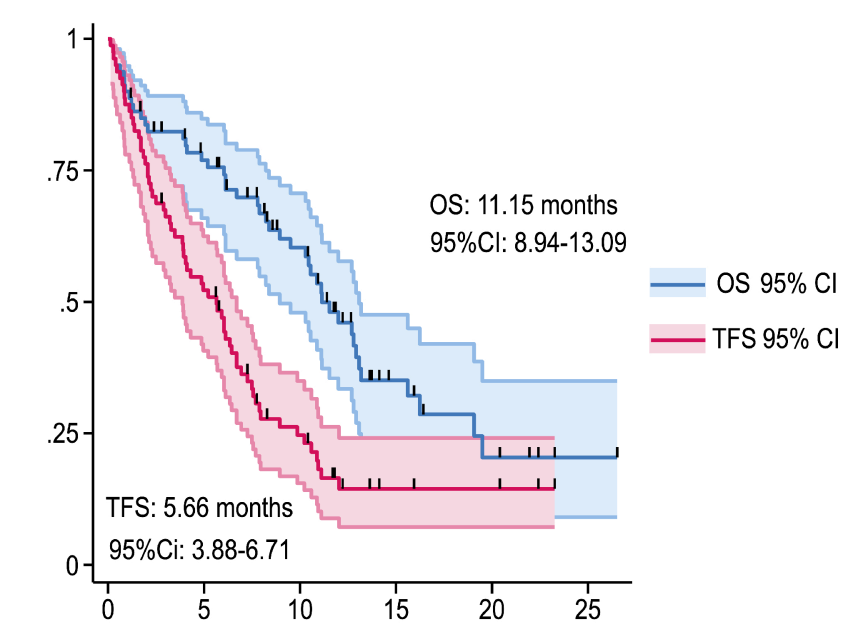
► nal-IRI治疗的长生存多维度分析
·NALLONG研究是一项全球多中心真实世界研究,旨在评估开始接受伊立替康脂质体(nal-IRI)+5-FU/亚叶酸钙治疗后存活至少1年的mPDAC患者的概况、既往治疗影响以及潜在的预后因素。结果显示nal-IRI在不同患者中显示出一致的疗效。在亚组分析中,nal-IRI方案存在超级应答者(44例,占27.0%),即nal-IRI治疗与之前治疗的PFS比值≥2.8。此外,既往接受过传统伊立替康治疗似乎对预后没有影响,而胰腺切除术史和既往接受过放疗则与OS延长有关。肝转移与mPDAC确诊后的OS降低有显著相关性。nal-IRI剂量调整(更长的治疗时间)明显减缓了患者接受nal-IRl治疗后的疾病进展(图6)。该研究表明,nal-IRI是治疗mPDAC重要选择,回答了临床对于既往接受过传统伊立替康治疗患者使用伊立替康脂质体是否有生存获益的疑问12。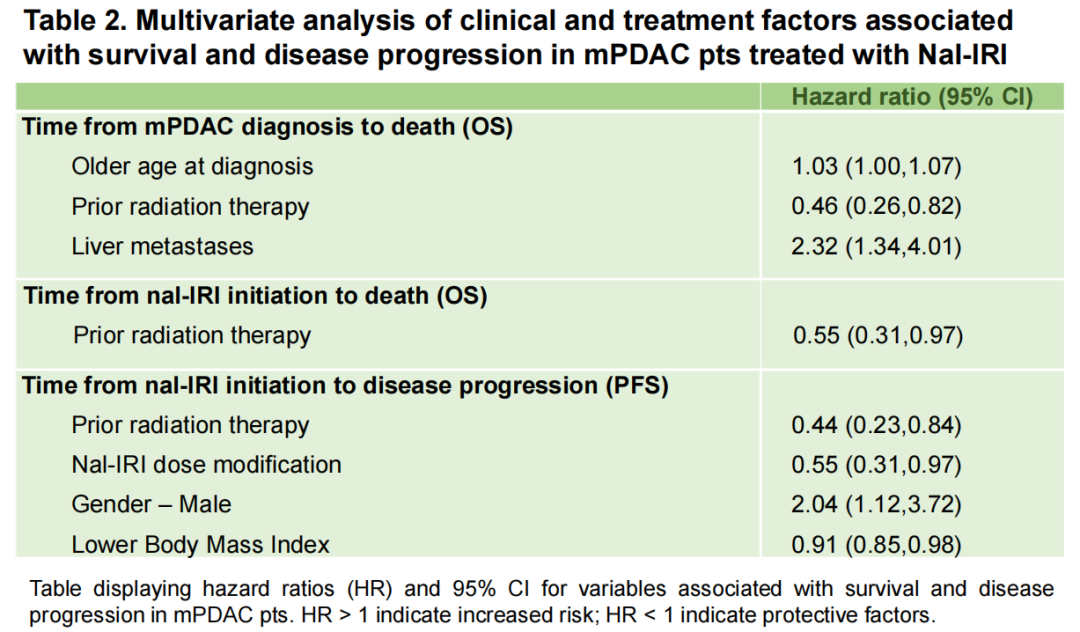
► Nal-IRI联合方案或提供更优二线选择
·一项研究分析了经吉西他滨和白蛋白紫杉醇(AG)一线治疗后病情进展并接受5-氟尿嘧啶(5-FU)+Nal-IRI或FOLFOX/XELOX治疗的mPDAC患者。研究收集了来自欧洲和亚洲11个中心的332例患者的数据,138例(41.6%)接受了5-FU+Nal-IRI治疗,194例(58.4%)接受了FOLFOX/XELOX治疗。5-FU+Nal-IRI组的中位OS显著高于FOLFOX/XELOX组(8.0个月 vs 6.0个月,HR 0.75,P=0.035)。经过倾向评分调整后,5-FU+Nal-IRI的生存期仍然更优(8.0 vs. 5.3个月,HR 0.52,P=0.0025)(图7)。两组总体不良时间发生率相似(89.1% vs 82.9%,P=0.1),但任何等级的腹泻(P=0.03)和AST/ALT升高(P<0.001)在5-FU+Nal-IRI组更常见,而神经病变(P<0.001)和血小板减少(P=0.01)在FOLFOX/XELOX组更常见。研究结果表明,与奥沙利铂为基础的治疗方案相比,5-FU+Nal-IRI的二线治疗方案可能具有更好的疗效。这两种治疗策略表现出不同的毒性,在选择最合适的疗法时应考虑这一点13。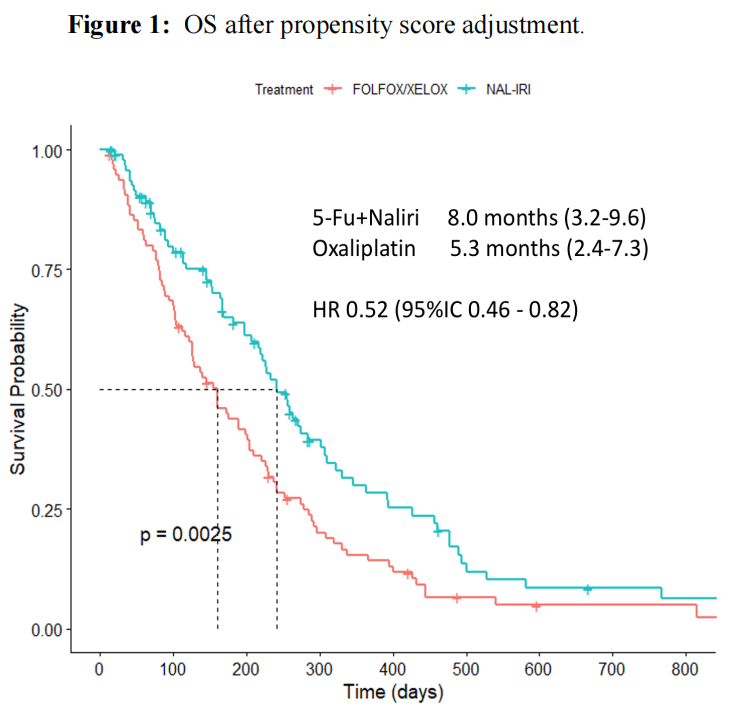
除了化疗以外,针对胰腺癌领域的其他治疗探索也层出不穷,涉及肿瘤电场治疗、新型环状多肽、CD40激动剂等多种创新治疗手段,能否请您分享相关研究成果?
王风华教授(中山大学肿瘤防治中心肿瘤内科):本次大会报道了很多令人激动的创新治疗方案的相关研究成果,为胰腺癌治疗提供了新的思路和方向。
► 肿瘤电场治疗优化局部进展期生活质量
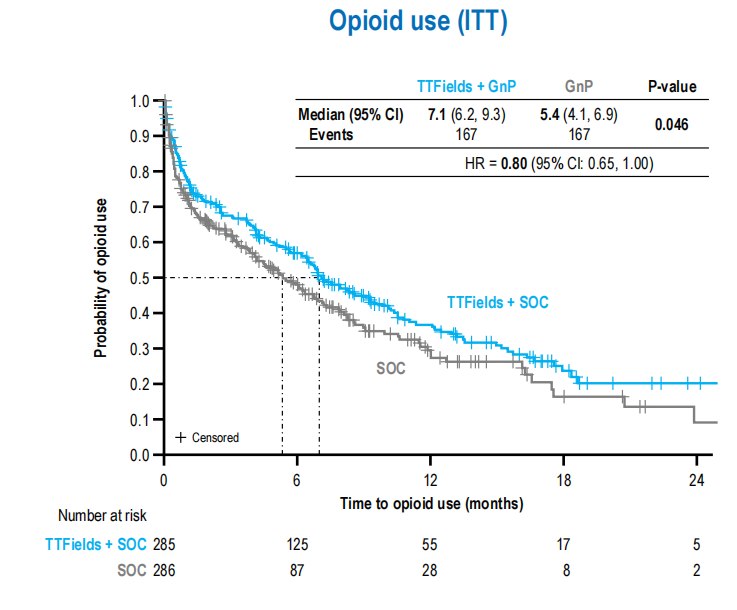
·PANOVA-3是一项评估肿瘤电场治疗(TTFields)联合AG对比单纯AG方案作为局部进展期胰腺癌一线治疗的III期研究,本次大会报告了TTFields对患者生活质量、胰腺癌症状和止痛药使用的影响。结果显示,TTFields组的疼痛恶化中位时间(10.1个月 vs. 7.4个月,P=0.003)、胰腺疼痛恶化中位时间(14.7个月 vs. 10.2个月,p=0.006)和使用阿片类药物的中位时间(7.1个月 vs. 5.4个月,P=0.046),以及整体健康状况恶化的时间(7.1个月 vs. 5.7个月,P=0.023)均明显长于单用AG方案(图8与图9)。研究表明,TTFields+AG方案对LAPC患者的疼痛和生活质量具有显著的统计学意义和临床意义的改善,支持TTFields+AG成为LAPC的新治疗方案14。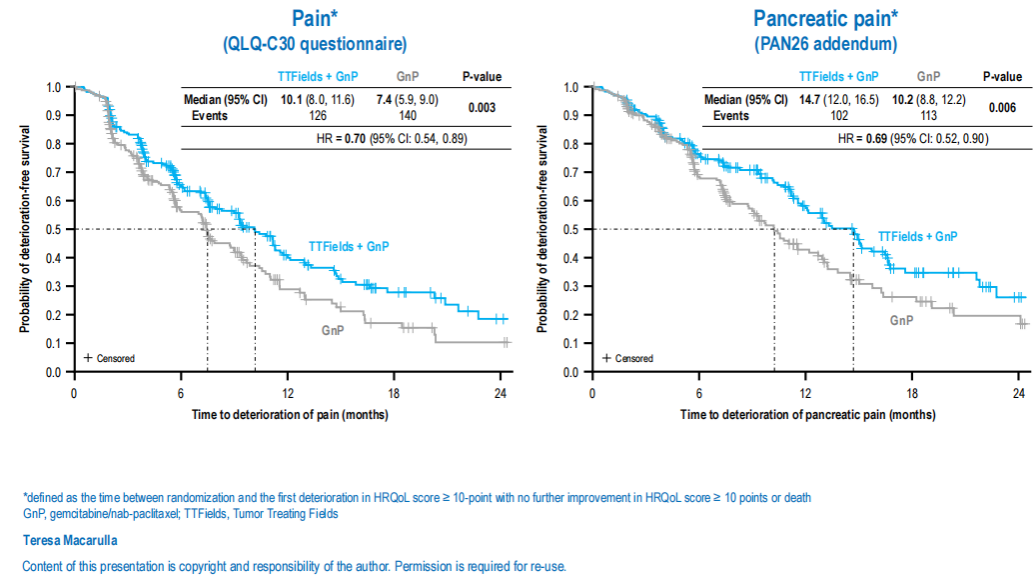
► 新型环状多肽增强抗肿瘤活性
·一项评估Certepetide(新型环状多肽,CERT)或安慰剂联合AG用于未经治疗的mPDAC患者的随机、双盲II期研究(AGITG ASCEND)公布了PFS结果。结果显示,相比安慰剂组(N=21),CERT组(N=42)的6个月PFS率(60.8% vs 25%)和mPFS(7.5个月vs 4.7个月,HR 0.60,P=0.08)较高,两组初步mOS分别为10.3个月和9.2个月(图10)。两组的ORR分别为45.2%和19%,DCR分别为85.7%和61.9%。CERT组88%的患者和安慰剂组77%的患者出现了3/4/5级不良事件。3/4级血液系统毒性方面,两组中性粒细胞减少率分别为34.3%和28.6%,血小板减少率分别为19%和14.3%。研究表明,CERT+AG方案对mPDAC患者有临床意义的改善趋势且安全性可控,支持进一步研究15。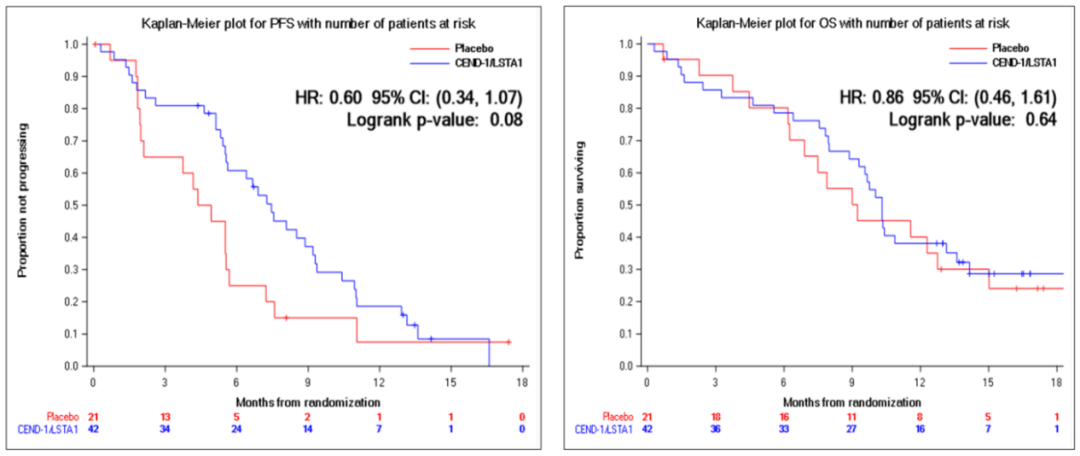
► CD40靶向联合疗法剂量递增试验
·米佐利单抗是一种靶向CD40的人源化单克隆抗体,可激活树突状细胞,从而激活肿瘤特异性T细胞,使更多的肿瘤特异性T细胞浸润并杀死肿瘤,提高抗肿瘤疗效。Ib/II期OPTIMIZE-1研究评估了米佐利单抗联合mFOLFIRINOX(氟尿嘧啶+伊立替康+奥沙利铂+亚叶酸钙)一线治疗mPDAC患者中的疗效和安全性。本次大会公布结果显示,450μg/kg(n=22)或900μg/kg(n=57)的mitazalimab+mFOLFIRINOX治疗,两种剂量显示出相似的安全性,证实了之前报告的数据。900μg/kg组(中位随访25个月)的最新疗效结果显示,中位DoR为12.6个月,mPFS为7.8个月,mOS为14.9个月(图11)。因此,与历史对照组相比,Mitazalimab(900μg/kg)联合mFOLFIRINOX继续显示出有临床意义的生存获益。在对450μg/kg剂量水平进一步表征后观察到的安全性和有效性结果支持选择900μg/kg作为III期试验的推荐剂量16。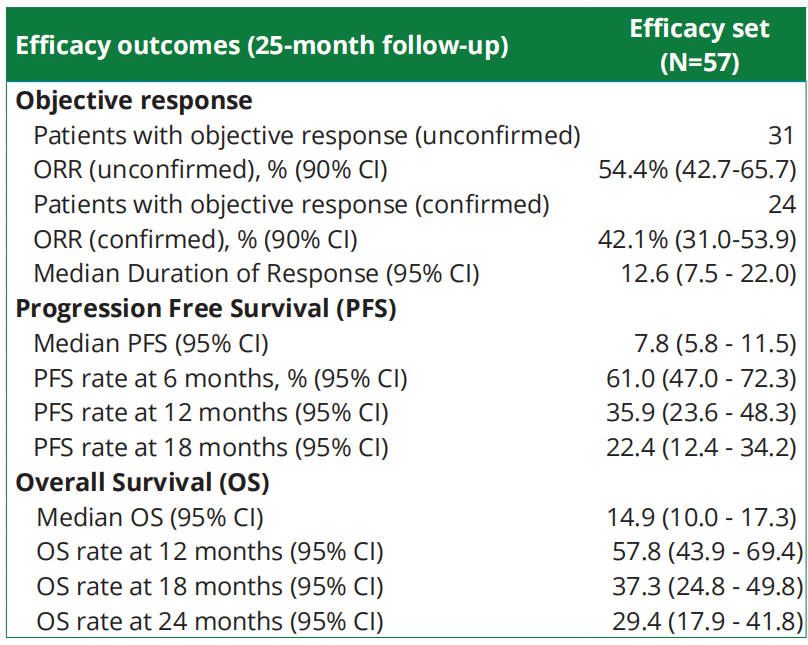
总结
正如王风华教授所总结,2025年ESMO GI大会上,胆管癌和胰腺癌治疗领域取得了多项重要进展。在胆管癌方面,IDH1突变靶向药物艾伏尼布在多项研究中表现出显著的疗效和安全性,进一步夯实了其治疗潜力。此外,针对FGFR2和HER2等靶点的研究也取得积极成果,有望为胆管癌的精准治疗提供更多选择。在胰腺癌领域,NALIRIFOX、Nal-IRI+5-FU等化疗方案在真实世界研究中展现出明显的生存获益。同时,肿瘤电场治疗、新型环状多肽Certepetide以及CD40激动剂米佐利单抗等创新疗法也显示出令人振奋的疗效。这些研究进展不仅丰富了胆管癌和胰腺癌的治疗策略,更推动胆胰肿瘤治疗朝着更加精准化和个体化的方向迈进。
审批号:M-TIBSO-CN-202507-00016
本文转自:医脉通
1.中华人民共和国国家卫生健康委员会医政医管局. 胰腺癌诊疗指南(2022年版). 中华消化外科杂志,2022,21(09):1117-1136.
2.Shroff RT, King G, Colby S, et al.SWOG S1815: A Phase III Randomized Trial of Gemcitabine, Cisplatin, and Nab-Paclitaxel Versus Gemcitabine and Cisplatin in Newly Diagnosed, Advanced Biliary Tract Cancers. J Clin Oncol. 2025 Feb 10;43(5):536-544.
3.Taghizadeh, H., Müllauer, L., Mader, R.,et al. Applied precision cancer medicine in metastatic biliary tract cancer. Hepatology international, 14(2), 288–295.
4.FDA批准艾伏尼布适应症https://www.fda.gov/drugs/resources-information-approved-drugs/fda-disco-burst-edition-fda-approval-tibsovo-ivosidenib-adult-patients-previously-treated-locally
5.EMA批准艾伏尼布适应症https://www.ema.europa.eu/en/medicines/human/EPAR/tibsovo
5.2025 ESMO GI. Abstract.262MO.
6.2025 ESMO GI. Abstract.337P.
7.2025 ESMO GI. Poster.322P.
8.2025 ESMO GI. Poster.338P.
9.2025 ESMO GI. Poster. 319P.
10.2025 ESMO GI. Poster. 271P.
11.2025 ESMO GI. Poster.293P.
12.2025 ESMO GI. Poster.274P.
13.2025 ESMO GI. Slides. LBA3.
14.2025 ESMO GI. Slides. 260MO.
15.2025 ESMO GI. Poster.265P.
排版编辑:肿瘤资讯-yu











 苏公网安备32059002004080号
苏公网安备32059002004080号


