胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC),长期以来治疗选择有限,患者预后极差,5年生存率仅为9%1。近年来,随着精准医学和免疫治疗的发展,PDAC治疗领域涌现出多项创新性临床试验,为这一"癌症之王"的治疗带来了新的希望。2025年美国临床肿瘤学会(ASCO)年会作为全球肿瘤学界最重要的学术盛会,发布了PDAC治疗领域的多项重磅研究成果,包括基于生物标志物的精准靶向治疗和免疫治疗的最新探索。为帮助临床医生和研究者全面了解这些突破性进展,特邀四川大学华西医院肿瘤内科曹丹教授,对本次ASCO年会上发布的PDAC临床研究进行深度解析。
四川大学华西医院临床联合党委书记
腹部肿瘤科主任、腹部肿瘤免疫微环境研究室主任
国家重点研发计划首席科学家
四川省学术技术带头人
中国临床肿瘤学会(CSCO)理事
CSCO胰腺癌专委会常委
CSCO胆道肿瘤专委会常委
CSCO神经内分泌肿瘤专委会常委兼秘书长
CSCO肝癌专委会委员
CSCO免疫治疗专委会委员
国际肝胆胰协会中国分会首届肝脏肿瘤专委会常委
中国医促会神经内分泌肿瘤分会副会长
四川省医师协会肿瘤多学科诊疗专委会主委
四川省抗癌协会肿瘤内分泌专委会候任主委
JCO胆道系统肿瘤中文版专刊 主编
国家自然科学基金通信评审专家、SCI杂志编委
以第一作者或通讯作者发表SCI论文70余篇(Signal Transduction and Targeted Therapy,Journal of Hepatology, Journal of Hematology & Oncology等)
主持国家重点研发计划项目、国家自然科学基金、省科技厅基金等
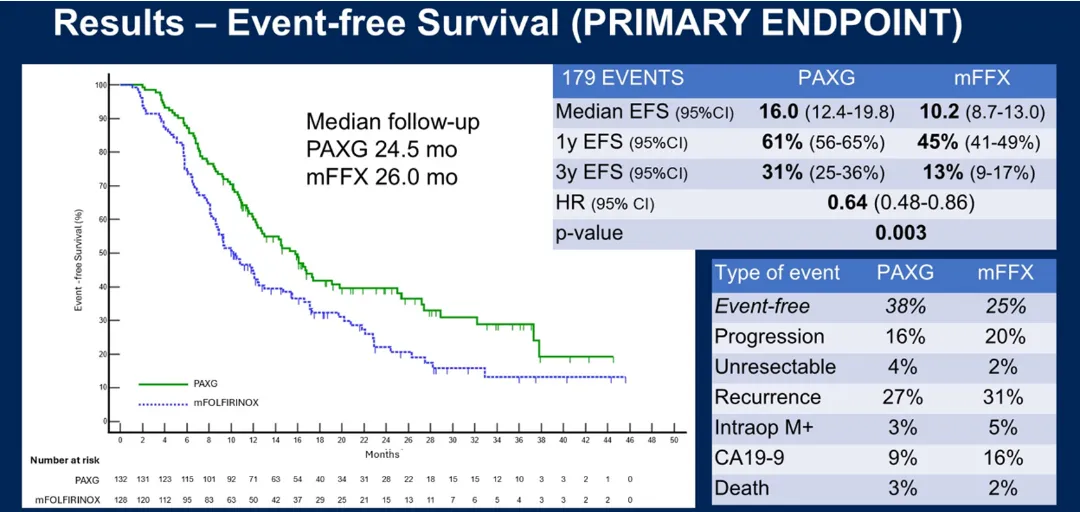
mFOLFIRINOX或PAXG术前化疗方案治疗I-III期胰腺导管腺癌的随机III期试验结果
Results of a randomized phase III trial of pre-operative chemotherapy with mFOLFIRINOX or PAXG regimen for stage I-III pancreatic ductal adenocarcinoma2
CASSANDRA研究是一项多中心III期优效性试验,旨在比较PAXG方案与mFOLFIRINOX方案在可切除/交界可切除PDAC患者新辅助治疗中的疗效。260例≤75岁的患者被随机分配到 PAXG组(A组,N=132,口服卡培他滨+双周顺铂、白蛋白结合型紫杉醇、吉西他滨)或 mFOLFIRINOX组(B组,N=128,双周5-氟尿嘧啶、伊立替康、奥沙利铂)。
结果显示,PAXG组的3年无事件生存率达30%,显著优于mFOLFIRINOX组的14%(HR 0.66,P=0.005)。PAXG组的疾病控制率为98%,CA19-9下降>50%的患者比例达88%,切除率为75%,病理分期<II期的患者占35%。主要3-4级毒性反应包括中性粒细胞减少症(44%)、疲劳(8%)和恶心呕吐(7%)。这一结果表明,PAXG方案在新辅助治疗中展现出良好疗效,且安全性可控。
NALIRIFOX方案在胰腺癌不同分期中的应用:中国学者临床使用经验
A phase II study of NALIRIFOX (liposomal irinotecan, 5-fluorouracil, leucovorin and oxaliplatin) in patients with locally advanced pancreatic cancer (LAPC)3
这项中国研究纳入了20例局部晚期胰腺癌(LAPC)患者。患者接受NALIRIFOX方案治疗,中位治疗周期为4(范围:2-6)。研究结果显示,ORR为35.0%,DCR达75.0%。更为重要的是,9例患者接受了手术探查,全部成功完成手术切除,手术转化率高达45.0%,且均实现R0切除。安全性方面,虽然所有患者都出现了治疗相关不良事件,但3级以上不良事件发生率为60%,主要包括淋巴细胞减少、腹痛和中性粒细胞减少等,总体可控。提示临床中NALIRIFOX方案可作为以手术切除为目标的LAPC的优选方案。
A real-world study of the NALIRIFOX regimen in perioperative treatment of borderline resectable and locally advanced pancreatic cancer in China4
这项中国的真实世界研究纳入了15例患者(12例交界可切除胰腺癌BRPC,3例LAPC)。患者接受4个周期新辅助NALIRIFOX方案治疗后手术,术后再接受4个周期辅助化疗。结果显示手术切除率为86.7%,R0切除率高达92.3%。影像学评估显示10例完全缓解,3例部分缓解,ORR达86.7%,DCR为100%。13例手术患者的9个月DFS为92.3%,1年DFS为84.6%。3级以上不良事件主要为腹泻(13.3%)和中性粒细胞减少(6.7%),安全性良好。
PANOVA-3:肿瘤电场治疗联合吉西他滨和白蛋白紫杉醇治疗局部晚期胰腺导管腺癌的III期研究
PANOVA-3: Phase 3 study of tumor treating fields (TTFields) with gemcitabine and nab-paclitaxel for locally advanced pancreatic ductal adenocarcinoma (LA-PAC)5
PANOVA-3研究是一项全球性、前瞻性、随机、开放标签、对照的III期试验,旨在评估肿瘤电场治疗(TTFields)联合吉西他滨与白蛋白结合型紫杉醇(GnP)对比单纯GnP方案作为不可切除局部晚期胰腺导管腺癌(LA-PAC)一线治疗的疗效。该研究纳入571例新诊断的不可切除LA-PAC患者,1:1随机分配接受TTFields/GnP或单独GnP治疗。
结果显示,TTFields/GnP组的中位总生存期为16.2个月,显著长于GnP组的14.2个月(HR 0.82,P=0.039)。一年生存率也显著改善(68.1% vs 60.2%,P=0.029)。该研究还创新性地采用无痛生存期作为研究终点之一,其延长至15.2个月(对照组9.1个月,P=0.027)。事后分析显示TTFields/GnP组的远处无进展生存期也有显著获益(13.9 vs 11.5个月,P=0.022)。安全性方面,81%接受TTFields治疗的患者出现轻度到中度皮肤反应。PANOVA-3研究为LA-PAC患者带来显著的总生存获益。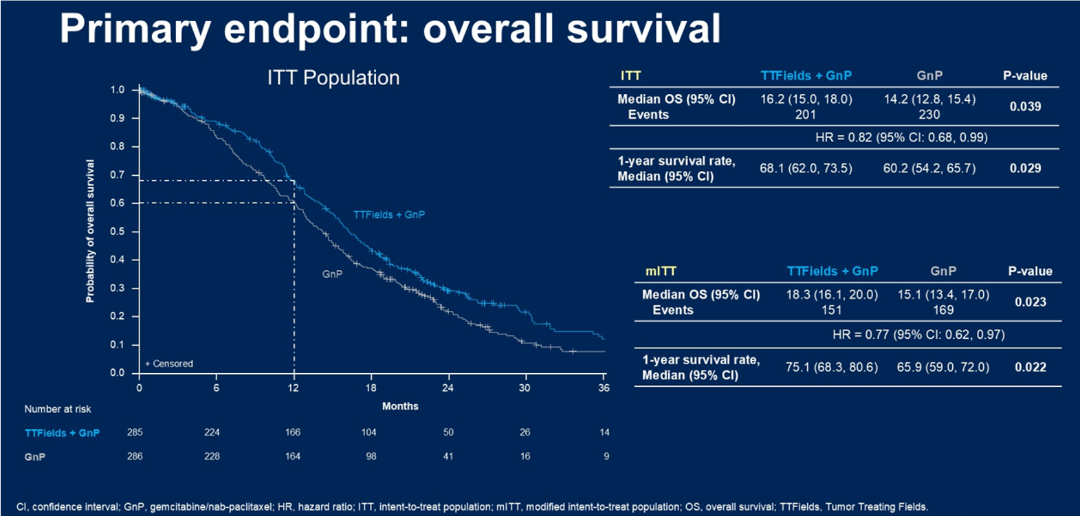
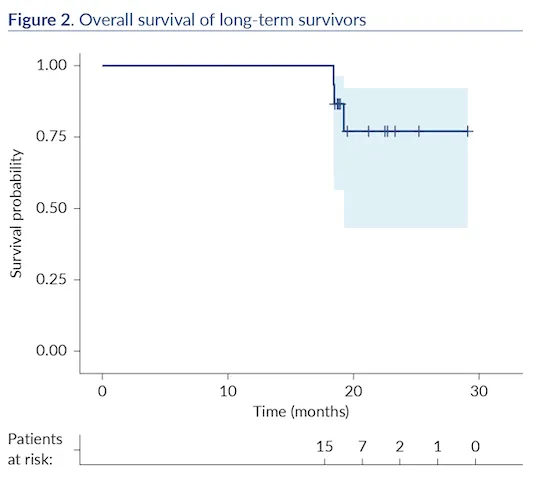
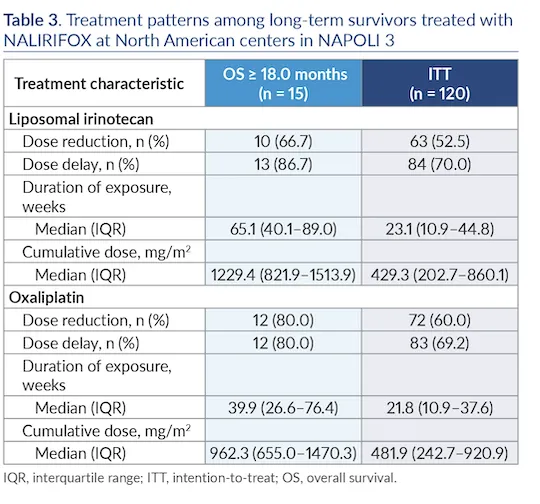
NAPOLI 3研究:NALIRIFOX方案治疗转移性胰腺癌的长期生存者特征分析
NAPOLI 3, a phase 3 study of NALIRIFOX in patients with metastatic pancreatic ductal adenocarcinoma (mPDAC): Final overall survival (OS) analysis and characteristics of the long-term survivors6
NAPOLI 3是一项评估NALIRIFOX方案治疗初治转移性胰腺导管腺癌(mPDAC)的III期临床试验。本次事后分析聚焦于北美中心120例患者中生存期≥18个月的长期生存者(n=15)。结果显示,长期生存者的中位总生存期达19.5个月,具有以下特征:中位年龄61岁(相对年轻)、53.3% ECOG评分为0、CA19-9中位值166.8 U/ml、53.3%肿瘤位于胰体。尽管66.7%有肝转移、53.3%有≥3个转移部位,但通过灵活的剂量调整(66.7%减少脂质体伊立替康剂量、80.0%减少奥沙利铂剂量),患者获得了较长的治疗暴露时间(脂质体伊立替康65.1周、奥沙利铂39.9周)和较高的累积剂量。
Elraglusib联合吉西他滨/白蛋白紫杉醇(GnP)对比单纯GnP治疗初治转移性胰腺导管腺癌的随机II期研究的初步结果
Preliminary results from the randomized phase 2 study (1801 part 3B) of elraglusib in combination with gemcitabine/nab-paclitaxel (GnP) versus GnP alone in patients (pts) with previously untreated metastatic pancreatic ductal adenocarcinoma (mPDAC)7
Elraglusib(9-ING-41)是首个GSK-3β抑制剂,可介导药物耐药、上皮间质转化和肿瘤免疫反应。这是一项开放标签的II期随机对照试验,按2:1的比例,将233例初治转移性胰腺癌患者随机分配至elraglusib/GnP组或GnP组。
结果显示,elraglusib/GnP组的1年总生存率为43.6%,显著高于GnP组的22.5%(P=0.002)。中位总生存期分别为9.3个月和7.2个月(HR 0.63,P=0.016)。elraglusib/GnP客观缓解率和疾病控制率也优于对照组。
本研究最常见的治疗相关不良事件是1-2级短暂视觉损害(>60%患者)。3级及以上不良事件发生为89.7%,主要包括中性粒细胞减少症(51.6%)贫血(24.5%)和疲劳(16.1%)。
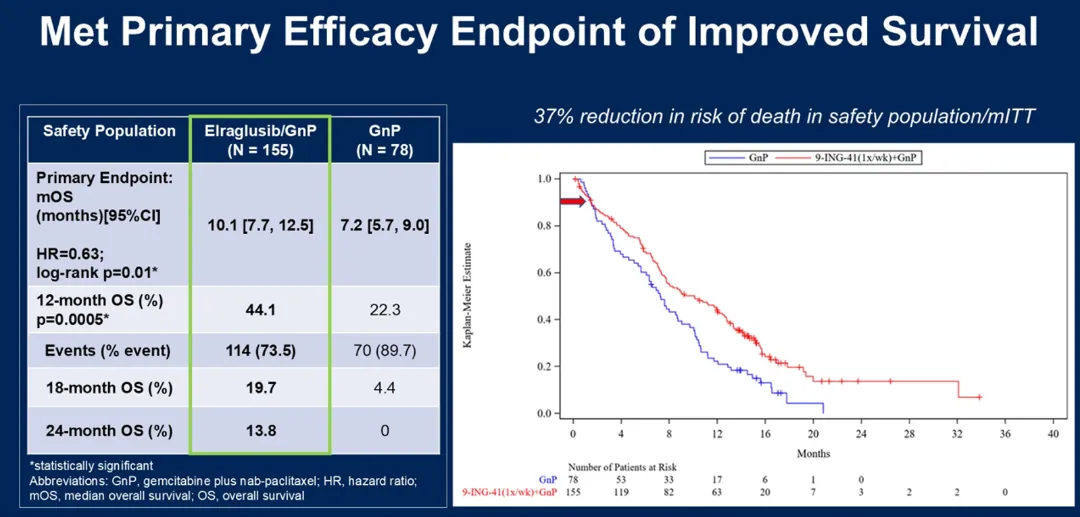
FOLFIRI联合OSE2101疫苗用于晚期胰腺导管腺癌诱导后维持治疗
Maintenance with plus FOLFIRI vs FOLFIRI alone after FOLFIRINOX (FFX) induction in patients (Pts) with advanced pancreatic ductal adenocarcinoma (aPDAC): Primary endpoint results of a randomized TEDOPAM GERCOR D17-01 PRODIGE 63 trial8
OSE2101是一种多肽癌症疫苗,靶向5种肿瘤相关抗原。TEDOPAM试验是一项创新性的多中心、随机、非对照的II期研究,评估了在8个周期FOLFIRINOX治疗后未进展的晚期胰腺癌患者中,FOLFIRI联合OSE2101疫苗用于维持治疗的效果。
107例患者随机分配至FOLFIRI组(A组)或FOLFIRI+OSE2101组(B组)。结果显示,在FOLFIRI维持治疗基础上联合OSE2101疫苗达到预设的OS终点(12个月-OS率:65.4%),两组的12个月总生存率分别为61%和65%。中位总生存期分别为17.3个月和15.5个月。 安全性方面,OSE2101组严重不良事件发生率略高(26% vs 12%),但未观察到意外的严重不良事件,未出现新的不良反应,且未增加FOLFIRI的毒性。
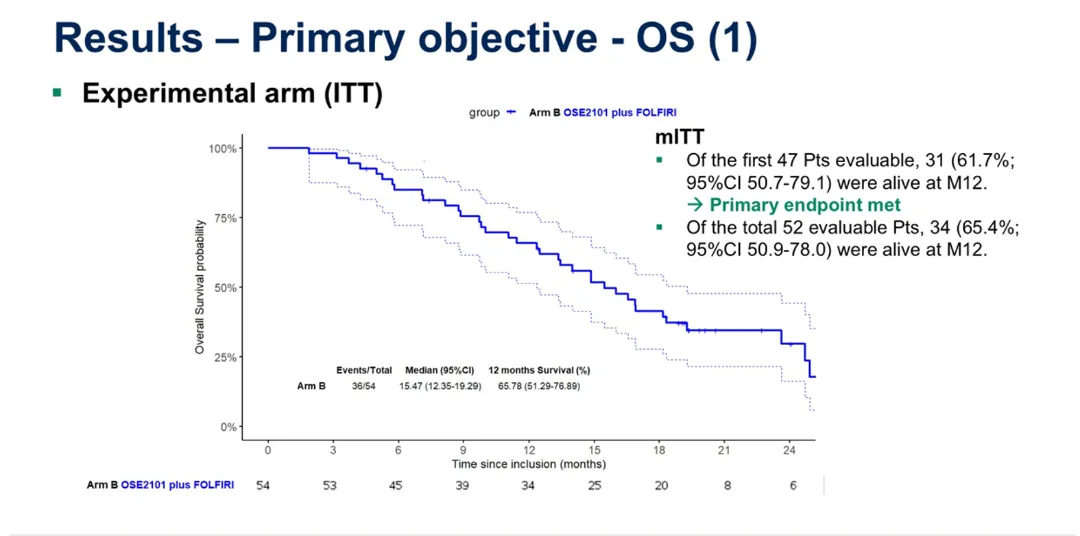
Claudin18.2表达与胰腺导管腺癌疗效:IBI343 I期剂量扩展队列研究结果
Claudin18.2 (CLDN18.2) expression and efficacy in pancreatic ductal adenocarcinoma (PDAC): Results from a phase I dose expansion cohort evaluating IBI3439
CLDN18.2在近60%的PDAC病例中高表达,IBI343是首个靶向CLDN18.2的抗体-药物偶联物(ADC)。该I期研究纳入了83例来自中国和澳大利亚的晚期PDAC患者,这些患者均表达较高水平的CLDN18.2且标准治疗失败或不耐受。研究对比了IBI343在CLDN18.2不同表达水平的疗效——患者被分为CLDN18.2高表达组(≥60%,44例)和低表达组(<60%,12例)。
初步结果显示:CLDN18.2高表达组的ORR(22.7% vs 0)、DCR(81.8% vs 41.7%)和中位PFS(5.4个月 vs 1.4个月)均明显高于低表达组,提示IBI343在CLDN18.2不同表达水平的患者中具有不同的疗效。安全性方面,最常见的治疗相关不良事件包括贫血(66.3%)、中性粒细胞计数减少(48.2%)和白细胞计数减少(47.0%),整体安全性与既往报告一致。
专 家 点 评
这几项研究代表了PDAC治疗领域的重要进展,给这种预后极差的恶性肿瘤带来了曙光。CASSANDRA研究虽然达到了主要终点,证明PAXG方案相比mFOLFIRINOX可显著改善无事件生存期,但这一结果也引发了诸多值得深思的问题。该研究采用的2×2双程随机设计虽然提高了统计学效力,但可能对未来亚组分析的解释造成混杂影响;PAXG这一包含四种化疗药物的复杂方案,其长期安全性仍需进一步验证; PANOVA-3研究是首个在局部晚期PDAC中证实总生存获益的III期试验,肿瘤电场治疗或许是一种有效的物理辅助治疗措施,不过,TTFields在胰腺癌中的应用仍处于起步阶段,其在真实世界中的可及性和成本效益需要进一步评估。
胰腺癌的转化治疗近年来取得新进展。以NALIRIFOX(伊立替康联合奥沙利铂、5-氟尿嘧啶和亚叶酸)为代表的新型化疗方案,不仅在局部晚期和交界可切除胰腺癌中实现了较高的手术转化率和R0切除率,还为肝脏寡转移患者提供了新的治疗选择。这些研究结果为胰腺癌的个体化治疗策略提供了重要依据,特别是对于传统上被认为无法手术的患者群体,NALIRIFOX方案为其带来了转化为可切除的希望。未来需要更长期的随访数据来评估生存获益。NAPOLI 3研究揭示了NALIRIFOX方案在mPDAC长期生存者中的应用特点。相对年轻、体能状态良好、CA19-9水平较低的患者更可能获得长期生存。即使存在广泛转移,通过个体化的剂量调整策略,维持持续的治疗暴露是实现长期生存的关键。这为临床识别可能从NALIRIFOX方案中获益的患者提供了重要参考。
靶向治疗和免疫治疗创新药物的开发也取得了重要突破。Elraglusib作为首个GSK-3β抑制剂,在转移性胰腺癌中显示出生存获益,其独特的作用机制可能为克服化疗耐药提供新途径。OSE2101疫苗在维持治疗中的应用,特别是能够将部分疾病稳定患者转化为客观缓解,展示了免疫治疗在胰腺癌中的潜力,不过其长期获益仍需后续数据验证。抗体药物偶联物的进展同样值得关注。IBI343在经多线治疗的晚期胰腺癌患者中仍能获得有意义的缓解率和疾病控制率,展现了精准医学在胰腺癌治疗中的巨大潜力。
这些研究共同推动了胰腺癌治疗从传统化疗向多模式、精准化治疗的转变,为这一预后极差的恶性肿瘤患者带来了实实在在的生存获益。随着更多创新治疗策略的不断涌现和完善,胰腺癌治疗前景将会更加光明。
整理:中国医学论坛报 林颖
1. Siegel, R.L., Miller, K.D., Fuchs, H.E. & Jemal, A. Cancer statistics, 2022. CA Cancer J Clin 72, 7-33 (2022).
2. Reni, M. et al. Results of a randomized phase III trial of pre-operative chemotherapy with mFOLFIRINOX or PAXG regimen for stage I-III pancreatic ductal adenocarcinoma. Journal of Clinical Oncology 43, LBA4004-LBA4004 (2025).
3. Xu, D. et al. A phase II study of NALIRIFOX (liposomal irinotecan, 5-fluorouracil, leucovorin and oxaliplatin) in patients with locally advanced pancreatic cancer (LAPC). Journal of Clinical Oncology 43, e16447-e16447 (2025).
4. Sun, P. A real-world study of the NALIRIFOX regimen in perioperative treatment of borderline resectable and locally advanced pancreatic cancer in China. Journal of Clinical Oncology 43, e16450-e16450 (2025).
5. Picozzi, V.J. et al. PANOVA-3: Phase 3 study of tumor treating fields (TTFields) with gemcitabine and nab-paclitaxel for locally advanced pancreatic ductal adenocarcinoma (LA-PAC). Journal of Clinical Oncology 43, LBA4005-LBA4005 (2025).
6. Chung, V. et al. NAPOLI 3, a phase 3 study of NALIRIFOX in patients 7. 7. Chung, V. et al. NAPOLI 3, a phase 3 study of NALIRIFOX in patients with metastatic pancreatic ductal adenocarcinoma (mPDAC): Final overall survival (OS) analysis and characteristics of the long-term survivors. Journal of Clinical Oncology 43, LBA4175-LBA4175 (2025).
7. Mahalingam, D. et al. Preliminary results from the randomized phase 2 study (1801 part 3B) of elraglusib in combination with gemcitabine/nab-paclitaxel (GnP) versus GnP alone in patients (pts) with previously untreated metastatic pancreatic ductal adenocarcinoma (mPDAC). Journal of Clinical Oncology 43, 400
8. Turpin, A. et al. Maintenance with OSE2101 plus FOLFIRI vs FOLFIRI alone after FOLFIRINOX (FFX) induction in patients (Pts) with advanced pancreatic ductal adenocarcinoma (aPDAC): Primary endpoint results of a randomized TEDOPAM GERCOR D17-01 PRODIGE 63 trial. Journal of Clinical Oncology 43, 4009-4009 (2025).
9. Yu, X. et al. Claudin18.2 (CLDN18.2) expression and efficacy in pancreatic ductal adenocarcinoma (PDAC): Results from a phase I dose expansion cohort evaluating IBI343. Journal of Clinical Oncology 43, 4017-4017 (2025).
本资料的内容仅作为科学信息参考,并仅用于医疗卫生专业人士间的学术交流之目的,请勿转发或用于任何其他用途。
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关政府部门批准使用的指南或规定。
审批号:M-ONIVD-CN-202506-00008
排版编辑:肿瘤资讯-yu











 苏公网安备32059002004080号
苏公网安备32059002004080号


