病史摘要:患者,女性,48岁,因“发现左侧乳腺肿物1周”于2022年1月6日入院就诊。
症状体征:查体双侧乳房形态对称,无乳头内陷或皮肤异常。左乳2点位,2cm处有一个约3cm×3cm大小、边界模糊、活动度差的肿块,无粘连或压痛。右乳无肿块。左腋下触及一硬质、可移动的2cm×1cm淋巴结。
诊断方法:左乳肿块及腋窝淋巴结穿刺病理,结果提示:左乳浸润性癌,HR+、HER-2+,cT2N1M0,IIB期,伴腋窝淋巴结转移。
治疗方法:根据病情评估采用新辅助TCbHP方案(白蛋白紫杉醇+卡铂+曲妥珠单抗+帕妥珠单抗)化疗6周期,期间对症使用硫培非格司亭6mg皮下注射预防中性粒细胞减少。新辅助后行保留乳头乳晕的皮下腺体切除术+即刻扩张器置入术,术后病理MP评分4级,提示未达pCR,术后应用恩美曲妥珠单抗(TDM-1)强化辅助治疗,并联合放疗及内分泌治疗,目前治疗仍在进行。
临床转归:患者继续按计划进行治疗,正等待进一步的疗效评估。
适合阅读人群:乳腺外科,肿瘤内科
关键词:乳腺癌;肿块;浸润性;淋巴结;中性粒细胞减少
引言
乳腺癌是女性最常见的恶性肿瘤,全球发病率持续上升,我国发病率为11.61/10万人口。乳腺癌的发病可能性约为10%,其死亡率相对较低,显示出乳腺癌治疗效果较好。病因涉及内分泌失调、遗传、环境等多因素。按病理类型,乳腺癌可分为非浸润性和浸润性两大类,前者包括小叶原位癌与导管内癌,后者则包括小叶浸润性癌、乳头状癌等多种亚型。
临床资料
一般资料
患者因左侧乳腺肿物于2022年1月6日首次来院就诊,经穿刺病理诊断为左乳浸润性癌。免疫组化检测结果显示ER(-),Her2(3+),PR(-),KI-67表达约30%,表明肿瘤具有一定的侵袭性。基于诊断,患者在2022年1月8日接受了DSA下静脉输液港植入手术,并开始术前新辅助治疗。为进一步治疗,患者再次就诊,以乳腺恶性肿瘤为诊断收入院。自发病以来,患者整体状况良好,精神状态、饮食睡眠及体重保持正常,无明显慢性病或传染病史。患者有2005年剖宫产和2007年输卵管结扎手术史,术后恢复良好,无药物或食物过敏史。
检查
乳腺及其引流区淋巴结彩超声: 双侧乳腺增生左侧乳腺结节(BI-RADS 5类)、左侧乳晕区乳腺导管弥漫性改变并钙化、左侧腋窝淋巴结肿大。详见图1。
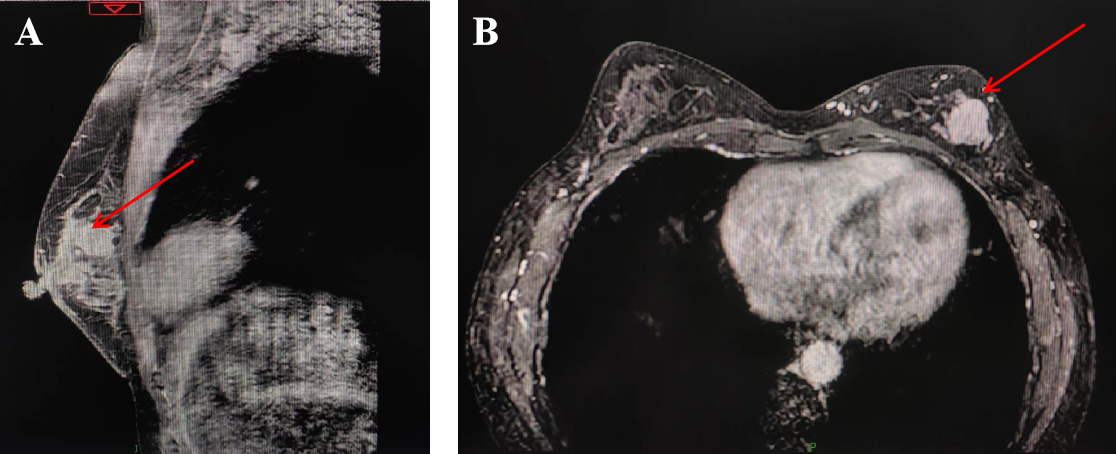
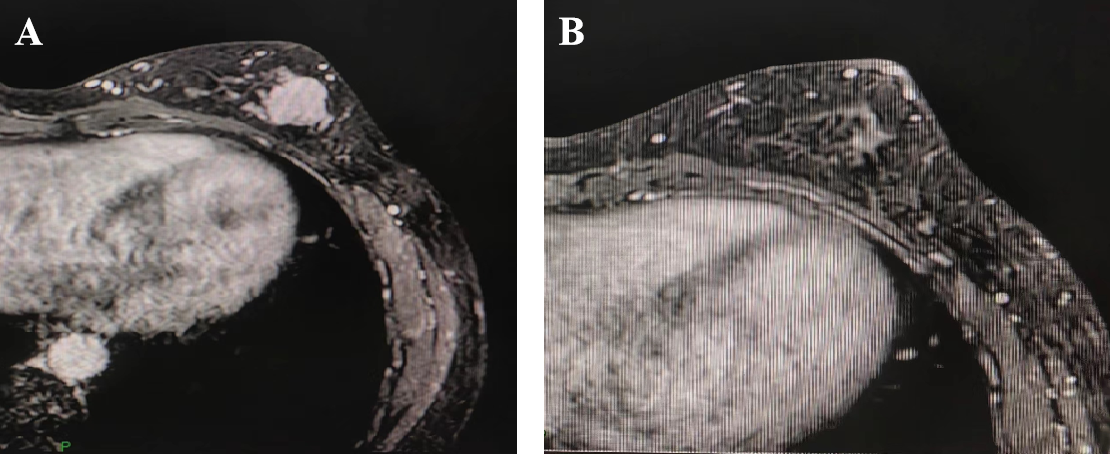
乳腺磁共振:左乳存在肿块性病变,高度怀疑恶性,伴有沿导管的浸润及左侧腋窝淋巴结转移,分级为BI-RADS 4C类,表明恶性可能性大。详见图2,图3。
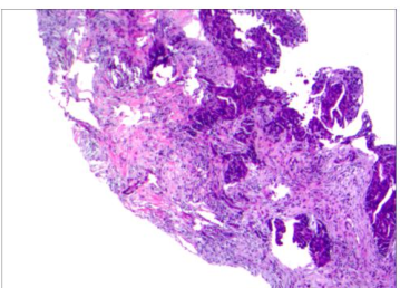
左乳肿物及腋窝穿刺:(左乳)浸润性癌,HR+、HER-2+;TNM分期:cT2N1M0 ,IIB期。腋窝淋巴结穿刺可见少量成团癌细胞。详见图4。
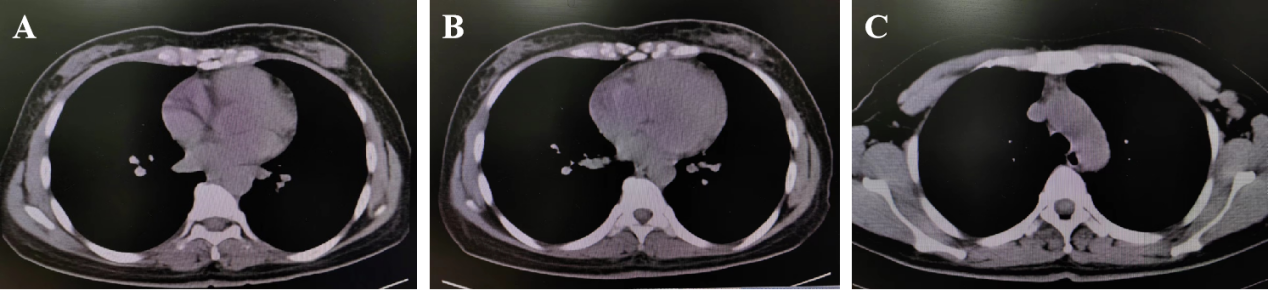
胸腹部CT:双肺散在直径5mm以下实性小结节,左乳腺体内多发结节灶,大者大小约20mm×17mm,边缘浅分叶,并见点状高密度灶、少许积气,邻近皮层增厚;左侧腋窝见多个短径11mm以下稍大淋巴结。肝脏形态大小未见异常,肝S2段见一直径约5mm囊状低密度灶。总体符合左乳结节穿刺术后改变;左腋窝淋巴结增大,考虑转移性淋巴结。详见图5。
诊断与鉴别诊断
诊断:左侧乳腺恶性肿瘤(浸润性癌,HR+,HER-2+,cT2N1M0,IIB期)。
诊断依据:根据患者查体、左乳肿块穿刺病理、腋窝淋巴结穿刺病理及影像学检查可明确诊断。
鉴别诊断:诊断明确,无需鉴别。
治疗
根据2021CSCO指南推荐术前新辅助治疗适应症和2021CBCS指南新辅助治疗内容,本例患者因乳腺肿块较大并有腋窝淋巴结转移,结合HER-2阳性和三阴性的状态,被确定为术前新辅助治疗的适应症对象。因此,患者采取了以TCbHP为基础的新辅助治疗方案,包括白蛋白紫杉醇、卡铂和两种单克隆抗体曲妥珠单抗与帕妥珠单抗,完成了6个治疗周期。为有效管理化疗潜在的恶心与呕吐反应,实施了包含5-HT3受体拮抗剂、地塞米松和NK-1受体拮抗剂的综合性止吐治疗。
在第一周期后,患者出现了III度粒细胞减少,这增加了感染风险,影响了后续化疗的连续性。因此,采用硫培非格司亭,一种长效聚乙二醇化重组人粒细胞集落刺激因子(PEG-rhG-CSF),以促进白细胞的快速恢复,保障患者能够安全地完成后续化疗周期。硫培非格司亭的使用大大减少了由于白细胞过低导致的治疗中断风险,同时降低了感染的概率,确保了治疗的顺利进行。此外,定期的血常规、心电图、心脏彩超检查及卵巢功能抑制剂的使用,共同构成了对患者的全方位保护,使患者能在最佳状态下接受治疗,进而提高了治疗的整体成功率。
治疗结果、随访及转归
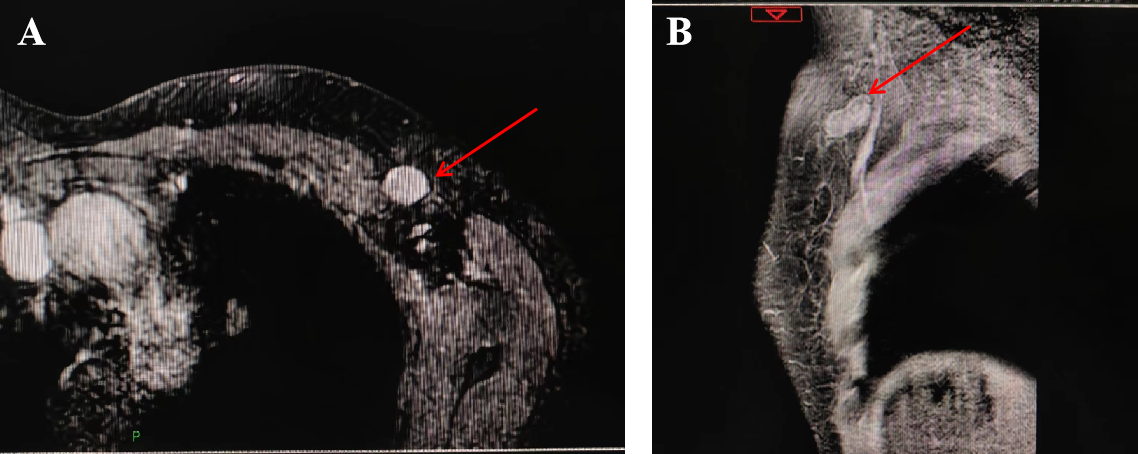
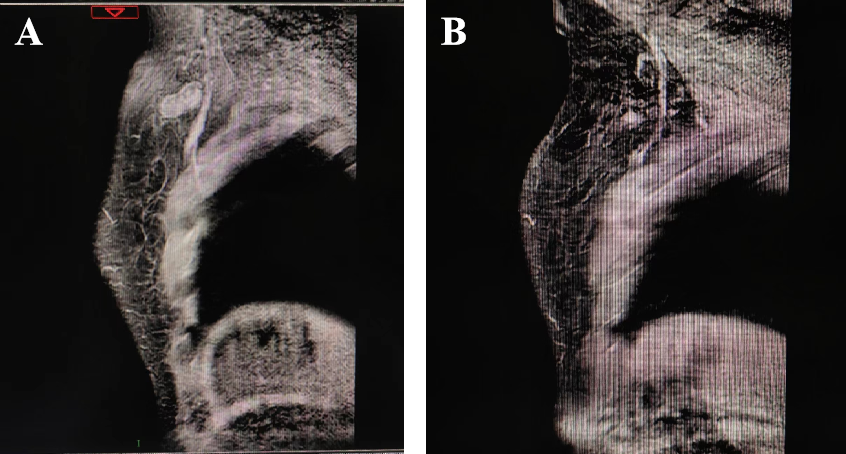
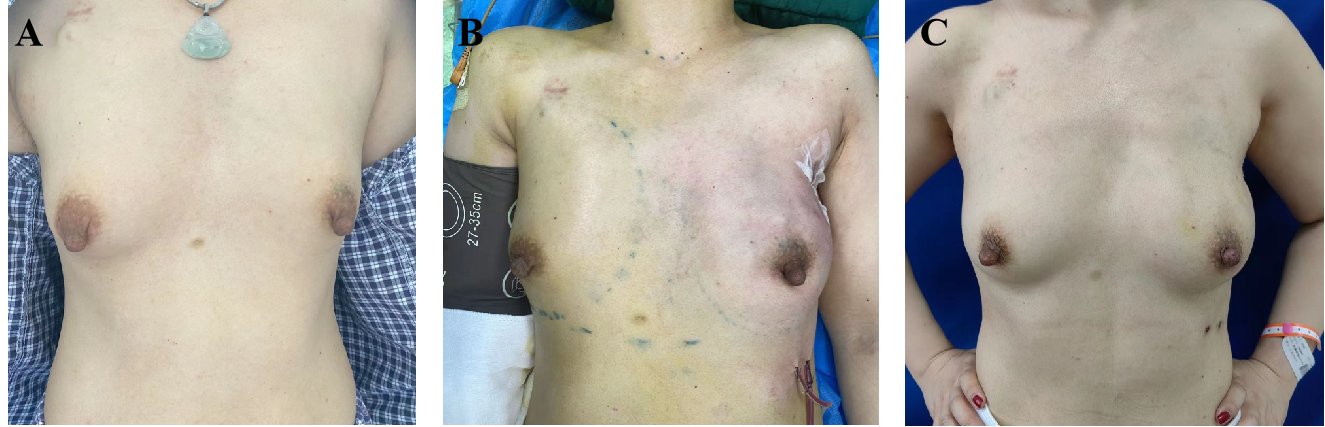
在行6周期新辅助化疗后,乳腺MRI显示:左乳肿块较前明显缩小;左侧腋窝肿大淋巴结较前明显缩小。详见图6、图7。随后,患者在2022年5月17日接受了保留乳头乳晕的皮下腺体切除术+腋窝淋巴结清扫术+即刻扩张器置入术。术后患者恢复良好,详见图8。术后病理结果显示:乳腺原发灶高级别(G4);免疫组化:ER(3+,约70%)、PR(3+,约30%)、HER-2(2+);腋窝淋巴结3枚中查见癌转移,其中1枚呈化疗后反应。提示未达pCR。详见图9。因此,患者在手术后接受了TDM-1加强辅助治疗,以增强治疗效果,同时配合放疗和内分泌治疗。患者目前仍在继续接受治疗,以进一步巩固疗效和改善预后。
讨论
乳腺癌(BC)的发病率正在逐渐增加,目前是全球女性健康面临的主要威胁之一[1]。乳腺癌的新辅助治疗已成为治疗较大原发性乳腺癌和局部晚期乳腺癌的首选治疗方法,这种方法不仅安全而且通常效果显著。新辅助治疗的核心优势在于其能够降低肿瘤的临床分期,从而减少手术切除的范围。在个体化治疗日益受到重视的今天,新辅助治疗还提供了一个独特的机会,用以评估患者对特定治疗方案的反应。此外,术前治疗环境为研究新型药物及治疗组合在实际人体乳腺癌中的效果提供了一个高效的平台。与传统的晚期疾病治疗相比,新辅助试验避免了适应性和抗药性的发展及预处理所带来的复杂性。在新辅助治疗的框架内,内分泌药物、化疗药物以及靶向药物的疗效对比不仅能迅速提供有关活性和疗效的数据,而且所需的时间和参与患者的数量都大大少于辅助治疗试验。新辅助治疗的效果在某些情况下甚至能够预示辅助治疗的潜在成效。尤其对于那些在新辅助治疗后实现病理学上完全反应的患者,以及那些因此能够避免乳房切除、保留自然乳房形态的女性来说,新辅助治疗带来的益处尤为显著。年轻乳腺癌患者在生存和生育方面面临双重挑战。面对年轻乳腺癌患者及其伴随的内科合并症,依据现有指南和共识,采用多学科合作模式,为患者量身定制了综合化、个性化、人性化的治疗方案,这种治疗策略不仅改善了患者的生存质量,还为乳腺癌的临床治疗提供了新的视角和可能性[2]。
本病例中的患者在新辅助治疗的选择与实施方面,体现了对当前临床指南的严格遵守,同时也展现了多个关键的治疗决策节点的处理。针对患者的HR+、HER2+状态,选择了新辅助化疗的TCbHP方案,并完成了六个周期的治疗。TCbHP方案是一种用于新辅助治疗HER2阳性乳腺癌的方案,在一项研究中,对408例HER2阳性乳腺癌患者的临床病理资料进行了回顾性分析,这些患者接受了不同的新辅助治疗方案,包括TCbHP方案。结果显示,TCbHP方案对HER2阳性激素受体阴性乳腺癌患者的疗效更优[3]。但是在治疗的第一周期后,患者出现了III度粒细胞减少,这是一种常见的化疗相关不良事件,但通过及时的给予硫培非格司亭,一种长效重组人粒细胞刺激因子,有效的刺激造血干细胞和粒细胞的增殖、分化,使患者能够良好地耐受后续治疗[4-5]。值得注意的是,体重对于化疗药物总剂量的影响是一个不可忽视的考量因素。体重较大的患者可能需要更多的药物剂量,以保证药物的疗效和安全性。化疗药物通常根据患者的体表面积计算剂量,而升白药物硫培非格司亭的固定剂量使用则是基于其在各种体重患者中的预防效果的广泛数据[6]。此外,化疗对于卵巢功能的影响也是一个需要特别关注的问题。尤其是在围绝经期患者中,通过合适的化疗方案和卵巢功能保护措施,可以降低化疗诱导的早期卵巢衰竭风险。在本例中,患者接受了卵巢功能抑制治疗,以降低化疗导致的早期卵巢衰竭风险。最后,手术后的病理结果显示患者未达到完全病理缓解(pCR),这是衡量新辅助化疗效果的重要指标。因此,患者在手术后接受了TDM-1强化辅助治疗[7]。T-DM1已获得FDA批准,用于治疗HER2阳性早期乳腺癌患者,在他们完成新辅助治疗并且仍有残留疾病后。T-DM1作为单药治疗,之前患者已经尝试过曲妥珠单抗和紫杉类药物。KATHERINE研究证实了T-DM1在HER2阳性早期乳腺癌新辅助治疗后未达到病理学完全缓解(non-pCR)的患者中的疗效。与继续使用曲妥珠单抗相比,T-DM1显著降低了这些患者的复发或死亡风险约50%[8]。
综上所述,本例患者的治疗经验强调了个体化治疗的重要性,并体现了在临床实践中处理复杂疗程的挑战。对粒细胞减少的监测与管理、卵巢功能的保护以及术后病理结果对后续治疗决策的指导作用是乳腺癌治疗中关键的考量点。这一案例为乳腺癌的多学科综合治疗提供了有力的证据,强调了标准化指南与个体化病人需求之间的平衡。
利益冲突声明 所有作者均声明本研究不存在利益冲突
[1] Lin, Cheng-Yao et al. “Incidence of second primary malignancies in women with different stages of breast cancer.” Frontiers in oncology vol. 12 1047684. 9 Jan. 2023, doi:10.3389/fonc.2022.1047684
[2] THOMPSON A M, MOULDER-THOMPSON S L. Neoadjuvant treatment of breast cancer [J]. Annals of Oncology, 2012, 23: x231-x6.
[3] Jie Min, Xinxin Li, Xin Wang. Efficacy comparation of different neoadjuvant chemotherapies combined with trastuzumab and pertuzumab in HER-2 positive breast cancer[J]. CHINESE JOURNAL OF CLINICAL ONCOLOGY, 2023, 50(22): 1142-1146. DOI: 10.12354/j.issn.1000-8179.2023.20231078
[4] Efficacy and safety of PEG-rhG-CSF versus rhG-CSF in preventing chemotherapy-induced-neutropenia in early-stage breast cancer patients[J]. BMC Cancer. 2023 Jul 26;23(1):702.
[5] Mayers C, Panzarella T, Tannock IF. Analysis of the prognostic effects of inclusion in a clinical trial and of myelosuppression on survival after adjuvant chemotherapy for breast carcinoma[J]. Cancer, 2001,91(12):2246–2257.
[6] Mecapegfilgrastim in Chemotherapy-Induced Neutropenia: A Profile of Its Use in China[J]. Clin Drug Investig. 2019 Oct;39(10):1009-1018.
[7] Exceptional and Durable Responses to TDM-1 After Trastuzumab Failure for Breast Cancer Skin Metastases: Potential Implications of an Immunological Sanctuary[J]. Front Oncol. 2018 Dec 3:8:581.
[8] Von Minckwitz G , Huang C S , Mano M S , et al. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer[J]. New England Journal of Medicine, 2018.
排版编辑:肿瘤资讯-黄洋洋











 苏公网安备32059002004080号
苏公网安备32059002004080号


