主要研究方向:消化道恶性肿瘤的内科综合诊治、肿瘤转移、肿瘤微环境的机制及转化研究。
主持省级课题1项,院内课题1项,以主要参与人参与多项国家级及省级课题。
以第一作者发表SCI及中文核心期刊论文2篇。
辽宁省免疫学肿瘤免疫分会青年委员。
ASCO 解读文献
维迪西妥单抗及特瑞普利单抗联合化疗或曲妥珠单抗一线治疗HER2表达的局部晚期或转移性胃癌患者的疗效及安全性研究(C027研究)
研究背景
在既往的一项I期临床试验中,维迪西妥单抗联合特瑞普利单抗二线及后线治疗HER2表达型胃/胃食管结合部癌患者显示出令人鼓舞的疗效和可控的安全性。本研究旨在评估维迪西妥单抗和特瑞普利单抗联合化疗/曲妥珠单抗一线治疗HER2阳性或HER2低表达局部晚期/转移性胃/胃食管结合部癌患者的疗效与安全性。本次ASCO会议主要公布随机II期部分研究结果,临床研究注册信息:NCT05980481。
研究方法
本研究是一项随机、多队列、II/III期临床研究,共纳入144例未经系统治疗的局部晚期或转移性HER2表达胃癌患者,分为HER2高表达组(n=51)及HER2中低表达组(n=93)。
HER2高表达组患者(IHC 3+或IHC 2+/FISH+),按1:1:1随机分成三个队列:
试验组1:维迪西妥单抗(2.5mg/kg,q2w)+特瑞普利单抗(3.0mg/kg,q2w)+CAPOX(奥沙利铂 130mg/m² d1;卡培他滨:1000mg/m²,d1-14,q3w);
试验组2:维迪西妥单抗(2.5mg/kg,q2w)+特瑞普利单抗(3.0mg/kg,q2w)+曲妥珠单抗(起始剂量8mg/kg,随后6mg/kg,q3w);
对照组:特瑞普利单抗(2.5mg/kg,q2w)+曲妥珠单抗(起始剂量8mg/kg,随后6mg/kg,q3w)+CAPOX(奥沙利铂 130mg/m² d1;卡培他滨:1000mg/m²,d1-14,q3w);
HER2中低表达患者(IHC 2+/FISH-或IHC 1+),分为两阶段探索:
第一阶段:按1:1随机分成2个队列:
试验组:特瑞普利单抗(3.0mg/kg,q2w)+维迪西妥单抗(2.5mg/kg,q2w)+CAPOX(奥沙利铂 130mg/m² d1;卡培他滨:1000mg/m²,d1-14,q3w);
对照组:特瑞普利单抗(3.0mg/kg,q2w)+CAPOX(奥沙利铂 130mg/m² d1;卡培他滨:1000mg/m²,d1-14,q3w);
第二阶段(剂量优化):按1:1:1随机分成3个队列:
试验组1:特瑞普利单抗(3.0mg/kg,q2w)+维迪西妥单抗(2.5mg/kg,q2w)+减量CAPOX(奥沙利铂 100mg/m²,d1;卡培他滨:750mg/m²,d1-14,q3w);
试验组2:特瑞普利单抗(3.0mg/kg,q2w)+维迪西妥单抗(2.0mg/kg,q2w)+减量CAPOX(奥沙利铂 100mg/m²,d1;卡培他滨:750mg/m²,d1-14,q3w);
对照组:特瑞普利单抗(3.0mg/kg,q2w)+CAPOX(奥沙利铂 130mg/m² d1;卡培他滨:1000mg/m²,d1-14,q3w);
主要研究终点:客观缓解率(ORR)。
次要研究终点:无进展生存期(PFS)、总生存期(OS)、缓解持续时间(DoR)和安全性。

研究结果
截止到2025年4月7日共入组51例HER2高表达胃癌患者和93例HER2中低表达胃癌患者。试验组和对照组的基线特征基本均衡。
HER2高表达患者:
中位随访13.2个月的数据显示:维迪西妥单抗+特瑞普利单抗+CAPOX组的cORR为66.7%(95%CI 41.0-86.7),中位PFS未达到(95%CI 8.2-NE);维迪西妥单抗+特瑞普利单抗+曲妥珠单抗组的cORR达82.4%(95%CI 56.6-96.2),mPFS也未达到(95%CI 8.5-NE),cORR进一步得到提升。对比对照组的cORR为68.8%(95%CI 41.3-89.0),mPFS为14.1个月(95%CI 3.1-NE)均有显著提高。对比对照组,两组试验组疾病进展或死亡风险分别降低54%(HR=0.46)和41%(HR=0.59),12个月PFS率分别为66.3%,67.0%和53.6%。
HER2中低表达患者:
第一阶段中位随访10.4个月的数据显示:特瑞普利单抗+维迪西妥单抗+CAPOX试验组(n=25)的cORR达72.0%(95%CI 50.6-87.9),显著高于特瑞普利单抗+CAPOX对照组的47.8%(95%CI 26.8-69.4),且mPFS延长(9.9 vs 7.2个月)。
第二阶段中位随访7.0个月的数据显示:特瑞普利单抗+维迪西妥单抗(2.5mg/kg)+减量CAPOX组的cORR为71.4%(95%CI 41.9-91.6),显著优于对照组的56.3%(95%CI 29.9-80.2),维迪西妥单抗 2.0 mg/kg组(n=15)的cORR为66.7%(95%CI 38.4-88.2),同样优于对照组。
所有HER2高表达及中低表达队列中,最常见的3级及以上TRAEs均为腹泻、中性粒细胞减少、血小板减少等,未见明显的新增不良反应事件。

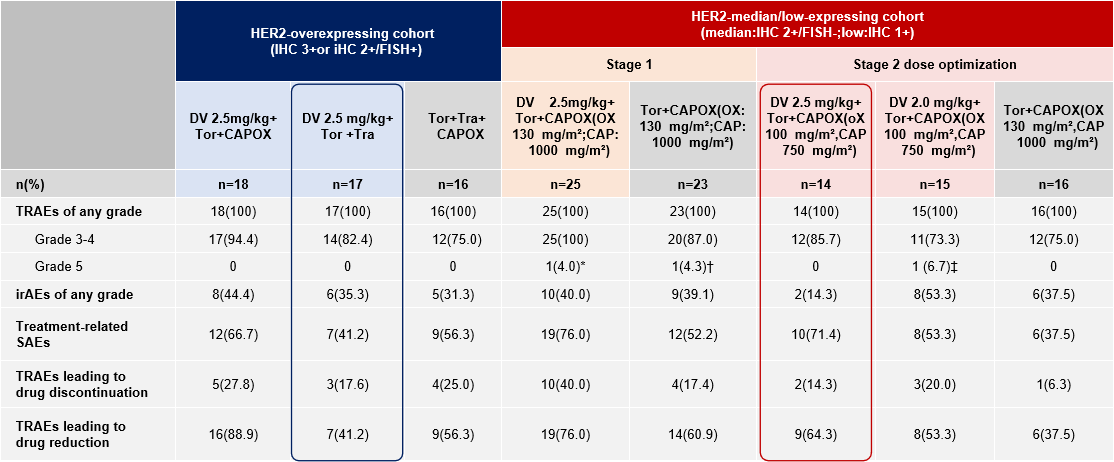
研究结论
在HER2表达局部晚期或转移性胃癌患者中,HER2高表达人群维迪西妥单抗联合曲妥珠单抗联合特瑞普利单抗方案展现出更高的ORR及更长的PFS,提供了“去传统化疗”可能性。HER2低表达人群,特瑞普利单抗联合维迪西妥单抗联合减量CAPOX方案,在增加耐受性的情况下,同样保持了较好的疗效,为抗HER2治疗提供了更多选择。
解读
胃癌抗HER2治疗的“前世今生”
在2010年以前,晚期胃癌治疗主要是以氟尿嘧啶及铂类药物为基础的化疗方案,但疗效不佳。2010年的ToGA研究[1]奠定了抗HER2治疗的基石,引领胃癌靶向治疗新时代。曲妥珠单抗联合化疗成为指南推荐的晚期HER2阳性胃癌的标准一线治疗方案。此后10余年,抗HER2治疗探索陷入沉寂,多项抗HER2胃癌临床研究(包括TKI药物拉帕替尼,HER2单抗药物帕妥珠单抗,新型ADC类药物恩美曲妥珠单抗等)接连失败。随着免疫时代的到来,KEYNOTE-811研究[2]揭开了“靶免化”联合治疗的序幕。研究结果显示帕博利珠单抗联合曲妥珠单抗联合化疗组总生存期达到20个月,然而在PD-L1<1的人群中,未观察到明显的生存获益,这揭示了抗HER2治疗与免疫治疗间的相互作用。2024年6月中国国家药品监督管理局(NMPA)批准帕博利珠单抗联合曲妥珠单抗、含氟尿嘧啶类和铂类药物化疗方案,用于PD-L1(CPS≥1分)的局部晚期不可切除或转移性HER2阳性胃/胃食管结合部癌患者的一线治疗,开启了HER2阳性胃癌免疫治疗新纪元,目前,多种新型抗HER2单克隆抗体的联合治疗的临床试验也在陆续开展中。随着新药的不断研发,新型ADC类药物逐渐走进我们的视野,抗HER2 ADC类药物在HER2阳性胃癌后线探索中疗效初显。
维迪西妥单抗及德曲妥珠单抗填补了胃癌后线抗HER2治疗的空白,改写了CSCO HER2阳性胃癌三线治疗的指南,抗HER2 ADC药物治疗也逐渐从后线向前线推进。2025年ASCO公布的DESTINY Gastric-04研究[3]作为HER2阳性胃癌领域首个头对头对比目前标准二线治疗方案并展现出有效性的III期临床研究,结果显示德曲妥珠单抗组中位OS长达14.7个月,显著长于标准治疗方案组的11.4个月,为HER2阳性胃癌患者二线治疗提供了更佳选择。德曲妥珠单抗一线治疗目前仍在探索中,初步疗效已显现。
维迪西妥单抗是我国首个国产HER2靶向ADC药物,其能通过精准锚定,精确杀伤HER2中高表达细胞,并通过“旁观者效应”损伤附近HER2低表达细胞。RC48-C008研究[3]纳入HER2 IHC 2+或3+的三线胃癌患者,结果显示ORR接近25%,中位PFS达4.1个月,中位OS达7.6个月,显著改善胃癌后线治疗预后,同时部分既往接受过曲妥珠单抗治疗的胃癌患者也可从中获益。基于此,CSCO指南将维迪西妥单抗写入胃癌三线治疗推荐。维迪西妥单抗后线治疗的成功经验推动其向前线治疗探索。既往研究观察到抗HER2治疗与免疫治疗的协同效应,维迪西妥单抗与免疫检查点抑制剂的联合治疗也在探索中。2025年ASCO公布了2项维迪西妥单抗重磅研究。RCTS研究[4]纳入53例HER2过表达晚期胃及胃食管交界部腺癌患者,一线应用维迪西妥单抗联合替雷利珠单抗和S-1治疗,ITT人群中ORR达到89.4%,中位PFS达到13.1个月,OS尚未成熟,18个月OS率达到67.8%。亚组分析显示PD-L1 CPS≥1这部分人群中位PFS甚至达到16.7个月,初步数据也推动了随机对照研究RCTS2研究进行,我们也期待新的研究数据能够改写临床实践。与此同时,维迪西妥单抗HER2低表达人群中的探索也取得了较为不错的结果。目前抗HER-2药物的种类较为丰富,其多样性推动了不同HER2表达模式下的探索。2025年CSCO指南将胃癌HER2表达模式进行了更新,根据免疫组化(IHC)及免疫荧光检测(FISH)结果,将HER2分为高表达(IHC 3+或IHC 2+/FISH +),中表达(IHC 2+/FISH -),低表达(IHC 1+)及不表达(IHC 0)。C027研究应用此HER2表达模式,同时纳入HER2高中低表达人群进行探索,在2025年ASCO会议上公布了初步数据。该研究是全球首个晚期胃癌一线“抗HER2 ADC+抗HER2靶向+PD-1单抗”新治疗模式的探索,旨在探究“双重抗HER2”模式的互补效应。C027研究[5]设计极具创新性,多队列平行研究、II/III期无缝设计,根据HER2高表达及中低表达分组,组内采用随机分组的同时,同步进行剂量优化。针对HER2高表达人群,设计维迪西妥单抗+特瑞普利单抗+曲妥珠单抗队列,实现“去传统化疗”,结果显示ORR可达到82.4%,实现了“零”的突破,目前经过中位13.2个月的随访,中位PFS尚未成熟,是极具前景的HER2阳性胃癌一线新的治疗模式,备受期待。
除此之外,双特异性抗体、TKIs类药物如雨后春笋般接踵而至,多项临床研究也在积极开展中。2025年ASCO会议也公布了双特异性抗体泽尼达妥单抗联合化疗用于一线治疗HER2阳性胃癌的4年随访结果,ccHER2+亚组cORR高达84%,中位OS达到36.5个月。这些新兴的抗HER2治疗药物展现了晚期胃癌抗HER2治疗的巨大潜力。
HER2低表达人群突破性探索
C027研究中,最具亮点的是HER2中低表达人群的探索。目前,HER2中低表达胃癌患者为靶向治疗排除人群,无法从抗HER2治疗中获益。C027研究中针对HER2中低表达人群进行探索,结果显示第一阶段维迪西妥单抗联合特瑞普利单抗联合CAPOX组的cORR值为72.0%,对比特瑞普利单抗联合CAPOX组,中位PFS为9.9个月vs7.2个月(HR=0.69),显示出明显的生存获益;第二阶段进行剂量优化,不同剂量维迪西妥单抗联合特瑞普利单抗联合减量CAPOX组对比特瑞普利单抗联合CAPOX组,cORR为71.4%vs 66.7% vs 56.3%,6个月PFS率为71.4% vs 72.7% vs 53.3%,证实了降低化疗剂量增加耐受性的同时,也能维持抗肿瘤治疗的有效性。C027研究的II期数据给HER2表达胃癌患者带来了新的治疗曙光,有望填补HER2中低表达人群抗HER2治疗的空白。基于此疗效,III期临床试验也在如火如荼地进行中,通过精准分层,有望改变HER2表达患者治疗格局。
HER2表达胃癌思考与展望
1.C027研究中整体纳入HER2中低表达人群,未进行亚组分析,中表达及低表达人群获益权重如何?如何选择“最佳CUT-OFF值”精准定位获益人群,期待III期的亚组分析数据给我们答案。
2.C027研究中对于PD-L1表达未进行分层分析,PD-L1 CPS<1这部分人群是否能够从“去传统化疗”治疗新模式中获益仍需观察。III期临床研究设计已经将PD-L1纳入分层分析因素,期待目前免疫治疗不获益人群能从新的治疗模式中获得更好的生存获益。
3. 部分HER2阳性胃癌患者抗HER2治疗存在原发性耐药,在接受一线抗HER2治疗后也可存在获得性耐药,耐药机制复杂,目前HER2阳性胃癌抗HER2治疗已经实现跨线应用,一线应用曲妥珠单抗治疗耐药后,后线仍可选择ADC及双特异性抗体类药物逆转耐药,实现全程抗HER2管理。如何精准选择HER2靶向药耐药人群后线抗HER2治疗的药物至关重要,也仍需进一步探索。随着新型药物的出现及新型药物治疗线数前移,此类药物耐药后如何逆转耐药亟待解决。期待未来,随着药物设计的不断优化,有效性更好、副反应更低的新型ADC及双特异性抗体类药物能够克服原发性耐药的难关,给HER2表达胃癌患者一个新的临床选择!
4. 研究表明,约30%-60%的胃癌患者经过曲妥珠单抗治疗后发生HER2丢失,这也是造成曲妥珠单抗继发性耐药的主要原因之一。部分患者也面临胃癌术后转移灶取病理困难,无法复核HER2表达情况的困境。随着ctDNA临床应用的普及,应用ctDNA动态监测HER2表达是一种可尝试的选择。ctDNA与转移灶HER2表达的一致性,仍需进一步的临床观察及探索。
5. 目前胃癌抗HER2治疗在一线及多线治疗中均取得较好的疗效,具有较高的ORR值。抗HER2治疗向围术期推进,争取更好的pCR率及预后将是未来探索的重要方向。
总结
HER2阳性胃癌患者治疗模式飞速发展,正式步入精准靶向治疗时代,抗HER2 ADC+抗HER2靶向药+PD-1单抗的“去传统化疗”治疗新模式展现出了较好的临床应用前景,随着新兴治疗药物(如双特异性抗体、TKIs、ADC药物等)的出现,如何排兵布阵实现抗HER2全程管理值得我们深度思考。此外,HER2中低表达人群实现以抗HER2 ADC类药物为基础的抗HER2靶向治疗,告别了“无靶向治疗”时代。希望未来大批临床试验数据的涌现,能够指导胃癌抗HER2治疗的临床实践,使患者能够得到更好的生存获益!
董茜教授-辽宁省肿瘤医院
随着新兴药物的不断研发,胃癌抗HER2治疗新模式不断涌现,但针对HER2中低表达人群治疗选择有限。以ADC类药物为基础的治疗新模式能够显著提升HER2中低表达人群治疗疗效,HER2高表达人群也向着“去化疗化”模式迈进。随着免疫治疗时代的到来,如何排兵布阵显得至关重要。本文分享者金悦医生从文献的角度出发,通过梳理胃癌抗HER2治疗最新进展,提出深刻且独到的个人见解。实现HER2胃癌的全程精准靶向治疗,未来可期!
【温馨提示】:如果您觉得金悦医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1.Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial[J]. Lancet, 2010, 376(9742): 687-697.
2. Janjigian YY, Kawazoe A, Bai Y, et al. Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet 2023;402:2197-208.
3. Shitara K, et al. Trastuzumab deruxtecan (T-DXd) vs ramucirumab (RAM) + paclitaxel (PTX) in second-line treatment of patients (pts) with human epidermal growth factor receptor 2-positive (HER2+) unresectable/metastatic gastric cancer (GC) or gastroesophageal junction adenocarcinoma (GEJA): Primary analysis of the randomized, phase 3 DESTINY-Gastric04 study. 2025 ASCO LBA4002.
4. Lian Liu, Song Li, Zimin Liu, et al. Disitamab vedotin (RC48), tislelizumab, and S-1 as first-line therapy for HER2-overexpressing advanced gastric or gastroesophageal junction adenocarcinoma (GC/GEJC): Updated results from the RCTS trial. 2025 ASCO, Abstract #4059.
5. Lin Shen,et al. 2025 ASCO. Abstract LBA4012.
6. Elena Elimova, Jaffer Ajani, Howard Burris, et al. Zanidatamab plus chemotherapy as first-line treatment for patients with HER2-positive advanced gastro-oesophageal adenocarcinoma: primary results of a multicentre, single-arm, phase 2 study. Lancet Oncology, June 2, 2025.











 苏公网安备32059002004080号
苏公网安备32059002004080号


