局部晚期乳腺癌(LABC)作为一种对治疗挑战较大的乳腺癌类型,亟需规范化的治疗方案。目前,LABC的治疗主要包括新辅助治疗、手术治疗及术后辅助治疗等多种治疗方式的联合治疗。为了提高LABC的治疗效果,由中国研究型医院学会乳腺专业委员会和中国女性局部晚期乳腺癌诊疗专家组,结合国内外最新研究成果和我国国情,制定了《中国女性局部晚期乳腺癌诊疗专家共识(2025年版)》。该共识从诊断及分类、治疗策略、手术时机、方案选择等方面进行详细阐述,旨在为临床医师提供明确的治疗指导、规范LABC的诊疗流程、改善患者的治疗效果、提升患者的生存质量。
中国研究型医院学会乳腺专业委员会,中国女性局部晚期乳腺癌诊疗专家组. 中国女性局部晚期乳腺癌诊疗专家共识(2025年版)[J]. 中国研究型医院(中英文),2025,12(03):1-10.DOI:10.19450/j.cnki.jcrh.2025.03.001
局部晚期乳腺癌(locally advanced breast cancer,LABC)在整体乳腺癌中占比相对较低,约占新诊断乳腺癌的10%;然而,在发展中国家,LABC的比例略高于这一水平[1,2]。迄今为止,国内外均尚未制定针对LABC的诊疗指南或共识,多数指南将LABC纳入晚期乳腺癌的诊疗范畴[3,4,5,6]。然而,LABC实际上是介于早期乳腺癌和晚期乳腺之间的一种分期类型,从无远处转移特征来看,其生物学特点和行为更接近于早期乳腺癌。由于LABC在临床上所占比例不高且定义尚不明确,迄今为止针对其病因、诊断、治疗以及预后的大规模研究有限,导致临床上对其治疗策略仍存在较多争议[7,8]。基于此,中国研究型医院学会乳腺专业委员会和中国女性局部晚期乳腺癌诊疗专家组结合当前循证医学证据,联合病理科、放疗科、肿瘤内科等多学科专家,经过深入讨论形成本共识,以期提升医务工作者对LABC的认知水平,推动其规范化诊治,从而提高我国LABC患者的预后及生活质量。
本共识循证医学证据来自130篇文献。文献以“局部晚期乳腺癌(locally advanced breast cancer,LABC)”为核心关键词,结合不同治疗策略,如“neoadjuvant therapy”“HER2-targeted therapy”“endocrine therapy”“triple-negative breast cancer”“axillary surgery”等进行主题词与自由词结合的检索,查阅了多个中英文数据库,包括:PubMed、Medline(via Ovid)、Web of Science(WOS)、中国知网(CNKI)、万方数据库、维普数据库。文献检索的时间主要集中在2010—2024年,特别关注近5年内(2019—2024年)高影响力研究与国际和国内权威指南,包括NCCN、ESMO、ASCO、CSCO等最新版本。共筛选文献400余篇,根据文献纳入和排除标准入选130篇。文献优先选取以下类型:大样本、高质量的随机对照试验(RCT)、重要的系统综述与Meta分析、最新的国际权威指南或共识、在国内具有高度代表性的临床实践研究与专家建议。文献纳入标准:(1)研究人群为乳腺癌患者,特别是以LABC为核心人群;(2)明确研究治疗方案、预后、疗效评估、转化手术等相关问题;(3)临床证据等级高,或在指南中被反复引用。排除标准:(1)样本量过小(<20例)、设计质量较低的初步观察性研究;(2)与LABC患者无直接关联的研究;(3)重复发表或内容高度雷同的综述性文献。
LABC的定义和分类
(一)LABC的定义
在不同指南中对LABC的表述略有不同。在 美国癌症联合委员会(American Joint Committee on Cancer,AJCC)临床分期系统中[9],将LABC归为Ⅲ期(包括ⅢA、ⅢB、ⅢC)。而在2024版《中国晚期乳腺癌规范诊疗指南》中[10],将LABC定义为可行根治性手术的部分ⅡB期(T3N0M0期)和ⅢA期(T3N1M0期)原发性乳腺癌以及难以行根治性手术的累及皮肤、胸壁或广泛淋巴结受累的ⅢB、ⅢC期乳腺癌,且其诊疗主要针对初始不可手术、尚未出现远处转移的ⅢB、ⅢC期乳腺癌。
本共识专家组结合包括美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)在内的多个指南中的定义,将本共识中的LABC定义为AJCC分期中的Ⅲ期乳腺癌。
(二)LABC的主要表现及分类
1.主要表现:LABC主要表现为累及乳腺和区域淋巴结,如果主要是累及乳腺皮肤或胸壁即为AJCC分期中的T4,即局部受累(local involvement);如果主要是累及区域淋巴结则为AJCC分期中的N2或N3,即区域受累(regional involvement);如果乳腺局部和区域淋巴结均受累则为局部区域受累(locoregional involvement)。这里提到的T4和N2或N3,可以是临床分期中的肿瘤和淋巴结分期,也可以是病理分期中的肿瘤和淋巴结分期。如果从LABC的治疗决策制定角度考虑,临床分期的价值更大[11,12]。所以,结合临床查体和辅助检查而获得的临床分期对于LABC的判断尤为重要。
2.分类:经分期判断为LABC后,临床上常按照是否可行手术分为可手术LABC(IIIA期)和不可手术LABC(IIIB期和IIIC期)。在NCCN指南中将不可手术LABC详细描述为炎性乳腺癌、肿大而融合固定的临床N2、临床N3以及临床T4期乳腺癌。也有部分学者认为,即使肿瘤侵犯皮肤和胸壁,或者区域淋巴结肿大融合,只要局部累及范围未超过乳腺皮肤的1/4、淋巴结虽融合但仍可推动、腋窝肿大淋巴结并未包绕腋静脉、且根治性切除手术在技术上可行,此类病例虽临床分期为ⅢB期,仍可被视为可手术范畴[13,14]。因此,不可手术LABC的定义目前尚存一定争议,仍需进一步细化分类精准定义。
本共识专家组建议,对于不可手术LABC的定义不宜简单等同于ⅢB期和ⅢC期。对于局部及区域受累有限且尚可施行根治性手术的病例,不应直接归类为不可手术LABC,以避免患者失去根治性手术机会。不可手术LABC特指ⅢB和ⅢC期病例中的炎性乳腺癌,或经临床审慎判别为确实难以实施根治性手术的乳腺癌(通过乳腺的查体和超声、MR,以及胸部CT检查评估乳腺皮肤累及范围超过乳腺皮肤的1/4,肿瘤已与胸壁固定不可推动或侵及胸膜,腋窝淋巴结融合固定不可推动,腋窝肿大淋巴结已包绕腋静脉)。
LABC的新辅助治疗
新辅助治疗是在乳腺癌根治性手术之前开展的系统性治疗,包括新辅助化疗、新辅助放疗、新辅助内分泌治疗、新辅助靶向治疗和新辅助免疫治疗。新辅助治疗最重要的指征和意义在于对不可手术LABC开展系统治疗从而降低临床分期,获得手术机会[15,16]。此外,现有循证医学证据表明,相同方案和疗程的新辅助治疗与辅助治疗在生存疗效上具有等效性[17,18,19,20]。然而,部分临床共识基于此扩大了新辅助治疗的适用人群,特别是将三阴性乳腺癌和人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)阳性乳腺癌列为新辅助治疗的优选人群,这一推荐缺乏充分的临床依据。值得注意的是,在新辅助治疗过程中,约有3%~5%的患者可能出现疾病进展,甚至导致原本具备的手术机会丧失[18,19]。因此,对于可手术乳腺癌患者不应随意扩大新辅助治疗的指征,尤其对于LABC,往往局部病变范围大,如果新辅助治疗无效或进展,将更容易出现丧失手术机会的不良结局。
新辅助治疗最先开始研究的领域是新辅助化疗,已有美国乳腺与肠道外科辅助治疗研究组(National Surgical Adjuvant Breast and Bowel Project,NSABP)主导的NSABP18和NSABP27等多个大型临床研究证实:新辅助化疗和辅助化疗在降低可手术乳腺癌复发风险和改善生存方面有同等的价值[18,19]。所以,对于需要化疗的可手术乳腺癌,治疗方案选择先手术或者先化疗,生存结局没有差别。但是从生活质量和经济角度考虑,化疗每2个疗程一次的影像评估,甚至可能的病理评估造成的经济负担,以及可能的疾病进展造成的治疗困境,都表明对于可手术LABC首选手术治疗更好。对于不可手术LABC,新辅助治疗是行之有效的治疗手段。
新辅助内分泌治疗是在乳腺癌内分泌治疗药物不断进展的基础上逐渐开展的,主要用于激素受体阳性的绝经后女性,采用芳香化酶抑制剂方案[21,22,23]。CDK4/6抑制剂上市之后,内分泌治疗为激素受体阳性乳腺癌患者提供了不弱于化疗的治疗效果[24,25,26,27]。但是,目前尚无明确证据支持新辅助内分泌治疗常规联合CDK4/6抑制剂的疗效。同时,新辅助内分泌治疗的最佳持续时间尚未明确,应该通过仔细评估患者的临床状态和治疗反应个体化地确定新辅助内分泌治疗的给药时间[5]。通常情况下,新辅助内分泌治疗应至少持续6个月,或持续至患者具备手术条件时停止[21]。
新辅助放疗在不可手术LABC中的应用相对较少[28,29,30]。与头颈部肿瘤及直肠肿瘤不同,新辅助放疗并非是乳腺癌标准的新辅助治疗策略,但可以作为个体化方案的一部分[31,32]。目前,关于新辅助放疗在不可手术LABC中的临床研究较为有限,尤其是与新辅助化疗联合应用的研究更为少见,这可能与两者联合治疗时潜在的毒性风险叠加有关。然而,对于存在明确内乳淋巴结转移或锁骨上淋巴结转移的LABC患者,新辅助放疗仍可能是一种有效的治疗选择,有望为后续根治性手术的实施创造有利条件[29,33]。
新辅助靶向与新辅助免疫治疗的发展随着新辅助化疗研究的深入,逐步在LABC中发挥重要作用[34]。对不可手术的HER2阳性LABC,化疗联合双靶(曲妥珠单抗+帕妥珠单抗)已成为推荐方案,临床总缓解率近90%,病理完全缓解(pCR)率约60%[35,36]。基于PHEDRA研究的结果,化疗联合曲妥珠单抗联合吡咯替尼也成为HER2阳性乳腺癌新辅助治疗的可选方案。德曲妥珠单抗作为新一代HER2靶向抗体偶联药物已在中国获批上市,但尚缺乏新辅助治疗相关研究结果支持[37,38]。PIK3CA、PTEN等靶点药物目前多用于解救治疗,是否能扩展至新辅助治疗仍需临床验证[39,40,41,42]。新辅助免疫治疗多应用于三阴性乳腺癌,通过在化疗基础上联合PD-1/PD-L1抑制剂提高治疗反应率。Keynote-522研究显示,帕博利珠单抗联合化疗显著提高pCR率并改善预后[43]。目前,国内对于帕博利珠单抗适应证仅批准用于肿瘤表达PD-L1综合阳性评分(combined positive score,CPS)≥20的患者[44,45],推荐方案为联合紫杉醇+卡铂(PCb)序贯多柔比星或表柔比星+环磷酰胺(AC/EC)共8个周期,术后序贯帕博利珠单抗单药辅助治疗1年[46]。2024年一项纳入9项RCT的荟萃分析表明,无论PD-L1状态如何,免疫联合化疗均可提升pCR率10%以上( OR=1.64,95% CI:1.19~2.25),其中TNBC患者的5年无事件生存率显著改善,而HER2阳性患者则无显著获益[47]。
本共识专家组建议:对于不可手术LABC,应根据患者的乳腺癌分子分型、药物可及性及患者的个体情况制定新辅助治疗方案。目前,临床上以新辅助化疗和新辅助靶向治疗为常用且优先推荐的方案;对于可手术LABC,应优先把握手术时机,尽早施行根治性手术,避免随意扩大新辅助治疗的适应证,以防止疾病进展导致患者丧失原本具备的手术机会。
LABC的手术治疗
(一)判断手术指征
对于LABC,手术治疗依然是重要且首选的治疗方式。因此,评估患者是否适合接受根治性手术,即明确LABC属于可手术还是不可手术类型,具有关键意义。根据第八版AJCC分期标准,乳房皮肤受累(仅累及真皮层除外)属于T4期表现,但如果受累皮肤病灶最大径<5 cm或受累皮肤范围不超过乳房总面积的1/4,通常仍可通过完整切除受累皮肤病灶实现根治性手术。同理,根据AJCC分期和2024版乳腺癌诊疗指南描述[9,10],锁骨下淋巴结转移(腋窝顶部淋巴结转移)属于N3分期,临床分期为IIIC期。然而,单纯锁骨下淋巴结转移若未与腋静脉粘连,肿瘤仍可实现根治性切除,这也是改良根治手术中常见的处理情况[48,49,50]。若仅因超声提示锁骨下淋巴结转移而放弃根治性手术,又顾虑新辅助治疗存在一定比例的疾病进展风险,可能会使患者陷入不必要的治疗困境。因此,在临床决策中应综合评估手术可行性,避免过度依赖分期标准而忽视根治性手术的机会。
本共识专家组建议:精准评估LABC患者的乳房、腋窝及颈部状况,审慎判断其是否属于可手术LABC,即明确手术指征,并据此制定个体化的精准治疗方案,是规范化治疗LABC流程中的第一步,也是最重要的一步( 图1 )。评估方法通常包括乳房、腋窝和颈部区域的体检和超声检查,以及乳腺钼靶检查。若存在可疑胸壁受侵或内乳淋巴结转移,需进一步明确时,可考虑结合胸部CT或乳腺MR检查。此外,还需通过全身影像评估(如骨扫描,胸腹部及盆腔CT或PET-CT等)排除远处转移,以确保治疗决策的全面性和准确性。
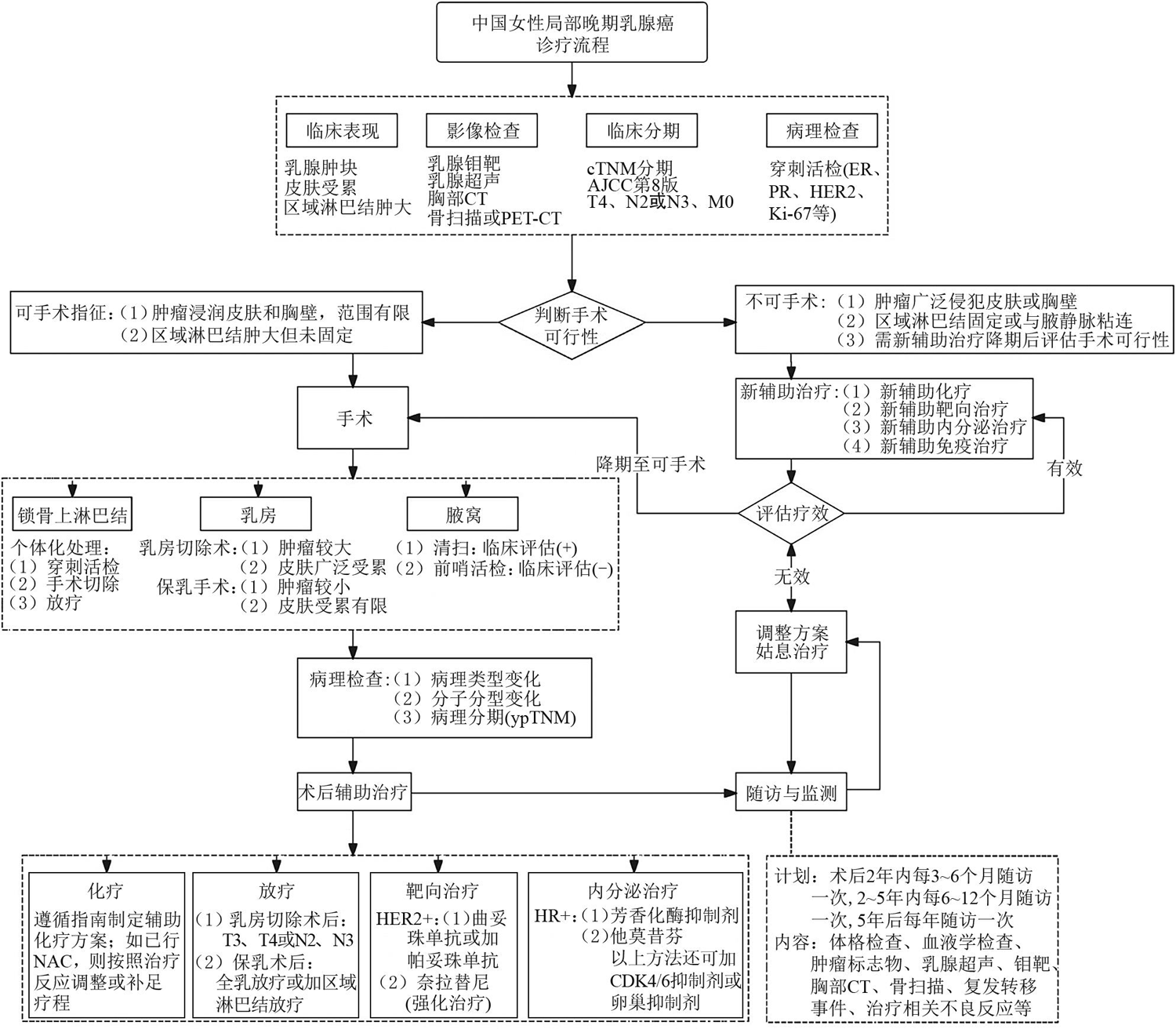
(二)乳房手术方式
对于经评估判断为可手术LABC的患者,根据具体情况可选择乳房切除术和保留乳房的乳腺癌切除术(保乳手术)[51]。尽管乳房切除术是LABC患者通常采用的手术方式,保乳手术仍可作为部分LABC患者的可行选择[52,53,54,55]。
LABC常表现为乳房肿瘤比较大或乳房皮肤受侵犯,所以乳房切除术是LABC患者常规和首选手术方式。若肿瘤侵犯皮肤形成溃疡、肉眼可见肿块或皮肤卫星结节,则需完整切除皮肤病灶,包括周围至少1 cm范围的正常皮肤组织[56]。如果受侵犯的皮肤病灶距离乳头较远,无法将皮肤病灶和乳头乳晕复合体同时完整切除,可考虑保留部分乳晕区皮肤或保留乳头,但需注意彻底切除乳头下方的腺体组织。乳房切除术通常采用横梭形切口,但若皮肤病灶分布不规则,梭形切口无法完全包含病灶时,可采用不规则形态的切口(如“丫”字形或“乙”字形等),以实现病灶的完整扩大切除。
对于部分可手术LABC患者,特殊情况下也可以选择保乳手术。例如老年患者、对全麻耐受有困难的患者,即使乳房皮肤受侵,如果受侵犯的皮肤面积较小、皮肤肿块和溃疡面积不大,梭形切口可以完整去除肿块和皮肤病灶,则保乳手术不失为一种可以选择的根治性手术方式。术后需根据保乳手术后的放疗原则辅以放射治疗。
(三)腋窝手术方式
LABC常表现为乳房局部肿瘤较大或乳房皮肤受侵犯,同时伴有腋窝淋巴结肿大甚至粘连。因此,腋窝手术方式以淋巴结清扫为主。即便腋窝淋巴结有明确的肿大、质硬、粘连,但若肿大粘连的淋巴结仍可推动且尚未局部固定,超声检查提示淋巴结尚未与腋静脉粘连或包裹,则仍可考虑行腋窝淋巴结清扫手术。此外,若仅有乳房皮肤或胸壁受累(即T4分期),而腋窝未见明确肿大淋巴结且符合腋窝前哨淋巴结活检的手术指征时,也可考虑行腋窝前哨淋巴结活检手术。乳房局部的T4期表现不应被视为前哨淋巴结活检的禁忌证[57,58,59]。
(四)锁骨上淋巴结的处理
根据第八版AJCC分期标准,锁骨上淋巴结转移属于N3c分期,仍属于LABC范畴,临床分期为ⅢC期。对于锁骨上淋巴结的处理,可以采取手术或放疗等局部治疗手段,也可以结合全身治疗如化疗、靶向治疗或内分泌治疗。临床上高度怀疑锁骨上淋巴结转移时,建议行穿刺以明确诊断。若穿刺证实存在肿瘤细胞,可在乳腺癌根治性手术的同时或之后施行锁骨上转移淋巴结切除或廓清术。若锁骨上淋巴结转移数目较少且淋巴结体积较小,也可考虑通过放疗达到瘤细胞减灭的目的[61,62]。近年来,随着放疗技术的不断优化和进展,其不良反应显著减少,未来放疗可能成为比手术更优的锁骨上转移淋巴结处理方式。
本共识专家组建议:对于可手术LABC患者,应综合评估乳房病灶的局部情况、腋窝及颈部淋巴结的区域状态以及穿刺病理类型特征,同时结合患者的意愿共同制定手术治疗方案。目前,临床上以改良根治手术为常用且优先推荐的手术方式,但在符合治疗指征的前提下,保乳手术和腋窝前哨淋巴结活检手术也可作为治疗选择。对于怀疑锁骨上淋巴结转移的病例,应尽可能通过穿刺获取病理诊断。治疗方式可选择乳腺癌根治性手术的同时或之后施行锁骨上转移淋巴结的切除或廓清术,也可考虑在乳腺癌根治性手术后进行颈部放疗。
LABC的术后辅助治疗
制定LABC患者的术后辅助治疗方案时,需要考虑手术前是否接受了新辅助化疗。如果没有接受新辅助化疗,而是直接施行根治性手术,则LABC患者辅助治疗方案的制定遵循一般性原则;如果LABC患者手术前接受了新辅助化疗,则需重点考虑以下几个方面:(1)病理信息:包括新辅助化疗前的穿刺病理结果和手术后的石蜡病理结果,以明确肿瘤的分子分型、组织学特征及治疗后的病理反应。(2)分期信息:包括新辅助化疗前的临床分期和手术后的病理分期,以评估肿瘤的初始负荷及治疗后的降期效果。(3)治疗反应及耐受性:密切关注患者对新辅助化疗方案的耐受情况以及治疗反应分级(如pCR率、部分缓解率等),以指导后续辅助治疗的强度和方案选择。通过综合以上信息,可为患者制定个体化、精准化的术后辅助治疗方案,以优化治疗效果并改善预后。
(一)新辅助化疗后的辅助治疗选择
1.关注病理类型和分子分型的变化:如果患者接受了新辅助化疗,则新辅助化疗前后的病理类型和分子分型可能存在部分差异[63],这是由于肿瘤异质性或化疗引起的治疗性改变。通常,应优先考虑其中阳性的部分或更为严重的指标。例如,若新辅助化疗前穿刺提示激素受体阴性,而术后石蜡病理提示激素受体阳性,则辅助治疗中可考虑加用内分泌治疗。
2.关注分期信息的变化:新辅助化疗前后的乳腺癌分期也可能存在差异,这可能是由于对腋窝临床分期的低估或化疗导致的腋窝降期[64]。通常,应优先考虑其中阳性的部分或更为严重的指标。例如,若新辅助化疗前仅有乳房局部皮肤受侵犯(T4),腋窝淋巴结无明显肿大或固定(N1),而术后石蜡病理提示腋窝淋巴结转移3个以上(pN2),则应按照更为准确的病理分期制定辅助治疗方案。若新辅助化疗前腋窝淋巴结穿刺提示转移且多个淋巴结转移可能性大,而术后病理提示腋窝淋巴结无转移,临床上对此情况存在一定争议。
本共识专家组建议:按照淋巴结有转移的情况制定术后辅助治疗方案,如采取局部放疗等。
3.关注患者对新辅助化疗方案的耐受情况和治疗反应分级:患者对新辅助化疗方案的耐受情况和治疗反应分级也是制定辅助治疗方案时需着重考虑的方面[6,65]。关于新辅助化疗的疗程控制,临床上存在两种观点:一种是沿用既定方案直至全部疗程结束;另一种是每2个疗程评估1次直至可手术时停止,手术后的辅助治疗阶段完成后续的化疗疗程及后续治疗。2024年圣安东尼奥乳腺癌会议公布的TRAIN-3研究报告中提出,每3个疗程通过MRI评估1次,若达到影像完全缓解则可停止新辅助化疗[66]。实际上,新辅助化疗的停止时间取决于其治疗目的。若新辅助化疗旨在将不可手术LABC降期为可手术LABC,则临床评估为可手术时即为停止新辅助化疗的时机。
本共识专家组建议需注意的是:部分患者在新辅助化疗初期表现为部分缓解(PR),但在后续疗程中可能出现疾病进展(PD)。若一味强调完成全部疗程,可能错失手术时机。对于LABC患者的新辅助化疗指征和疗程控制应更为审慎[67,68]。
(二)直接手术治疗患者的辅助治疗选择
对于未接受新辅助化疗而直接施行根治性手术LABC患者,术后辅助治疗方案的制定相对简单,没有前后的病理分型和分期变化的选择比较问题,可直接依据国内外乳腺癌系统治疗指南制定辅助治疗方案。根治性手术获得的病理分期准确且全面,避免了新辅助化疗过程中每2个疗程评估带来的经济负担和身体损害,更避免了新辅助化疗过程中的进展(PD)和无效(SD)导致的生存损失。从这一角度再次强调了手术治疗应作为可手术LABC患者的优选治疗方案。
近年来,辅助治疗的强化在早期高危乳腺癌中的研究不断丰富。LABC属于早期高危乳腺癌,具有辅助强化治疗的绝对适应征。基于临床研究证据的不断涌现,对三阴性类型以卡培他滨做辅助化疗的强化、对HER2阳性类型以奈拉替尼做辅助靶向治疗的强化、对受体阳性类型以CDK4/6抑制剂做内分泌治疗强化,均已成为LABC患者辅助治疗方案的标准选择。
本共识专家组建议:基于新辅助化疗可能出现无效或进展而对患者生存造成不利影响,手术治疗应优先作为可手术LABC患者的治疗方案。若评估为不可手术LABC并计划行新辅助化疗,应每2个疗程评估疗效1次,并在判定为可手术时及时停止新辅助治疗并施行手术。在制定术后辅助治疗方案时,需综合对比新辅助化疗前的穿刺病理与手术后的石蜡病理、新辅助化疗前的临床分期与手术后的病理分期,以及患者对新辅助化疗方案的耐受情况和治疗反应分级。在制定术后辅助治疗方案时,应优先考虑其中阳性的部分或更为严重的指标,以确保治疗方案的精准性和有效性。
总结
目前,国内外尚未制定单独针对LABC的临床诊疗指南或共识,现有的指南通常将LABC纳入到早期乳腺癌或晚期乳腺癌的诊治范畴,导致临床医师在相关诊疗工作中缺乏明确的依据和指导。为此,我们在查阅大量文献证据的基础上,广泛征询了乳腺外科、病理科、放疗科、影像科、肿瘤内科等多学科一线专家的意见,制定了此共识。
由于LABC在整体乳腺癌中所占比例相对较低,相关的临床研究数量有限,很多临床争议性问题尚未得到明确解答。因此,本共识的部分诊疗方案可能存在一定的偏颇和局限之处。我们期待未来在中国研究型医院学会乳腺专业委员会的引领下,开展更多高质量的临床研究,共同解决LABC诊疗中的难点和痛点问题,从而对本共识进行逐步的补充和完善,为临床实践提供更科学、更精准的指导。
略











 苏公网安备32059002004080号
苏公网安备32059002004080号


