免疫检查点抑制剂(ICIs)是一类新型、广谱抗肿瘤药物,显著改善了肿瘤患者的生存,但同时也可能造成全身多个器官、组织损伤,部分严重免疫检查点抑制剂相关不良反应(irAEs)甚至危及生命,已成为全球肿瘤领域关注的焦点。东部战区总医院肿瘤科是国内最早一批应用ICIs的医学中心,并率先成立了irAEs多学科专家团队(MDT),在irAEs管理方面积累了非常丰富的经验。为系统性分享诊治经验,专家组特在肿瘤资讯平台开设专栏,其核心特色在于:1. 全程追踪疑难案例 专栏深度展示具有代表性的疑难病例从诊断、治疗到随访的完整过程,传递不同系统irAEs的精准诊治思路与前沿进展;2. 汇聚多学科智慧 真实记录MDT讨论精华,融合肿瘤、心脏、肝脏、呼吸、消化、内分泌、皮肤、影像、病理等多学科视角,分享跨学科的理论知识、指南共识与实战经验;3. 系统连载即时更新 病例采取定期连载形式发布,确保内容的时效性、系统性与持续的高品质输出。本专栏力求为同行提供实用参考,然学海无涯,文中疏漏之处在所难免,恳请各位同道不吝批评指正,共同推动irAEs管理水平的提升。
参加人员:东部战区总医院免疫相关不良反应多学科专家组
病例介绍
耿海云(主管医生):汇报患者病情经过。
患者,男性,38岁,因“肝内胆管癌Ⅳ期1个月余,肝功能异常2周”入院。患者2025年2月11日因进食后腹胀在当地医院检查肿瘤标志物:CA199 3161.0U/ml,CA125 127.0U/ml,NSE 40.7ng/ml。行腹部CT检查示:肝左叶、肝右前叶肿块伴肝内多发结节,考虑肝内胆管细胞癌伴肝内转移可能,胃小弯壁可疑受累;右侧心膈角、腹膜后、肝门区多发淋巴结转移,腹膜转移;大网膜及腹膜后多发淋巴结。2025年2月14日上海某三甲医院PET/CT检查示:肝脏多发肿瘤伴多处(腹腔、腹膜后、右侧内乳区及右侧心膈角)淋巴结转移,腹盆腔种植转移,左侧膈肌转移,双肺转移。2025年2月18日行肝穿刺活检术,术后病理示:腺癌,胆管来源可能;免疫组化检查示:CD56(-),CK19(+),CK7(+),Claudin18.2(-),GPC3(-),Hepa(部分+),Her-2(10%+),Ki-67(30%阳性),MLH1(+),MSH2(+),MSH6(+),PMS2(+),PD-1(肿瘤-,间质-),PD-L1(22C3)(肿瘤-,间质1%+,TPS=0,CPS=1),PD-L1(E1L3N)(肿瘤-,间质1%+),SATB 2(少量+),TTF-1(-),HNF-1β(+),ARG-1(-),P63(-),P40(-),结合病史及免疫组化结果,符合肝内胆管癌。基因检测结果:FGFR2 exon17、10和9融合突变,KRAS、NRAS、PIK3CA、BRAF、ALK、ROS1均未检测到突变。
2025年2月22日行GEMOX方案(吉西他滨1600mg VD 第1、8天;奥沙利铂200mg VD 第1天)化疗1周期,同时联合PD-1抑制剂(200mg静滴 第1天)治疗1次。治疗1周后自觉肝区不适,且逐渐加重,停用第8天吉西他滨治疗。2025年3月19日检查肝功能示:丙氨酰氨基转移酶(ALT) 1254U/L,天冬氨酸氨基转移酶(AST) 554U/L,谷氨酰转肽酶(GGT) 332U/L,碱性磷酸酶(ALP) 293U/L,结合既往用药考虑药物性肝损伤,其中免疫性肝炎不除外,在当地医院接受甲泼尼龙治疗,起始剂量280mg 1/日,同时辅以异甘草酸镁、谷胱甘肽、双环醇护肝治疗7天后,复查ALT 543U/L,AST 124U/L,GGT 493U/L,ALP 244U/L,将甲泼尼龙减量至240mg 1/日,辅以上述护肝治疗。2025年4月2日复查ALT 591U/L,AST 270U/L,GGT 769U/L,ALP 234U/L。于2025年4月3日为进一步治疗收入我院。
患者入科时主诉右腹部阵发性隐痛,查体:肝区轻度压痛,胸部皮肤散在红色皮疹,无明显瘙痒。入院后完善检查如下(见辅助检查),于入院当天予以甲泼尼龙160mg 1/日(约2mg/kg)静滴,联合吗替麦考酚酯胶囊1g 2/日口服,辅以异甘草酸镁、多烯磷脂酰胆碱和双环醇片护肝治疗。其后定期复查肝功能指标逐渐下降,2025年4月8日、4月13日将甲泼尼龙先后减量至120mg 1/日和80mg 1/日,2025年4月15日检查肝功能示:ALT 91U/L,AST 77U/L,GGT 531U/L,ALP 206U/L。
辅助检查
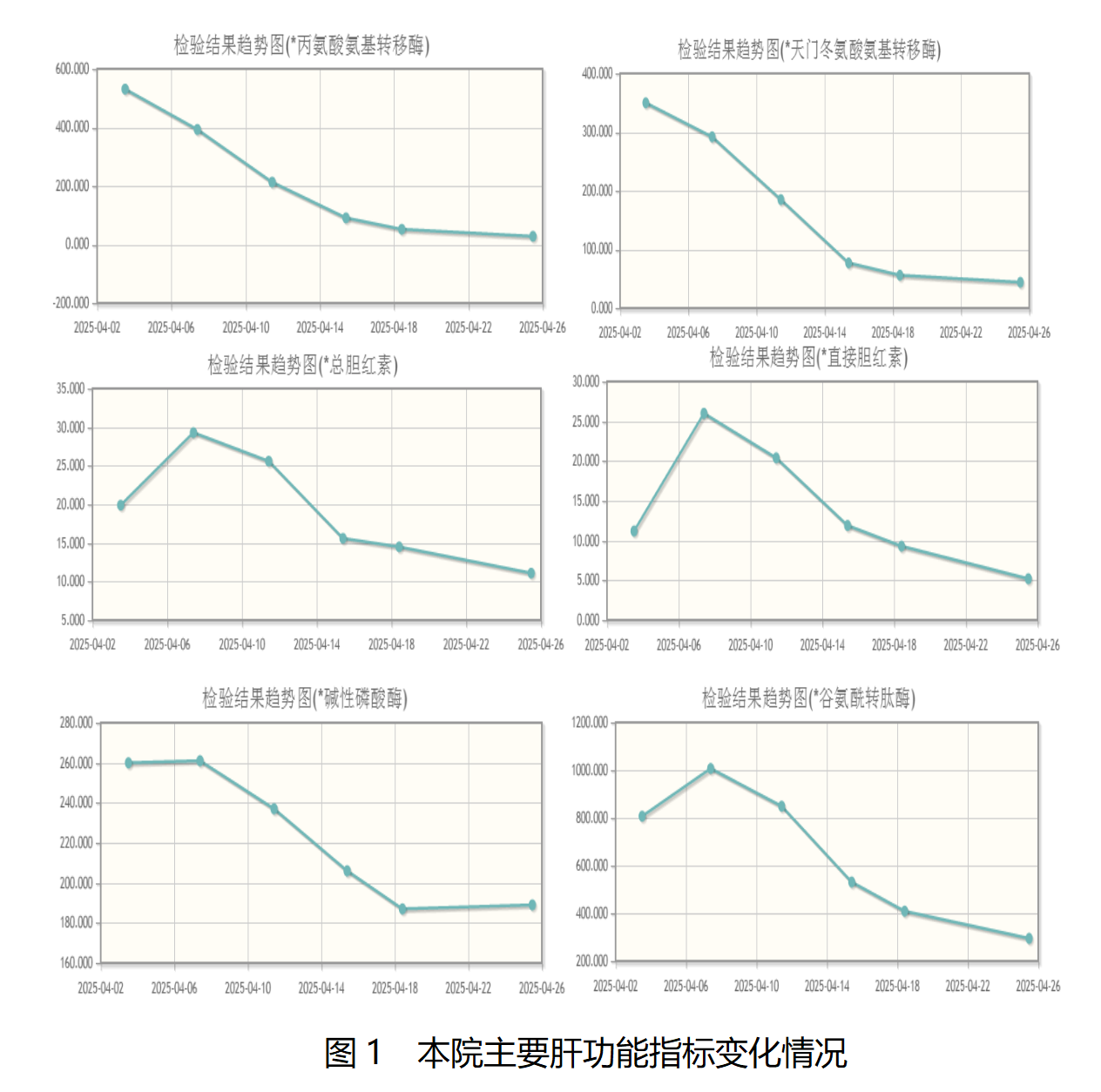
2025年4月3日实验室检查:肝功能示ALT 531U/L(正常值范围:0~38 U/L),AST 350U/L(正常值范围:0~38 U/L),GGT 807U/L(正常值范围:0~73 U/L),ALP 260U/L(正常值范围:50~172 U/L)。性激素测定:皮质醇(AM8:00)1.77μg/dl(正常值范围:7.2~32 μg/dl)。细胞因子测定示IL-6 16.33pg/ml(正常值范围:0~5.3 pg/ml),IL-10 75.51pg/ml(正常值范围:0~4.91 pg/ml)。HBV DNA 4.94×102IU/ml。其余血常规、肾功能、心肌酶谱、甲状腺功能、促肾上腺皮质激素均正常。
2025年4月7日肝功能示:TBIL 29.3μmol/L(正常值范围:2~20.4 μmol/L),DBIL 26 μmol/L(正常值范围≤6.8 μmol/L),ALT 393U/L,AST 292U/L,GGT 1007U/L,ALP 261U/L。
2025年4月12日肝功能示:TBIL 25.6μmol/L,DBIL 20.4μmol/L,ALT 213U/L,AST 185U/L,GGT 849U/L,ALP 237U/L。
2025年4月15日肝功能示:TBIL 15.6μmol/L,DBIL 11.9μmol/L,ALT 91U/L,AST 77U/L,GGT 531U/L,ALP 206U/L。主要肝功能指标变化情况见图1。
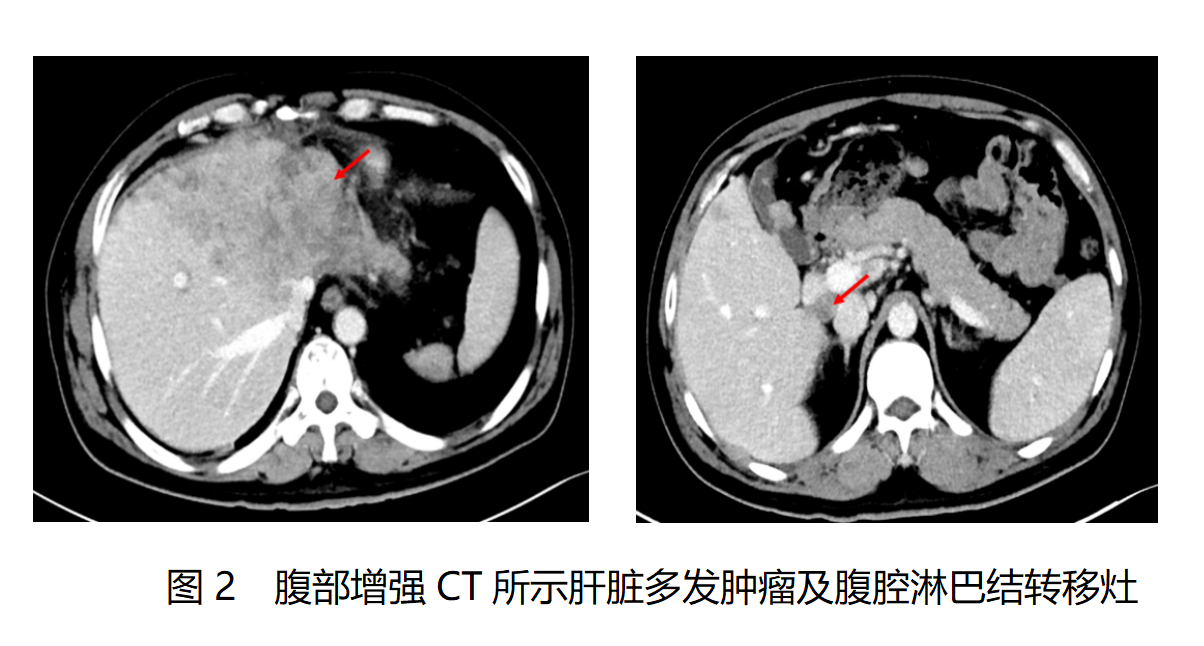
2025年4月10日胸腹盆增强CT检查:肝左叶团块状低密度病灶及肝内多发结节状低密度影,考虑肝胆管细胞癌伴肝内转移;门静脉左支及肝左静脉显示不清,考虑癌栓形成可能。肝周、脾周、胃周、右侧结肠旁沟多发结节影,右心膈角、肝门区、腹膜后、系膜区多发淋巴结,考虑转移;两侧髂血管旁及盆腔内多发小淋巴结。两肺多发结节影,考虑转移瘤。患者影像学征象见图2。
MDT会诊内容
王锋(肿瘤科):关于这个病例,我们主要围绕以下几个问题进行讨论:1. 这位患者是否确诊为免疫检查点抑制剂相关肝炎?2. 患者是否需要进一步检查排除其它原因引起的肝损伤?3. 目前的治疗措施是否需要调整?4. 待患者肝功能恢复正常后,如何进行下一步抗肿瘤治疗?
王锋(肿瘤科):首先请影像科赵主任从影像学角度分析一下患者病情。
赵颖(影像科):好的,从影像学检查来看,患者PET/CT检查显示的肿瘤征象与肝穿刺病理报告(肝内胆管癌)是相符合的。肝内胆管癌通常为低分化腺癌,葡萄糖代谢活跃,PET检查上表现为明显的高代谢病灶(SUV值较高),而肝细胞癌一般在PET检查上表现为轻度代谢值增高,大约50%的患者代谢与肝脏本底等摄取。因此,一些小肝癌在PET检查上往往显示不清,而MRI检查却能更清晰地显示,我院PET/MRI检查兼具两种检查手段的优点,并且没有离子辐射和碘过敏的顾虑,在肝脏肿瘤诊断方面具有明显优势。另外,该患者的血清肿瘤标志物NSE明显高于正常值,提示肿瘤可能还合并神经内分泌癌成分,这种成分的肿瘤细胞增殖速度快,在PET上代谢可能会更高。
王锋(肿瘤科):这位患者经肝穿刺病理活检诊断为相对少见的肝内胆管癌,既往有慢性乙型肝炎病史,在第一次免疫联合化疗后出现4级转氨酶升高,抗肿瘤治疗方案包括化疗药物(吉西他滨、奥沙利铂)和免疫药物(PD-1抑制剂),发生肝损伤的原因,究竟是化疗引起的?还是免疫药物引起的?会不会是肿瘤本身进展所致?还是基础肝病所致?需要仔细鉴别。赵主任,从影像学角度,我们该怎么去判断肝损伤是免疫药物,还是化疗药物引起的?
赵颖(影像科):从影像学上区分免疫药物还是化疗药物引起的肝损伤是比较困难的。文献报道显示,化疗药物、靶向药物、免疫药物引起的肝功能损伤可能出现一些非特异性影像学征象,例如肝肿大、水肿,汇管区炎症,血管狭窄,胆管扩张等,但迄今没有特异性的影像学征象能够明确与某种药物肯定有关,目前影像学检查主要用于排除肝脏、胆道原发性或继发性肿瘤、胆管梗阻或压迫等原因引起的肝损伤。这位患者存在肝脏恶性肿瘤,肿瘤负荷较大,但在药物治疗前肝功能正常,药物治疗后才出现肝功能损伤,且抗肿瘤治疗前、治疗后的肝脏肿瘤体积变化不大,因此肝损伤可能与肝脏肿瘤无关,影像学检查也没有胆管梗阻的征象,推测肝损伤还是与免疫药物或化疗药物治疗有关。
王锋(肿瘤科):是的,如果不是药物引起的,而是肿瘤引起的肝损伤,激素和护肝药物的疗效也不佳,肝功能异常指标往往很难降至正常范围。而这位患者经激素等药物治疗后肝功能明显好转,也证明了肝损伤是与药物治疗有关,而与肿瘤本身无关。接下来请肝病科谢主任分析一下这位患者肝损伤的原因。
谢芳(肝病科):这位患者药物治疗后出现转氨酶4级升高(ALT 1254U/L,AST 554U/L),但总胆红素、直接胆红素正常。患者既往没有酒精性肝病、自身免疫性肝病等病史,也没有近期特殊病原体感染的临床表现,虽然患有慢性乙型肝炎,但是HBV DNA载量不高,肝功能损伤高度怀疑与抗肿瘤药物有关,按照药物性肝损伤(DILI)诊疗指南,属于肝细胞损伤型。肝功能损伤无论是化疗药物,还是PD-1抑制剂引起的,理论上都属于药物性肝损伤范畴。患者出现肝损伤后,在外院考虑免疫性肝炎,一开始应用大剂量甲强龙(4mg/kg,280mg)静滴,联合常规护肝药物治疗。临床上,对于药物性肝损伤,我们一般可以先尝试常规的护肝药物治疗3~5天后,看一下肝功能指标的变化趋势,再决定是否使用激素、使用多大剂量的激素。如果经过常规护肝药物治疗,转氨酶能够迅速下降,其实没必要应用大剂量的激素冲击治疗,大剂量的激素可能会引起高血糖、高血压、消化性溃疡、水钠潴留、骨质疏松、二重感染等不良反应或并发症。
该患者初诊时出现4级转氨酶升高,但胆红素正常,凝血相关指标基本正常,说明患者出现肝衰竭的风险较小,所以总体预后是较好的。该患者目前转氨酶在逐渐下降,总胆红素一过性升高后下降,谷氨酰转肽酶、碱性磷酸酶逐渐达峰后下降,符合肝细胞型药物性肝损伤的发展规律,患者目前已处于恢复期,预计转氨酶在短期内能够降至正常范围,建议接下来逐渐降低激素剂量,常规护肝药物不变。
王锋(肿瘤科):从您的经验来看,哪些指标异常预示将来发生肝衰竭的风险较高?
谢芳(肝病科):主要看总胆红素和凝血功能,总胆红素显著升高(通常≥171μmol/L)或者每日升高≥17.1μmol/L;PT(凝血酶原时间)明显延长,PT活动度≤40%或国际标准化比值(INR)≥1.5。这位患者总胆红素和凝血常规基本正常,虽然ALT大于1000U/L,但没有肝衰竭的前期表现。
王锋(肿瘤科):这位患者有乙型肝炎病史,抗肿瘤治疗前HBV DNA正常,且给予恩替卡韦预防,目前HBV DNA 4.94×102IU/ml,肝损伤可能是乙肝病毒激活引起的吗?
谢芳(肝病科):患者之前并不知道自己是乙肝携带者,2025年2月发现肝肿瘤时抽血化验提示“乙肝小三阳”,HBV DNA 阴性,给予预防性口服恩替卡韦抑制乙肝病毒,后来经历了1个周期的化疗联合免疫治疗。此次入院查HBV DNA 4.94×102IU/ml,病毒激活可能与化疗、免疫药物有关,目前乙肝病毒的复制量处于低水平,一般不会引起严重肝功能损伤。临床上,HBV DNA 往往在1×106至1×107IU/ml以上,才可能导致严重肝功能损伤。为了更好、更快地抑制HBV DNA,该患者已经采取恩替卡韦联合富马酸丙酚替诺福韦治疗,这是临床上比较常见的经验性用药,其实恩替卡韦的耐药屏障较高,经济条件允许可行恩替卡韦耐药位点检测(如rtM204V/I突变合并rtT184、rtS202或rtM250位点突变)。两种抗病毒药物联合使用可以减少耐药风险,但长期联合的获益需要更多证据支持。后面应定期监测HBV DNA,及时调整抗病毒药物。
王锋(肿瘤科):临床上我们面临的一个难题是:如何区分免疫药物引起的肝炎,还是化疗引起的肝炎,因为这两者治疗方式有所不同,我们能否通过一些实验室指标或检查来区分?
谢芳(肝病科):目前并没有什么特殊的实验室指标或检查可以区分这两种肝炎,鉴别诊断主要依靠医生的经验。一般来说,判断肝损伤与哪个药物有关,可以通过用药的先后顺序判断。比如,患者前面一直做化疗,没有出现肝损伤,后面加了新的治疗(免疫治疗),出现肝损伤了,那么免疫治疗引起的可能性较大,但这位患者的化疗和免疫治疗是同时使用的,而且都只用了一次,所以很难鉴别。
王锋(肿瘤科):杨主任好,肝脏穿刺活检病理可以明确究竟是免疫药物引起的肝炎,还是化疗引起的肝炎吗?
杨志慧(病理科):免疫药物、化疗药物、非甾体抗炎药(NSAID)、中草药等都是引起肝损伤的常见药物。理论上,病理学研究可以帮助鉴别各种类型肝损伤,但迄今仍无法明确肝损伤的病理特征是否具有特异性、跟哪种药物有关。文献报道在免疫药物引起的肝损伤中,CTLA-4抑制剂往往可见全小叶性肝炎伴小叶中央坏死,以肉芽肿性肝炎为主伴纤维蛋白环状肉芽肿,并可见小叶中央静脉内皮炎;而PD-1抑制剂亦可出现小叶性肝炎伴小叶中央坏死,但炎症以门静脉周围炎症为主,无纤维蛋白环状肉芽肿,并少见胆汁淤积性损伤伴胆管消失综合征。由此可见,不同免疫检查点抑制剂出现肝损伤的病理特征有差异,但存在交叉,用肝穿刺组织病理来明确诊断尚有很大的挑战性,希望随着临床病例的增加,病理特征的不断积累,未来能够在病理方面有一些突破性的研究成果,甚至期待可以根据特异性病理特征给予个体化治疗方案。
谢芳(肝病科):我们目前诊断免疫性肝炎,主要还是从临床角度进行分析,结合用药史、用药顺序、实验室指标和影像学检查进行排他性诊断。肝脏穿刺活检是有创性操作,在重度肝功能异常时,患者的凝血功能也往往有异常,肝脏穿刺活检存在大出血的风险。因此,在肝脏穿刺前一定要做好和患者及其家属的沟通工作。这位患者之前在外院就诊时,已经用了糖皮质激素和常规护肝药物,可能对穿刺病理结果造成影响。目前这位患者的肝功能指标已明显好转,进行肝脏穿刺活检的实际临床意义不大。
李祥(药学科):这位患者的肝功能损伤判断与药物相关是合理的,但难以断定与免疫药物肯定有关,我们还能找到哪些临床特征或实验室指标协助诊断免疫相关毒性?
王锋(肿瘤科):我们在临床上发现,当患者出现一些重度免疫相关毒性时,往往会同时发生其他免疫毒性,例如心肌炎合并肌炎,肺炎合并心肌损伤等,我科曾收治一位患者同时发生5种毒性,包括肺炎、心肌炎、肝炎、肌炎和甲状腺功能减退。这位肝内胆管癌患者除了肝损伤之外,还合并了皮质醇降低、皮疹,这些内分泌毒性、皮肤毒性都是常见的免疫毒性,从一定程度上支持免疫性肝炎的诊断。另外,我们还查了炎症细胞因子,患者IL-6和IL-10明显增高,这些也可以作为参考指标。从机制上来讲,免疫毒性主要源于免疫效应细胞被过度激活,导致细胞大量快速分泌炎症细胞因子,继而造成单个或多个器官或组织损伤。
谢芳(肝病科):如果这样分析的话,我也觉得这位患者免疫性肝炎的可能性更大,请教一下,化疗药物会不会引起皮疹或皮质醇降低?
王锋(肿瘤科):化疗的影响不能完全排除,因为吉西他滨引起皮疹的副作用并不少见,而奥沙利铂一般很少发生皮疹,但是化疗药物一般不会引起皮质醇降低。因此,从个人经验来看,该患者肝功能损伤首先考虑是免疫药物相关,与化疗的相关性比较小。
谢芳(肝病科):为了进一步排除其他疾病如感染、自身免疫性肝炎等引起的肝损伤,还需要查一下EB病毒(EBV)、巨细胞病毒(CMV)等,以及自身免疫性肝炎相关指标。
王锋(肿瘤科):在所有免疫相关不良反应中,免疫性肝炎的鉴别诊断是相对较难的,因为需要排除的病因很多。我有一个想法,如果希望找到一些实验室指标来区分是免疫药物,还是其他药物引起的肝炎,肝病科和肿瘤科可以合作开展前瞻性队列研究,针对一些疑似免疫药物、自身免疫性肝病或其他药物引起的肝损伤,同期检测病原体感染指标、肝炎病毒(甲乙丙丁戊)抗体、自身免疫性肝炎指标和炎症细胞因子等,当积累相当一部分病例,进行统计学分析,就可能找到免疫性肝炎相对特异性标志物,另外,如果能够拿到肝脏穿刺病理学结果将更有价值。
李祥(药学科):这是很好的研究思路。另外,我想了解一下,免疫性肝炎有没有具体的分型?
王锋(肿瘤科):《CSCO免疫检查点抑制剂相关的毒性管理指南》将免疫性肝炎主要分为三大类:肝细胞型(hepatitis)、胆管炎型(cholangitis)、混合型(mixed)。这位患者抗肿瘤治疗后一开始出现转氨酶增高,而胆红素正常,属于肝细胞型,这种类型最多见,约占50%以上,对药物治疗敏感,预后较好。3种类型中,胆管炎型预后最差,也就是初始以总胆红素升高为主,而转氨酶正常或轻度升高,这种类型罕见,对激素治疗不敏感,死亡率较高。
谢芳(肝病科):我补充一下,在药物性肝损伤(DILI)方面,我们肝病科主要通过计算R值来进行分型,R值的公式为:(ALT实际值/ALT正常上限)÷(ALP实际值/ALP正常上限),肝细胞损伤型是指ALT>3ULN,且R>5;胆汁淤积型是指ALP>2 ULN,且R<2;混合型是指ALT>3 ULN,ALP>2ULN,且2<R<5。如果ALT和ALP达不到上述标准,则称为“肝脏生化学检查异常”,而不能诊断为DILI。
李祥(药学科):这种分型方法很好,既能帮助了解患者的预后,也能大致了解发生机制,指导临床治疗用药。免疫性肝炎根据损伤程度有相应的分级标准吗?
王锋(肿瘤科):目前免疫性肝炎没有专门的分级标准,而是参照其他药物性肝损伤标准进行分级。肿瘤科一般依据NCI制定的常见不良事件评价标准(Common Terminology Criteria for Adverse Events, CTCAE)5.0版进行分级,具体为:G1 AST或ALT <3倍正常值上限(ULN),TBIL <1.5倍ULN;G2 AST或ALT 3~5倍ULN,TBIL 1.5~3倍ULN;G3 AST或ALT 5~20倍ULN,TBIL 3~10倍ULN;G4 AST或ALT >20倍ULN,TBIL >10倍ULN;G5 因肝毒性死亡。
谢芳(肝病科):肝病科与肿瘤科不同,肝损伤还是参照DILI分级标准,如果不考虑症状,单纯实验室的指标分级如下:1级 血清ALT和/或ALP水平升高,TBIL<2.5 倍ULN,INR < 1.5;2级 血清ALT和/或ALP水平升高,总胆红素≥2.5 倍ULN或INR ≥1.5;3级 血清ALT和/或ALP水平升高,总胆红素≥5 倍ULN,伴或不伴INR ≥1.5;4级 INR≥1.5的凝血异常,总胆红素≥ 10 倍ULN 或每日升高≥ 1.0 mg/dL(17.1μmol/L);5级 死于DILI,或需要接受肝移植才能生存。
李祥(药学科):两个学科对肝功能损伤的分级细节描述上略有差别,但都对严重程度进行详细划分,有利于我们根据不同分级制定不同的治疗方案。我们知道常用的护肝药物主要分为抗炎保肝类、解毒类、利胆类、抗氧化类及促进肝细胞再生类五大类,在临床上,免疫性肝炎有哪些针对性的护肝药物?
谢芳(肝病科):临床上,我们需要根据肝损伤的类型、严重程度及机制综合判断后再决定用何种护肝药物,一般轻度药物性肝炎采取单药护肝治疗,中重度患者需要多种药物联合治疗。免疫性肝炎的主要机制是炎症细胞因子风暴,所以常常会用到有抗炎作用的甘草酸制剂;这位患者以ALT升高为主,双环醇类对这类肝损伤疗效较好;另外,免疫药物也可能造成胆管或毛细胆管损伤,熊去氧胆酸等利胆类药物也是常用药物之一。值得注意的是,肝损伤治疗的同时需结合生活方式干预如戒酒、低脂饮食等。另外,一些重度肝损伤患者,如果对常规护肝药物疗效不佳,可能要采取人工肝支持系统治疗,如血浆置换、分子吸附再循环系统等。在重度药物性肝衰竭不可逆转时,可选择性采取肝移植手术,但在免疫药物引起的肝损伤中,尚未见到肝移植的文献报道。
李祥(药学科):指南推荐对于3/4级免疫性肝炎,一般推荐甲强龙1~2mg/kg·d,这位患者初始剂量达到4mg/kg·d,是否过量?
王锋(肿瘤科):CSCO、NCCN指南推荐免疫性肝炎的激素剂量一般不超过2mg/kg·d,只有在3/4级免疫性心肌炎时,采用冲击剂量激素治疗,这位患者起始剂量激素4mg/kg·d,值得商榷。总体而言,肝细胞型免疫性肝炎对激素治疗是非常敏感的,而这位患者经激素和护肝治疗后,转氨酶下降速度较快,也体现了这一点,也反证了这位患者是免疫性肝炎,而不是化疗引起的肝炎,因为后者我们常规是不用激素治疗的。
这位患者年轻,存在多系统免疫毒性,肿瘤恶性程度高,肝脏肿瘤负荷巨大,有基础疾病慢性乙型肝炎,如果不能在较短的时间内快速把转氨酶降下来,一旦肝脏肿瘤进展再加上肝功能损伤,很容易发生肝功能衰竭而危及生命。所以,来我院后,我们给予2mg/kg·d甲泼尼龙联合常规护肝治疗。值得注意的是,这位患者转氨酶呈逐渐下降趋势,但出现TBIL、GGT、AKP逐渐上升(最高峰时TBIL 29.3μmol/L,GGT 1007U/L,ALP 261U/L),临床上,有少数肝细胞型或混合型免疫性肝炎因诊断延迟或处理不当,可能出现TBIL进行性升高,而转氨酶达峰后逐渐下降,即“胆酶分离”现象,最终因肝功能衰竭而死亡。所以,我们在激素、常规护肝基础上,加予吗替麦考吩酯口服,目的是进一步加强免疫抑制,减轻胆管损伤,缩短病程,为后续抗肿瘤治疗创造机会。
谢芳(肝病科):大剂量的糖皮质激素治疗会不会导致肿瘤快速进展?
王锋(肿瘤科):这个问题值得关注,重度免疫性肝损伤的治疗需要一段较长的时间,这段时间内抗肿瘤治疗是暂停的,而激素的使用可能降低机体免疫力,存在肿瘤进展的可能性。所以我们必须在最短时间内迅速将肝功能降至正常范围,并及时衔接上抗肿瘤治疗。在临床上,我们确实碰到过在激素治疗期间出现肿瘤爆发性进展的病例,但只占很小的一部分。
李祥(药学科):一开始我觉得该病例的肝损伤很难确定具体原因,但是经过刚才几位主任抽丝剥茧样的分析后,免疫相关性肝炎的诊断还是比较明确的。文献报道免疫性肝炎可以发生在用药后的任意时间,最常出现在首次用药后8~12周,PD-1/PD-L1抑制剂的肝损伤发生率约5%,CTLA-4抑制剂的肝损伤发生率低于10%,总体死亡率约2%,免疫联合靶向、化疗或双免疫联合治疗的发生率和死亡率更高,医生应高度重视。临床上,不同的恶性肿瘤使用免疫药物,肝炎的发生率是否不同?
王锋(肿瘤科):在临床实践过程中,我们发现有一种有趣的现象,发生在某种脏器或组织的肿瘤,用了免疫药物后容易出现同一脏器或组织的免疫毒性,例如,肺癌患者容易发生免疫性肺炎,肝癌患者容易发免疫性肝炎,而皮肤黑色素瘤容易出现白癜风。这位患者存在肝脏肿瘤,且有病毒性肝炎病史,使用免疫药物发生免疫性肝炎的机率更大一些。
耿海云(主管医生):这位患者的肝功能恢复正常后,能不能重新使用免疫药物?
李祥(药学科):从药学角度,判断不良反应与药物的相关性,有一条标准是重新启用药物,再次出现同样的不良反应,那么更能印证药物与不良反应的相关性。但这位患者前期转氨酶高于正常上限20倍以上(4级),从安全角度来说,不建议再使用原先的免疫药物了。
王锋(肿瘤科):有研究显示,重启免疫治疗后,大约有一半的患者会再次发生免疫毒性,约1/4~1/3的患者出现同一系统的免疫毒性。目前国内外指南一致建议,一旦出现4级免疫毒性,永久停用免疫药物。所以,不建议该患者使用免疫药物。目前国内外指南争论的焦点在于,对G3级肝功能损害,若治疗后肝功能恢复正常,能否重启免疫治疗?ASCO、SITC指南建议永久停用免疫药物,CSCO指南认为可以重启免疫治疗,但作为Ⅱ级专家推荐。结合本中心临床经验,单纯肝细胞型免疫性肝炎预后较好,若G3级肝功能损害恢复至≤1级,可以启用原先的免疫药物或换用别的免疫检查点抑制剂(不包括CTLA-4抑制剂或PD-1/CTLA-4双抗)。
赵颖(影像科):晚期肝内胆管癌恶性程度高,进展速度快,从影像学检查来看,这位患者肿瘤负荷较大,以肝左叶为主,有向肝门区发展的趋势,如果肿瘤进一步发展,可能出现梗阻性黄疸,预后会非常差。后续的抗肿瘤治疗该选择什么方案?
王锋(肿瘤科):尽管近年来胆道肿瘤的药物治疗有了较大进步,但总体有效率不高,这位患者的后期抗肿瘤治疗比较棘手,因为患者的肿瘤负荷较大,而且从肿瘤标志物来看,NSE也明显增高,提示患者的肿瘤不是单纯的胆管癌,可能还合并神经内分泌癌的成分,患者年纪轻,肿瘤发展速度往往较快。
这位患者经过积极治疗,肝功能已明显好转,后续应尽快进行抗肿瘤治疗。患者出现4级肝功能损伤,后续抗肿瘤治疗暂不考虑免疫治疗。前期使用吉西他滨、奥沙利铂联合治疗1周期,目前肿瘤较稳定,理论上可继续用原方案治疗,考虑刚经历严重肝功能损伤,使用单药吉西他滨更为安全。当然,也可以换用白蛋白结合型紫杉醇为主的方案化疗,该药的肝功能损伤较小。另外,这位患者的基因检测提示FGFR2融合突变,可以考虑给予FGFR2抑制剂药佩米替尼靶向治疗,但该药属于自费药物,价格昂贵,需要结合患者的经济条件。从肿瘤病理性质和血清标志物来看,该患者的肿瘤恶性程度高,异质性也很高,针对单一靶点的靶向药物很难控制病情,必要时采用靶向药物联合化疗,注意防治药物相关不良反应。
王锋(肿瘤科):请肿瘤科3病区戴芳护士长从护理的角度,谈谈您的建议。
戴芳(肿瘤科):药物性肝炎和免疫性肝炎,在临床症状上没有太大的区别,患者往往表现为腹胀、嗳气、食欲不佳、乏力、情绪低落等,护理方面可以建议清淡饮食,适当运动,加强心理疏导。一些胆红素升高的患者可能会出现不同程度的皮肤、巩膜黄染,尿色加深,严重梗阻性黄疸会出现大便颜色呈白陶土样。免疫不良反应造成不良后果往往归因于不能早期发现,患者每次输注免疫药物只需要半小时左右,在家中休息2~3周,所以除了急性的输注反应,大多数免疫不良反应发生在院外,所以,我们需要对于初次使用免疫药物的患者,提前做好药物不良反应的健康宣教,无论是在医院或家中,出现异常情况,患者及其家属应及时与主管医生联系、沟通,只有做到免疫不良反应的早期发现和早期干预,才能明显降低一些严重免疫毒性的死亡率。
MDT小结
该患者首先考虑免疫性肝炎,不完全排除化疗药物引起的肝功能损伤,与乙肝病毒复制、肝脏肿瘤可能无关,但肝脏基础疾病、肝脏肿瘤负荷可能加重肝功能损伤的不良后果;
可进一步查自身免疫性肝炎相关抗体、EBV、CMV等,以排除其他病因引起的肝损伤,患者已处于肝功能恢复期,不建议行肝脏穿刺活检术;
目前甲泼尼龙、护肝、吗替麦考吩酯等治疗有效,激素可逐渐减量使用,抑制乙肝病毒药物可采用恩替卡韦联合丙酚替诺福韦,继续维持护肝药物;
待肝功能进一步好转,择期行化疗或FGFR2抑制剂治疗。
随访结果
患者于2025年4月18日复查肝功能示:TBIL 14.5μmol/L,DBIL 9.3μmol/L,ALT 52U/L,AST 56U/L,GGT 409U/L,ALP 187U/L;于当天予吉西他滨单药化疗,停用PD-1抑制剂,因经济情况不佳,暂未使用FGFR2抑制剂。
2025年4月25日转氨酶降至正常,停用泼尼松、吗替麦考吩酯,化疗期间继续口服护肝药物。
2025年4月25日HBV DNA 降至正常,继续口服恩替卡韦、富马酸丙酚替诺福韦。


附“免疫性肝炎顺口溜”
免疫肝损常警惕,
联合治疗更留意。
化验影像肝活检,
排他诊断思缜密。
护肝利胆和激素,
三板斧头谁可敌?
胆酶分离世难题,
综合治疗或可倚。
注释:免疫检查点抑制剂相关肝炎(简称免疫性肝炎)是常见的免疫治疗相关不良反应之一,在PD-1/PD-L1抑制剂因不良反应致死病例中,免疫性肝炎的死亡人数位列第二位,仅次于免疫性肺炎,应予以高度警惕;免疫检查点抑制剂联合靶向药物、化疗或双免疫联合的肝功能损伤发生率高于免疫检查点抑制剂单药。免疫性肝炎主要通过实验室指标、影像学检查和肝穿刺活检病理明确诊断,需要排除其他病因如基础肝病(病毒性肝炎、酒精性肝炎、脂肪肝等)、其他药物引起的肝损伤、自身免疫性肝炎、肝脏原发/继发性肿瘤、胆道梗阻等。
免疫性肝炎的主要治疗药物包括抗炎、利胆类护肝药物以及糖皮质激素,大多数患者治疗后肝功能可以恢复正常。目前临床上的难题是胆管炎型免疫性肝炎,往往表现为总胆红素明显升高,而转氨酶正常或轻度升高;也有部分患者因诊断延迟或处理不当,从肝细胞型或混合型肝炎逐渐发展成胆酶分离现象,治疗棘手,预后较差。因此,针对难治性免疫性肝炎,除了常规的护肝、利胆、激素治疗之外,还需要及时采用其他免疫抑制剂或人工肝等综合治疗方法才能转危为安。
本期专家组成员
东部战区总医院肿瘤科
中国抗癌协会(CACA)肝脏肿瘤整合康复专业委员会副主任委员
中国临床肿瘤学会(CSCO)肿瘤心脏病学专家委员会常委兼秘书长
中国临床肿瘤学会(CSCO)黑色素瘤专家委员会常务委员
中国临床肿瘤学会(CSCO)肝癌专家委员会委员
中国临床肿瘤学会(CSCO)中西医结合专家委员会委员
中国临床肿瘤学会(CSCO)青年专家委员会委员
江苏省抗癌协会理事
江苏省癌症康复与姑息治疗委员会委员
江苏省免疫学会肿瘤免疫专业委员会委员
《CSCO肝癌诊疗指南》、《CSCO免疫检查点抑制剂相关毒性管理指南》、《肝癌术后辅助治疗中国专家共识(2023版)》、《肝癌新辅助治疗中国专家共识(2023版)》等执笔专家组成员












 苏公网安备32059002004080号
苏公网安备32059002004080号


