乳腺原发性小细胞癌(PSCCB,Primary small cell carcinoma of the breast)是一种罕见(约占1%)且高度侵袭性的乳腺癌。既往文献报道极为有限。尽管其原发于乳腺,但其在病理学、生物学行为以及对治疗的反应上与小细胞肺癌 (SCLC) 高度相似。这种高度同源性赋予了两者在临床诊断和治疗方案选择上重要的相互关联和借鉴意义。
近日,美国底特律韦恩州立大学医学院报告了一例引人关注的51岁女性原发性乳腺小细胞癌(PSCCB)病例。【肿瘤资讯】对该病例的诊疗历程进行了详细梳理,并对当前治疗策略进行综述与总结。
病例介绍
基本资料:患者女,50余岁,绝经后。乳房自检发现左乳肿块。
病史:患者20年前曾接受抗结核治疗,4月前乳房自检发现左乳肿块。
入院后检查:常规乳腺X线摄影检出左乳4cm肿块及左腋窝1.4cm肿大淋巴结。
初始鉴别诊断:良性病变(如纤维腺瘤、脂肪坏死、结核性乳腺炎)、恶性肿瘤。
左乳肿块及淋巴结行超声引导下活检,病理提示:符合小细胞癌累及左乳及腋窝淋巴结。
免疫组化染色示:ER、PR、HER2及GATA结合蛋白3受体活性阴性。
免疫组织化学染色示:AE1/AE3阳性(提示上皮源性肿瘤,有助于排除肉瘤或淋巴瘤),而嗜铬粒素和突触素染色阴性,则排除了典型的神经内分泌分化。支持小细胞癌的诊断。
CD56染色阳性(该免疫组化标记用于识别特定肿瘤并支持小细胞癌诊断)(图1)。
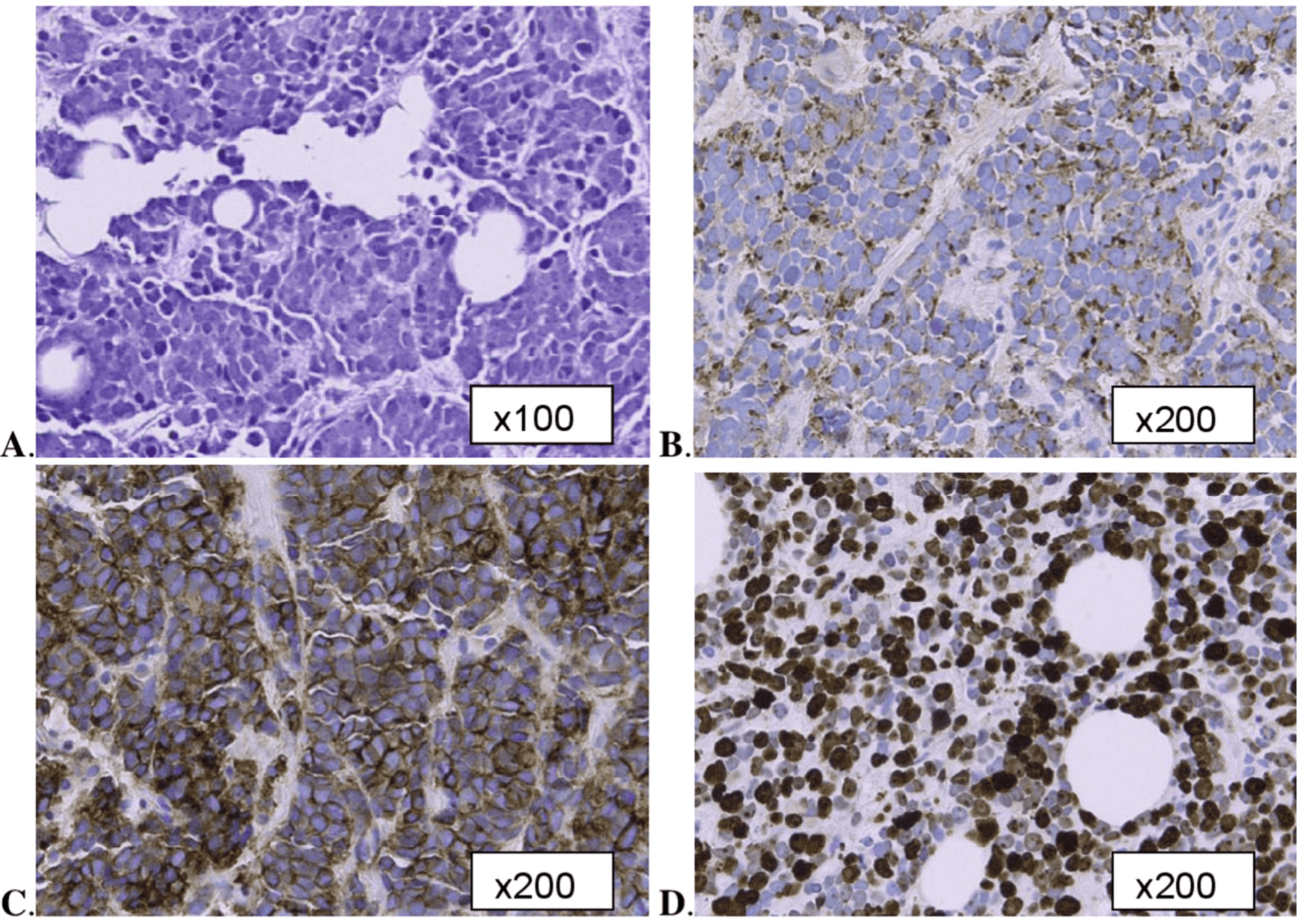 图1:肿瘤组织呈巢状排列,间质纤维组织穿插分隔(A)。肿瘤细胞形态单一,边界不清,可见核挤压现象,胞质稀少,核分裂活跃。细胞核染色质淡染,呈圆形至卵圆形,染色质细腻颗粒状,核仁显著。免疫组化显示:CAM5.2(一种低分子量角蛋白,主要与人角蛋白反应)呈斑片状核周阳性(B);CD56呈弥漫性膜强阳性(C);Ki-67增殖指数(细胞增殖标志物)>85%(D)。
图1:肿瘤组织呈巢状排列,间质纤维组织穿插分隔(A)。肿瘤细胞形态单一,边界不清,可见核挤压现象,胞质稀少,核分裂活跃。细胞核染色质淡染,呈圆形至卵圆形,染色质细腻颗粒状,核仁显著。免疫组化显示:CAM5.2(一种低分子量角蛋白,主要与人角蛋白反应)呈斑片状核周阳性(B);CD56呈弥漫性膜强阳性(C);Ki-67增殖指数(细胞增殖标志物)>85%(D)。
全身PET扫描发现,患者左乳房有一个5.3cm的坏死肿块,目前未扩散到其他部位(图2)。
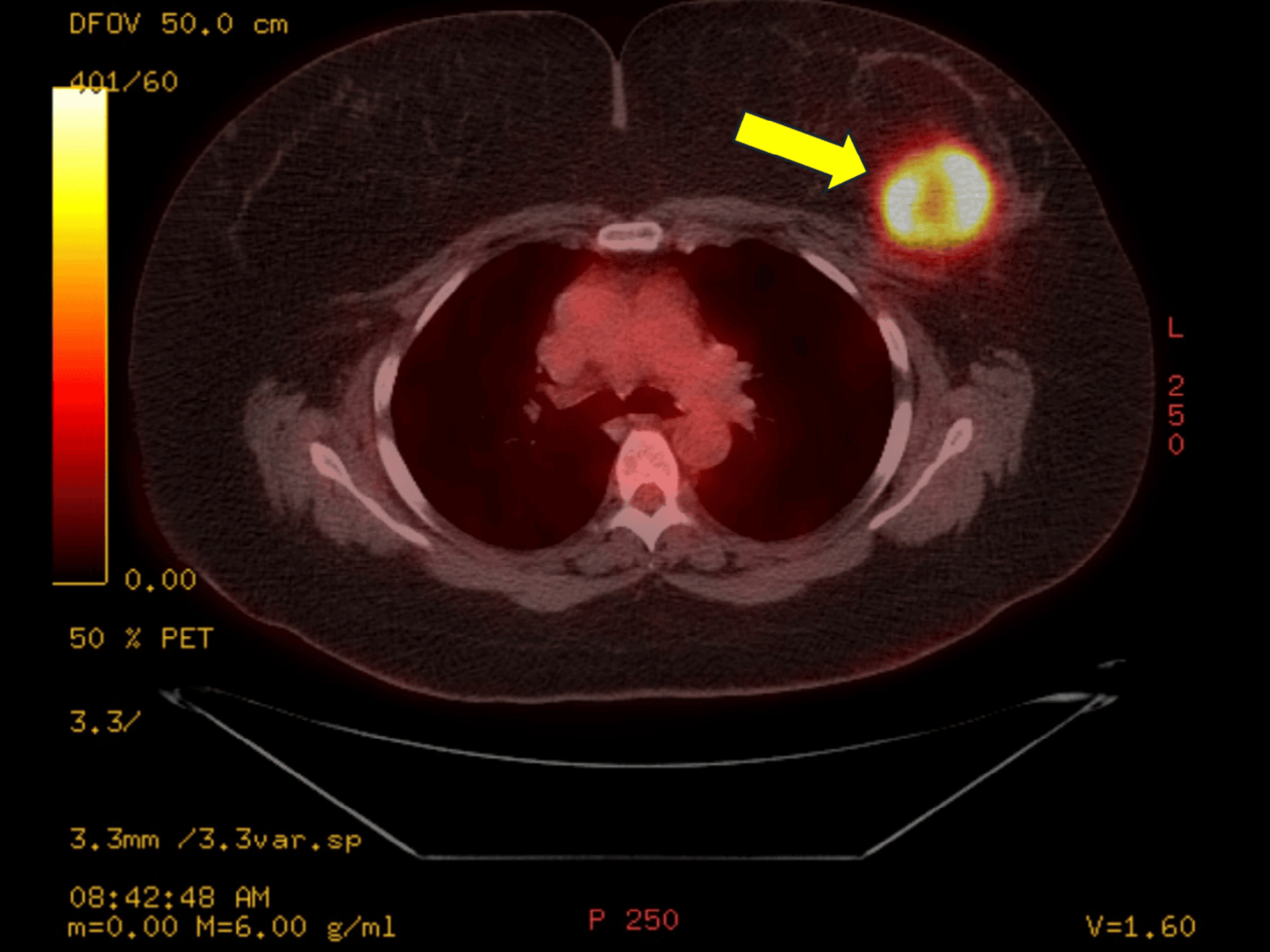 图2: 正电子发射断层扫描(PET)图像,黄色箭头指示左乳病灶。
图2: 正电子发射断层扫描(PET)图像,黄色箭头指示左乳病灶。
治疗:完成初步影像评估后,患者选择保乳治疗(肿瘤切除术联合左乳外照射放疗)。为缩小原发灶以利保乳治疗并处理潜在转移灶,首先接受6周期新辅助卡铂+依托泊苷化疗。随后行肿瘤切除术切除左乳1.7cm肿瘤,切缘阴性,同期切除的腋窝淋巴结未见恶性证据。后续接受为期4周的左乳外照射放疗,采用双野切线照射技术(内侧和外侧切线野),使用15/6 MV光子线分16次给予总剂量4272厘戈瑞(cGy)(单次267 cGy)。对切除腔外扩1cm区域追加4次250 cGy(总剂量1000 cGy)的15 MV光子线照射(图3)。
 图3:左侧乳腺及瘤床外照射放疗(EBRT)等剂量线轴向视图。黄色区域为5272 cGy等剂量线(高剂量区),紫色区域为覆盖全乳的4272 cGy等剂量线(中剂量区),粉色轮廓为肿块切除腔解剖标记。
图3:左侧乳腺及瘤床外照射放疗(EBRT)等剂量线轴向视图。黄色区域为5272 cGy等剂量线(高剂量区),紫色区域为覆盖全乳的4272 cGy等剂量线(中剂量区),粉色轮廓为肿块切除腔解剖标记。
患者完成新辅助化疗、手术及左乳术后外照射放射治疗(EBRT)一年后,随访PET扫描显示左锁骨上、锁骨下及纵隔淋巴结代谢活性增高。
通过CT引导下纵隔淋巴结活检获取组织标本,病理学提示:低分化癌伴非特异性腺体分化(尚不明确该病灶为左乳低分化腺癌复发抑或新发非小细胞肺癌)。值得注意的是,此时双侧乳腺及腋窝未见明确病灶(图4)。
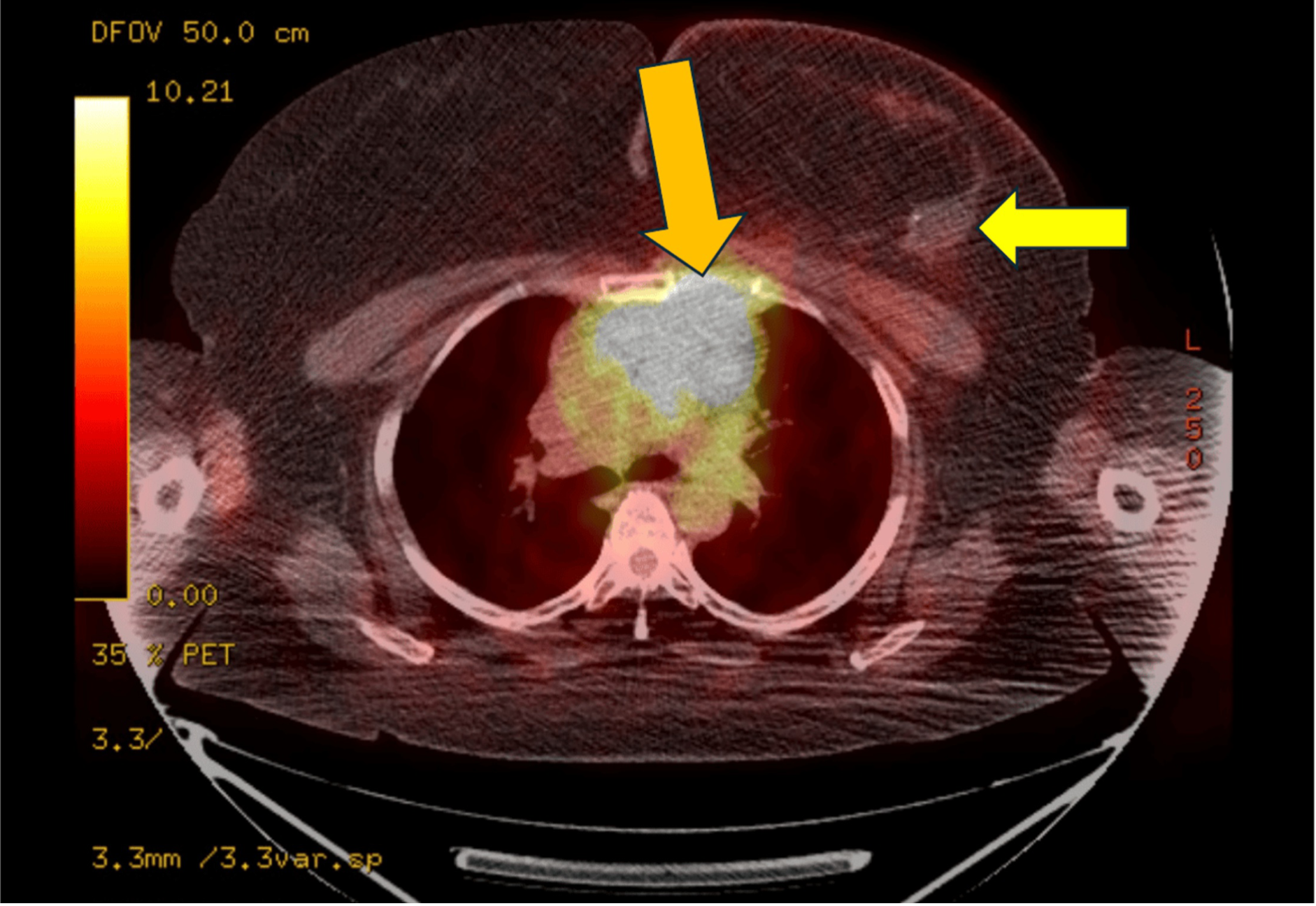
图4:正电子发射断层扫描(PET)图像显示纵隔病灶(橙色箭头标注)。需特别指出,左乳肿瘤床区域PET显像阴性(黄色箭头标示),提示局部无代谢活跃病灶残留。
患者随后接受同步化疗(紫杉醇联合卡铂)及外照射放射治疗。大体肿瘤靶区(GTV)为PET阳性病灶,计划靶区(PTV)为GTV外扩5 mm边界。采用6兆伏光子的调强放射治疗技术,对PTV实施30次分割共6000 cGy的剂量照射(图5)。
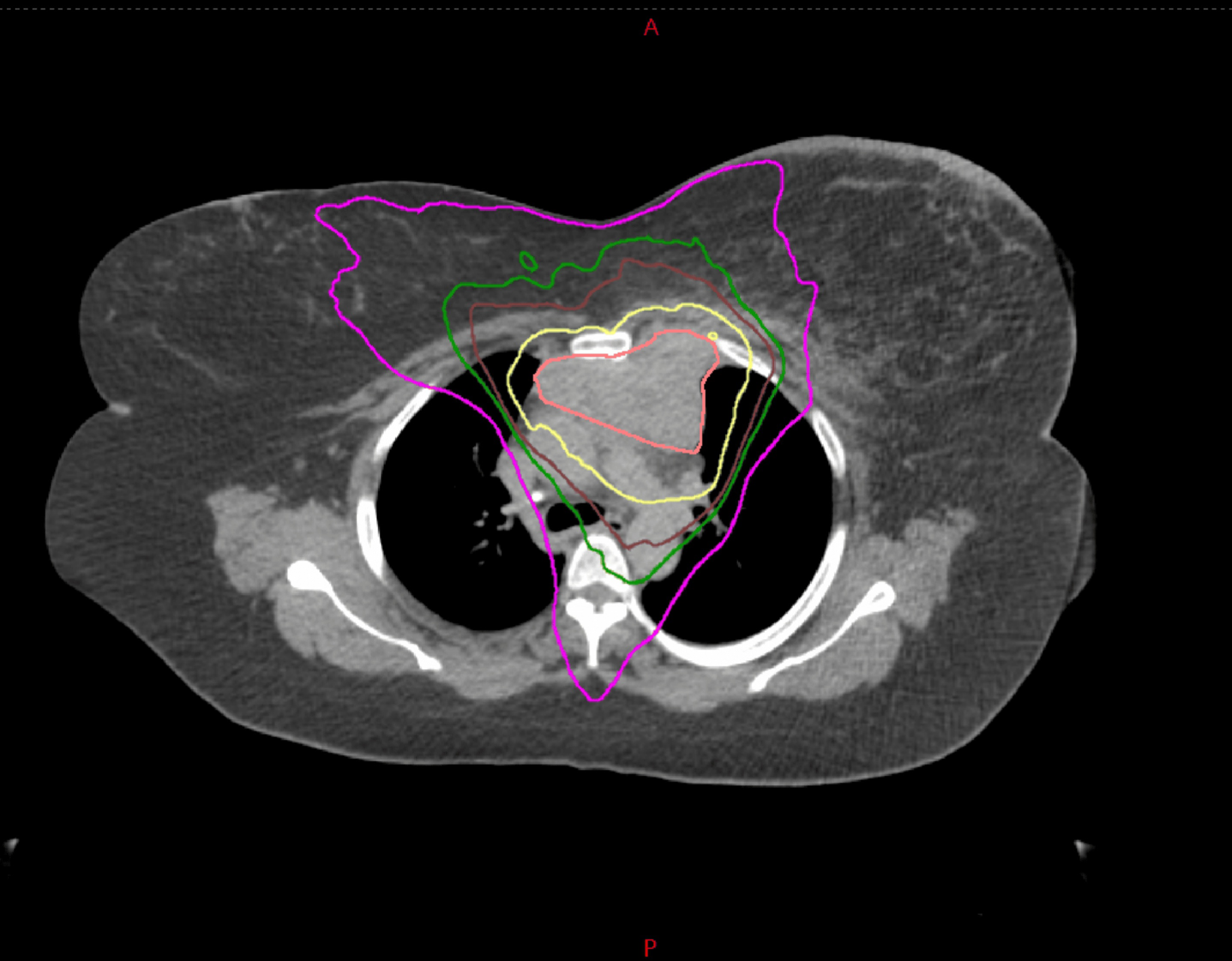 图5:纵隔病变放射治疗剂量分布图。紫色区域为3000 cGy等剂量线(低剂量区),深绿色为4200 cGy等剂量线(中剂量区),棕色为4800 cGy等剂量线(高剂量区),黄色为6000 cGy等剂量线(超高剂量区)。玫红色轮廓为PET扫描显示的纵隔肿瘤解剖定位。
图5:纵隔病变放射治疗剂量分布图。紫色区域为3000 cGy等剂量线(低剂量区),深绿色为4200 cGy等剂量线(中剂量区),棕色为4800 cGy等剂量线(高剂量区),黄色为6000 cGy等剂量线(超高剂量区)。玫红色轮廓为PET扫描显示的纵隔肿瘤解剖定位。
治疗期间主要急性不良反应为轻度食管炎,未观察到远期并发症。治疗结束后建议行为期一年的免疫治疗,但患者拒绝,选择继续随访观察。
针对纵隔病灶的放射治疗完成15个月后,胸部常规CT扫描发现新发右心膈角淋巴结,后续PET扫描证实其代谢活跃。
淋巴结活检示:小细胞癌,高度怀疑源自左乳腺癌转移。患者接受立体定向体部放射治疗(SBRT),采用6兆伏光子对受累淋巴结进行5次分割共3000 cGy的照射(图6)。
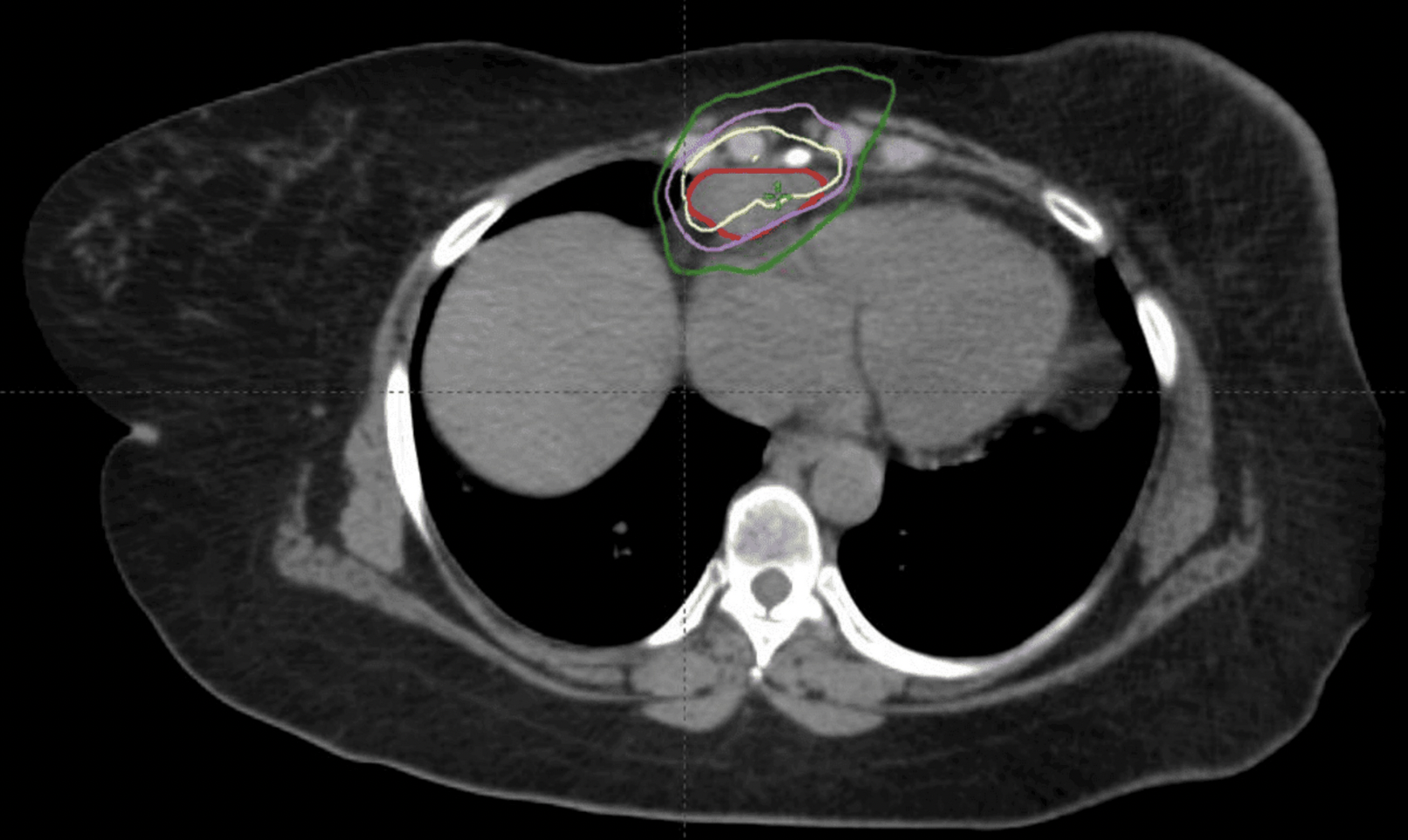 图6:膈肌角淋巴结放射剂量分布图。深红色区域为大体肿瘤靶区(GTV),黄色轮廓线代表100%处方剂量覆盖范围(最高剂量区),紫色轮廓线对应90%等剂量线(高剂量区),绿色轮廓线标示70%等剂量线(中剂量区)。
图6:膈肌角淋巴结放射剂量分布图。深红色区域为大体肿瘤靶区(GTV),黄色轮廓线代表100%处方剂量覆盖范围(最高剂量区),紫色轮廓线对应90%等剂量线(高剂量区),绿色轮廓线标示70%等剂量线(中剂量区)。
GTV定义为PET阳性病灶,PTV为GTV各向均匀外扩0.5 cm边界。SBRT的应用旨在限制心脏与肺的受照剂量,同时避免与既往EBRT照射野重叠。
右心膈淋巴结SBRT术后三个月,患者因呼吸困难急诊就诊。胸部、腹部及盆腔增强CT显示纵隔、心包前部、腹膜及右颈根部多发结节/肿块,伴腰椎及骶骨溶骨性病变。右侧胸腔穿刺引流750mL胸水,细胞学检出恶性细胞。遂接受4周期卡铂+依托泊苷+度伐利尤单抗方案化疗,后续行度伐利尤单抗维持治疗(此决策基于CASPIAN临床试验,该研究证实广泛期小细胞癌患者接受度伐利尤单抗联合铂类-依托泊苷方案可显著改善总生存)。
5个月后,针对右颈根部疼痛性水肿软组织肿块行姑息性外照射放疗。采用三维适形技术,15 MV光子线分10次给予总剂量3000 cGy。治疗后右上肢症状显著改善。
治疗启动约1.5年后,胸部腹部监测CT发现新发肝转移灶及右颈淋巴结增大。遂停用度伐利尤单抗,启用鲁比卡丁治疗。首周期即出现严重恶心、腹泻、乏力及血细胞减少,第二周期减量后耐受性改善。最终完成两周期鲁比卡丁治疗,影像评估提示SD。
乳腺原发性小细胞癌 VS 小细胞肺癌异同
乳腺原发性小细胞癌(PSCCB)与小细胞肺癌(SCLC)之间存在着重要的关联,主要体现在以下几个方面:
组织病理学相似性:
小细胞癌(Small Cell Carcinoma)是一种高度恶性的神经内分泌肿瘤,其癌细胞在显微镜下呈现出相似的“小细胞”形态特征,包括细胞小、胞浆量少、核形不规则、核染色质呈细颗粒状(胡椒面样),核分裂活跃等。
无论是发生在肺部的SCLC,还是发生在乳腺的原发性小细胞癌,它们在病理形态学上都非常相似。
神经内分泌分化:
小细胞癌,一般来说无论其原发部位在哪里,都具有神经内分泌分化的特征。这意味着这些癌细胞表达一些神经内分泌标记物(如嗜铬粒素A、突触素等)(注:本病例中嗜铬粒素A、突触素均为阴性)。这种神经内分泌特性是它们共同的生物学基础。
诊断上的挑战
由于乳腺原发性小细胞癌形态上与SCLC高度相似,因此在诊断时需要特别注意鉴别。
当在乳腺发现小细胞癌时,医生首先需要排除其他部位(尤其是肺部)是否存在原发性小细胞癌并转移到乳腺的情况。只有在确切排除其他原发灶,或发现乳腺原位癌成分时,才能确诊为乳腺原发性小细胞癌。
免疫组化标记物,如TTF-1 (Thyroid Transcription Factor 1),在鉴别诊断中起着重要作用。TTF-1通常在肺部的小细胞癌中呈阳性,而在乳腺原发性小细胞癌中呈阴性,这有助于区分二者。
治疗策略
由于该病的罕见性,目前没有针对该病种的明确、大型的临床试验来指导治疗。
因此,其治疗方案往往会借鉴小细胞肺癌的治疗模式(后文详述)。尽管两种疾病的预后可能存在差异,但这种治疗方案的借鉴是基于它们共同的生物学和组织病理学特征。
诊疗小结
PSCCB疾病特征:
极为罕见、具有高度侵袭性,占比不足1%;超半数新诊断患者淋巴结受累
患者多为60岁以上女性
病因未明,可能为多因素致病
PSCCB的诊疗策略:
需通过临床手段排除非乳腺原发部位的转移灶。
免疫组化检测具有重要鉴别价值,相较于其他器官来源的小细胞癌(如SCLC),PSCCB细胞在病理特征上通常保留原发肿瘤的典型表型。
现有治疗方案:
1.治疗模式:手术联合化疗+外照射放疗(EBRT)±内分泌治疗
个案报告与回顾性研究提示手术联合放化疗的多模式治疗可能有效,若HR+可加用内分泌治疗。文献显示多数病例采用保乳术(切缘阴性)或乳房切除术联合辅助放疗。
2.化疗方案差异显著:多沿用SCLC的经典铂类+依托泊苷方案;部分采用乳腺癌常规蒽环类/紫杉类化疗方案;少数联合上述两类方案。
(本例选用铂类+依托泊苷方案,因该方案在PSCCB中证据相对充分。)
3.治疗原则:尽早确诊、MDT可为PSCCB患者提供最佳生存机会,这包括:
1)全面的组织化学检测
2)早期启动MDT讨论
3)严密监测与随访
Jay K Garlapati, Desten Howard, Jordan Maier, et al. Primary Small Cell Cancer of the Breast: An Unusual Presentation.Cureus. 2025 Apr 4;17(4):e81710. doi: 10.7759/cureus.81710.
排版编辑:肿瘤资讯-Annie











 苏公网安备32059002004080号
苏公网安备32059002004080号


