据新华社报道,当地时间5月18日,美国前总统拜登办公室在一份声明中表示,现年82岁的拜登被诊断罹患侵袭性前列腺癌,目前癌细胞已扩散至骨骼。该消息一经发布,迅速引发全球关注。
据世界卫生组织2020年统计[1],在世界范围内,前列腺癌年龄标化发病率30.7/10万,在男性所有恶性肿瘤中位仍居第二,死亡率为7.7/10万。其中,骨转移是常见且危害严重的并发症,可使患者致死亡风险增加高达6.6倍,严重影响患者生存质量[2]。针对中国诊疗现状,结合临床实践与国内外相关研究,中国抗癌协会泌尿男生殖系统肿瘤专业委员会在叶定伟教授牵头下,于2021年制定了前列腺癌骨转移和骨相关疾病临床诊疗专家共识。【肿瘤资讯】特邀复旦大学附属肿瘤医院叶定伟教授与大家共同探讨前列腺癌骨转移的危害及精准时代下前列腺癌骨转移的治疗策略,以期为临床医师提供更为合理的前列腺癌骨转移诊疗策略。
复旦大学附属肿瘤医院 泌尿外科
复旦大学附属肿瘤医院副院长、泌尿肿瘤MDT首席专家
上海市泌尿肿瘤研究所所长
复旦大学前列腺肿瘤研究所所长
中国抗癌协会整合前列腺肿瘤委员会执行主任
中国抗癌协会整合泌尿肿瘤委员会副主任
中国抗癌协会男性生殖系统肿瘤专委会(CACA-GO)主任委员
中国临床肿瘤学会(CSCO)前列腺癌专家委员会主任委员
中国初级卫生保健基金会泌尿外科专委会主任委员
中国抗癌协会泌尿男生殖系肿瘤专委会(CACA-GU)前任主任委员
中华医学会泌尿外科学分会(CUA)肿瘤学组副组长、CPCC主任委员
中国临床肿瘤学会(CSCO)尿路上皮癌专家委员会副主任委员
中国临床肿瘤学会(CSCO)肾癌专家委员会副主任委员
中国临床肿瘤学会(CSCO)免疫治疗专家委员会副主任委员
中国肿瘤医院泌尿肿瘤协作组(UCOG)主任委员
中国抗癌协会常务理事、中国临床肿瘤学会常务理事
《中华肿瘤杂志》副总编辑
NCCN前列腺癌、肾癌、膀胱癌亚洲诊治共识专家委员会委员
晚期前列腺癌圣加仑共识专家委员会委员
上海市抗癌协会泌尿肿瘤专委会主任委员
上海市医师协会泌尿外科医师分会副会长
亚太前列腺学会(APPS)前任主席
亚太冷冻外科学会副会长等
尤待重视,前列腺癌骨转移的高发病率及高危害性
近年来,前列腺癌在全球的发病率和死亡率逐年升高,严重威胁男性健康。骨是前列腺癌最常见的转移部位,我国初诊前列腺癌约2/3为转移性或局部晚期前列腺癌,在转移性前列腺癌患者中,骨转移发生比例超过90%[3]。由于前列腺血管与椎静脉丛有广泛的交通,前列腺癌细胞通过血道转移至骨,因此,脊椎、骨盆、肋骨和长骨近端等部位是骨转移好发部位,以中轴骨转移为主,常为多发转移[4]。骨转移一旦发生,可导致骨相关事件(SREs),包括病理性骨折、脊髓压迫、骨外科手术、骨放射治疗(包括放射性同位素的使用)[5]。
由于前列腺癌骨转移早期通常没有明显不适,很多人是在骨痛、骨折或手脚活动不灵时才就诊。这些情况伴随而来的SREs,及病情进展引发的骨质疏松性骨折等会严重影响患者的生活质量,增加了死亡率,加重了医疗负担,对整个家庭都会造成很大的痛苦。此外,由于前列腺癌骨转移患者骨质代谢紊乱,可能出现高钙血症、碱性磷酸酶升高等血液学指标改变,若不积极处理,严重者甚至出现全身器官功能衰竭。因此,临床应重视前列腺癌骨转移患者的治疗,早期发现、早期识别骨转移并采取有效干预措施,以减少或延缓SREs发生,提高患者生活质量的同时降低其对抗肿瘤治疗的影响,延长患者总生存期。
有效筛查,早期识别高危人群及潜在转移风险
临床上,尽早诊断前列腺癌患者是否发生骨转移可及时预防和治疗SREs,可减少SREs对患者的不利影响。前列腺癌骨转移和骨相关疾病临床诊疗专家共识(2021版)指出[6],当患者出现以下情况时,应怀疑是否出现骨转移:(1)骨痛或骨折;(2)脊髓或神经受压症状;(3)血碱性磷酸酶升高;(4)高钙血症。若初诊的前列腺癌患者Gleason评分≥8分或临床分期≥T3期,也可将其视为骨转移高危人群[6]。
前列腺癌骨转移需要结合病史、症状、体征、影像学检查共同判断,当临床诊断有疑问时可进行活检(具体诊断流程推荐见图1)。
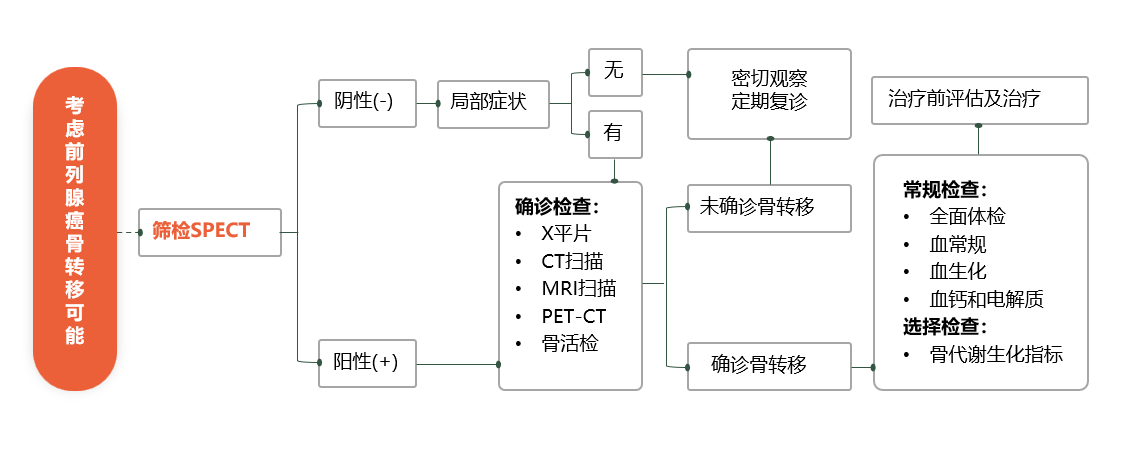
SPECT是前列腺癌骨转移首选的筛查方法,但该检查手段存在假阳性的可能,一些单纯通过SPECT无法明确诊断的,需结合其他影像学检查综合判断。此外,X线、CT、MRI及PET-CT等均是诊断骨转移的主要方法,临床实践中,医师可结合患者情况采取有效的检测手段予以进一步确认。另需强调的是,病理学是诊断肿瘤骨转移的金标准,骨穿刺活检是主要诊断方法,但当影像学检查已经明确提示存在骨质破坏的患者不必常规穿刺活检。骨代谢标志物可反映骨的代谢状况,但特异度和敏感度较低,目前其仅作为辅助诊断。
精准施治,前列腺癌骨转移“控肿瘤+护骨骼”的综合策略
对于前列腺癌骨转移患者,综合治疗十分关键。需以“控肿瘤”和“护骨骼”为核心,结合全身治疗与局部干预。其中,全身性抗肿瘤治疗是基础,包括贯穿全程的雄激素剥夺治疗(ADT)、新型内分泌药物、化疗以及针对特定基因突变(如同源重组修复缺陷)的PARP抑制剂,旨在缩小肿瘤、延缓进展。同时,对承重骨或高危转移灶需联合放疗或手术,预防病理性骨折或脊髓压迫,例如通过精准放疗快速止痛或通过骨水泥填充、内固定术加固骨骼。此外,骨保护剂的使用对延缓SREs的发生具有积极意义,可在很大程度上减少前列腺癌患者的骨折风险。一项针对1199例高危转移性激素敏感性前列腺癌(mHSPC)的LATITUDE研究事后分析显示[7],应用骨保护剂的患者均较未使用骨保护剂者延长了SERs的发生时间,无论是在醋酸阿比特龙联合泼尼松组(差值7.8[95% CI,4.2-11.3]个月)还是ADT组(差值9.3[95%CI,5.2-13.3]个月)。
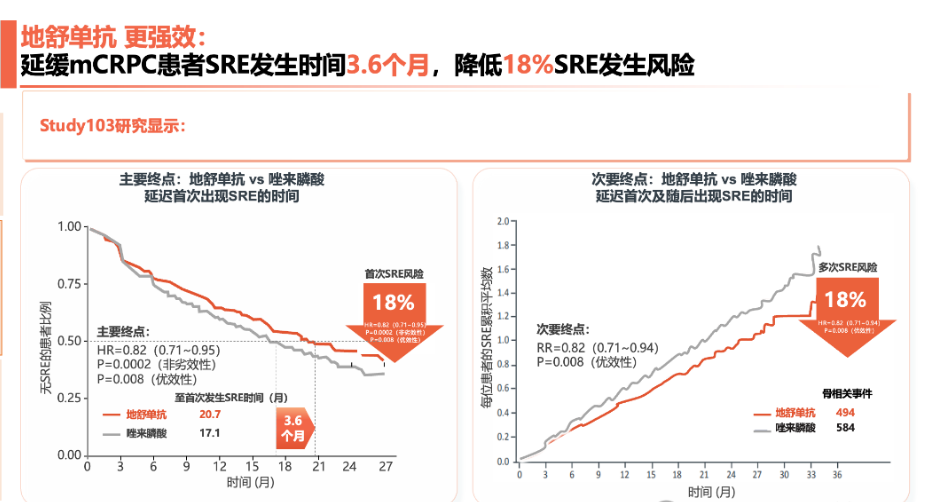
目前,临床上应用的骨保护剂主要为双膦酸盐和RANKL抑制剂。既往有研究显示,双膦酸盐可以显著减少骨转移患者的SREs,特别是病理性骨折,但双膦酸盐可能引发肾功能损伤等较严重不良事件,因而前列腺癌骨转移的药物治疗仍存在未被满足的临床需求。随着药物的发展,RANKL抑制剂地舒单抗的问世为此类人群带来新的希望与选择。在一项对比地舒单抗和唑来膦酸治疗转移性去势抵抗性前列腺癌(mCRPC)的III期随机对照临床研究中,地舒单抗显著延长了首次SERs的发生时间(20.7个月 vs 17.1个月,HR 0.82[95%CI 0.71-0.95],p=0.008)。而且,显著降低骨相关事件首发或再发风险达18%。地舒单抗还能显著延迟疼痛恶化时间达到8.3个月(比唑来膦酸延长1.4个月)[5]。
对于接受双膦酸盐治疗过程中出现骨相关事件的患者,更换地舒单抗能够显著降低再次出现SERs发生的风险(HR 0.47[95%CI 0.25-0.88],p=0.019)[8]。目前地舒单抗已经成为国外指南推荐的首选骨保护治疗药物。
另外,在骨保护药物使用时机的选择上,有研究表明,骨保护药物的使用时机与SREs的发生风险相关。一项真实世界多中心观察性队列研究表明,早期接受骨保护剂治疗的患者出现症状性骨相关事件的风险显著减低(13.2个月 vs. 11.0个月,p=0.001)[9]。因此,临床实践中对于前列腺癌骨转移人群,在其确诊骨转移时应及时启动骨保护治疗。
前列腺癌骨转移的防治之路,是科技与人性关怀的交响曲。骨健康是晚期癌症患者尊严生存的基石,随着临床对前列腺癌骨转移机制的研究不断加深,相信未来骨转移的临床诊疗必将取得较大进展。但无论是RANKL抑制剂的应用,还是未来更新型药物所带来的治疗选择,它们终将为前列腺癌骨转移患者托起生命的重量。
1. WU S, WANG Y, HONG G, et al. An artificial intelligence model for detecting pathological lymph node metastasis in prostate cancer using whole slide images: a retrospective, multicentre, diagnostic study [J]. EClinicalMedicine, 2024, 71,102580.
2. Zhong Y, Valderrama A, Yao JY, et al. Economic Evaluation of Treating Skeletal-Related Events among Prostate Cancer Patients. Value Health. 2018 Mar;21(3):304-309.
3. Qian Z, Wang YH, Tang ZY, et al. Clinical characteristics, treatment pattern, and medical costs associated with metastatic castration-resistant prostate cancer in Chinese tertiary care hospital settings. J Med Econ. 2019;22(8):728-735.
4. Carlin BI, Andriole GL. The natural history, skeletal complications, and management of bone metastases in patients with prostate carcinoma [J]. Cancer, 2000, 88(12 Suppl): 2989-2994.
5. Fizazi K, Carducci M, Smith M, et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study[J]. Lancet, 2011, 377(9768): 813-822.
6. 中国抗癌协会泌尿男生殖系统肿瘤专业委员会. 前列腺癌骨转移和骨相关疾病临床诊疗专家共识(2021 版)[J]. 中华肿瘤杂志, 2021, 43(10):1016-1026.
7. Fukuokaya W, Mori K, Urabe F, et al. Bone-Modifying Agents in Patients With High-Risk Metastatic Castration-Sensitive Prostate Cancer Treated With Abiraterone Acetate. JAMA Netw Open. 2024;7(3):e242467.
8. AnneMarthe M, Gustav Z, Antonis V. Optimizing antiresorptive treatment in patients with bone metastases: time to initiation, switching strategies, and treatment duration. Support Care Cancer. 2019 Oct;27(10):3859-3867.
9. Malou CP, Hans MW, Alfons JM, et al. Symptomatic Skeletal Events and the Use of Bone Health Agents in a Real-World Treated Metastatic Castration Resistant Prostate Cancer Population: Results From the CAPRI-Study in the Netherlands. Clin Genitourin Cancer. 2022 Feb;20(1):43-52.
排版编辑:肿瘤资讯-IRIS











 苏公网安备32059002004080号
苏公网安备32059002004080号


