病史摘要:患者,女性,59岁,因"反复头晕、乏力1个月余"入院,因门诊提示中度贫血,首诊入住血液科进一步排查原因,于血液科完善胸腹CT、乳腺MR等检查提示左乳及双侧腋窝淋巴结异常,并行骨髓穿刺病理证实为转移性腺癌,符合转移性乳腺小叶癌。患者转入本院后行左侧乳房肿物穿刺,证实为乳腺浸润性小叶癌,同时完善双侧腋窝淋巴结穿刺病理均支持为转移癌,患者进一步完善PET/CT排除其他远处脏器转移可能。既往有高血压、糖尿病多年,长期服用非洛地平缓释片、二甲双胍、美托洛尔、格列吡嗪控释片等药物控制。2022年5月曾在当地医院因左侧乳腺肿物行手术治疗,自诉病理结果为良性肿瘤,具体不详。20余年前曾因甲状腺结节行甲状腺手术,具体不详。
症状体征:入院体格检查贫血貌,营养一般,左乳中央区皮肤质地硬,范围约14 cm×8 cm,形状不规则,下方可及质硬肿物,范围基本同质硬皮肤范围,边界不清,活动度差,与皮肤及胸壁相黏连,乳头内陷固定,左侧腋窝可及肿大淋巴结,大小约1.5 cm×1.0 cm,质地硬,边界欠清。右侧腋窝及双侧锁骨上下淋巴结未及明显肿大。
诊断方法:骨髓病理诊断:转移性腺癌,符合转移性乳腺小叶癌。左侧乳房肿物穿刺病理诊断:浸润性小叶癌,考虑为经典型。免疫组化结果:ER(强+,90%)、PR(−)、AR(中-强+,80%)、Her-2(1+)、P53(强弱不等+)、GATA-3(+)、E-cad(−)、P120(部分膜浆+)、Ki-67(热点区15%+)。左侧腋窝淋巴结穿刺病理诊断:乳腺浸润性小叶癌侵犯淋巴结被膜外纤维脂肪组织。免疫组化:GATA-3(+)、GCDFP-15(少量+)。右侧腋窝淋巴结穿刺病理诊断:符合淋巴结转移性癌,考虑乳腺来源。免疫组化:GATA-3(+)、Ma mmaglobin(+)。
治疗方法:乳腺癌姑息性化疗方案AC-T,具体使用药物及剂量为多柔比星脂质体60 mg(35 mg/m 2)+环磷酰胺0.9 g(600 mg/m 2)×4次,后予以白蛋白紫杉醇400 mg(260 mg/m 2)×4次,均为3周1个疗程。使用化疗药物期间预防性使用硫培非格司亭注射液6 mg进行升白细胞处理。在化疗期间如出现血红蛋白低于70 g/L,则予以输注去白悬浮红细胞处理;如出现血小板减少,则使用白介素-11和重组人血小板生成素(rhTPO)等药物进行治疗。
临床转归:患者顺利完成8个疗程的姑息性化疗,治疗期间定期进行疗效评价,在8个疗程结束后复查PET/CT见肿瘤负荷较前明显减低,整体疗效评价为cPR。结合目前指南的推荐以及上级专家会诊意见,患者目前接受德曲妥珠单抗(DS-8201)的维持治疗,目前仍在接受治疗。
推荐阅读人群:肿瘤科;乳腺科;血液科
关键词:乳腺癌;骨髓转移;骨髓抑制;姑息性化疗;硫培非格司亭注射液
前言
目前乳腺癌已经成为全球女性发病率第1位的恶性肿瘤。晚期乳腺癌常见的转移部位有肺、肝、骨、颅脑等多个脏器,而其中骨髓转移的临床报道较为少见。骨髓作为人体的造血器官承担重要的造血功能,如乳腺癌合并骨髓转移则进一步引起造血功能的缺陷,在临床上也多以血液系统的症状为首发表现而被确诊。目前在临床中对于骨髓转移的患者能否接受化疗,以及化疗是否会进一步加重骨髓抑制导致患者无法耐受从而加重疾病进展等问题仍存在一定的争议。有学者通过研究证实乳腺癌骨髓转移患者未经化疗的中位生存期仅1个月,而接受化疗的中位生存期可达10个月(联合化疗)和16个月(单药化疗) [ 1 ]。并且也有一些相关的病例报道证实,即使是乳腺癌患者合并全身多处转移、骨髓转移,并且存在重度骨髓抑制的情况下,使用合理的化疗药物可以使得骨髓的功能逐渐好转 [ 2 , 3 , 4 , 5 ]。因此本文报道1例乳腺癌合并骨髓转移的病例,重点报道我们对她在接受化疗期间骨髓抑制的全程管理,旨在为这一特殊人群的治疗提供一定临床实践经验。
临床资料
一般资料
患者,女性,59岁。
主诉:反复头晕、乏力1个月余。
现病史:患者1个月来无明显诱因开始出现头晕,肢体乏力,活动后心悸明显,头晕时无天旋地转感,无胸闷、胸痛,无恶心、呕吐,无晕厥,患者曾到当地医院就诊,门诊血常规:WBC 3.71×10 9/L,HGB 70 g/L,MCV 96.5 fl,PLT 160×10 9/L,当地医院建议上级医院就诊。起病以来,患者无发热、咳嗽、咳痰,无视力障碍、耳鸣、记忆力减退,无腹胀、腹痛、便血和血尿,无皮肤粘膜出血、牙龈出血和鼻出血。精神进食可,大小便正常。体重无明显减轻。
既往史:有高血压、糖尿病多年,长期服用非洛地平缓释片、二甲双胍、美托洛尔、格列吡嗪控释片等药物。2022年5月,曾在当地医院因左侧乳腺肿物行手术治疗,自诉病理结果为良性肿瘤,具体不详。20余年前曾因甲状腺结节行甲状腺手术,具体不详。否认肝炎史。否认结核史。否认疟疾史。否认脑血管病史。否认精神病史。否认外伤史。否认输血史。否认食物、药物过敏史。预防接种史不详。否认心脏病史。
个人史:久居出生地。无化学性物质、放射性物质、有毒物质接触史。无吸毒史。无吸烟史。无饮酒史。无冶游史。
月经史:已绝经,既往经量正常,无痛经。
婚育史:已婚已育,配偶和子女体健。
家族史:否认家族性遗传病史。否认家族性肿瘤史。
疾病的诊疗难点:患者为中老年女性,以"头晕乏力"来诊,初步完善血常规提示中度贫血。首诊由血液科医师接诊,进一步排查贫血发生的原因,患者病因不明,需结合相关的检查检验结果深入排查原因,抽丝剥茧,最终进行针对性的治疗。
检查
胸部+腹部CT(2023年8月28日):1.左侧乳腺皮肤增厚;双侧腋窝淋巴结显示,左侧为著,伴周围渗出,请结合临床。2.胆囊底部结节,性质待定,建议进一步检查。3.双肺多发微小结节,考虑良性结节,建议复查。4.右侧第11肋骨后段陈旧性骨折。5.主动脉及冠脉硬化。6.甲状腺双侧叶多发结节,请结合相关检查。7.胆囊结石。8.双肾多发小囊肿。9.肝门区淋巴结稍增大。
乳腺磁共振(2023年8月31日):1.左乳弥漫腺体病变,累及左侧胸大肌及左侧乳头及皮肤,考虑恶性病变,伴左侧腋窝多发淋巴结转移,左侧乳腺BI-RADS 5类。2.右乳6:00方向结节影,未除外恶性可能,右侧腋窝多发淋巴结肿大,右侧乳腺BI-RADS 4a类( 图1 )。
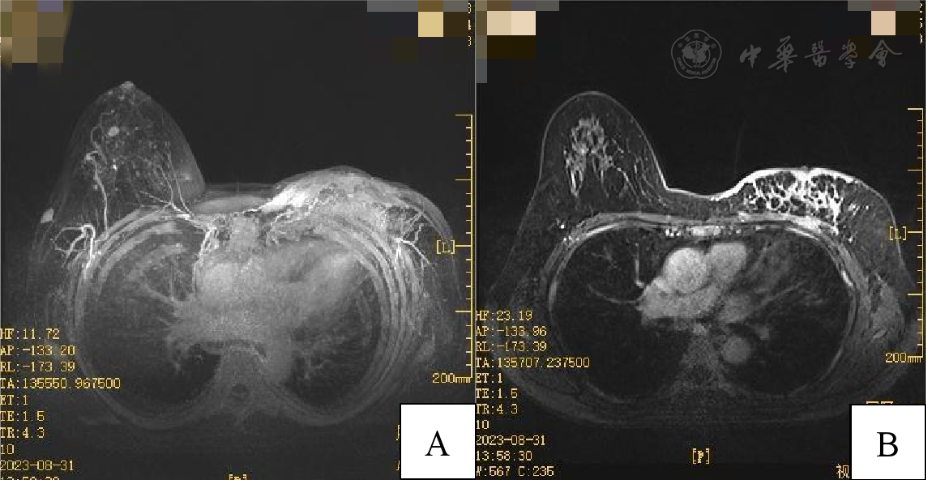 图1患者乳腺磁共振结果 A:左乳;B:右乳
图1患者乳腺磁共振结果 A:左乳;B:右乳
骨髓病理(2023年9月5日)诊断:转移性腺癌,符合转移性乳腺小叶癌。免疫组化:ER(95%强+);PR(−);Her-2(1+);Ki-67(15%+);CK7(+);GATA-3(+);GCDFP-15(+);P53(强弱不等+,野生型表达)。MPO(−);CD61(−);CD71(−);CD235a(−);CD34(−),见 图2 。
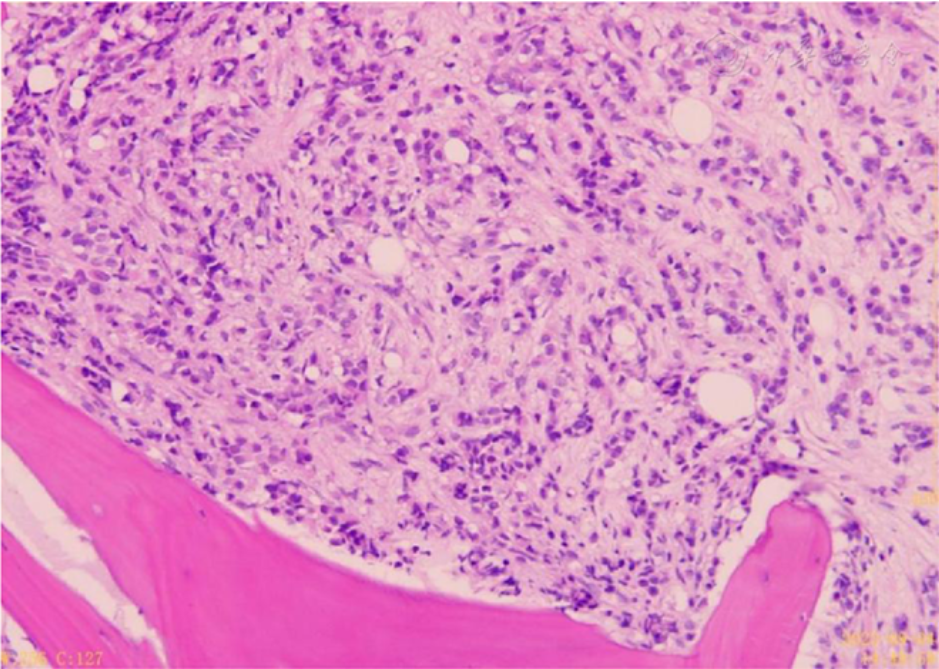 图2患者骨髓病理涂片 HE 中倍
图2患者骨髓病理涂片 HE 中倍
左侧乳房肿物穿刺病理(2023年9月5日),诊断:浸润性小叶癌,考虑为经典型。免疫组化结果:ER(强+,90%)、PR(−)、AR(中-强+,80%)、Her-2(1+)、P53(强弱不等+)、GATA-3(+)、E-cad(−)、P120(部分膜浆+)、Ki-67(热点区15%+)。
左侧腋窝淋巴结穿刺病理(2023年9月5日)示:乳腺浸润性小叶癌侵犯淋巴结被膜外纤维脂肪组织。免疫组化:GATA-3(+)、GCDFP-15(少量+)。
右侧腋窝淋巴结穿刺病理(2023年10月7日)示:符合淋巴结转移性癌,考虑乳腺来源。免疫组化:GATA-3(+)、Ma mmaglobin(+)。
PET/CT(2023年9月7日)示:1.左侧乳腺腺体分布欠均匀,糖代谢增高,符合乳腺癌改变,伴左侧乳腺皮肤(包括左乳头)及左侧胸大肌受侵;右侧乳腺外下象限结节,糖代谢轻度增高,不除外恶性病变可能;右乳钙化灶。2.双侧腋窝、左侧胸肌间、左侧颈部Ⅳ/Ⅴ区多发淋巴结,糖代谢增高,考虑淋巴结转移;其中左侧腋窝淋巴结周围多发条片影,考虑淋巴道转移、堵塞改变。3.骨质疏松症;中轴骨、骨盆骨及所见四肢骨骨髓糖代谢增高,考虑肿瘤骨髓浸润合并贫血引起反应性改变,建议结合骨髓穿刺结果。4.甲状腺双侧叶肿大,密度欠均匀,糖代谢未见增高,考虑结节性甲状腺肿,建议结合超声检查综合评估;双侧颈部Ⅱ/Ⅲ区及右侧颈部Ⅳ/Ⅴ区多发淋巴结,糖代谢增高,多考虑炎性/反应性增生,请随诊复查。5.脂肪肝;胆囊底部壁结节,糖代谢未见增高,多考虑良性病变(胆囊腺肌症可能);胆囊结石;结直肠多发结节状、条带状糖代谢增高灶,多考虑生理性摄取,不除外合并息肉、腺瘤等病变可能,请结合内镜检查综合评估。6.双肺散在纤维灶;双侧胸膜增厚;主动脉及冠状动脉粥样硬化;双侧输卵管结扎术后改变;拟右侧第8后肋骨岛;右侧第11后肋陈旧性骨折。7.其余体部显像未见FDG代谢明显异常增高灶。
PET/CT(2024年3月11日):1.左侧乳腺腺体分布欠均匀,糖代谢轻度增高,符合乳腺癌治疗后改变,病灶摄取范围较前减小、摄取程度较前减低;左侧乳腺皮肤(包括左乳头)及左侧胸大肌病灶较前缩小,摄取程度较前减低;原右侧乳腺外下象限结节大致同前;右乳钙化灶。2.原双侧腋窝、左侧胸肌间、左侧颈部Ⅳ/Ⅴ区多发淋巴结较前明显减少、缩小,部分显示不清,摄取程度较前减低,呈治疗后改变。3.骨质疏松症;中轴骨、骨盆骨及所见四肢骨骨髓糖代谢增高,考虑反应性改变合并肿瘤骨髓浸润可能,建议ECT随诊。4.鼻中隔偏曲;拟左侧蝶窦炎症;鼻咽左侧咽隐窝糖代谢增高,黏膜未见明显增厚,多考虑炎性病变,必要时内镜进一步检查;甲状腺双侧叶肿大,密度欠均匀,考虑结节性甲状腺肿,请结合超声检查综合评估;双侧颈部Ⅱ/Ⅲ区及右侧颈部Ⅴ区多发淋巴结,较前缩小,多考虑炎性/反应性增生,请随诊复查。5.双肺多发微小结节,考虑良性结节,建议随诊复查;双肺少许散在纤维灶;主动脉及冠状动脉粥样硬化;右侧胸壁输液港置入术后改变。6.胆囊底部壁结节,多考虑良性病变(胆囊腺肌症可能);胆囊结石;双侧输卵管结扎术后改变;胸10椎体高密度灶,建议随诊复查;拟右侧第8后肋骨岛同前;右侧第11后肋陈旧性骨折。7.余体部PET/CT影像未见明确结构及糖代谢异常。
血常规(2023年8月25日):WBC 4.36×10 9/L,NEU 2.45×10 9/L,HGB 75.0 g/L,PLT 182.0×10 9/L。
血常规(2023年10月18日):WBC 5.73×10 9/L,NEU 4.28×10 9/L,HGB 69.0 g/L,PLT 123.0×10 9/L。
血常规(2023年12月26日):WBC 6.84×10 9/L,NEU 5.37×10 9/L,HGB 59.0 g/L,PLT 88.0×10 9/L。
血常规(2024年1月2日):WBC 11.21×10 9/L,NEU 10.50×10 9/L,HGB 61.0 g/L,PLT 63.0×10 9/L。
血常规(2024年2月18日):WBC 4.5×10 9/L,NEU 2.92×10 9/L,HGB 94.0 g/L,PLT 165.0×10 9/L。
诊断与鉴别诊断
诊断:1.乳腺中央部恶性肿瘤,左侧乳腺浸润性小叶癌(cT 4N 3M 1 Ⅳ期luminal B1型);2.骨髓继发恶性肿瘤;3.腋窝淋巴结继发恶性肿瘤(右侧);4.中度贫血;5.高血压病;6.2型糖尿病;7.重度骨质疏松。
病理活检诊断明确,无需鉴别。
治疗
入院后患者于血液科完善相关检查,并行骨髓穿刺送病理学检查证实为骨髓转移,且为乳腺来源,会诊后转入我科进一步治疗。于我科行左侧乳腺肿物穿刺活检术,病理证实为浸润性小叶癌。行双侧腋窝淋巴结穿刺活检术,病理证实为转移癌。结合患者其他检查及PET/CT检查结果,临床分期为cT 4N 3M 1 Ⅳ期luminal B1型。经过多学科诊疗,综合考虑患者基础疾病、年龄、疾病状态、一般体力状态、身体机能评估结果,考虑患者骨髓转移为内脏危象,如不及时控制极可能丧失治疗机会,因此和患者充分沟通后拟行姑息性化疗。患者于2023年9月8日至2024年2月19日期间,共完成了8个疗程的姑息性治疗,方案为EC-T(具体用药:多柔比星脂质体60 mg+环磷酰胺0.9 g×4序贯注射用紫杉醇白蛋白结合型400 mg×4)。由于患者本身存在骨髓转移,考虑到患者骨髓造血功能受损,因此我们在整个治疗期间密切监测患者的血常规,并在整个化疗期间我们使用硫培非格司亭进行一级预防。患者在治疗期间,我们发现经过硫培非格司亭进行一级预防后,患者仅出现过Ⅰ度白细胞减少,经过短效的粒细胞刺激因子补充治疗后均可升至正常,并没有出现因白细胞减少引起相关的粒缺性发热、延误治疗甚至威胁生命等情况。而更值得关注的是患者的"最初症状"贫血,虽然在治疗期间对患者积极地补充铁剂、叶酸等红细胞生成的原料,以及中成药如生血宝等药物的辅助治疗,但是患者的血红蛋白仍在治疗期间出现缓慢下降。尤其是患者在前几个疗程化疗期间,其复查血常规最低曾达到重度贫血的标准。针对这位患者的处理方法是输注红细胞,在达到内科输血指征后(即血红蛋白<70.0 g/L,患者有明显的头晕乏力等临床症状)即对患者进行多次输血治疗。在前几次化疗住院期间曾对患者分别输注4次去白悬浮红细胞2~3 U,患者输血过程耐受,曾出现输液反应在予以对症处理后好转,并且经过输血后患者的血红蛋白可以维持,且可耐受下一疗程的姑息性化疗。另外,对于血小板的管理,患者在1~8个疗程姑息性化疗期间,仅在第6个疗程(使用白蛋白紫杉醇)期间出现1~2度的血小板减少,血小板计数最低为63.0 ×10 9/L,经白介素11+rhTPO联合治疗后,患者血小板计数恢复至正常,未产生不良后果。
治疗结果、随访及转归
患者经姑息性化疗后进行疗效评价为cPR,但复查PET/CT及再次骨髓活检仍见骨髓转移迹象,结合目前指南的推荐以及上级医院专家会诊意见,患者目前接受DS-8201的维持治疗,耐受良好,目前仍在积极治疗中。
讨论
乳腺癌已经成为全球女性发病率第一位的恶性肿瘤。晚期乳腺癌可以转移到身体的任何部位,常见的转移部位有骨、肺、肝、颅脑等器官,而骨髓转移报道较少。骨髓转移早期因没有明显的临床表现被忽视,而后期常以贫血、血小板减少、骨痛等症状而被发现。骨髓穿刺活检证实癌细胞转移是骨髓转移诊断的金标准,而PET/CT可以通过检测局部葡萄糖代谢活性的变化,在骨髓结构变化之前更早地发现转移病灶,有研究证实其敏感度高达90%,可作为更早诊断骨髓转移的一个有效的检查手段 [ 6 ]。
以往的理念认为乳腺癌合并骨髓转移的患者存在一定的化疗禁忌,因为骨髓作为一个重要的造血器官,受到癌细胞的侵犯必然使其造血功能受到影响,属内脏危象的一类。如化疗进一步引起骨髓抑制加重,并且无有效手段促进其恢复,甚至进展至衰竭阶段,会加速患者的死亡。因此既往相当一部分患者仅接受对症支持治疗,而缺乏化疗等抗肿瘤的治疗措施。以往的报道也证实了这部分病人最终的生存时间也较短。孙君重等 [ 1 ]针对62例乳腺癌伴骨髓转移的病例进行回顾性分析,结果显示未接受化疗者(13例)的中位生存期仅1个月,而联合化疗组(24例)与单药化疗组(25例)的中位生存时间分别为10个月和16个月。近期的研究更倾向于骨髓转移患者如无禁忌更应积极地在病程的早期接受化疗,因为其预后差,进展迅速,内分泌治疗无效可能导致患者失去化疗的时机。而最佳的化疗方案的选择尚无统一定论。有研究报道,乳腺癌骨髓转移患者接受联合化疗和单药化疗的疗效相当,但单药组患者的OS显著延长 [ 7 ]。因此选择化疗方案时应综合患者基础疾病、体能状态评分、肿瘤负荷、分子分型、预期寿命等多种因素适当选择,如骨髓功能明显受抑制的患者更倾向于单药化疗。
化疗最常见的不良反应是骨髓抑制,尤其是中重度的骨髓抑制,如重度贫血、血小板减少、粒细胞缺乏、粒缺性发热等严重的不良反应,如不及时处理严重者可威胁患者的生命。因此乳腺癌骨髓转移的患者接受化疗,更要密切地关注患者的骨髓功能,并且针对患者骨髓的目前功能状态、血常规提示的三系状况,积极地予以预防管理措施。根据FN(粒细胞减少性发热)的风险分级及合并症的评估,骨髓转移的患者推荐接受一级预防。此例患者我们在全程治疗的过程中使用硫培非格司亭进行一级预防。硫培非格司亭是聚乙二醇重组人粒细胞刺激因子(PEG-rhG-CSF),其作用机制是G-CSF与造血细胞的表面受体结合后,作用于粒系祖细胞,刺激粒细胞系统增殖、分化成熟和粒细胞功能的活化。与重组人粒细胞集落刺激因子(rhG-CSF)相比,PEG-rhG-CSF能够降低血浆清除率,延长半衰期并增加疗效。通过一级预防升白细胞的处理,本例患者接受8个疗程的化疗过程中,仅出现过Ⅰ度的白细胞减少,且经过短效G-CSF的治疗后可升至正常。目前指南对于化疗相关性贫血(CRA)主要的治疗推荐是EPO和输血。输注红细胞或全血可以快速提升血红蛋白,是治疗CRA最有效的手段之一,但因其存在一定的副作用如获得性传染病风险、输血反应、过敏反应、溶血反应等多种并发症,指南严禁滥用,并推荐HB<60 g/L时建议输血。而这例患者在化疗期间,结合其血红蛋白和临床症状,如有头晕乏力等明显的临床表现,输血指征则适当放宽至70 g/L [ 8 ]。经过治疗期间多次输血治疗,患者头晕乏力的症状逐渐好转,而且后期患者无需输血血红蛋白亦可维持在一个理想的水平,这也证实了有效的化疗可以逆转骨髓转移患者的骨髓功能。同样目前治疗化疗引起的血小板减少的主要方法有输注血小板以及使用促血小板生成因子两大类。此例患者在化疗期间仅有1次出现了Ⅰ~Ⅱ的血小板减少,最低为63.0×10 9/L,经白介素11+rhTPO联合治疗后,患者血小板计数恢复至正常,无需输注血小板。
在治疗整体有效的前提下,患者的骨髓功能似乎也在逐渐好转,后续几个疗程患者的贫血症状明显好转,在不需要输血的维持下患者的血常规可恢复至轻度贫血甚至达到正常范围。由此可见,化疗带来的风险和获益是把双刃剑,虽然此例患者病情重并且存在骨髓转移的内脏危象,但是良好的化疗期间病情管理可以有效地减少严重不良反应的发生,让患者能更多地在化疗中获益。通过回顾此例患者治疗经过,启发临床治疗化疗期间应定期监测血常规,以早期识别骨髓抑制。对于轻度的骨髓抑制,可以及时使用升白药物,期间若血常规异常及时就诊。同时此病例也为乳腺癌骨髓转移患者化疗期间骨髓抑制的管理提供了很好的临床经验。随着升白细胞、血小板等辅助治疗药物的更新发展,"重在预防"的管理理念逐步为临床所重视,而且又有红细胞、血小板等血液制品的保驾护航,也为未来针对此类病情重的患者提供了更多治疗的信心和新选择。
[1]孙君重,江泽飞,宋三泰,等. 乳腺癌骨髓转移特点及治疗方法探讨[J]. 中华骨肿瘤骨病, 2020,9(3) :223-226.
[2]Pahouja G , Wesolowski R , Reinbolt R ,et al. Stabilization of bone marrow infiltration by metastatic breast cancer with continuous doxorubicin[J]. Cancer Treat Commun, 2015,3:28-32. DOI: 10.1016/j.ctrc.2014.11.002 .
[3]王雯邈,徐兵河,王佳玉,等. 乳腺癌骨髓转移伴重度骨髓抑制治疗后长期生存一例并文献回顾[J]. 中国肿瘤临床与康复, 2012,19(1) :75-77.
[4]Ballot J , McDonnell D , Crown J . Successful treatment of thrombocytopenia due to marrow metastases of breast cancer with weekly docetaxel[J]. J Natl Cancer Inst, 2003,95(11):831-832. DOI: 10.1093/jnci/95.11.831-a .
[5]Bjelicradisic V , Stöger H , Winter R ,et al. Long-term control of bone marrow carcinosis and severe thrombocytopenia with standard-dose chemotherapy in a breast cancer patient: a case report[J]. Anticancer Res, 2006,26(2B):1627-1630.
[6]Miller JA , Pappan K , Thompson PA ,et al. Plasma metabolomic profiles of breast cancer patients after short-term limonene intervention[J]. Cancer Prev Res (Phila), 2015,8(1):86-93.
[7]Dodiya HG , Brahmbhatt AP , Khatri PK ,et al. Neoadjuvant chemotherapy in patients with locally advanced breast cancer: a pilot-observational study[J]. J Cancer Res Ther, 2015,11(3):612-616.
[8]中国抗癌协会乳腺癌专 业委员会 ,中华医学会肿瘤学分会乳腺肿瘤学组,邵志敏. 中国抗癌协会乳腺癌诊治指南与规范(2024年版)[J]. 中国癌症杂志, 2023,33(12) :1092-1186. DOI: 10.19401/j.cnki.1007-3639.2023.12.004 .
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


