文献解读101期,一个新阶段的开始,大家都发现了一个潜在的危机,有些重要的数据库,已经不对中国学者开放,研学社使用的pubmed,目前仍可以正常检索,但未来情况如何,并不知晓。这个现象已经非常明确的告知,国人必须、尽快、全力地建设中国人自己的生命与科学数据库,非常急迫!又到劳动节,恰逢小长假,研学社祝大家节日快乐、假期愉快!
本期GIST月评检索了来自Pubmed 2025.03.26-2025.04.25的GIST相关文献,排除仅发表英文摘要与非英文论文,共42篇,其中中国学者发表论文14篇。南京医科大学附属医院徐皓教授团队发表身体指标预测伊马替尼治疗疗效文章,表示祝贺。本期选择11篇文献进行解读,31篇文献进行列表,其中伊马替尼与瑞戈非尼一线交替使用的研究正式发表,多篇基础与病理研究值得大家关注,化疗联合免疫治疗SDH缺陷型GIST个案带来新的信息!
本期文献月评检索与标题首页排版编辑得到再鼎医学GI团队协助完成,并感谢范雯霏女士文字排版与刘丹博士的校审。
基础研究版块
1. AT101通过靶向YAP/TAZ-CCND1和FBXW7–MCL1轴抑制GIST生长并促进凋亡⭐️ ⭐️ ⭐️
AT101 Suppresses Gastrointestinal Stromal Tumor Growth and Promotes Apoptosis via YAP/TAZ–CCND1 and FBXW7–MCL1 Axes

【摘要】:
背景:酪氨酸激酶抑制剂(TKI)伊马替尼(IM)是胃肠道间质瘤(GISTs)患者的一线治疗方法。然而,大多数 GIST 患者因继发 KIT 突变诱导了获得性耐药,从而限制了IM的疗效。此外,研究已明确,KIT非依赖型GIST对靶向KIT/PDGFRA的小分子抑制剂展示出强耐药,新的挑战随之而来。因此,迫切需要研究伊马替尼耐药GIST的潜在治疗靶点。
患者与方法:该研究运用了IM耐药前后的细胞系和IM治疗前后的GIST患者组织样本,开展了体外实验和体内实验,对FBXW7-MCL1轴和 YAP/TAZ-CCND1通路进行了分析。
结果:在IM 耐药GIST细胞和IM治疗后GIST样本中,MCL1表达上调且 YAP/TAZ-CCND1 通路激活。AT101,一种 BCL-2抑制剂,通过抑制GIST细胞MCL1过表达发挥促凋亡作用,并且 AT101联合IM通过调节由FBXW7-MCL1 轴调控的IM活性发挥更强的促凋亡作用。此外,在小鼠移植瘤和转移模型中,证实了AT101通过靶向YAP/TAZ-CCND1通路抑制 GIST 的生长和转移。值得注意的是,不管GIST细胞对IM的敏感性如何,AT101均具有抑瘤活性,在GIST-T1和IM耐药GIST 细胞中,AT101均能增强和恢复IM活性。
结论:AT101既可以靶向FBXW7-MCL1轴又可以靶向YAP/TAZ-CCND1通路发挥强大的抗肿瘤活性,这表明AT101单药或联合IM值得未来开展临床试验探索。
原单位:北京大学肿瘤医院;
现单位:北京大学深圳医院
高静研究员
【简评】:
通读完该文,没着急去点评该文章的核心轴线及优劣,第一时间在网上搜了下BCL-2抑制剂的获批上市情况,毕竟印象中,关于细胞凋亡了解的很多,认识时间也很长,但靶向凋亡相关分子的药物研发不是太顺。果然,目前肿瘤领域获批上市的BCL-2抑制剂只有一个,获批在临床试验阶段的有几个,但关于BCL-2抑制剂研发仍然以血液系统肿瘤为主。再联系上该文的结果,我又要怀疑GIST与白血病在前世是一家了,伊马替尼架起了白血病和GIST中的第一座桥梁,难不成BCL-2抑制剂很有可能是第二座?回到该文,虽然发表的杂志影响因子不高,虽然结果都很容易理解(如上,所以不需点评过多),虽然也就用了一对细胞系和少量样本验证,但AT101的确展示了一定的抑瘤活性,尤其在IM耐药细胞中,联合IM具有很强的协同抑瘤,的确值得后续深入探索,当然在毒副作用可控前提下。
2. SLC25A11,一个与Carney-Stratakis综合征相关的新基因 ⭐️ ⭐️ ⭐️
SLC25A11, a Novel Gene Associated With Carney-Stratakis Syndrome

【摘要】:
背景:Carney-Stratakis综合征(CSS)是一种以副神经节瘤和/或嗜铬细胞瘤(PPGL)及胃肠间质瘤(GIST)为特征的罕见综合征,通常由琥珀酸脱氢酶亚单位(SDHB、SDHC、SDHD)的胚系杂合致病性变异引起。
方法:对一例59岁女性CSS(左侧嗜铬细胞瘤9 cm,副神经节瘤4.8 cm,GIST 9.3 cm)分别进行组织学、遗传学和功能分析。采用全外显子组测序(WES)对胚系DNA与肿瘤DNA进行配对比较。
结果:WES在线粒体2-酮戊二酸/苹果酸载体基因(SLC25A11)中发现了一个罕见的胚系变异(c.293G>A/p.Arg98His)。该变异位于SLC25A11线粒体载体结构域的高度保守残基中,生物信息学预测为有害变异(REVEL评分=0.81)。嗜铬细胞瘤、副神经节瘤和GIST中均未检出以前报道的与这些肿瘤相关基因的体细胞致病性变异。与来自cluster 1型 (SDHB/SDHD/VHL,1.39±0.45;P=0.0229)和cluster 2型(RET/TMEM127,1.79±0.71;P=0.0154)的肿瘤相比,SLC25A11在这名具有SLC25A11基因c.293G>A胚系变异的患者的肿瘤组织中表达更低(0.69±0.003)。与mRNA表达结果一致,这名患者的嗜铬细胞瘤和副神经节瘤中SLC25A11的蛋白水平明显低于其他肿瘤。5-羟甲基胞嘧啶在这名患者3种肿瘤中均染色阴性,提示尽管SDHB表达水平正常,但与cluster 1A型相似,这3种肿瘤均具有DNA高甲基化的特征。然而,全基因组拷贝数变异分析未发现SLC25A11位点的杂合性缺失。
结论:SLC25A11在肿瘤中的表达缺失、缺乏体细胞驱动变异以及高甲基化状态强烈支持SLC25A11在CSS发病中的作用。
天津肿瘤医院病理科
孙燕教授
【简评】:
Carney-Stratakis综合征(CSS)常表现为嗜铬细胞瘤和/或副神经节瘤(PPGL)与胃肠间质瘤(GIST)并存,多发生于儿童和青少年时期,常由琥珀酸脱氢酶亚单位的胚系杂合性功能丧失性致病变异引起。该研究中的患者没有出现肺软骨瘤,排除了Carney三联征的可能性。此外,KIT和PDGFRA基因未检出致病性体细胞变异,也排除了与多发性PPGL相关的散发性GIST的假设。该患者出现了这3种肿瘤,临床上符合CSS,但3种肿瘤均缺乏SDHx致病性变异或SDHB/SDHD/SDHC基因缺失。作者通过WES,证实该患者的3种肿瘤均存在SLC25A11的胚系变异(c.293G>A/p.Arg98His),该变异导致肿瘤组织中SLC25A11的mRNA和蛋白水平显著降低,表现出类似于SDH突变肿瘤的高甲基化状态,因此提出SLC25A11是一个与Carney-Stratakis综合征相关的新基因。该研究不仅初步探索了SLC25A11胚系突变在CSS发病中的作用,丰富了我们对于CSS发生机制的认知;而且提醒我们:由于遗传多样性,Carney-Stratakis综合征可能并不具有典型的SDHx胚系变异。如果临床不能排除CSS的可能性,即使未检出SDHx胚系变异,需要通过胚系和体系的WES、甲基化检测等多种检测手段,对肿瘤的基因特点进行全面综合的分析。
3. 胃肠间质瘤中基因组DNA甲基化与拷贝数变异的研究 ⭐️ ⭐️ ⭐️
Genome-Wide DNA Methylation and Copy Number Alterations in Gastrointestinal Stromal Tumors

【摘要】:
本研究旨在探索全基因组DNA甲基化与拷贝数变异(CNV)作为胃肠道间质瘤风险分层的补充工具。研究纳入28例未经伊马替尼治疗的原发性GIST患者(15例无进展,13例进展),通过Illumina甲基化芯片分析全基因组甲基化模式,并结合CNV分析评估其预后价值。结果显示,GIST的甲基化模式与肿瘤解剖位置(胃、小肠等)和基因型(KIT、PDGFRA、SDH缺陷)相关;进展性胃GIST中鉴定出6个基因(如CLCN3、TNXB)的8个差异甲基化区域。进展性GIST的CNV数量显著高于低风险病例,且染色体1p、14q、15q等区域的缺失在进展性病例中更为常见。例如一例低风险但术后转移的GIST(病例16)表现出复杂的CNV谱(包括*CDKN2A/B*纯合缺失),提示分子特征可能优于传统病理分级。
北京大学肿瘤医院
消化肿瘤内科 章程教授
【简评】:
该研究联合了全基因组甲基化和CNV分析,揭示了两者在在GIST肿瘤异质性和进展中的协同作用,例如甲基化模式反映解剖位置特异性,而CNV负荷与临床侵袭性直接相关。研究通过甲基化分类器模型验证GIST分子分型,有望为未来临床应用提供参考。该研究提出了结合甲基化和CNV分析可改善现有风险分层标准不足的新思路,适用于传统低风险、但实际进展的病例。
但本研究也存在一些不足之处。研究受到样本量限制,仅纳入28例样本,其中进展组13例,尤其是胃GIST亚组分析仅3例进展病例,统计效力不足,可能影响结果的可靠性。此外,部分病例随访时间差异较大,且未明确是否混杂治疗(如伊马替尼)对甲基化或CNV的影响,肿瘤的临床异质性可能对结果产生较大干扰。在技术方面,甲基化芯片无法覆盖非CpG岛区域,且CNV分析依赖芯片探针密度,可能遗漏复杂结构变异。此外尽管作者发现多个差异甲基化基因(如CLCN3、TNXB),但未通过功能实验验证基因表达或蛋白水平的生物学意义,难以确认甲基化与肿瘤表型的因果关系。
病理版块
1. 肉瘤中检测NTRK融合的实践指南:现状和诊断挑战⭐️⭐️⭐️
Practical Guidance on the Detection of NTRK Fusions in Sarcomas: Current Status and Diagnostic Challenges

【摘要】:
肉瘤是一组类罕见且具有异质性的间叶源性恶性肿瘤,在欧洲,约占所有成人癌症的1%和儿童实体瘤的20%。随着技术进步,人们能够更准确、高效地描绘出不同肉瘤亚型发病机制背后的分子机制,并发现了具有预后/预测生物标志物的新型的潜在治疗靶点,尤其是神经营养酪氨酸受体激酶(NTRK)基因融合。最近,NTRK 融合检测已成为不可切除的局部晚期或转移性癌症患者治疗管理的标准组成部分,并在多种肿瘤类型中被检出。在较为常见的成人和儿童肉瘤中,NTRK融合的发生率分别为1%和20%,而在某些罕见亚型中则超过90%。研究发现,第一代TRK抑制剂对TRK活性的抑制在成人和儿童患者中均显示出良好疗效且耐受性良好,且不受肿瘤类型限制。总体而言,这些患者的临床获益足以弥补NTRK基因融合检测的技术挑战。然而,NTRK基因融合的罕见性和诊断的复杂性给临床医生带来了诸多问题和挑战。为此,由肿瘤内科、小儿肿瘤科、放射科、外科、骨科和病理医生组成的专家委员会通过文献综述和专题讨论,并提出了NTRK融合肉瘤的诊断流程和策略。本文旨在汇总该领域最新进展,并为软组织肉瘤、婴幼儿纤维肉瘤、胃肠间质瘤和骨肉瘤患者的最佳治疗管理提供专家建议和实用指导。
复旦大学附属肿瘤医院
病理科 喻林副主任医师
【简评】:
神经营养酪氨酸受体激酶(NTRK)基因是近年来备受瞩目的泛癌种罕见钻石靶点,包含 NTRK1、NTRK2 和 NTRK3 三个成员,分别编码TRKA、TRKB和TRKC蛋白。NTRK 基因融合整体发生率约 0.3%,在肺癌、乳腺癌、肠癌等常见肿瘤中发生率约 0.2%;而在乳腺分泌性癌、涎腺分泌性癌、婴幼儿纤维肉瘤及先天性中胚层肾瘤等罕见肿瘤中,其发生率常超过 90%,呈现“小瘤种高突变,大瘤种低突变” 的显著特征。此外,NTRK融合伴侣基因种类繁多,超过80种,其中ETV6、TPM3、LMNA 和 TPR是最常见的4个伴侣基因。第一代TRK抑制剂拉罗替尼和恩曲替尼,在儿童及成人 NTRK 融合实体瘤治疗中展现出卓越疗效与良好耐受性。2022年拉罗替尼和恩曲替尼被国家药品监督管理局获批上市,恩曲替尼并纳入医保,这标志着泛癌种广谱治疗新时代的开启。如今,NTRK 融合基因检测已成为不可切除的局部晚期或转移性癌症患者诊疗过程中的关键环节,助力更多患者从 TRK 抑制剂治疗中获益。
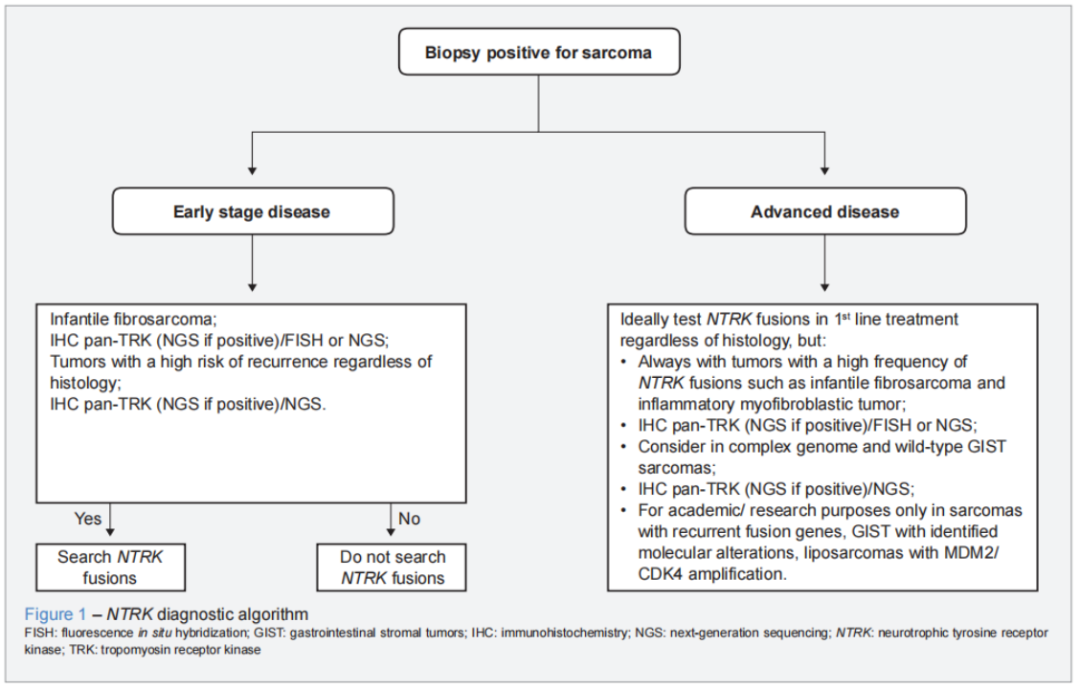
在软组织肉瘤领域,NTRK 融合总体发生率不足 1%。婴幼儿纤维肉瘤和 NTRK 重排梭形细胞肿瘤属于高频融合类型,融合率分别高达 > 90% 和 100%,而胃肠间质瘤(GIST,<5%)与骨肉瘤(<0.5%)中的融合率极低。ESMO工作组提出了关于NTRK基因融合检测的建议,国内也已发布《中国实体瘤NTRK基因融合临床诊疗专家共识》检测推荐,但针对肉瘤的 NTRK 融合检测,此前尚无专门的临床指南或推荐。葡萄牙 MDT 专家团队提出的指南填补了这一空白。该指南聚焦肉瘤中的 NTRK 融合检测,系统回顾了 NTRK 融合在软组织肉瘤、婴幼儿纤维肉瘤、胃肠间质瘤和骨肉瘤中的分布特征与检测难点,并对免疫组化(IHC)、逆转录聚合酶链反应(RT-PCR)、荧光原位杂交(FISH)、基于 DNA 和 RNA 的下一代测序(NGS)及 NanoString nCounter等常用检测技术的优缺点进行了对比分析,为临床医生选择合适检测方法提供了有力参考。指南明确推荐,基于 RNA的NGS仍是检测肉瘤NTRK基因融合的 “金标准”,同时提出IHC检测 panTRK(克隆号 EPR17341)初筛联合NGS 确认的高效检测流程,兼顾准确性与经济性。此外,该指南还制定了契合真实世界临床实践的肉瘤 NTRK 融合检测策略及流程(详见下图),充分考量肿瘤分期、组织学类型和融合频率等要素,具备极高的临床应用价值。
不过,当前肉瘤中 NTRK 融合检测仍面临诸多挑战,包括检测技术的固有局限、遗传变异的复杂特性,以及患者药物可及性受限等问题。未来,需持续优化检测技术与流程,整合临床检测数据与治疗经验,科学制定筛查和检测策略,从而推动精准诊疗理念在临床实践中的深入应用与落地。
2. 识别和管理胃肠道间质瘤的罕见亚型⭐️ ⭐️ ⭐️
Identifying and managing rare subtypes of gastrointestinal stromal tumors

【正文背景】:
胃肠道间质瘤(GIST)是起源于胃肠道间叶组织的罕见肿瘤,约80%的病例由KIT或PDGFRA基因突变驱动,但仍有15%的病例缺乏这些突变(即KIT/PDGFRA野生型GIST)。这类野生型GIST具有高度异质性,包括SDH缺陷型、RAS/RAF通路突变型、四重野生型(Quadruple WT)以及综合征相关亚型。本文系统性综述了这些罕见亚型的分子机制、临床特征及治疗策略,并探讨了当前研究的挑战与未来方向。在临床管理方面,文章提出多学科协作与患者管理中心的重要性,并汇总了针对不同亚型的临床试验(如HIF-2α抑制剂Belzutifan、奥雷巴替尼等),同时指出手术仍是局部病变的主要治疗手段。
福建协和医院胃肠外科
周永建教授
【述评】:
1、文章覆盖了罕见GIST亚型的所有主要类别,从分子机制到临床管理逐一解析,尤其是对SDH缺陷型GIST的代谢异常和表观遗传调控机制阐述清晰,为靶向治疗提供了理论依据。
2、文章结合最新临床试验数据(如NCT04924075中Belzutifan的应用),为临床医生提供了治疗选择的参考,并强调多中心协作的必要性,具有现实指导意义。
3、该研究也有不足之处,首先是虽然列举了多项临床试验,但缺乏对不同治疗方案疗效的横向比较(如奥雷巴替尼与瑞戈非尼在SDH缺陷型中的优劣),临床决策参考价值受限。其次文中引用的某些临床数据(如替莫唑胺单药疗效)基于小样本研究或个案报告,需更多III期试验支持。
3. 位于十二指肠、空肠与回肠的小肠肿瘤的生存结果分析 ⭐️ ⭐️ ⭐️
Survival outcomes in small intestine tumors: The role of duodenum, jejunum, and ileum

【摘要】:
小肠肿瘤较为罕见,其预后因素复杂多样,而肿瘤位置对生存结局的影响仍存在争议。本研究探讨了肿瘤位置(十二指肠、空肠、回肠)对生存的影响。我们分析了2010年至2017年SEER数据库中诊断为小肠肿瘤的患者数据,通过Kaplan-Meier法和竞争风险模型评估不同部位的生存差异,并按腺癌(ADC)、神经内分泌肿瘤(NET)和胃肠间质瘤(GIST)分层分析。采用倾向性评分匹配(PSM)校正混杂因素。研究共纳入6047例患者:2611例十二指肠肿瘤、2584例回肠肿瘤和852例空肠肿瘤。ADC在十二指肠最常见(51.4%),而NET多见于回肠(84.21%)。总体而言,回肠肿瘤预后最佳,十二指肠肿瘤预后最差(p <0.001)。在ADC中,十二指肠肿瘤的总生存期(OS)和疾病特异性生存期(DSS)最差(p <0.001),而GIST的预后与位置无关(p >0.05)。竞争风险模型显示,ADC中空肠肿瘤的预后优于十二指肠(HR=0.80, p=0.048),而回肠与十二指肠的风险相似(HR=0.99, p=0.94);GIST和NET的预后则不受位置影响(p >0.05)。PSM后生存曲线再次证实,十二指肠与回肠ADC的生存差异不显著(p >0.05)。结论:肿瘤位置显著影响小肠腺癌的预后,其中十二指肠肿瘤结局最差;而位置对GIST和NET的预后无显著影响。
解放军总医院第一医学中心
普外科医学部 吴欣教授
【简评】:
本研究通过大样本数据揭示了小肠肿瘤预后的异质性,具有重要临床价值。对于腺癌,十二指肠因解剖复杂、手术难度高及淋巴转移早发,预后显著劣于回肠/空肠,提示临床需优先优化该部位的多学科诊疗(如新辅助治疗或扩大淋巴结清扫)。而GIST与NET的预后与位置无关,印证了此类肿瘤以生物学行为(如核分裂象、Ki-67)为主导的诊疗逻辑,避免过度依赖解剖分型,这对个体化治疗策略的制定具有指导意义。但需注意:研究基于SEER数据库,缺乏手术细节(如R0切除率)和分子标志物(如GIST的KIT/PDGFRA突变),可能遗漏关键预后因素。未来需整合基因组学与治疗反应数据,构建更精准的预测模型。此外,十二指肠腺癌的高危性提示需探索靶向治疗(如HER2/Claudin18.2)或免疫微环境干预的可能性,而不仅是强化传统手术。总之,该研究为小肠肿瘤的临床分层管理提供了循证依据,但需结合分子分型及多中心数据完善结论,最终推动从“解剖导向”到“生物学导向”的诊疗模式转型。
药物版块
1. 伊马替尼与瑞戈非尼交替使用对比单独使用伊马替尼一线治疗晚期胃肠间质瘤:AGITG ALT-GIST组间随机II期试验 ⭐️ ⭐️ ⭐️ ⭐️
Imatinib alternating with regorafenib compared to imatinib alone for the first-line treatment of advanced gastrointestinal stromal tumor: The AGITG ALT-GIST intergroup randomized phase II trial

【摘要】:
背景:旨在评估酪氨酸激酶抑制剂伊马替尼和瑞戈非尼交替给药方案对晚期胃肠道间质瘤(GIST)患者预后的改善效果。
方法:ALTGIST研究(NCT02365441)是一项随机II期临床试验,将标准伊马替尼治疗(A组)与实验性伊马替尼-瑞戈非尼交替给药方案(B组)进行对比。主要终点为9个月时的最佳客观肿瘤缓解率(OTR)。
结果:76例符合条件患者(A组36例,B组40例)纳入分析。中位随访时间46.0个月(范围6.5-64.6)。9个月时两组最佳缓解和OTR无显著差异。A组18例(50.0%)与B组12例(30.0%)患者因疾病进展终止治疗。A组无患者因不可耐受毒性退出,B组12例(30.0%)因此终止治疗。A组12例(33.2%)与B组12例(30.0%)报告至少1次严重不良事件(多为3级)。次要终点1年无进展生存期(PFS)和总生存期(OS无统计学差异。
结论:伊马替尼与瑞戈非尼交替给药方案未改善9个月客观缓解率及次要终点PFS、OS。交替治疗组患者毒性反应及方案终止率更高。
临床试验注册号:NCT02365441
四川大学华西医院
胃肠外科 张波教授
【解读】:
这项国际多中心、随机、开放标签的II期临床试验(ALT-GIST, NCT02365441)比较了标准连续伊马替尼治疗(A组)与伊马替尼-瑞戈非尼交替治疗(B组)用于晚期GIST一线治疗的疗效和安全性。在本研究中:
1. 疗效终点未达预期: 研究的主要终点是治疗9个月时的客观缓解率(OTR)。结果显示,两组在9个月时的OTR非常相似(A组 61.1% vs B组 60.0%),没有统计学差异。这表明交替方案并未带来更高的肿瘤缓解。此外,包括1年无进展生存(PFS)率(A组 83.3% vs B组 87.5%)、1年总生存(OS)率(A组 97.2% vs B组 97.5%)、中位PFS(A组 37.0月 vs B组 36.7月)以及更新至4年的PFS和OS数据,两组之间均未显示出统计学上的显著差异。
2. 毒性增加,耐受性降低: 交替治疗组(B组)经历了更严重的毒副反应。B组发生3/4级不良事件的比例(57.5% vs 44.4%)、需要剂量调整的比例(62.5% vs 30.5%)以及因不可耐受毒性而停止治疗的比例(30% vs 0%)均显著高于标准伊马替尼组。B组常见的严重不良事件包括手足皮肤反应和高血压,这与瑞戈非尼的已知毒性一致。
3. 亚组分析未见明确获益: 根据KIT外显子11突变状态等进行的亚组分析,也未能证明交替方案在特定人群中有优势。
ALT-GIST研究结果表明,一线交替使用伊马替尼和瑞戈非尼的策略未能达到改善疗效(OTR、PFS、OS)的预期目标。其背后的理论假设——即通过药物轮换和洗脱期来克服或延缓耐药——在本次临床实践中未能得到证实。
在本研究中交替方案不仅没有带来疗效上的获益,反而显著增加了治疗的毒性和复杂性,导致患者耐受性下降,甚至有30%的患者因此停止了方案治疗。这在临床实践中是不可接受的。该研究结果进一步巩固了连续口服伊马替尼作为晚期GIST患者(转移性非 D842V 突变 GIST)一线标准治疗的地位。对于该类患者,伊马替尼本身已具有很高的初始活性,在此基础上增加其他药物(尤其是毒性较大的药物)可能弊大于利。
由于入组速度慢和资金问题,研究提前终止,样本量小于最初计划,这限制了检测较小疗效差异的统计学效力。但考虑到主要终点和次要终点均无获益趋势,且毒性显著增加,即使样本量更大,得出阳性结论的可能性也极低。
综上,在一线治疗晚期GIST时,伊马替尼与瑞戈非尼交替给药的方案相比于标准连续伊马替尼治疗,既不能提高客观缓解率,也不能改善生存结局,反而显著增加了治疗毒性和中断风险。因此,不推荐采用该交替策略。临床医生应继续遵循指南,将连续伊马替尼作为大多数晚期GIST患者的一线标准治疗选择。
2. 使用身体成分预测伊马替尼治疗胃肠间质瘤患者的治疗相关不良事件和无病生存期:一项回顾性队列研究 ⭐️ ⭐️ ⭐️
Using body composition to predict treatment-related adverse events and disease-free survival in patients with gastrointestinal stromal tumors treated with imatinib: a retrospective cohort study

【摘要】:
背景:伊马替尼(IM)是胃肠道间质瘤(GIST)的主要治疗药物,但其面临着耐药性和高不良事件发生率的严峻挑战。本研究旨在评估基线身体成分参数对接受伊马替尼治疗的GIST患者治疗相关不良事件和无病生存期(DFS)的预测价值。
方法:对南京医科大学第一附属医院2014年至2020年确诊的107例中高危分层GIST患者进行单中心回顾性分析。通过腹部CT影像及临床资料获取患者体成分参数,包括骨骼肌指数(SMI)、肌脂肪变性、恶病质指数(CXI)、无脂肪体重(FFM)等。采用Logistic和COX回归模型分析上述指标与治疗相关不良事件及DFS的关系。
结果:多因素分析显示,肌脂肪变性(OR=7.640,P<0.001)和药物剂量(OR=1.349,P=0.010)是不良事件的独立危险因素,而较高的CXI(OR=0.983,P=0.017)具有保护作用。LAMA/SMA%(OR=1.072,P=0.028)是剂量限制性毒性(DLT)的独立危险因素。肌肉减少症(HR=3.067,P=0.013)、肌脂肪变性(HR=6.985,P=0.024)、风险分层(HR=9.562,高危vs.中危,P=0.003)和C-KIT突变(HR=3.615,C-KIT外显子9突变vs.11突变,P=0.013)是DFS的独立预测因素。
结论:基线体成分参数,尤其是肌脂肪变性,可有效预测伊马替尼治疗患者的不良事件和无病生存期。个性化治疗,例如有针对性的营养和运动干预,以及对肌脂肪变性或肌肉减少症患者的密切监测,可提高依从性并改善生存率。
南京医科大学一附院
胃肠外科 徐皓教授
【简评】:
该研究探索了肌脂肪变性、肌肉减少症和恶病质指数(CXI)等身体成分参数在预测接受伊马替尼治疗的GIST患者不良事件和DFS中的作用。该研究具有临床相关性,提出了一种基于列线图的GIST患者不良事件和DFS的预测模型。模型中将肌脂肪变性确定为预测标志物为世界范围内首例,并通过对其针对性的改善可提高患者生存。这一重要发现为推动胃肠道间质瘤的个体化诊疗体系建设提供了有力支持,具有现实意义。
然而,该研究在方法学设计和结果解读方面仍存在若干值得商榷之处:首先,107名患者的样本量较小且研究的单中心性质限制了研究结果的普适性。选择偏差是不可避免的,未经进一步验证,结果可能不适用于更广泛的患者群体。其次,目前国际上对肌脂肪变性的定义还未统一,目前主要有以下几种定义:(1)肌肉衰减(MA),(2)NAMA/TAMA指数,(3)LAMA/SMA指数。该研究只选取了LAMA/SMA指数作为标准,缺乏对肌脂肪变性和肌肉减少症定义的多种国际共识指标,可能无法涵盖这些病症的全部范围。再者,由于本研究发现肌脂肪变性对于GIST患者的药物并发症和DFS之间存在重要关联,十分有必要开展了一项GIST患者代谢组学的前瞻性研究,通过CT图像选取肌脂肪变性患者,对GIST肿瘤标本以及患者血液进行基因组学、转录组学、蛋白组学测序,以希望能够找到与GIST患者代谢相关的重要分子。总而言之,未来需要通过设计更严谨的多中心、大样本、前瞻性研究,并结合组学分析,进一步验证和优化基于身体成分指标的GIST个体化全程治疗策略。
3. Ozuriftamab vedotin (BA3021) 的临床前开发,一种新型ROR2特异性、有条件活性的生物抗体-药物偶联物 ⭐️ ⭐️ ⭐️
Preclinical development of ozuriftamab vedotin (BA3021), a novel ROR2-specific conditionally active biologic antibody-drug conjugate

【背景介绍】:
受体酪氨酸激酶样孤儿受体(ROR2)可激活经典与非经典wnt通路,促进肿瘤增殖,ROR2在包括黑色素瘤、肾癌、骨肉瘤、GIST、结直肠癌等肿瘤中表达。作者团队开发了一种新型抗体-药物偶联物(ADC),ozuriftamab vedotin(BA3021),它仅在酸性肿瘤微环境中与ROR2结合。在体内,BA3021在人类癌症异种移植物小鼠模型(包括患者来源的异种移植物模型)中具有有效和持久的抗肿瘤活性。在非人灵长类动物中,BA3021在高达10mg/kg的剂量下具有良好的耐受性,并在体内表现出优异的稳定性。这些临床前结果表明,ROR2 ADC是有效且耐受性良好的,可能成为ROR2阳性表达肿瘤患者的一种有前途的治疗方法。
北京大学肿瘤医院
消化肿瘤内科 李健教授
【简评】:
靶向治疗是GIST目前唯一的药物治疗类型,但随着靶向药物的耐药及克服耐药面临的困难,开发更多类型的药物是GIST治疗亟待解决的问题。免疫治疗的微环境壁垒仍未打破,同时,传统的化疗药物对GIST效果不佳,ADC药物是一个可以期待的潜在开发药物选择,虽然诸如DS-6157a因为企业策略停止开发,但类似以ROR2为靶点的多肿瘤阳性表达的ADC药物仍是值得关注的新药,一旦有新型ADC药物获得成功,不仅是单独增加一个新的药物,更可能开创ADC药物与靶向药物联合使用的局面;本篇文章关于GIST的内容不多,但仍可以看到BA3201在GIST PDX模型(GS 11353,具体类型细节没有检索到)中,观察到明显的抑瘤效果。未来我们会密切关注ADC药物在GIST领域的研发,也欢迎对GIST领域感兴趣的ADC研发企业多来骚扰我们。
经典个案
1. 病例报告:化疗和免疫检查点抑制剂治疗转移性琥珀酸脱氢酶缺陷型胃肠间质瘤 ⭐️ ⭐️ ⭐️
Case Report: Metastatic succinate dehydrogenase-deficient gastrointestinal stromal tumor treated with chemotherapy and immune checkpoint inhibitor

【摘要】:
我们报告了一名青年人,患有复发性转移性琥珀酸脱氢酶(SDH)缺陷型胃肠间质瘤(GIST),通过化学免疫治疗方案实现了病理完全缓解。患者接受了胃镜检查,发现胃大弯处有一个大的溃疡肿瘤。组织学分析显示分化差的SDHB缺陷型GIST,PDL1表达率为100%,RET基因融合。胃大部切除术后快速转移复发对伊马替尼耐药。该患者接受了四个周期的顺铂,依托泊苷和帕博利珠单抗治疗,然后接受帕博利珠单抗维持治疗,实现了完全缓解。3年后出现远处复发采用相同的方案治疗,并取得了完全病理缓解。两年后,一个孤立的病灶被移除,病理提示复发性SDH缺陷GIST。帕博利珠单抗仍在维持中,迄今为止没有复发。化学免疫疗法作为复发性转移性SDH缺陷型PDL1阳性GIST患者治疗的一部分的作用值得进一步研究。
中山大学肿瘤医院胃肠外科
邱海波主任医师
【简评】:
这篇病例报告报道了化疗联合免疫治疗(顺铂、依托泊苷与帕博利珠单抗)在转移性SDH缺陷型GIST中的显著疗效,为这一罕见难治亚型提供了重要治疗启示。SDH缺陷型GIST约占所有GIST的10%,以年轻患者、胃部原发、PDGFRA/KIT野生型为特征,对伊马替尼原发耐药且缺乏有效系统治疗手段。本病例中,患者因肿瘤快速进展及PD-L1高表达(100%)接受化疗联合帕博利珠单抗治疗,实现多次病理完全缓解,且维持治疗期间耐受性良好,提示该方案可能通过免疫微环境调控与细胞毒性协同作用突破传统治疗瓶颈。研究亮点在于结合肿瘤生物学特性(低分化、PD-L1高表达)选择治疗方案,并通过长期随访验证了治疗的持久性,为临床决策提供了新思路。然而,作为单病例报告,其结论外推需谨慎。RET基因融合在本例中的驱动作用及与治疗反应的关系尚未阐明,且SDH缺陷型GIST的异质性可能导致不同患者疗效差异。此外,PD-L1表达作为免疫治疗预测标志物在GIST中的阈值及临床意义仍需标准化验证。未来需开展前瞻性临床试验,明确化疗联合免疫治疗在该亚型中的适应人群、最佳序贯策略及分子机制,并探索RET抑制剂等靶向药物的潜在联合价值。尽管存在局限性,本研究为SDH缺陷型GIST的精准治疗开辟了探索方向,强调了综合治疗与分子分型在罕见肿瘤管理中的重要性。
系统综述
1. 胃肠间质瘤的下一个问题:未解决的挑战和未来方向 ⭐️ ⭐️ ⭐️
Next questions on gastrointestinal stromal tumors: unresolved challenges and future directions

【摘要】:
综述目的:尽管在胃肠道间质瘤(GIST)的全程管理方面取得了显著进展,但关键挑战依然存在。风险分层、辅助治疗的最佳持续时间以及提高一线治疗疗效的策略等关键方面仍然是持续争论的话题。本综述探讨了旨在完善患者选择和优化治疗决策以进一步改善临床结局的新兴概念和创新方法。
近期发现:分子和基因组参数的引入改良了传统的风险模型,从而对高危患者进行更精准的分层。人工智能和液体活检的创新正在成为完善复发和治疗反应预测的强大工具。同时,肿瘤破裂的定义和预后意义仍然是影响风险评估和辅助治疗决策的关键挑战。此外,转录组学和多组学分析揭示了具有重大预后和治疗意义的不同GIST亚型,为更量身定制的治疗策略铺平道路。
总结:将分子特征整合到临床决策中可能会完善GIST患者的风险评估,并使治疗个性化。未来的研究应侧重于验证这些工具,并重新定义临床试验设计,以加速这种罕见疾病的药物开发。
中山大学附属肿瘤医院
李伟豪、 伍小军
【简评】:
辅助伊马替尼治疗可显著改善术后复发风险较高的GIST患者的无复发生存率(DFS)和总生存率(OS),目前被认为是标准治疗。然而,风险分层、辅助治疗的选择和持续时间的优化仍然是当前面临的挑战,也是一直以来研究和讨论的热点,是进一步改善GIST患者临床结局的突破口。本综述从以下几个方面进行探讨:
1.风险分层和辅助治疗的需求
当前的辅助治疗的标准治疗是对于高复发风险的患者使用伊马替尼至少三年。这一建议基于三项关键的临床研究,这些试验显示了无复发生存(RFS)的获益,仅SSGXVIII/AIO研究证明了OS的获益,也是唯一评估辅助伊马替尼持续时间超过2年的随机试验。然而,不同的研究应用了不同的风险分类和纳入标准,这可能影响了最终结果。因此,定义哪些患者真正处于高复发风险,哪些患者会从延长治疗中受益,以及哪些患者可以安全地省略辅助治疗是至关重要的。当前的风险分层模型虽然能够相对清晰地区分低风险和高风险患者,但对于中等风险组的临床异质性较高。而分子和基因组标志物的引入有机会改良传统风险模型,使高风险患者的分层更加精确。例如,某些KIT基因的缺失突变与更激进的行为和更差的预后相关,而其他突变则与更良好的临床结局相关。
2.辅助伊马替尼的最佳持续时间
辅助治疗的最佳时长仍然是一个开放性话题,这也取决于患者的个体化选择。PERSIST-5和IMADGIST试验分别研究了将辅助治疗延长至5年或6年的情况。这些试验和现实世界研究的数据表明,延长辅助治疗可以降低疾病复发的风险,但同时也伴随着更高的不良事件发生率和伊马替尼早期停药的风险。伊马替尼停药后,复发率可能会增加多达五倍,这表明至少在高危患者中,辅助治疗可能不是最终治愈的,而是延迟了复发。
3.肿瘤破裂的标准化
GIST患者肿瘤破裂的管理仍然是一个有争议的话题。尽管大多数研究表明其独立的负面预后意义,但由于缺乏普遍接受的定义,关于其真实流行率和辅助治疗效果的数据存在异质性。一项新的分类提议包括六种不同的临床情况,这是朝着标准化的重要一步。然而,对于其回顾性研究偏倚、具有异质性生物学特征的临床情况等问题仍值得进一步探究。
4.提高转移性GIST的一线疗效
伊马替尼改变了转移性GIST患者的临床治疗结局,然而,在大多数转移性GIST病例中,伊马替尼的有效性持续时间有限,不可避免地在中位30个月后发生进展。维持对GIST驱动因子的持续抑制至关重要,因为伊马替尼的停药与更差的结果相关。伊马替尼诱导的KIT-MAPK信号轴抑制并不能完全根除肿瘤细胞,因为一些细胞进入可逆的静止状态,导致治疗适应性。可能存在的旁路激酶信号通路有助于KIT驱动的增殖,强调了需要更广泛的信号抑制以增强抗肿瘤作用。
5.新的分子分型指导治疗
更好地表征肿瘤内和肿瘤间的异质性对于进一步理解疾病和指导治疗决策至关重要。GIST可能是实施临床循环肿瘤DNA(ctDNA)分析的理想模型,因为它们依赖于主要驱动突变,并且经常出现获得性耐药突变。多组学分析可以帮助更好地理解GIST的生物学和异质性,并可能指导治疗决策。国内王跃祥、曹晖教授团体研究GIST基因组及转录组全景图,基于多组学分析提出了四种GIST分子亚型,不同分型GIST间具有不同的基因组、表达谱、免疫学及临床特征,并根据每种亚型的特征提出了不同的治疗方案,包括可能的TKI与免疫治疗或CDK抑制剂的联合。
6.临床试验设计的新概念
作为罕见肿瘤,GIST的临床研究面临独特挑战。有限的患者人群使得随机对照试验难以进行,多年来,安慰剂对照组一直被用作标准方法。然而,最近对III期试验的分析显示,分配到安慰剂的患者中位PFS仅为1.2个月,与接受实验治疗的患者相比,OS显著降低。这些发现强调了一个关键的伦理问题:将晚期GIST患者暴露于安慰剂已不再合理。相反,我们必须采用创新的试验设计,如外部和合成对照组,利用历史和现实世界的数据更有效地评估新治疗方法。这种方法将加速药物批准,同时确保患者接受积极治疗,而不是无效的安慰剂。
总而言之,近年来对GIST的研究加深了我们对这种疾病的认识,表征了越来越多的遗传和基因组改变。新的分子和基因组的研究发现,以及人工智能的日益整合,可以帮助我们更好地识别高复发风险的患者,优化那些将受益的患者的治疗,并避免过度治疗。重新思考罕见和异质性疾病如GIST的临床试验设计至关重要,以克服当前的统计学限制,并促进更好的分子分型表征,以便开发新的靶向治疗。ctDNA分析和基于多组学研究的临床应用等新兴技术可以帮助更好地选择患者参与新药的临床试验。以前认为放疗对GIST疗效不佳,但在临床中观察到部分耐药的患者加上放疗后明显获益,是放疗改变了肿瘤微环境逆转耐药,还是其他的机制也会是一个研究热点
GIST文献(2025.4)列表
1. Survival outcome and impact of delayed imatinib therapy in gastric gastrointestinal stromal tumors.Jansuwan R, Samphao S, Chaochankit W.
Front Surg. 2025 Apr 3;12:1569677. doi: 10.3389/fsurg.2025.1569677. eCollection 2025.
2. Characterization of the epidemiologic, pathologic, radiologic, and management profile of patients with gastrointestinal stromal tumors (GISTs): A 5-year Chilean experience.Schiappacasse G, Cocio R, Cristi J, Torres J, Aliaga F, Vial M, Hepp J, Castiblanco A.
Rev Gastroenterol Mex (Engl Ed). 2025 Apr 16:S2255-534X(25)00004-0. doi: 10.1016/j.rgmxen.2024.04.009. Online ahead of print.
3. An unusual presentation of a gastric gastrointestinal stromal tumor as a chronic contained perforation with concomitant Helicobacter pylori infection: A case report and literature review. Lee S, Bowman JA.
Int J Surg Case Rep. 2025 Apr 14;130:111307. doi: 10.1016/j.ijscr.2025.111307. Online ahead of print.
4. Sarcomatoid Carcinoma of the Ileum Mimicking a Gastrointestinal Stromal Tumor (GIST) Presenting With Primary Subfertility: A Report of a Rare Case.Madhawa JKG, Wijesinghe H, Rajapaksha RAMN, Saranga V, Wickramasinghe VC.
Cureus. 2025 Mar 17;17(3):e80716. doi: 10.7759/cureus.80716. eCollection 2025 Mar.
5. A Case Report on Pulmonary Tumor Embolism in a Patient With a Metastatic Gastrointestinal Stromal Tumor Invading the Inferior Vena Cava: Tumor or Thrombus?Pandey T, Safar M.
Cureus. 2025 Mar 16;17(3):e80684. doi: 10.7759/cureus.80684. eCollection 2025 Mar.
6. Hepatic hemangiomas mimicking gastrointestinal stromal tumors: A case report.Wang JZ, Chen H.
World J Clin Cases. 2025 Apr 16;13(11):101668. doi: 10.12998/wjcc.v13.i11.101668.
7. Gastric Schwannoma Mimicking Gastrointestinal Stromal Tumor (GIST)-A Diagnostic Dilemma.Qureshi A, Ali H, Abbas H, Adhikari D, Saqib H, Rashid T, Ahmed L, Siddiqa A, Anjum F.
JGH Open. 2025 Apr 15;9(4):e70152. doi: 10.1002/jgh3.70152. eCollection 2025 Apr.
8. Potential biomarkers for the prognosis of gastrointestinal stromal tumors.Sun YF, Cao XK, Wei Q, Gao YH.
World J Gastrointest Oncol. 2025 Apr 15;17(4):102831. doi: 10.4251/wjgo.v17.i4.102831.
9. Characterization of a novel cell line established from mice gastrointestinal stromal model by chemical induction.Zhao Z, Qiu S, Zhang X, Liu S, Wang L, Guan H, He J, Hu Y, Li X, Luo S, Chen Z, Mo T, Zhang Y, Zhao X, Pan Y, Ding H, Cao J, Pan J.
Transl Oncol. 2025 Apr 14;56:102388. doi: 10.1016/j.tranon.2025.102388. Online ahead of print.
10. A Large Gastrointestinal Stromal Tumor under the Disguise of a Gastric Diverticulum: Report of a Case and Review of the Literature.Lagopoulos VI, Gigi E, Savvakis S, Sidiropoulou M, Gkoutziotis I, Emfietzis PK.
Surg Case Rep. 2025;11(1):24-0133. doi: 10.70352/scrj.cr.24-0133. Epub 2025 Apr 2.
11. A case of gastrointestinal stromal tumor with epithelioid-like morphology in a guinea pig (Cavia porcellus).Yoshizaki K, Ariyoshi H, Yamada Y, Tatara S, Sakurai M, Morimoto M.
J Vet Med Sci. 2025 Apr 14. doi: 10.1292/jvms.24-0524. Online ahead of print.
12. An Incidental Finding of Appendiceal Gastrointestinal Stromal Tumor with Abundant Skeinoid Fibers: A Rare Case Report with Insights from a Comprehensive Literature Review.Liu Y, Chen Y, Feroze A, Fu Z.
Diagnostics (Basel). 2025 Apr 3;15(7):924. doi: 10.3390/diagnostics15070924.
13. Advancement in medical treatment for gastrointestinal stromal tumors (GISTs): a ray of hope.Singh H, Mohanto S, Chopra H, Chopra S, Mishra AK, Venkatachalam T, Emran TB.
Ann Med Surg (Lond). 2024 Dec 19;87(3):1383-1393. doi: 10.1097/MS9.0000000000002843. eCollection 2025 Mar.
14. A Population-based Analysis of Gender Differences in Survival Outcomes for Gastric Gastrointestinal Stromal Tumors.Ren X, Wang G, Chen J, Liu L.
J Gastrointest Surg. 2025 Apr 8:102055. doi: 10.1016/j.gassur.2025.102055. Online ahead of print.
15. An artificial intelligence model utilizing endoscopic ultrasonography for differentiating small and micro gastric stromal tumors from gastric leiomyomas.Duan R, Duan L, Chen X, Liu M, Song X, Wei L.
BMC Gastroenterol. 2025 Apr 9;25(1):237. doi: 10.1186/s12876-025-03825-y.
16. Gastrointestinal stromal tumors with an uncommon primary mutation responded well to imatinib.Shahid G, Qudsia M, Naima I, Ibrahim K.
Cancer Pathog Ther. 2024 Aug 30;3(2):176-178. doi: 10.1016/j.cpt.2024.08.005. eCollection 2025 Mar.
17. Establishment and validation of a prognostic nomogram for extra-gastrointestinal stromal tumors.Jia G, Li X.
Front Oncol. 2025 Mar 20;15:1527237. doi: 10.3389/fonc.2025.1527237. eCollection 2025.
18. A real-world disproportionality analysis of ripretinib data mining of the public version of FDA adverse event reporting system.Feng Y, Fa X, Wang Y, Zhang T, Sun X, Li F.
Front Pharmacol. 2025 Mar 18;16:1469597. doi: 10.3389/fphar.2025.1469597. eCollection 2025.
19. Surgical resection for small (2 cm) gastric gastrointestinal stromal tumor.Tan S, Yang G.
Eur J Surg Oncol. 2025 Mar 25;51(7):109998. doi: 10.1016/j.ejso.2025.109998. Online ahead of print.
20. Endoscopic full-thickness resection vs surgical resection for gastric stromal tumors: Efficacy and safety using propensity score matching.
Zhao SQ, Wang SY, Ge N, Guo JT, Liu X, Wang GX, Su L, Sun SY, Wang S.World J Gastrointest Surg. 2025 Mar 27;17(3):101002. doi: 10.4240/wjgs.v17.i3.101002.
21. Combined application of the preclosure technique and traction approach facilitates endoscopic full-thickness resection of gastric submucosal tumors.Zu QQ, You Y, Chen AZ, Wang XR, Zhang SH, Chen FL, Liu M.
World J Gastrointest Surg. 2025 Mar 27;17(3):95704. doi: 10.4240/wjgs.v17.i3.95704.
22. Gastrointestinal stromal tumor causing bleeding and intussusception: A case report.Awad A, Theerman I, Beckermann J.
Int J Surg Case Rep. 2025 Apr;129:111203. doi: 10.1016/j.ijscr.2025.111203. Epub 2025 Mar 25.
23. Programmed Cell Death-ligand 1 as Biomarker of Poor Prognosis in Patients with Gastrointestinal Stromal Tumour.Yasheng D, Aierken A, Li Y, Aili A, Abudureyimu K.
J Gastrointestin Liver Dis. 2025 Mar 27;34(1):30-39. doi: 10.15403/jgld-5858.
24. (18)F-fluorodeoxyglucose positron emission tomography-computed tomography as a prognostic marker of imatinib-resistant gastrointestinal stromal tumors.Kawabata K, Takahashi T, Nishida T, Kurokawa Y, Yamamoto K, Saito T, Momose K, Yamashita K, Tanaka K, Makino T, Kawabata R, Takeno A, Nakajima K, Eguchi H, Doki Y.
Surg Today. 2025 Mar 28. doi: 10.1007/s00595-025-03029-7. Online ahead of print.
25. Acute abdomen due to a perforated giant GIST of the small intestine evolving slowly for 6 years: A case report.Ben Mahmoud A, Hammami M, Atri S, Sebai A, Haddad A, Kacem M.
Int J Surg Case Rep. 2025 Apr;129:111207. doi: 10.1016/j.ijscr.2025.111207. Epub 2025 Mar 25.
26. A case of quadruple wild-type gastrointestinal stromal tumor with CDC42BPB::NTRK3 fusion and abundant lymphoid infiltration.Xiang W, Yuan W, Ren L, Huang W, Liang H, Huang J, Luan L, Xu C, Hou Y.
Diagn Pathol. 2025 Mar 25;20(1):31. doi: 10.1186/s13000-025-01630-5.
27. Neoadjuvant Imatinib in Recurrent/Metastatic Gastrointestinal Stromal Tumors: A Systematic Review and Meta-analysis of Proportions.Stavrou N, Memos N, Filippatos C, Sergentanis TN, Zagouri F, Gavriatopoulou M, Ntanasis-Stathopoulos I.
J Gastrointest Cancer. 2025 Mar 26;56(1):88. doi: 10.1007/s12029-025-01210-2.
28. Incidental Gastrointestinal Stromal Tumor in a Patient Undergoing Robotic Sleeve Gastrectomy.Ahmed A, Ranjbar T, Lovell RY, Colon S, Tejada B, Platt C, Russell C, Mukherjee I, Haney O.
CRSLS. 2025 Mar 25;11(4):e2024.00045. doi: 10.4293/CRSLS.2024.00045. eCollection 2024 Oct-Dec.
29. Gastrointestinal stromal tumor surgery in pediatrics.Israel SD, Del Cañizo A, Monje S, Sáenz M, Bueno J, Ordóñez J, Pérez Egido L, García Casillas MA, Cerdá JA, Bada Bosch I, Fanjul M, Peláez D, de Agustín JC.
Cir Pediatr. 2025 Apr 7;38(2):74-76. doi: 10.54847/cp.2025.02.17.
30. CRE25-047: Avapritinib Induced Pseudoprogression in a Gastrointestinal Stromal Tumor With a PDGFRA Exam 18 842 Mutation.Trivedi C, Murtha T, Zaidi Z, Safran H.
J Natl Compr Canc Netw. 2025 Mar 28;23(3.5):CRE25-047. doi: 10.6004/jnccn.2024.7150.
31. Transanal endoscopic local resection versus radical excision in the treatment of massive rectal gastrointestinal stromal tumors: striving for therapeutic advantages.Wan T, Xiao J, Zhang X, Shi Y, Xie H, Ye F, Zheng H, Zhou Y, Liu Z, Kang L, Huang L.
Therap Adv Gastroenterol. 2025 Mar 31;18:17562848251328860. doi: 10.1177/17562848251328860.






















 苏公网安备32059002004080号
苏公网安备32059002004080号


