2022年,全球范围内新发乳腺癌(BC)病例约达230万例,其中大部分为早期乳腺癌(EBC)[1,2]。激素受体阳性(HR+)/人表皮生长因子受体2阴性(HER2-)EBC是最常见的亚型,其标准治疗为至少5年的辅助内分泌治疗(ET)[3,4]。近年来,学术界逐渐意识到,HR+/HER2-早期乳腺癌 (EBC) 治疗后的复发风险仍不容忽视。历史上曾有多项研究与Meta分析曾对此进行了探讨,但在当下学术界,我们仍需要新兴数据来更好地了解目前标准治疗下的复发风险。近期,一项发表于The Breast的真实世界研究评估了3133 名 HR+/HER2- EBC 患者(II/III 期)的辅助ET后10年内的复发风险。结果发现,第 5 年和第 10 年,侵袭性疾病的风险分别为 26.1% 和 45.0%;其中II期、N0患者5年复发风险同样逾20%[5]。该研究结果在提示HR+早期乳腺癌存在广泛未满足的治疗需求的同时,其II期、N0患者的复发风险结果同样为我们敲响了警钟。【肿瘤资讯】在此对该研究进行整理,以期为临床诊疗带来思考。
期待新兴证据填补空白,HR+早期乳腺癌10年复发风险求索
尽管接受标准辅助ET,HR+/HER2-乳腺癌复发风险仍持续存在,且可延续数十年,其中约50%的复发发生在5年后[6]。学术界此前对于该分子分型乳腺癌的短期与长期复发风险均进行了探索——对于HR+/HER2-早期乳腺癌的短期(3年、5年)复发风险,一项纳入14项随机临床试验的最新Meta分析提示,I-IIIC期HR+/HER2- EBC患者辅助辅助ET治疗后,3年绝对复发风险为7%,5年时升至12%[7]。而针对ET治疗5年后的长期复发风险,Pan等人开展的Meta分析纳入了88项研究、62,923例HR+ BC患者[8],该Meta分析表明,尽管接受辅助ET,复发仍持续至治疗后20年。II期患者20年远处复发风险约27-37%,III期患者约46-57%。
然而,尽管Pan等揭示了HR+早期乳腺癌5年后的复发风险[8],但该分析入组时间为1976-2011年。学术界仍需要基于当代治疗标准的5年后复发风险分析来理解长期复发规律。
对于HR+/HER2- EBC患者,现行指南根据绝经状态和临床风险推荐使用芳香化酶抑制剂(AI)或他莫昔芬[3,4]。真实世界研究显示,非甾体类AI(NSAI)总体使用率高于他莫昔芬,但使用模式因绝经状态而异:绝经后患者多使用AI,绝经前患者多使用他莫昔芬[9]。比较AI与他莫昔芬的随机临床试验和Meta分析表明,AI在HR+/HER2- EBC中疗效更优[10-15]。虽然随机临床试验提供了重要疗效数据,但真实世界分析可补充临床实践中的治疗模式信息,更广泛评估非临床试验环境下的患者治疗结局,可能具有更好的外推性。
我们仍需要基于当代治疗标准的数据深化对HR+/HER2- EBC复发风险的认知。真实世界研究与前瞻性临床试验相结合,可为不同患者群体和临床场景提供洞见。因此,研究者开展了这项真实世界研究,以期评估II/III期HR+/HER2- EBC患者辅助ET后10年内的复发风险。
基于ConcertAI Patient360 BC数据库进行探索,研究终点为iDFS、DDFS、OS
这项回顾性队列研究对加入ConcertAI Patient360 BC数据库(数据截止日期:1995年1月1日至2021年4月30日)的HR+/HER2-EBC患者进行了研究,这些患者接受了辅助ET治疗。ConcertAI Patient360数据库包括来自400多个美国学术(30%)和社区(70%)肿瘤诊所接受治疗的600万患者的电子病历。
通过改良的 STEEP 标准评估了无侵袭性疾病生存(iDFS)以确定复发风险。此外,针对辅助治疗中使用NSAI与他莫昔芬的患者,进行了内分泌治疗的亚组分析,评估了无侵袭性疾病生存(iDFS)、无远处疾病生存(DDFS)和总生存(OS)。
复发风险规律几何?研究结果揭秘
患者人口统计学和临床特征
本研究从数据库中筛选出 33,714 名患者归类为BC队列(图 1)。在这一初始 BC 队列中,32,057 名患者具有完整的性别记录且年龄≥18 岁,其中 25,927 名患者接受了手术切除。在这些患者中,13,697 名为HR+/HER2-乳腺癌患者,5,258 名为 II 期或 III 期乳腺癌患者。其中,3,750 名患者接受了至少一种符合条件的辅助ET。在排除了那些记录显示为转移性疾病的患者后纳入了 3,321 名患者。
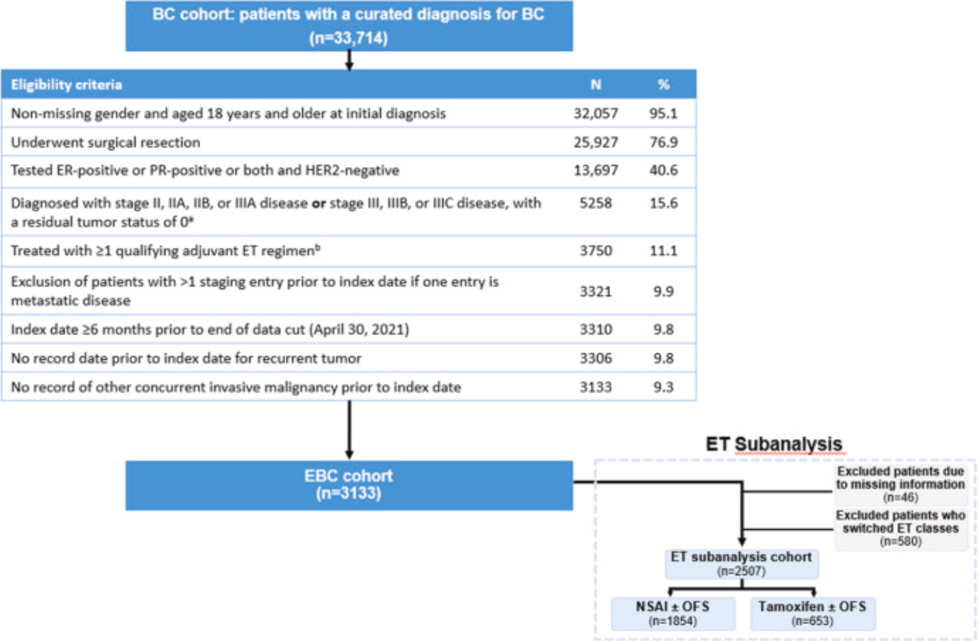
在 EBC 队列(N = 3,133)中,绝大多数患者为女性(98.8%)。患者的中位年龄为 59 岁(范围:24–87 岁)。大多数患者为 II 期疾病(80.9%),且大多数患者淋巴结阳性(根据肿瘤、淋巴结、转移分期;57.1%)(表 1)。
表1 启动ET治疗时关键人口统计学和临床特征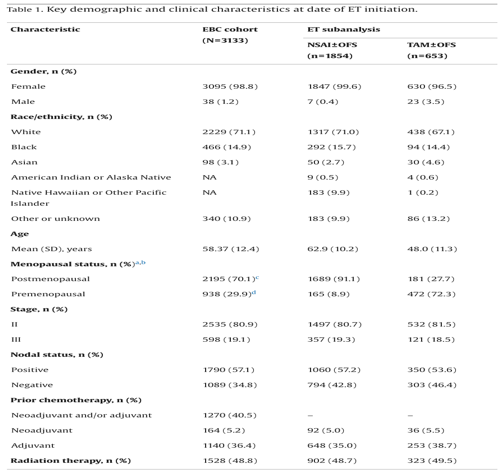
大多数患者为绝经后状态(70.1%)。当绝经状态未知或未记录时,年龄(≥50 岁)被用作判断绝经状态的替代指标,这种情况占 33.5%。在这些患者中,40.5% 在索引日期之前接受了(新)辅助化疗,48.8% 的患者在乳腺癌治疗计划中接受了放疗。大多数患者接受了部分乳房切除术(51.8%),30.3% 的患者接受了全乳房切除术,21.61% 的患者接受了其他/未指明的切除术。
复发风险:EBC 队列中的iDFS
本分析的中位随访时间为 68.1 个月。在EBC队列中, iDFS事件的中位时间为 141.3 个月(95% 置信区间 [CI],131.0–152.0)(图 2)。
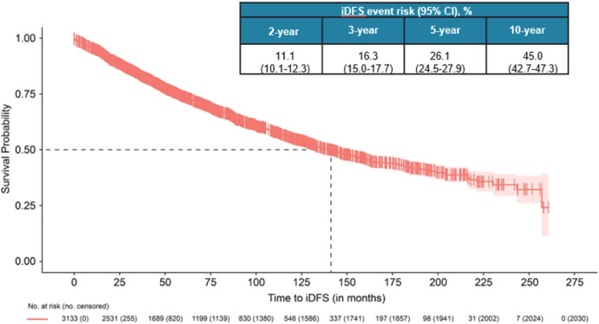
在 5 年和 10 年时,iDFS 事件的风险分别为 26.1% 和 45.0%。在 II 期疾病患者中,iDFS 事件的中位时间为 160.2 个月(95% CI,145.7–184.5);5 年和 10 年的 iDFS 事件风险分别为 22.7% 和 40.5%(图 3A)。在 III 期疾病患者中,iDFS 事件的中位时间为 82.6 个月(95% CI,72.8–91.7)。5 年和 10 年的 iDFS 事件风险分别为 40.4% 和 62.9%。对 iDFS 时间进行的多变量 Cox 回归分析表明,与 II 期疾病患者相比,III 期疾病患者的 iDFS 事件风险更高(风险比 [HR],1.89 [95% CI,1.62 至 2.21,P < 0.001])。
淋巴结阳性患者发生 iDFS 事件的风险高于淋巴结阴性患者(5 年:28.9%;10 年:49.4% 对比 5 年:22.1%;10 年:36.9%)(图 3B)。
在 II 期和 III 期患者中,淋巴结阳性患者的这一较高风险基本一致。在诊断时为绝经前的患者与绝经后患者相比,iDFS 事件的风险相似(5 年:24.0%;10 年:41.9% 对比 5 年:27.0%;10 年:46.4%)(图 3C)。
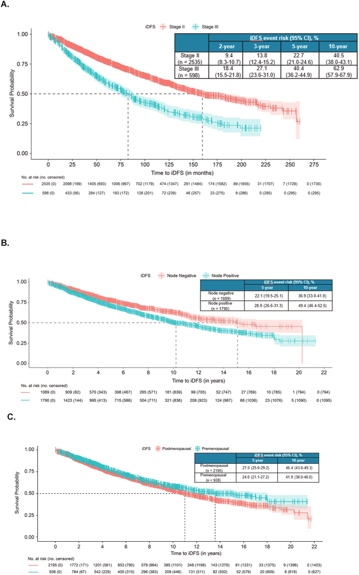
A:疾病分期;B:淋巴结状态;C:绝经状态
接受(新)辅助化疗的患者发生 iDFS 事件的风险高于未接受(新)辅助化疗的患者(5 年:32.6%;10 年:51.0% 对比 5 年:22.2%;10 年:41.4%)。
ET亚组分析
在ET亚组分析中,因信息缺失(n = 46)或在随访期间更换 ET 类别(n = 580),从早期乳腺癌(EBC)队列中排除了 626 名患者。在 ET 亚组分析队列的 2,507 名患者中,1,854 名(74%)接受了NSAI治疗(伴或不伴卵巢功能抑制 [OFS]),653 名(26%)接受了他莫昔芬治疗(伴或不伴OFS](可见图 1)。NSAI 组和他莫昔芬组的患者大多为女性(分别为 99.6% 和 96.5%),且大多数患者为 II 期疾病(分别为 80.7% 和 81.5%),并伴有淋巴结阳性(分别为 57.2% 和 53.6%)(表 1)。NSAI 组的平均年龄高于他莫昔芬组(分别为 62.9 岁和 48.0 岁),且绝经后患者比例更高(分别为 91.1% 和 27.7%)。在治疗中断时间方面,接受 NSAI 和他莫昔芬治疗的患者中位治疗中断时间相当(分别为 41.3 个月和 37.1 个月)(表 2)。
表2 ET亚组分析:ET治疗中断时间
对于所有患者,若无明确记录,则将死亡、失访或研究结束日期作为 ET 中断日期。在 ET 亚组分析中,76.8% 的患者 ET 中断原因未记录(因数据缺失)。
多变量 Cox 回归分析表明,与他莫昔芬相比,NSAI 可显著降低复发风险(表 3)。
表 3 NSAI与TAM事件发生时间的多变量Cox回归分析(N=2507)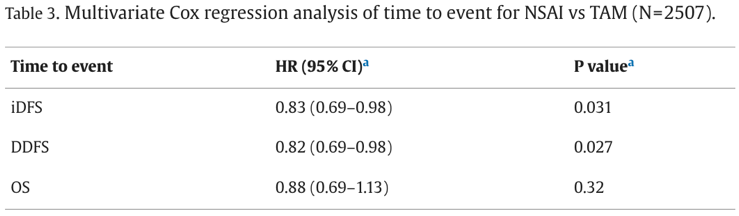
NSAI 治疗与 iDFS 事件相对风险降低 17% 相关(HR 0.83;95% CI,0.69–0.98;p = 0.031),与 DDFS 事件相对风险降低 18% 相关(HR 0.82;95% CI,0.69–0.98;p = 0.027)。OS分析显示,NSAI 组与他莫昔芬组相比,死亡风险的 HR 为 0.88(95% CI,0.69–1.13;p = 0.32);但需注意,他莫昔芬组和 NSAI 组中分别仅有 15.3% 和 19.1% 的患者死亡。未调整的 Kaplan-Meier 分析按 ET 和绝经状态分层显示,这些 iDFS、DDFS 和 OS 趋势在绝经前和绝经后患者中基本一致。然而,绝经后患者亚组(n = 181 例接受他莫昔芬治疗)和绝经前患者亚组(n = 165 例接受 NSAI 治疗)的样本量相对较小。
复发风险居高不下,II/III期HR+/HER2- EBC治疗需求审视与思考
这项针对II/III期HR+/HER2- EBC患者的真实世界研究结果显示,5年iDFS事件总体风险为26.1%,10年达45.0%。与预期一致,III期患者iDFS事件风险高于II期患者,淋巴结阳性患者风险亦高于淋巴结阴性患者。值得注意的是,II期患者(5年风险22.7%)或淋巴结阴性患者(5年风险22.1%)同样具有相当的复发风险。考虑到EBC队列中II期患者数量是III期的近四倍(淋巴结阴性患者约占三分之一),这些发现证实了HR+/HER2- EBC广泛人群(包括II期或淋巴结阴性患者)持续存在的未满足临床需求。
接受过(新)辅助化疗的患者占总体人群的40.5%,其5年和10年iDFS事件风险高于未化疗者。这符合预期,因化疗使用可能反映更高危疾病特征。然而,绝经前与绝经后患者的iDFS风险无差异,此结果较为意外。但需注意,33.5%患者绝经状态未知,虽用年龄替代判断,仍存在误分类可能,这对亚组分析结果产生影响。
ET亚组分析显示,NSAIs使用率比他莫昔芬高三倍(后者主要用于绝经前患者)。多变量分析校正年龄、分期、Charlson合并症指数及化疗史后,NSAIs±OFS组较他莫昔芬±OFS组iDFS(风险降低17%)、DDFS(风险降低18%)和OS均有改善,且结果在不同绝经状态中一致。本研究发现与既往RCT荟萃分析共同证实NSAIs的疗效优势[10,13]。但需注意本研究中他莫昔芬组绝经后患者仅181例,NSAIs组绝经前患者165例,且OFS联用可能影响结果,需进一步分析。
Pan等的荟萃分析揭示了HR+ EBC长期复发风险[8],其报道的II期患者10年任何乳腺癌事件风险为≈19-29%,III期为≈34-45%。但该结果基于临床试验数据,与本研究采用改良STEEP标准的真实世界iDFS定义存在差异。此外,真实世界人群异质性显著高于临床试验。
本研究存在局限性:数据源自美国商业保险患者的ConcertAI Patient360数据库,未涵盖老年医保患者及其他国家人群,未来需扩展研究人群。依从性与治疗持续时间数据缺失可能影响复发评估。电子病历的回顾性分析存在变量缺失/重复问题(如多次HER2检测阳性者被排除)。本研究iDFS定义基于改良STEEP标准,与临床试验的严格判定存在差异。未来研究应纳入STEEP 2.0推荐的其他终点(如无浸润性乳腺癌生存)。
综上,本真实世界证据表明,II/III期HR+/HER2- EBC患者(包括淋巴结阴性者)在标准辅助治疗后复发风险仍居高不下,需为此人群开发新治疗策略。
[1]F. Bray, M. Laversanne, H. Sung, et al.Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries.CA Cancer J Clin, 74 (3) (2024), pp. 229-263, 10.3322/caac.21834
[2]J. Iqbal, O. Ginsburg, P.A. Rochon, P. Sun, S.A. Narod.Differences in breast cancer stage at diagnosis and cancer-specific survival by race and ethnicity in the United States
JAMA, 313 (2) (2015), pp. 165-173, 10.1001/jama.2014.17322
[3]National Comprehensive Cancer Network.NCCN clinical practice guidelines in oncology.Breast Cancer (March 2025)V3 2025.
[4]S. Loibl, F. Andre, T. Bachelot, et al.Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up.Ann Oncol, 35 (2) (2024), pp. 159-182, 10.1016/j.annonc.2023.11.016
[5] Joyce O'Shaughnessy, Sara M. Tolaney b, Denise A. Yardley,et al. Real-world risk of recurrence and treatment outcomes with adjuvant endocrine therapy in patients with stage II-III HR+/HER2- early breast cancer.March 2025The Breast 81(3):104437.
[6]K.R. Hess, L. Pusztai, A.U. Buzdar, G.N. Hortobagyi
Estrogen receptors and distinct patterns of breast cancer relapse
Breast Cancer Res Treat, 78 (1) (2003), pp. 105-118, 10.1023/a:1022166517963.
[7]G.C. Curigliano, K. Kalinsky, D. Proudman, et al. Short-term risk of recurrence in patients with HR+/HER2− early breast cancer treated with endocrine therapy in randomized clinical trials: a meta-analysis. ASCO, 2024 (2024)
[8]H. Pan, R. Gray, J. Braybrooke, et al. 20-year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years.N Engl J Med, 377 (19) (2017), pp. 1836-1846, 10.1056/NEJMoa1701830
[9]C. Criscitiello, D. Spurden, A. Rider, et al.82P A multinational study of real-world treatment patterns among patients with early stage HR+/HER2-breast cancer (BC).Ann Oncol, 31 (2020), pp. S42-S43
[0]Early Breast Cancer Trialists' Collaborative Group.Aromatase inhibitors versus tamoxifen in premenopausal women with oestrogen receptor-positive early-stage breast cancer treated with ovarian suppression: a patient-level meta-analysis of 7030 women from four randomised trials.Lancet Oncol, 23 (3) (2022), pp. 382-392, 10.1016/s1470-2045(21)00758-0
[11]A. Howell, J. Cuzick, M. Baum, et al.Results of the ATAC (Arimidex, Tamoxifen, Alone or in Combination) trial after completion of 5 years' adjuvant treatment for breast cancer
Lancet, 365 (9453) (2005), pp. 60-62, 10.1016/S0140-6736(04)17666-6.
[12]Breast International Group 1-98 Collaborative Group, Thurlimann B, Keshaviah A,et al.A comparison of letrozole and tamoxifen in postmenopausal women with early breast cancer.N Engl J Med, 353 (26) (2005), pp. 2747-2757, 10.1056/NEJMoa052258
[13]Early Breast Cancer Trialists’ Collaborative Group.Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials.Lancet, 386 (10001) (2015), pp. 1341-1352, 10.1016/S0140-6736(15)61074-1
[14]O. Pagani, M.M. Regan, B.A. Walley, et al.Adjuvant exemestane with ovarian suppression in premenopausal breast cancer.N Engl J Med, 371 (2) (Jul 10 2014), pp. 107-118, 10.1056/NEJMoa1404037
[15]P.A. Francis, G.F. Fleming, I. Lang, et al.Adjuvant endocrine therapy in premenopausal breast cancer: 12-year results from SOFT.J Clin Oncol, 41 (7) (2023), pp. 1370-1375, 10.1200/JCO.22.01065
审批码:KIS0044384
排版编辑:肿瘤资讯-CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


