随着CDK4/6抑制剂、口服选择性雌激素受体降解剂(SERD)及抗体药物偶联物(ADC)等新型疗法的不断进展,个体化治疗策略日益成为临床实践中的主流选择。近日,美国罗斯威尔公园综合癌症中心肿瘤学系助理教授Shipra Gandhi博士通过分析多项关键III期临床试验数据,探讨了CDK4/6抑制剂、口服SERD和ADC药物在激素受体阳性(HR+)乳腺癌个体化治疗中的应用和潜在治疗策略,为优化患者的长期管理提供了重要指导[1-2]。【肿瘤资讯】精心梳理访谈内容如下,以飨读者。
CDK4/6抑制剂的选择:患者特征和临床数据的综合考量
CDK4/6抑制剂联合内分泌治疗(ET)已成为HR+/HER2-晚期乳腺癌患者的标准一线治疗方案。在HR+晚期乳腺癌中,多项关键性III期CDK4/6抑制剂晚期一线治疗相关研究数据为临床决策提供了依据。MONALEESA-2研究的总生存期(OS)最终分析结果表明,瑞波西利联合来曲唑一线治疗HR+/HER2-晚期乳腺癌患者的中位OS相较于安慰剂组显著延长12.5个月(63.9个月 vs 51.4个月),并且随着治疗时间的推移,瑞波西利的OS获益逐渐增加。MONALEESA-7研究证实一线使用瑞波西利联合ET在绝经前HR+/HER2-晚期乳腺癌患者中的OS获益具有统计学意义,中位OS达到58.7个月。目前3项MONALEESA研究均已证实:不论是绝经前还是绝经后人群,瑞波西利联合ET一线治疗HR+/HER2-晚期乳腺癌患者,均可一致性显著提高PFS和OS获益[3-5]。值得关注的是,PALOMA-2研究的OS最终分析未达到统计学显著OS获益[6],而MONARCH3研究在2023年SABCS大会中公布的OS结果也并未获得显著的统计学差异[7],这意味着瑞波西利是目前唯一在一线III期研究中均取得OS显著获益的CDK4/6抑制剂,夯实了瑞波西利在HR+/HER2-晚期乳腺癌的一线优选地位。
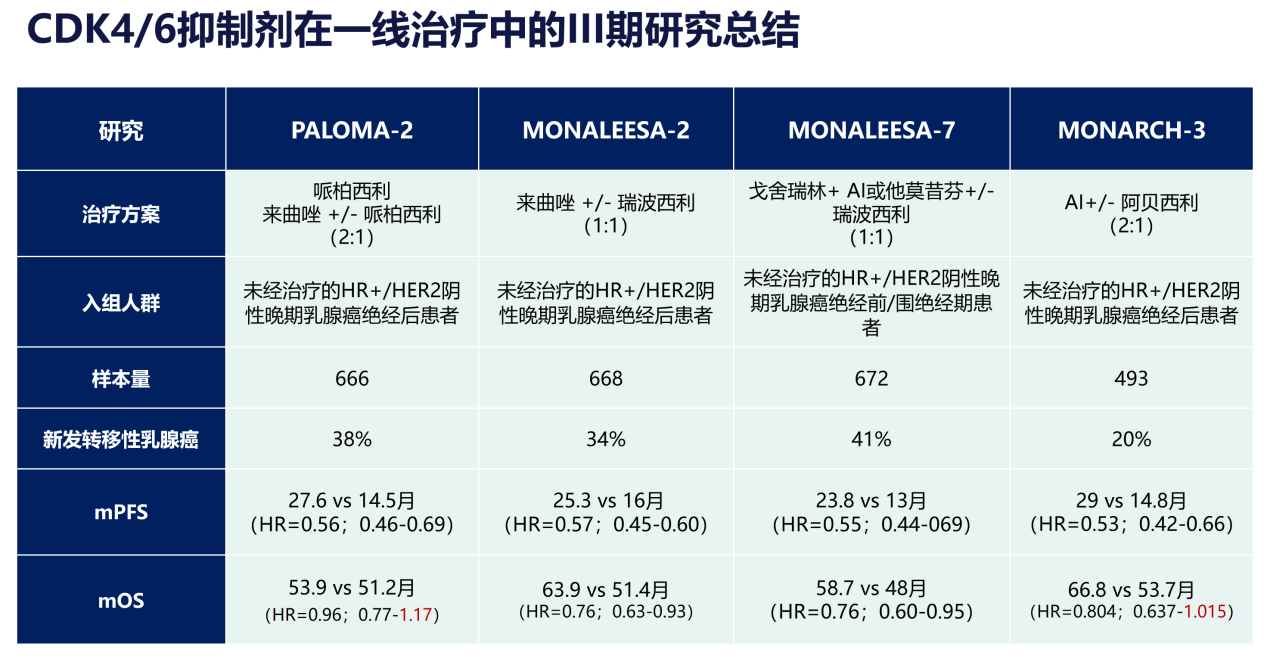
老年患者是肿瘤高发人群,与年轻患者相比,老年患者不仅有更差的美国东部肿瘤协作组体能状态(ECOG PS)评分,且更容易伴随心血管疾病、糖尿病等慢性疾病,合并用药有可能影响抗肿瘤药物的耐受性。从CDK4/6抑制剂相关研究入组患者特征来看,MONALEESA系列研究中ECOG PS 1分的患者占比、65-75岁亚组和≥75岁亚组的比例更高。更让人惊喜的是,在疗效方面,所有年龄亚组均可从瑞波西利联合ET治疗中取得PFS和OS获益。安全性方面,不同年龄亚组接受瑞波西利治疗的安全性类似,因为治疗相关不良事件(TEAEs)导致的减量频率一致。在值得关注的生活质量改善方面,瑞波西利可以明显改善三个年龄亚组在疼痛和疲劳评分的至恶化时间(TTD),更体现了为高龄患者带来的生活质量(QoL)获益[8]。
CDK4/6抑制剂不仅在HR+晚期乳腺癌解救治疗中取得了亮眼成果,在HR+早期乳腺癌辅助强化治疗方面也强势入局。目前美国FDA已经批准了瑞波西利用于中高危HR+/HER2-早期乳腺癌的辅助强化治疗。2024.v5版NCCN指南也推荐将瑞波西利与芳香化酶抑制剂(AI)联合使用,用于HR+/HER2-早期乳腺癌患者的辅助治疗[9]。这一更新不仅为临床医生提供了依据,也为患者带来了更多的治疗选择。
ADC:从HER2+到HER2低表达乳腺癌的治疗扩展
ADC的应用近年来在乳腺癌治疗中取得了显著进展,特别是在HR+和三阴性乳腺癌患者中。戈沙妥珠单抗(SG)和德曲妥珠单抗(T-DXd)是目前已由FDA获批用于治疗的两种ADC。T-DXd在多个III期临床试验中显著延长了患者的PFS和OS。
DESTINY-Breast02试验评估了T-DXd在重度治疗后的HER2+乳腺癌患者中的应用,结果显示T-DXd较医生选择的治疗方案显著延长了PFS和OS[10]。随后,DESTINY-Breast03试验进一步探讨了T-DXd在HER2+转移性乳腺癌二线治疗中的效果,并取得阳性结果[11]。DESTINY-Breast04试验则将T-DXd的适应症从HER2+扩展至HER2低表达乳腺癌患者,并显示出显著的PFS和OS改善[12]。这一系列的研究推动了T-DXd在HER2低表达患者中的广泛应用。
此外,TROPION-Breast01试验评估了Dato-DXd在既往接受治疗的HR+/HER2-乳腺癌患者中的疗效[13]。结果显示与化疗相比,Dato-DXd显著延长了PFS。目前,Dato-DXd可能很快获得批准,这使得临床医生面临如何合理排序使用这些ADC药物的新挑战。TRADE-DXd试验正在研究Dato-DXd和T-DXd的最佳用药顺序,这将是未来研究的重要领域。
CDK4/6抑制剂治疗进展后的选择:HR+乳腺癌的创新治疗方案与研究方向
对于CDK4/6抑制剂治疗后进展的患者,治疗选择日益多样化。Gandhi博士指出,如果患者没有可靶向的突变,可以继续使用CDK4/6抑制剂,或者使用依维莫司联合内分泌治疗,这是一种已被广泛应用的方案。然而,如果存在可靶向的突变,例如PIK3CA/AKT突变或PTEN改变,则可以使用Capivasertib;对于ESR1突变的患者,可以选择Elacestrant。
目前,口服SERD在HR+乳腺癌中的应用正在逐步扩大。唯一获批的口服SERD是Elacestrant,用于治疗转移性HR+乳腺癌。这一批准基于EMERALD研究,该III期随机临床试验纳入了接受过CDK4/6抑制剂治疗的晚期HR+乳腺癌患者。试验结果显示,在存在ESR1突变且对内分泌治疗敏感的患者中,Elacestrant组的中位PFS为8.6个月,而内分泌治疗组仅为1.9个月,两者差异为6.7个月[2]。
除了Elacestrant外,其他口服SERD也在积极开展临床研究。例如,SERENA-2研究是一项评估口服Camizestrant(AZD9833)疗效的II期临床试验,结果显示在ESR1突变患者中,Camizestrant较Fulvestrant具有PFS优势。目前,针对Camizestrant的III期研究SERENA-6正在招募转移性HR+乳腺癌患者,该研究采用循环肿瘤DNA(ctDNA)检测ESR1突变,阳性患者将随机接受口服Camizestrant联合更换CDK4/6抑制剂或继续使用原有CDK4/6抑制剂联合AI治疗。值得注意的是,在SERENA-6研究中,即便在ctDNA检测出ESR1突变但未出现影像学进展的情况下,患者也可接受Camizestrant治疗。这一研究的结果将备受期待。此外,口服Imlunestrant(LY3484356)也正在EMBER-3研究中进行III期评估,这同样是值得关注的研究。
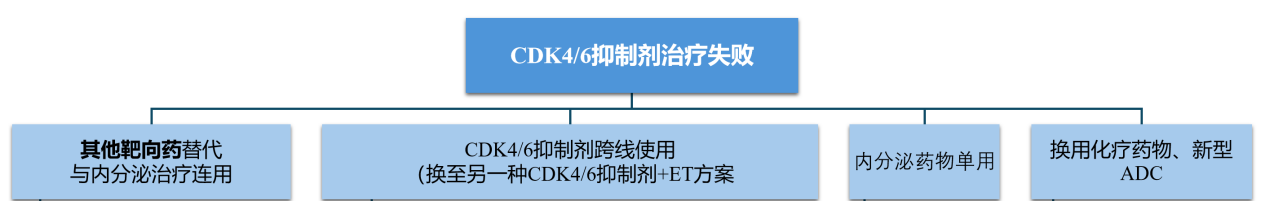
针对携带胚系BRCA突变的患者,基于EMBRACA研究和OlympiAD研究的III期数据,PARP抑制剂已由FDA获批准应用于这类患者[14,15]。2024年ASCO年会上展示的TBCRC 048研究扩展队列数据表明,PARP抑制剂的应用范围可能扩展至携带体细胞BRCA突变或胚系PALB2突变的肿瘤[16]。数据显示,接受奥拉帕利单药治疗的携带胚系PALB2突变的患者的客观缓解率(ORR)为75%。
此外,Gandhi博士还提到了一些正在进行中的研究方向,例如在HR+、淋巴结阳性的年轻患者中探讨能否避免使用化疗,或在解剖学高危但基因组低危的肿瘤中避免化疗?CDK4/6抑制剂已经拓展至早期治疗,而ADC也正在新辅助和辅助治疗中进行评估,尽管尚未获批用于这些适应症。这引发了一个重要问题:如果患者在接受这些方案后出现复发,应选择何种治疗方案?在CDK4/6抑制剂治疗后的二线治疗中,存在两种可能的靶向突变。临床医生将面临的挑战是是否同时靶向这两种突变,还是继续采用序贯治疗?如果同时使用靶向药物,患者将面临哪些毒性?这些药物联合使用与序贯使用的优缺点是什么?这些都是目前尚未解答的重要问题,需要在未来的研究中进一步探索。
[1]https://www.onclive.com/view/cdk4-6-inhibitors-adcs-and-pi3k-inhibitors-individualize-hr-breast-cancer-management?utm_source=www.onclive.com&utm_medium=relatedContent
[2]https://www.onclive.com/view/the-hr-positive-breast-cancer-treatment-paradigm-sits-on-the-cusp-of-significant-shifts
[3]Hortobagyi GN, Stemmer SM, Burris HA, et al. Overall Survival with Ribociclib plus Letrozole in Advanced Breast Cancer. N Engl J Med. 2022 Mar 10;386(10):942-950.
[4] Neven P, Fasching P, Chia S, et al. Updated overall survival (OS) results from the first-line (1L) population in the Phase III MONALEESA-3 trial of postmenopausal patients (pts) with HR+/HER2? advanced breast cancer (ABC) treated with ribociclib (RIB) + fulvestrant (FUL). 2022 ESMO. LBA4.
[5] Lu YS, Im SA, Colleoni M, et al. Updated Overall Survival of Ribociclib plus Endocrine Therapy versus Endocrine Therapy Alone in Pre- and Perimenopausal Patients with HR+/HER2- Advanced Breast Cancer in MONALEESA-7: A Phase III Randomized Clinical Trial. Clin Cancer Res. 2022 Mar 1;28(5):851-859.
[6] Richard S, Hope S, Veronique C, et al. Overall survival (OS) with first-line palbociclib plus letrozole (PAL+LET) versus placebo plus letrozole (PBO+LET) in women with estrogen receptor–positive/human epidermal growth factor receptor 2–negative advanced breast cancer (ER+/HER2−ABC): Analyses from PALOMA-2. 2022 ASCO. LBA1003.
[7] Matthew P, Masakazu T, Jens H, et al. MONARCH 3: Final overall survival results of abemaciclib plus a nonsteroidal aromatase inhibitor as first-line therapy for HR+/HER2- advanced breast cancer. 2023 SABCS. GS01-12.
[8] Lowell Hart, et al. Efficacy, safety, and quality of life with ribociclib + endocrine therapy in elderly patients with HR+/HER2– advanced breast cancer across the MONALEESA-2, -3, and -7 trials. 2023 SABCS. PS02-01.
[9] NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Breast Cancer. Version 5.2024.
[10] Modi, S., Jacot, W., Yamashita, T., Sohn, J., Vidal, M., Tokunaga, E., et al. (2022). Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. The New England Journal of Medicine, 386, 610-621. (DESTINY-Breast02)
[11] Cortés, J., Kim, S. B., Chung, W. P., Im, S. A., Park, Y. H., Hegg, R., et al. (2022). Trastuzumab deruxtecan versus trastuzumab emtansine for breast cancer. The New England Journal of Medicine, 386, 1143-1154. (DESTINY-Breast03)
[12] Modi, S., Ohtani, S., Lee, C., Vidal, M., Yamashita, T., Tokunaga, E., et al. (2022). Trastuzumab deruxtecan in HER2-low–expressing breast cancer. The New England Journal of Medicine, 387, 9-20. (DESTINY-Breast04)
[13] Bardia A, Jhaveri K, Kalinsky K, et al. TROPION-Breast01: Datopotamab deruxtecan vs chemotherapy in pre-treated inoperable or metastatic HR+/HER2- breast cancer. Future Oncol. 2024;20(8):423-436. (TROPION-Breast01)
[14] Litton, J. K., Rugo, H. S., Ettl, J., Hurvitz, S. A., Gonçalves, A., Lee, K. H., et al. (2018). Talazoparib in patients with advanced breast cancer and a germline BRCA mutation. The New England Journal of Medicine, 379, 753-763.
[15] Robson, M., Im, S. A., Senkus, E., Xu, B., Domchek, S. M., Masuda, N., et al. (2017). Olaparib for metastatic breast cancer in patients with a germline BRCA mutation. The New England Journal of Medicine, 377, 523-533. (OlympiAD)
[16] Tung, N. M., Robson, M. E., Ventz, S., Santa-Maria, C. A., Nanda, R., Marcom, P. K., et al. (2024). Olaparib in patients with metastatic breast cancer with germline PALB2 mutations: TBCRC 048. Journal of Clinical Oncology, 42(suppl 16; abstr 1021), 1021-1021. (TBCRC 048)
审批码KIS0035515-81345,有效期为2024-12-16至2025-12-15,资料过期,视同作废
排版编辑:肿瘤资讯-Hyc











 苏公网安备32059002004080号
苏公网安备32059002004080号


