艾帕洛利托沃瑞利单抗(以下简称“艾托组合抗体”,研发代号QL1706)是利用MabPairTM生物技术平台研发的由IgG4型抗PD-1抗体和IgG1型抗CTLA-4抗体按照固定比例组成的组合抗体。2020年,中山大学肿瘤防治中心张力教授牵头组织并开展了艾托组合抗体治疗晚期实体瘤患者的首次人体Ⅰ/Ⅰb期临床研究[1]。研究证实,艾托组合抗体治疗实体瘤患者耐受性好,具有良好的抗肿瘤活性。该研究成果为艾托组合抗体应用于晚期实体瘤患者奠定了坚实的基础。随后,由四川大学华西医院毕锋教授担任主PI的艾托组合抗体联合贝伐珠单抗一线治疗晚期肝细胞癌(HCC)的Ⅰb/Ⅱ期QL1706-106研究结果入选2023年ASCO。在晚期HCC一线治疗探索中,艾托组合抗体崭露头角、大放异彩,为突破该领域的治疗瓶颈带来新希望。【肿瘤资讯】将该项研究的主要结果整理如下,并特邀四川大学华西医院毕锋教授针对该研究的重要内容进行点评。
教授/主任医师 博士生导师
四川大学华西医院肿瘤内科主任
信号转导及分子靶向治疗研究室主任
中国生物医学工程学会肿瘤分子靶向治疗专委会主任委员
中国研究型医院学会肿瘤分会副主任委员
中国老年医学会肿瘤分会副会长
中国医师协会结直肠肿瘤内科治疗专委会副主任委员
中国临床肿瘤学会胆道肿瘤专家委员会副主任委员
四川省卫健委肿瘤内科首席专家
国家杰出青年科学基金获得者
QL1706-106研究
艾托组合抗体(5mg/kg)联合贝伐珠单抗的ORR达到38.3%,mPFS达到6.7个月
QL1706-106研究是一项探索QL1706或QL1604(齐鲁制药生产的抗PD-1抗体)联合贝伐珠单抗一线治疗晚期HCC的开放标签、多中心、适应性的Ⅰb/Ⅱ期研究。研究纳入未经系统治疗的BCLC B期或C期HCC患者,Ⅰb期为安全性导入期和扩展期(第1阶段),患者接受QL1706 5mg/kg+贝伐珠单抗Q3W治疗。Ⅱ期分为两个阶段:第2阶段和第3阶段。第2阶段患者随机分配至QL1706 5mg/kg+贝伐珠单抗Q3W组或QL1604 200mg+贝伐珠单抗Q3W组。根据第1阶段和第2阶段的析因分析结果来确定是否启动第3阶段。研究的主要终点是安全性。次要终点包括客观缓解率(ORR)、缓解持续时间(DoR)、疾病控制率(DCR)、研究者根据RECIST v1.1评估的中位无进展生存期(mPFS)和中位总生存期(mOS)等[2]。研究设计如图1所示。
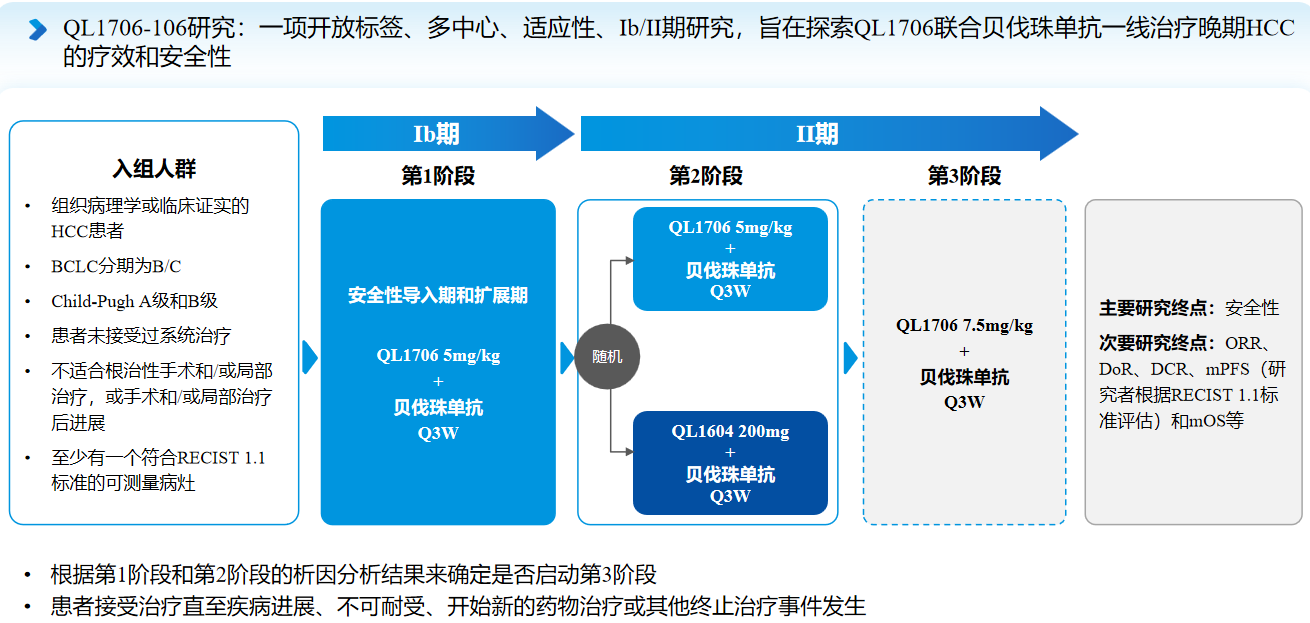 图1 QL1706-106研究设计
图1 QL1706-106研究设计
截至2022年11月18日,第1阶段和第2阶段共纳入76例患者(QL1706组:50;QL1604组:26),本文主要展示QL1706组的主要结果。QL1706组的中位年龄为57岁(范围:34-79)。ECOG体能状态评分为1的患者有26例(52%),男性居多(42例,84%)。至数据截止时间,QL1706组有22例(44%)患者仍在接受研究治疗。基线特征请参见表1。
表1 QL1706-106研究的基线特征(全分析集)
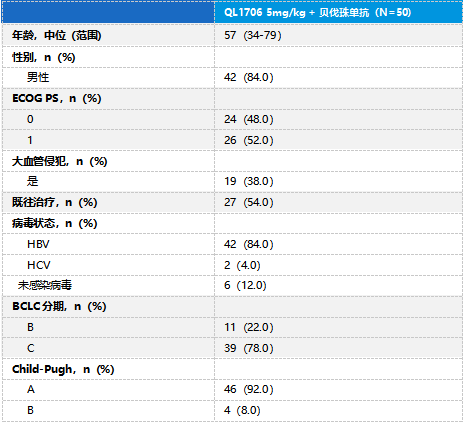
在安全性方面,QL1706组有43例(86%)患者出现治疗相关不良事件(TRAE),有17例(34%)患者出现≥3级TRAEs。QL1706组中,最常见的TRAEs是蛋白尿(32%),8例(16%)患者出现治疗相关严重不良事件(TRSAE),25例(50%)患者出现免疫相关不良事件(irAEs),16例(32%)患者因TRAEs导致剂量中断,仅1例(2%)患者因TRAEs(高钾血症和上消化道出血)而终止治疗。安全性数据请参见表2。
表2 QL1706-106研究的安全性数据(安全分析集)
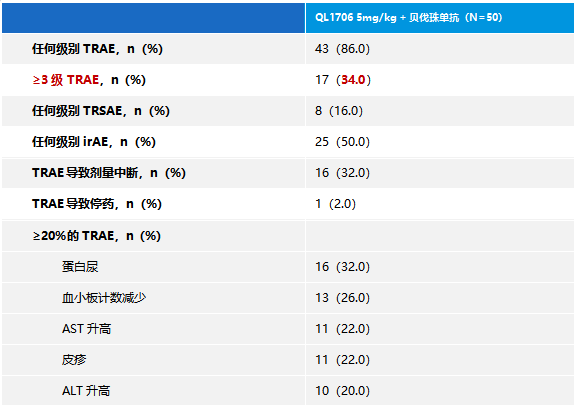
在疗效可评估患者中(N=47),QL1706组的ORR达到38.3%(18/47; 95%CI: 24.5-53.6),DCR达到74.5%(35/47; 95%CI: 59.7-86.1)。疗效数据请参见表3和图2。
表3 RECIST 1.1评估的肿瘤应答(疗效评估集)
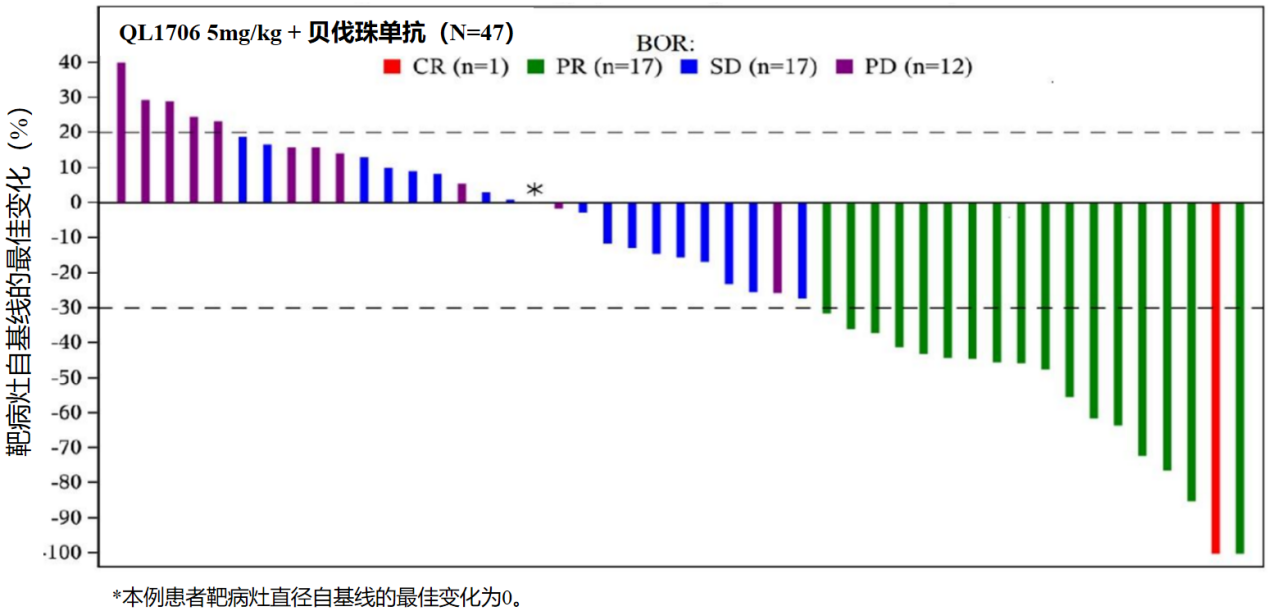 图2 靶病灶自基线的最佳变化
图2 靶病灶自基线的最佳变化
QL1706组的中位PFS为6.7个月(95% CI:3.0~11.4),中位OS未达到。
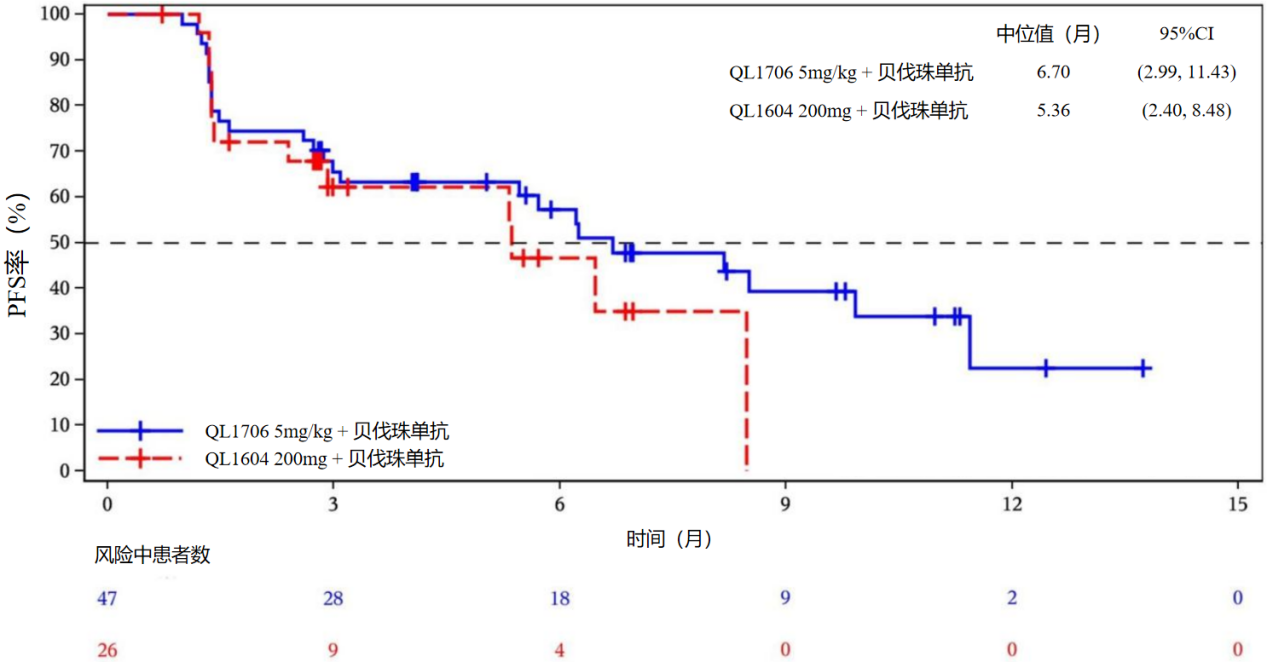 图3 PFS Kaplan-Meier曲线-疗效分析集
图3 PFS Kaplan-Meier曲线-疗效分析集
大咖点评
挑战:晚期HCC临床治疗尚需更多高效方案探索
在全球范围内,HCC作为一类高发恶性肿瘤,其治疗领域正经历着前所未有的变革。尽管近年来免疫治疗的兴起为HCC患者带来了新的希望,但晚期患者的预后依然不容乐观。目前国内已获批上市的免疫单药或靶免联合一线治疗方案的ORR尚未达到30%(基于RECIST 1.1标准),mPFS亦不足半年[3-7]。这些数据揭示了现有治疗方案在提升疗效方面面临巨大挑战。
为了进一步提高治疗效果,医学界将探索的目光投向了双免治疗,即PD-1抗体或PD-L1抗体与CTLA-4抗体的联合应用。这种联合治疗策略已经在HIMALAYA研究中得到验证[8],度伐利尤单抗联合Tremelimumab的STRIDE方案取得了成功。此外,CheckMate 9DW研究中纳武利尤单抗联合伊匹木单抗的治疗方案也显示出良好的疗效[9]。但双免联合治疗也为临床实践带来了一些挑战,如安全剂量的探索和不良反应的管理。在实际应用中,需要仔细评估患者的体质状况和基础肝功能情况,以确定是否适合接受双免联合治疗。
机遇:艾托组合抗体联合贝伐珠单抗助力革新晚期HCC一线治疗实践
在寻求更优治疗方案的道路上,艾托组合抗体作为一种新型的双靶点免疫药物,在与贝伐珠单抗联合用于晚期HCC一线治疗的研究中展现出了令人瞩目的疗效与安全性。2023年,我们开展的艾托组合抗体Ⅰb/Ⅱ期临床研究入选ASCO大会,该研究旨在探索艾托组合抗体联合贝伐珠单抗一线治疗晚期HCC的安全性和有效性,为晚期HCC的免疫治疗探索全新的可能性。
我们开展的这项研究结果显示,在疗效方面,艾托组合抗体(5mg/kg)联合贝伐珠单抗治疗组,ORR达到38.3%,mPFS达到6.7个月。这些数据不仅意味着更多的患者能够从治疗中受益,更预示着艾托组合抗体联合贝伐珠单抗在提高晚期HCC治疗效果上的巨大潜力。
在保证疗效的同时,艾托组合抗体联合贝伐珠单抗的安全性同样值得信赖。该研究显示,艾托组合抗体联合贝伐珠单抗一线治疗晚期HCC,任何级别的TRAEs发生率为86.0%,与当前已获批免疫治疗方案的数据相当,体现了该联合治疗方案在安全性上的可靠表现。≥3级TRAEs的发生率仅为34.0%,彰显了艾托组合抗体联合贝伐珠单抗在安全性上的优势。值得注意的是,仅2.0%的患者因TRAEs而终止治疗,而32.0%的患者经历剂量中断后仍能继续接受治疗,这无疑为患者提供了更持久、更连续的治疗机会。
综上所述,艾托组合抗体联合贝伐珠单抗不仅在疗效上实现了明显提升,在安全性方面同样表现出色,有望为晚期HCC患者提供一种全新的、有前景的治疗选择,开启晚期HCC免疫治疗的新篇章。
大样本、高质量Ⅲ期临床研究有望重塑晚期HCC一线治疗版图
为了进一步验证艾托组合抗体联合贝伐珠单抗在晚期HCC治疗中的临床价值,由复旦大学附属中山医院樊嘉院士和中国药科大学附属南京天印山医院秦叔逵教授牵头,一项旨在评估艾托组合抗体联合用药方案对比信迪利单抗联合贝伐珠单抗一线治疗晚期HCC的Ⅱ/Ⅲ期研究正在紧锣密鼓地开展中[10],相关研究结果有望在今年的ESMO年会中公布。该研究聚焦于评估不同治疗方案在疗效和安全性上的差异,以期为临床医生和患者提供更为详尽的治疗指导。
研究纳入未经系统治疗的BCLC B期或C期HCC患者,随机接受艾托组合抗体(7.5mg/kg)+贝伐珠单抗+XELOX化疗(试验组1)、艾托组合抗体(7.5mg/kg)+贝伐珠单抗(试验组2)、艾托组合抗体(7.5mg/kg)+XELOX化疗(试验组3)或信迪利单抗+贝伐珠单抗(对照组)治疗。Ⅱ期研究的主要终点为研究者根据RECIST 1.1标准评估的ORR,这一指标直接反映了治疗方案对肿瘤缩小的有效程度。Ⅲ期主要研究终点为OS,旨在全面评估治疗对患者生存期的影响。此外,研究还将评估一系列次要终点,包括DoR、DCR、PFS和至进展时间(TTP)等,以更全面地评价治疗方案的短期和长期疗效。
通过这一系列严谨的临床研究设计,艾托组合抗体联合用药方案与信迪利单抗联合贝伐珠单抗的对比研究不仅将为晚期HCC治疗领域带来新的洞见,更有望为患者提供多样化、个性化的治疗选择,引领晚期HCC一线治疗迈入一个崭新的时代。
[1] Zhao Y, Ma Y, Zang A, et al. First-in-human phase I/Ib study of QL1706 (PSB205), a bifunctional PD1/CTLA4 dual blocker, in patients with advanced solid tumors. J Hematol Oncol,2023, 16(1): 50.
[2] Bi F, Zhang Y, Gu SH, et al. An Open-label, Multicenter, Adaptive, Phase Ⅰb/Ⅱ Study of QL1604 plus Bevacizumab as First-Line Treatment in Patients with Advanced Hepatocellular Carcinoma. 2023 ASCO abstract 4077.
[3] Finn RS, Qin SH, Ikeda M, et al. IMbrave150: Updated overall survival (OS) data from a global, randomized, open-label phase III study of atezolizumab (atezo) + bevacizumab (bev) versus sorafenib (sor) in patients (pts) with unresectable hepatocellular carcinoma (HCC).2021 ASCO-GI abstract 267.
[4] Qin S, Ren Z, Feng Y H, et al. Atezolizumab plus Bevacizumab versus Sorafenib in the Chinese Subpopulation with Unresectable Hepatocellular Carcinoma: Phase Ⅲ Randomized, Open-Label IMbrave150 Study.Liver Cancer, 2021, 10(4): 296-308.
[5] Ren ZHG, Xu JM, Bai YX, et al. Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase Ⅱ-Ⅲ study. Lancet Oncol, 2021;22:977-990.
[6] Vogel A, Chan SL, Gu SHZH, et al. Camrelizumab plus rivocerani vs sorafenib as first-line therapy for unresectable hepatocellular carcinoma: final overall survival analysis of the phase Ⅲ CARES-310 study. 2024 ASCO Poster #90P.
[7] Qin S, Kudo M, Meyer T, et al. Tislelizumab vs Sorafenib as First-Line Treatment for Unresectable Hepatocellular Carcinoma. JAMA Oncol,2023;9(12):1651-1659.
[8] Abou-Alfa GK, Chan SL, Kudo M, et al. Phase Ⅲ randomized, open-label, multicenter study of tremelimumab and durvalumab as first-line therapy in patients with unresectable hepatocellular carcinoma: HIMALAYA. 2022 ASCO-GI abstract 379.
[9] Galle PR, Decaens T, Kudo M, et al. Nivolumab plus ipilimumab vs lenvatinib or sorafenib as first-line treatment for unresectable hepatocellular carcinoma: first results from CheckMate 9DW. 2024 ASCO LBA4008.
[10] https://classic.clinicaltrials.gov/ct2/show/NCT05976568.
审核号:NP202407290003-valid until 202507
排版编辑:肿瘤资讯-Zika











 苏公网安备32059002004080号
苏公网安备32059002004080号


