2024年11月,国际知名期刊Journal of Clinical Medicine发表了一篇原创研究文章,该研究主要探讨了磷酸化AXL(pAXL)表达与胃癌(GC)患者预后的关系。研究发现,较高的pAXL表达与GC患者生存率提高显著相关,尤其是在男性患者中。pAXL表达还与纤连蛋白和磷酸化AKT(pAkt)上调呈正相关,提示其在促进肿瘤侵袭和上皮间质转化(EMT)中的作用[1]。【肿瘤资讯】整理该研究要点,以飨读者。
研究背景
胃癌(GC)仍然是全球癌症相关死亡的主要原因,尤其是在东亚地区[2]。除了已知的风险因素外,最近的研究还集中在参与GC进展的分子机制上,包括caspase-3、Ki-67、ERK和STAT3等关键基因和蛋白[3-4]。这些分子在细胞凋亡、增殖、信号传导和肿瘤微环境中发挥着不同的作用。
此外,多种抗原如Ki-67、pAkt、pErk和pStat3在侵袭性癌症中通常高表达,促进细胞增殖和存活[5-7]。CD31和纤连蛋白促进血管生成和转移,而E-钙粘蛋白和N-钙粘蛋白参与细胞粘附和上皮-间质转化(EMT)[8]。pAMPK和DNAJB4参与细胞应激反应,而HMGA1和MCRS1参与染色质重塑[9]。HOXA5和IGF2BP1调节基因表达,EphA5影响肿瘤进展[10]。
AXL是一种受体酪氨酸激酶,在多种细胞过程中发挥作用,其过度表达与不良预后和治疗抵抗力增强有关[11]。AXL的活化涉及与配体GAS6结合以及配体非依赖性机制[12]。磷酸化AXL(pAXL)通过磷酸化关键底物来调节细胞过程,其失调与癌症有关[13]。在胃癌中,pAXL促进肿瘤生长、侵袭和转移,并与较差的总体生存率相关[14]。
先前关于AXL和GC的研究对患者的人口统计学和临床特征关注有限。本研究旨在对pAXL与患者年龄、性别、分化程度、侵袭深度和相关基因表达的关系进行全面分析,以提供对生存结果的更深入了解,并为潜在的治疗策略提供信息。
研究方法
该研究回顾性分析了2000年至2013年间收集的188例胃癌标本。研究人员从这些标本中构建了组织阵列,并进行了免疫组织化学(IHC)染色以评估pAXL、纤连蛋白和pAkt的表达。IHC染色程序经过优化,以确定每种抗体的最佳稀释度、孵育时间和抗原修复方法。
使用BenchMarkXT自动染色机对组织切片进行染色,并使用EDTA进行抗原修复。将切片与一抗和二抗孵育,然后使用DAB显色液进行可视化。染色强度从0+到3+进行评分,并记录染色百分比。H分数通过将染色强度乘以染色百分比来计算,范围从0到300。H分数为3.1被确定为pAXL表达的最佳截止点(图1)。
 图1. 不同评分的pAXL免疫染色示意图。
图1. 不同评分的pAXL免疫染色示意图。
研究结果
该研究首先比较了低pAXL表达组和高pAXL表达组的患者特征和肿瘤特征,发现两组间在性别、年龄、肿瘤等级、大小和分期方面存在一些差异,但这些差异均未达到统计学显著性(P > 0.05)。高pAXL表达组的女性患者比例较高,中位年龄较低,早期GC患者的比例较高,但这些差异均不显著。两组的肿瘤等级和大小分布相似,大多数肿瘤分化较差(表1)。
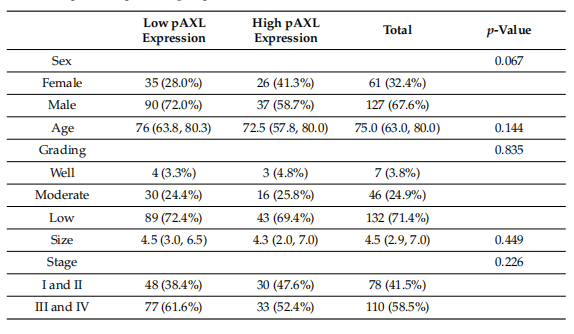
该研究进一步分析了pAXL表达与其他生物标志物表达之间的关系,发现pAXL表达与多种生物标志物的表达水平显著相关。高pAXL表达组的纤连蛋白、pAkt、pErk、pStat3和HMGA1表达水平显著高于低pAXL表达组,而低pAXL表达组的pAMPK和IGF2BP1表达水平显著高于高pAXL表达组。其他生物标志物,如Caspase3、Ki-67、CD31、E-cadherin、N-cadherin、DNAJB4、HOXA5、MCRS1和EhpA5DrTT在两组间的表达差异均不显著(图2)。
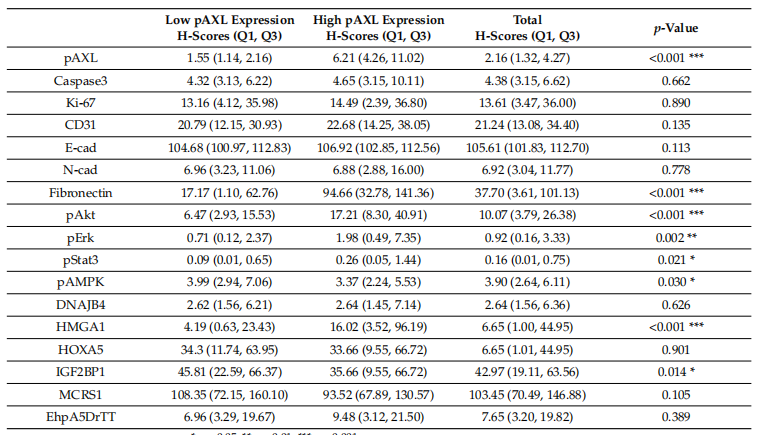
Kaplan-Meier生存曲线分析显示,pAXL表达水平与胃癌患者的生存率显著相关。pAXL高表达的患者生存率更高,累积生存率下降速度更慢,而pAXL低表达的患者则表现出较低的生存率和更快的死亡率(图2)。
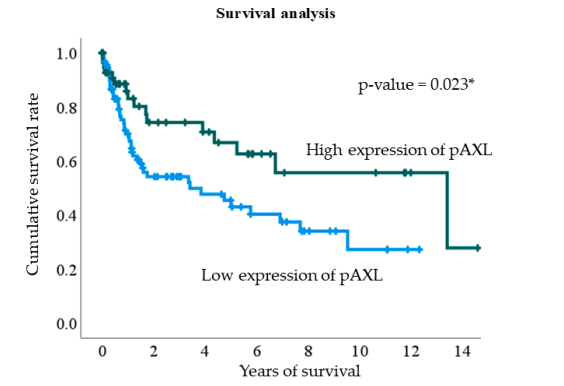
图2. 不同pAXL表达水平的Kaplan–Meier生存分析图。
随后该研究进行了单因素和多因素逻辑回归分析,以确定哪些因素与pAXL表达相关。分析结果显示,男性患者与较高的pAXL表达显著相关,而年龄、肿瘤分级、肿瘤大小和肿瘤分期等因素与pAXL表达无显著相关性(表3,图3)。
在众多生物标志物中,纤连蛋白和pAkt表达水平与pAXL表达水平显著正相关。这意味着pAXL表达越高,纤连蛋白和pAkt的表达水平也越高。
其他一些生物标志物,如CD31、N-cadherin、pErk、pStat3、HMGA1和IGF2BP1,仅在单因素分析中显示出与pAXL表达的相关性,但在多因素分析中调整其他因素后便不再相关。

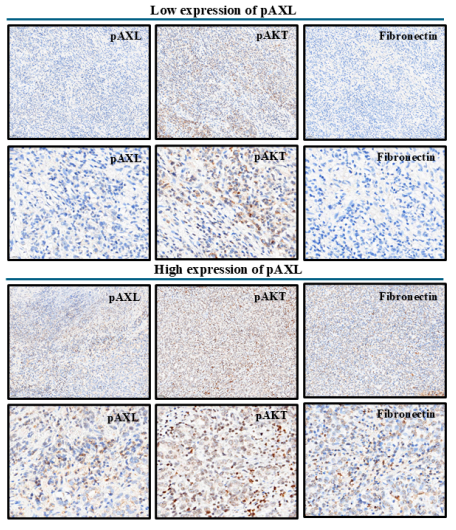 图3. 低和高pAXL表达组pAKT和纤连蛋白免疫染色。
图3. 低和高pAXL表达组pAKT和纤连蛋白免疫染色。
按性别对患者进行分组分析,以进一步探究pAXL表达与生存率之间的关系。结果显示,在男性患者中,pAXL表达水平与生存率之间存在显著关联。pAXL高表达的男性患者比pAXL低表达的男性患者拥有更高的生存率(P = 0.009)(图4)。
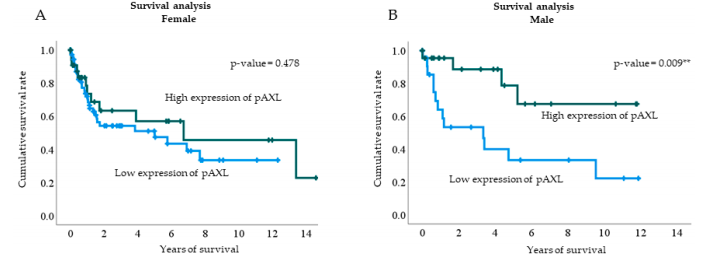 图4. 根据不同性别中pAXL表达水平进行Kaplan–Meier生存分析
图4. 根据不同性别中pAXL表达水平进行Kaplan–Meier生存分析
研究讨论
该研究表明,pAXL是胃癌的重要预后标志物,其高表达与更好的生存率相关,尤其是在男性患者中。纤连蛋白和pAkt是pAXL表达的重要预测因子,提示pAXL可能通过调节EMT和PI3K/AKT信号通路促进胃癌进展。
与既往研究结果的差异可能源于样本量、数据变化和患者背景特征的差异。pAXL表达与男性之间的相关性表明可能存在性别偏见,需要进一步研究。
该研究的局限性包括样本量有限、数据变化和对患者背景特征的关注有限。未来的研究应进一步探讨pAXL的预后价值,并关注性别差异和pAKT表达的作用。
该研究强调了pAXL作为胃癌预后标志物和潜在治疗靶点的意义。未来的研究应进一步探索pAXL的预后价值,并关注性别差异和pAKT表达的作用。
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编码:CN-148807
有效期至:2025-6-30
1. Ho H, Cheng CY, et. al. Association Between Phosphorylated AXL Expression and Survival in Patients with Gastric Cancer. J Clin Med. 2024 Nov 7;13(22):6694.
2. Karimi P, Islami F, et. al Gastric cancer: descriptive epidemiology, risk factors, screening, and prevention. Cancer Epidemiol Biomarkers Prev. 2014 May;23(5):700-13.
3. Andrés-Sánchez N, Fisher D, et. al. Physiological functions and roles in cancer of the proliferation marker Ki-67. J Cell Sci. 2022 Jun 1;135(11):jcs258932.
4. Luo G, Hu Y, et. al. Clinicopathologic significance and prognostic value of Ki-67 expression in patients with gastric cancer: a meta-analysis. Oncotarget. 2017 Jul 25;8(30):50273-50283.
5. Menon SS, Guruvayoorappan C, et. al. Ki-67 protein as a tumour proliferation marker. Clin Chim Acta. 2019 Apr; 491:39-45.
6. Singh V, Ram M, et. al. Phosphorylation: Implications in Cancer. Protein J. 2017 Feb;36(1):1-6. 7. El-Tanani M, Al Khatib AO, et. al. Importance of STAT3 signalling in cancer, metastasis and therapeutic interventions. Cell Signal. 2022 Apr;92:110275.
8. Ward C, Maselko M, et. al. Interaction of the Human Respiratory Syncytial Virus matrix protein with cellular adaptor protein complex 3 plays a critical role in trafficking. PLoS One. 2017 Oct 13;12(10):e0184629.
9. Mortazavi G, Mortazavi SAR, et. al. "Triple M" Effect: A Proposed Mechanism to Explain Increased Dental Amalgam Microleakage after Exposure to Radiofrequency Electromagnetic Radiation. J Biomed Phys Eng. 2018 Mar 1;8(1):141-146.
10. Yao VJ, D'Angelo S, et. al. Ligand-targeted theranostic nanomedicines against cancer. J Control Release. 2016 Oct 28;240:267-286.
11. Goyette MA, Côté JF. AXL Receptor Tyrosine Kinase as a Promising Therapeutic Target Directing Multiple Aspects of Cancer Progression and Metastasis. Cancers (Basel). 2022 Jan 18;14(3):466.
12. Tanaka M, Siemann DW. Therapeutic Targeting of the Gas6/Axl Signaling Pathway in Cancer. Int J Mol Sci. 2021 Sep 15;22(18):9953. doi: 10.3390/ijms22189953. PMID: 34576116; PMCID: PMC8469858.
13. Yang YY, Lin SC, et. al. Intervention of AXL in EGFR Signaling via Phosphorylation and Stabilization of MIG6 in Non-Small Cell Lung Cancer. Int J Mol Sci. 2023 Oct 4;24(19):14879.
14. Bae CA, Ham IH, et. al. Inhibiting the GAS6/AXL axis suppresses tumor progression by blocking the interaction between cancer-associated fibroblasts and cancer cells in gastric carcinoma. Gastric Cancer. 2020 Sep;23(5):824-836.
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


