结直肠癌(colorectal carcinoma, CRC)已成为全球最常见的恶性肿瘤之一,其发病率和死亡率列居全球恶性肿瘤的第4位和第3位[1]。随着人们生活水平的不断提高以及生活方式的改变,我国CRC的发病率和死亡率呈逐年上升趋势,部分结直肠癌具有家族遗传性。由于CRC筛查项目的实施、诊断技术的发展以及治疗水平的提高,在过去10多年间,我国CRC的生存率呈逐渐上升趋势。然而,我国CRC 5年生存率(57.6%)仍低于英国(60.0%)和美国(64.9%),也低于亚洲的日本(67.8%)和韩国(71.8%)[1]。
专家介绍
山东省肿瘤医院结直肠外科二病区主任,外科学教研室副主任
山东省临床肿瘤学会结直肠癌专业委员会主任委员
山东省抗癌协会大肠癌分会候任主任委员
中国抗癌协会中西整合结直肠癌专委会常务委员
中国抗癌协会结直肠肿瘤整合康复专委会委员
中国康复医学会外科快速康复专业委员会委员
山东省抗癌协会青年理事会常务理事
山东省抗癌协会胃肠肿瘤外科青年委员会副主任委员
山东省抗癌协会大肠癌分会青年委员会副主任委员
山东省医学会肝脏肿瘤多学科联合委员会副主任委员
山东省医学会肛肠病分会青年委员会副主任委员
山东省医师协会结直肠外科青年委员会副主任委员
山东省研究型医院协会胃肠肿瘤MDT专业委员会副主任委员
山东省抗癌协会肿瘤营养与支持治疗分会常务委员
山东省抗癌协会胃癌分会常务委员
山东省医师协会神经内分泌肿瘤专业委员会常务委员
《中华临床医师杂志》特邀编辑
《中华肿瘤防治杂志》编委
专家介绍
山东省肿瘤医院结直肠外科二病区主治医师
山东省临床肿瘤学会结直肠癌专业委员会委员
山东省抗癌协会大肠癌专业委员会委员
山东省老年医学学会胃肠外科微创专业委员会委员
山东省老年学与老年医学学会胃肠动力专业委员会委员
病例资料
■ 基本情况:李某,女性,37岁。
■ 就诊日期:2023年10月03日。
■ 现病史:患者于2月前因“肛周脓肿”于当地医院行手术治疗,术后发现(直肠肿物)不规则组织,病理显示:高级别上皮内瘤变,局灶癌变,为求进一步治疗,门诊以“直肠癌”收治入院。
■ 既往史:2014年曾行剖宫产手术,2023年因肛周脓肿行手术治疗。
■ 家族史:无。
完善检查及诊断
■ 体格检查
发育正常,营养良好,无异常面容,表情自如,自主体位,神志清楚,查体合作。全身皮肤黏膜无黄染,无皮疹,无皮下出血,无皮下结节,无瘢痕,皮下无水肿,无肝掌,无蜘蛛痣。腹软平坦,无压痛,无反跳痛,腹部无包块。肝脏未触及。脾脏未触及,Murphy氏征阴性,肾区无叩击痛,无移动性浊音。肠鸣音存在。肛诊:胸膝位,肛周皮肤黏膜正常,进指约4cm于直肠后壁可触及一环3/4周溃疡型肿物下缘,肠腔略狭窄,质韧,有触痛,上缘无法触及,退指套染血。
■ 血液检查
●2023-10-08血细胞常规:白细胞计数 5.33X10^9/L,红细胞计数 4.23X10^12/L↓,血红蛋白 124g/L,血小板计数 255X10^9/L;肝肾功电解质:总胆红素 7.1μmol/L,直接胆红素 3.2μmol/L↑,间接胆红素 3.9μmol/L↑,白蛋白 42g/L;肿瘤标志物:癌胚抗原 14.10ng/mL↑,糖类抗原CA19-9 9.80U/mL。
●2024-01-19血细胞常规:白细胞计数 2.76X10^9/L↓,红细胞计数 3.01X10^12/L↓,血红蛋白 101g/L↓,血小板计数 87X10^9/L↓;肝肾功电解质:总胆红素 7.5μmol/L,直接胆红素 3.4μmol/L↑,间接胆红素 4.1μmol/L,白蛋白 39.2g/L↓;肿瘤标志物:癌胚抗原 1.76ng/mL,糖类抗原CA19-9 8.750U/mL。
■ 影像学检查
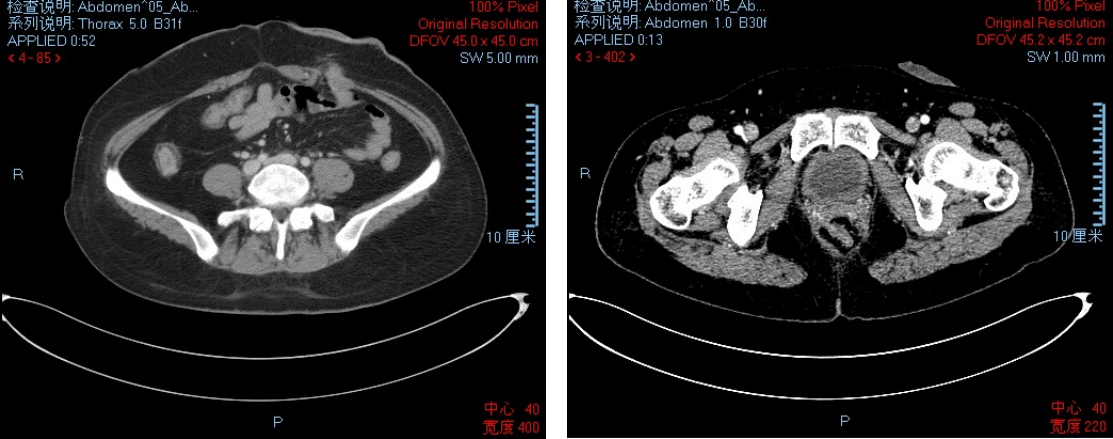
● 2023-10-04 CT:考虑直肠癌,盆腔淋巴结略大,考虑转移;肛周脓肿术后,直肠左旁及左侧肛周低密度影,不除外为术后改变;右附件增大,左附件囊性占位,建议动态观察。
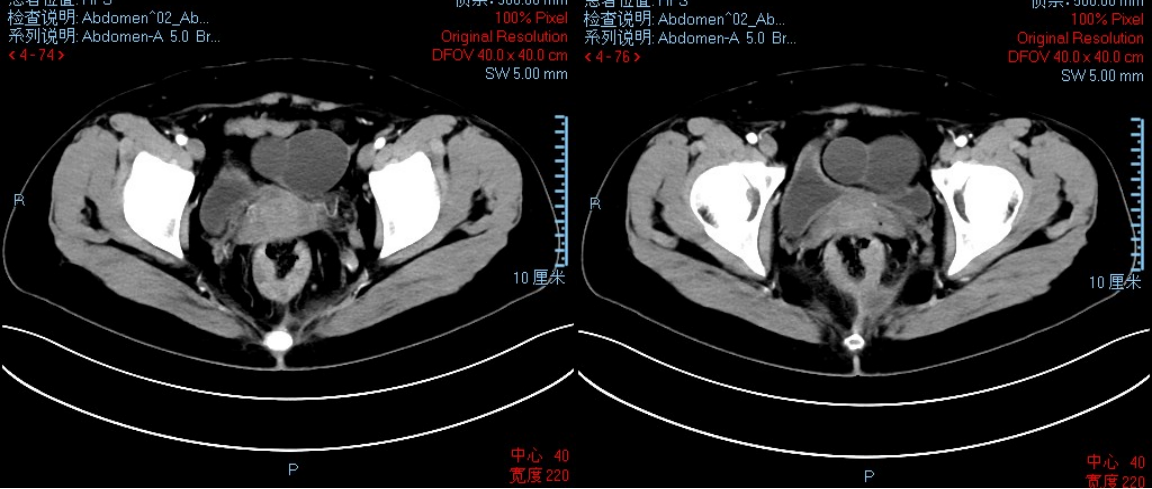
● 2023-10-04 MR:直肠癌(低位),肠周、双侧骼血管及腹股沟周围多发淋巴结,(T3NXM0;MRF+;EMVI+);增厚的肠壁左侧旁异常信号灶,肛瘘?请结合临床;左附件囊肿,请结合超声检查。
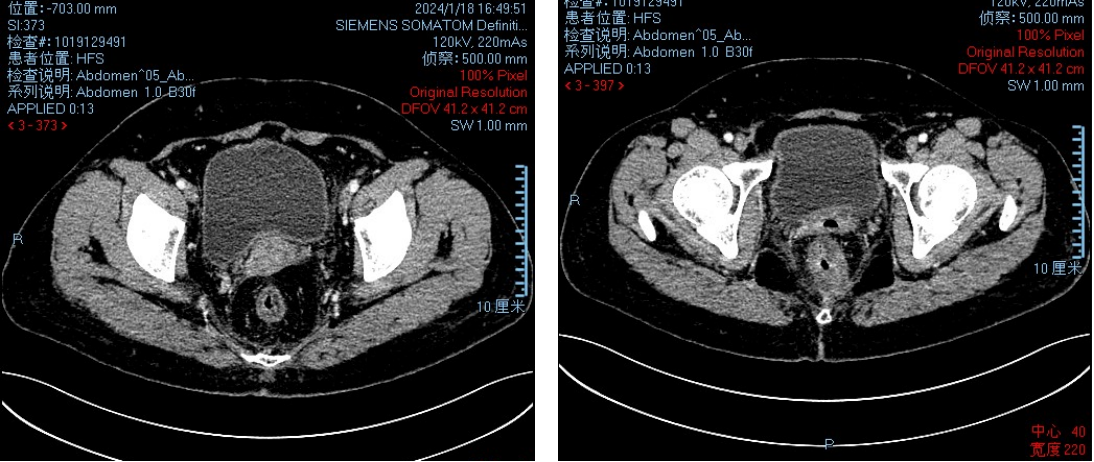
● 2024-01-17 CT:直肠癌较前2023-10-04好转,盆腔淋巴结转移显示不清;肛周脓肿术后改变;右附件增大,左附件囊性占位,变化不著。
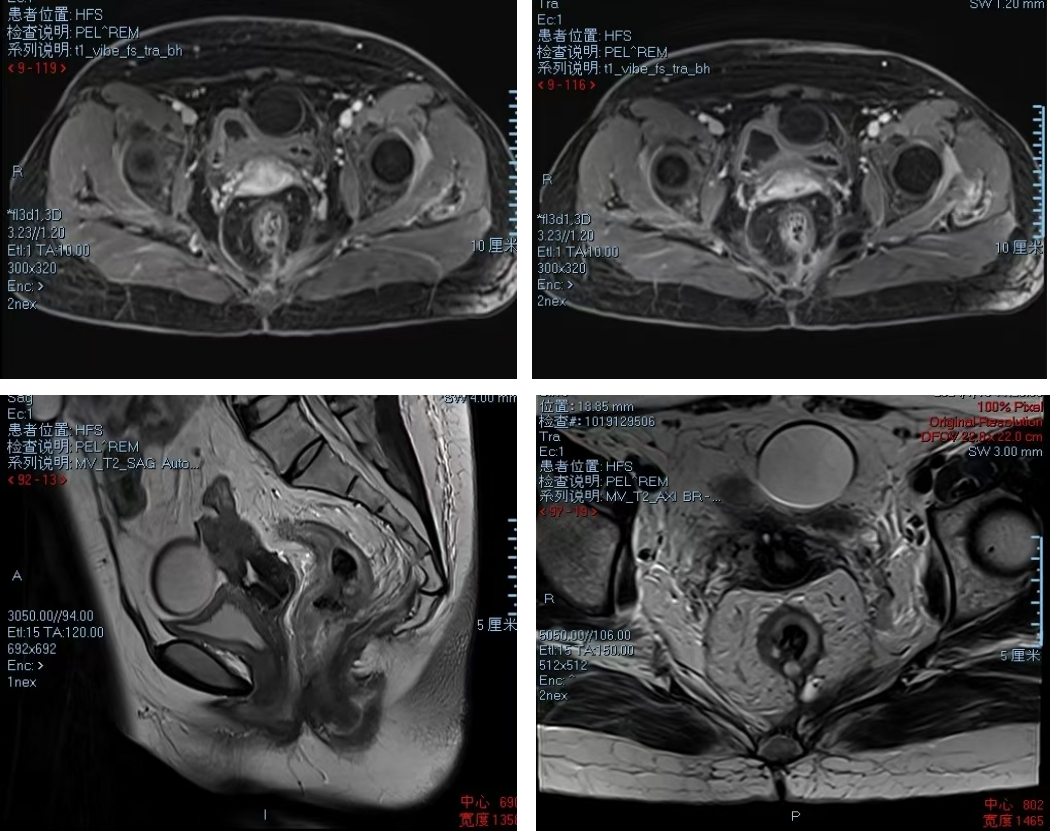
● 2024-01-17 MR:直肠癌治疗后改变;肛周脓肿术后改变;左附件囊性灶,卵巢囊肿可能,观察。
■ 内镜检查
● 2023-10-05 病理免疫组化所见:(直肠活检)腺体高级别上皮内瘤变,局灶恶变为粘膜内腺癌。免疫组化:202330913-A01#:MLH1(+)、PMS2(+)、MSH2(+)、MSH6(+)。
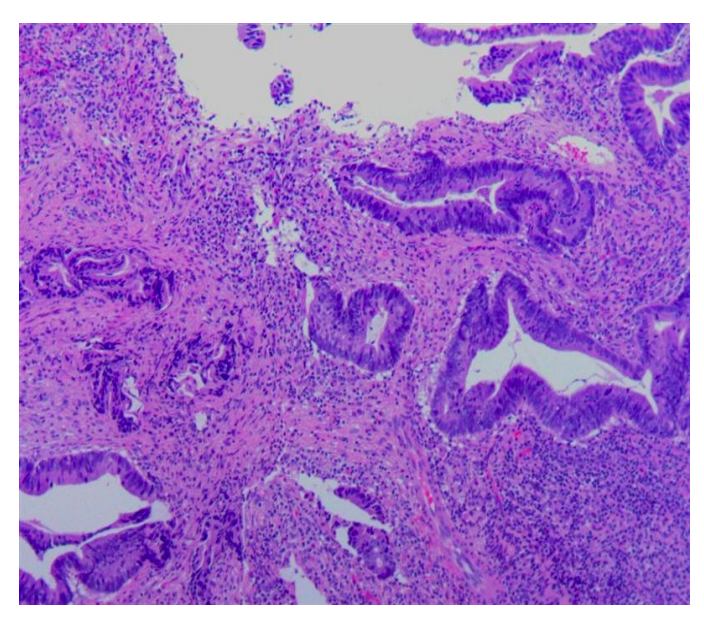
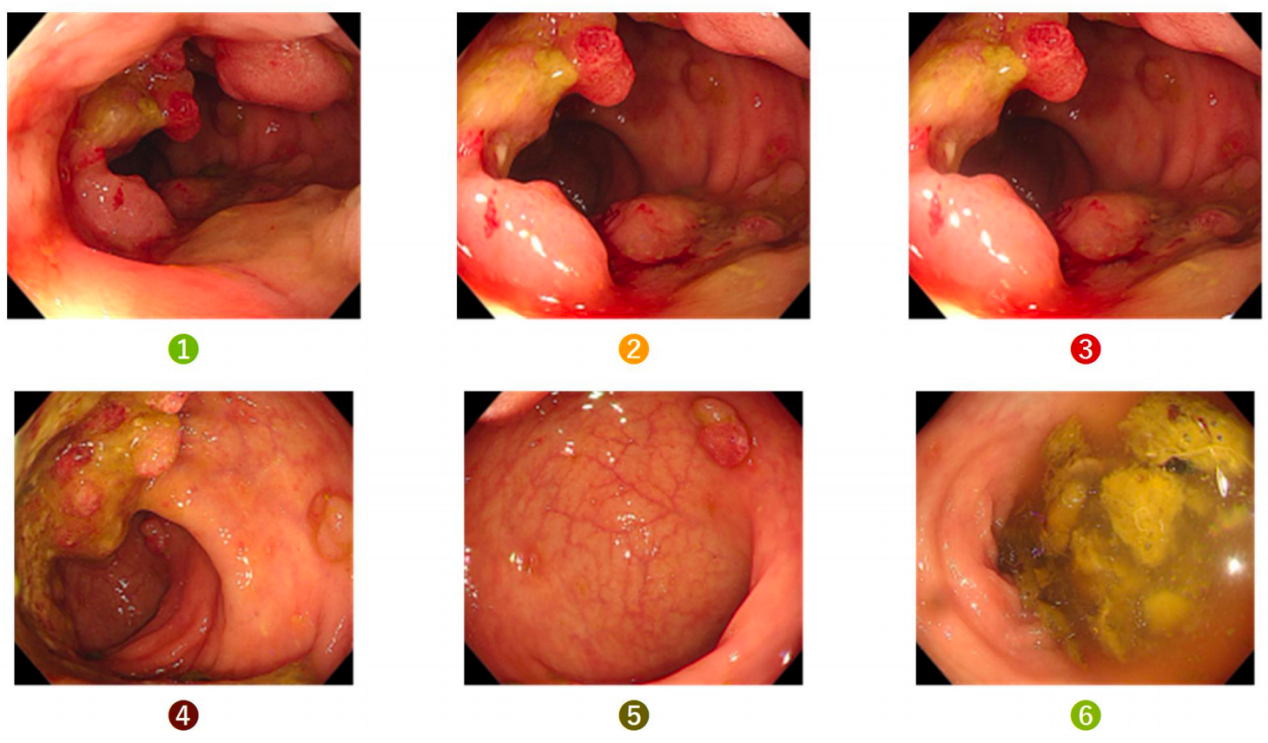
● 2023-10-09 肠镜所见:肠道清洁差,结肠大量块状物;距肛门约2-6cm直肠近半周隆起溃疡型肿物,肿物周边散在多发息肉样肿物,部分充血糜烂。诊断:直肠Ca。
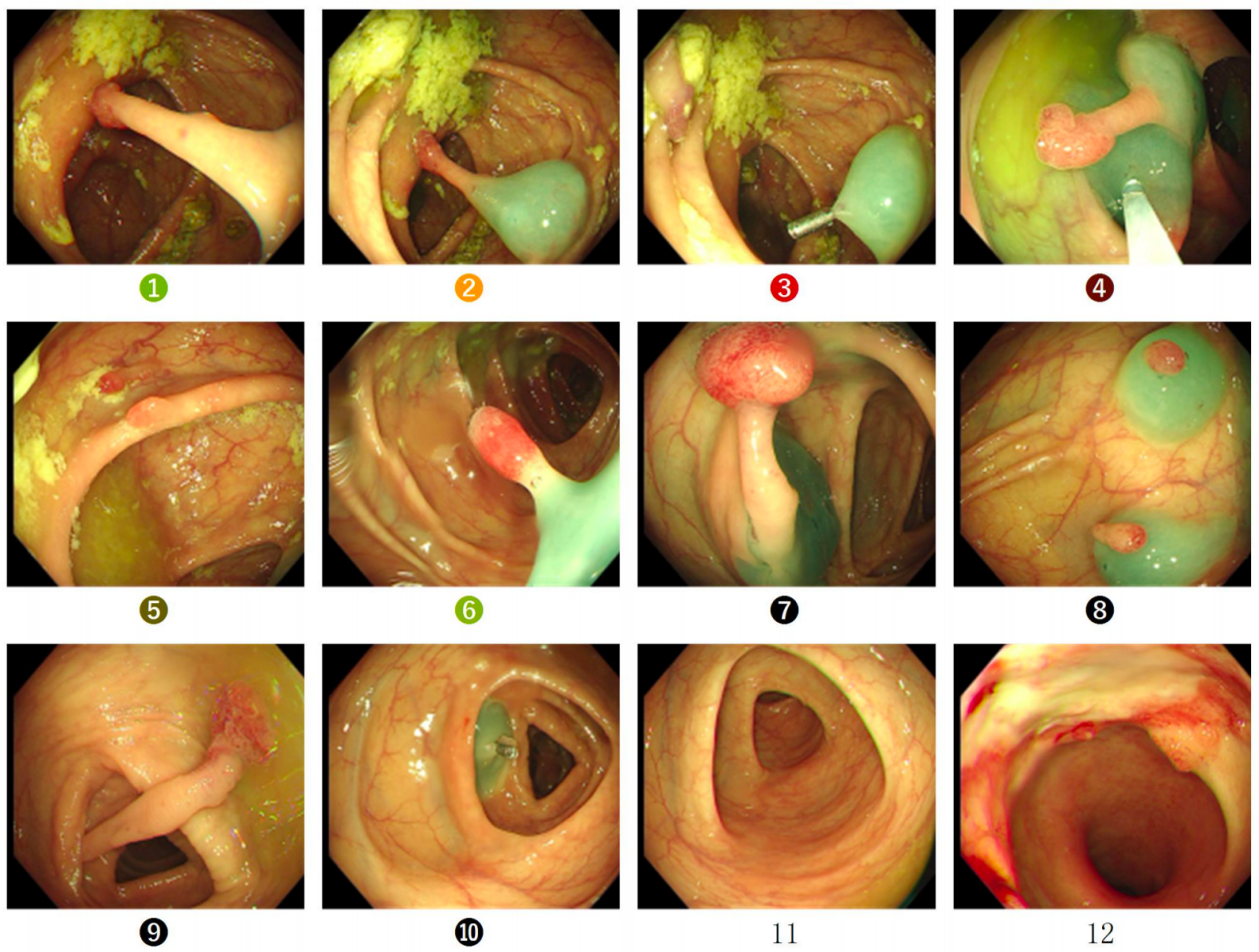
● 2024-02-18 肠镜所见:升结肠、横结肠及降结肠散在见多枚息肉样隆起,隆起处黏膜充血色红;粘膜下注射使病变隆起,大者圈套器电凝电切切除,共切除息肉15枚;直肠距肛缘约4cm见溃疡型肿物,表面糜烂充血,局部凹陷覆白苔,镜身触之易出血。诊断:结肠多发息肉电凝电切术;结合病史,直肠Ca治疗后。
治疗经过
■ 药物治疗
● 2023-10-09给予奥沙利铂+卡培他滨化疗2周期,同时给予盆腔放疗,处方剂量50Gy/25F。
■ 手术治疗
● 2024-02-19在全麻下行腹腔镜下直肠癌Dixon术+肠系膜淋巴结清扫术+预防性回肠末端双腔造口术+肠粘连松解术+左侧卵巢肿物切除术;术中探查见:左侧卵巢可见一肿物,呈囊性,约6*5*4cm大小,直肠肿瘤位于直肠下段,肿瘤下缘距肛缘约3cm,溃疡型,约3*2*2cm大小,呈放化疗后改变,肠周左后方可见一凸出肿物,质硬。
■ 术后病理
● 2024-02-19结果显示直肠中分化腺癌,残余少许管状腺癌及极少许粘液腺癌,侵犯固有肌层;治疗反应--肿瘤:见大量纤维组织增生、炎细胞浸润及大量无细胞粘液湖,考虑为治疗后改变;上切线、“下切线”及环周切缘未见癌;肠周(0/7)、“253组”(0/1);(左侧卵巢肿物)副中肾管囊肿。
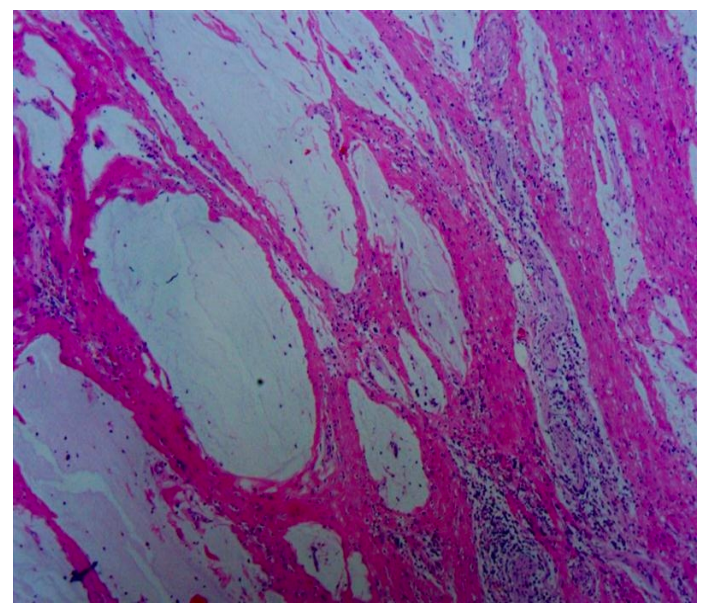
■ 复查结果
2024-03-19 CT:直肠癌术后改变,注意复查;肛周脓肿术后改变;右附件饱满;左侧附件囊性占位术后改变,盆腔少量积液。
讨论
李某在此次入院前因“肛周脓肿”于当地医院行手术治疗(结肠多发息肉电凝电切术),术后经MR、肠镜以及病理检查诊断“直肠癌”。入院后经体格检查、实验室检查、影像学检查、内镜检查以及病理检查诊断为直肠癌(cT3NxM0,MRF+;EMVI+,pMMMR)。院内多学科会诊后采用新辅助放化疗+手术治疗,术后复查CT有明显改善。
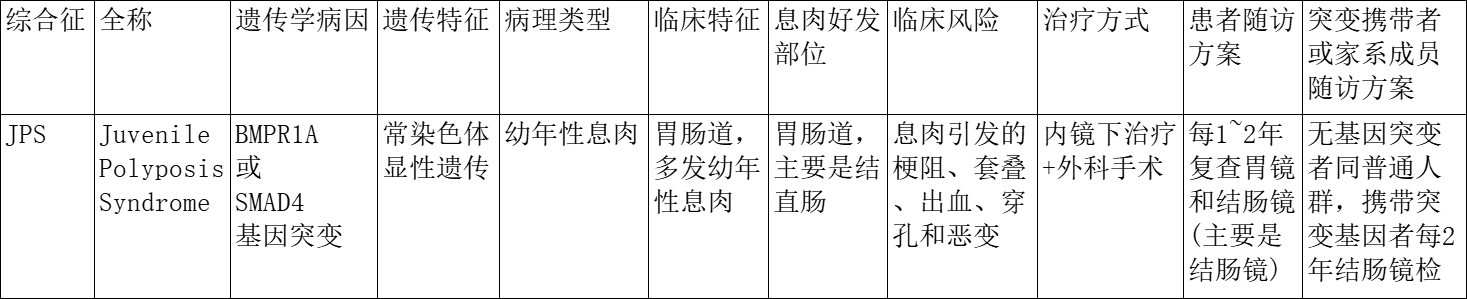
考虑患者年轻,且肠镜下息肉数量较多,负责医生2024年5月8号给患者行遗传易感150基因筛查,发现患者携带BMPR1A和FANCD2 Ⅳ级变异。BMPR1A exon9 c.802_806delinsA .(E268Tfs*14)为移码突变,导致基因编码蛋白第268位氨基酸由谷氨酸突变为苏氨酸并于281位发生终止。该患者可以确诊为幼年性息肉病综合征(JPS)。

幼年性息肉病综合征(juvenile polyposis syndrome,JPS)是一种罕见的常染色体显性遗传的错构瘤性息肉病综合征[2]。JPS患者可能在婴儿期发病,也有可能到成年期才发病,大部分JPS个体在20岁前出现息肉。JPS患者的息肉主要发生在结直肠和胃,数量通常从5枚到数百枚不等。此外,尽管有报道称在JPS患者的十二指肠、空肠和回肠中发现了息肉,但是有关JPS患者消化道息肉发生率的研究较少。罕见的情况下,没有结肠息肉的JPS患者也可出现大量胃息肉[3]。JPS与胃肠道癌症的发生风险增加有关。大部分幼年性息肉是良性的,但可能发生恶变。JPS患者终生罹患结直肠癌和上消化道癌(主要是胃癌)的风险分别约为38%和21%[4-6],报道的中位诊断年龄为42岁。
目前已知转化生长因子β(TGF-β)超家族的Ⅰ型受体BMPR1A基因和抑癌基因SMAD4的致病性胚系突变可引起JPS。在50%~60%的JPS患者中发现了SMAD4或BMPR1A基因的致病性胚系突变[7-9]。这两个基因都参与了BMP/TGF-β通路。大部分突变是这两个基因编码区中的点突变或小的碱基对缺失;也有少部分突变为大片段缺失,约占所有检出突变的14%[7-8]。PTEN基因是Cowden综合征(Cowden syndrome,CS)和Bannayan-Riley-Ruvalcaba综合征(Bannayan-Riley-Ruvalcaba syndrome,BRRS)的致病基因,PTEN基因也被认为是JPS的致病基因。也有学者认为,PTEN基因突变的JPS患者可能是还未出现肠外表现的CS/BRRS患者[10]。BMPR1A基因与PTEN基因毗邻,两者的连续基因缺失与早发性JPS的严重表型相关(婴儿期幼年性息肉病)[11]。
下一步治疗
JPS发病率低,相关的临床研究很少,JPS的治疗指南主要基于专家意见[12-13]。由于JPS罕见,建议转诊到专业的团队进行治疗。合并JPS危险致病因素或高度怀疑JPS的患者,应在15岁时或首次出现症状时进行结肠镜和上消化道内镜检查[14]。确诊JPS后,还应检查整个胃肠道是否存在息肉。对于JPS患者,建议每2~3年复查一次结肠镜和上消化道内镜检查。对于发现存在息肉的患者,应每年进行内镜检查,直至没有再发现息肉为止。息肉较少的JPS患者可以通过定期行内镜下息肉切除术来治疗[14]。无法通过内镜下治疗处理的结直肠幼年性息肉病可以考虑行全结肠切除术或次全结肠切除术。结肠手术时也可考虑行术中肠镜检查以评估小肠息肉[15]。为了预防发生结直肠癌和胃癌,以下JPS患者可能需要进行预防性手术:(1)无法通过内镜处理的结直肠息肉病患者(体积过大,或息肉数目>100枚);(2)严重的胃肠道出血或腹泻;(3)伴有不典型增生的幼年性息肉;(4)有结直肠癌家族史的患者[16-18]。外科手术方式包括次全结肠切除术+回肠直肠吻合术、全结肠切除术或全大肠切除术[16]。但具体何种术式为最佳的手术方式,目前仍存在争议。由于残余直肠和储袋中息肉复发率高,因此术后仍需定期复查结肠镜[16]。
规范筛查
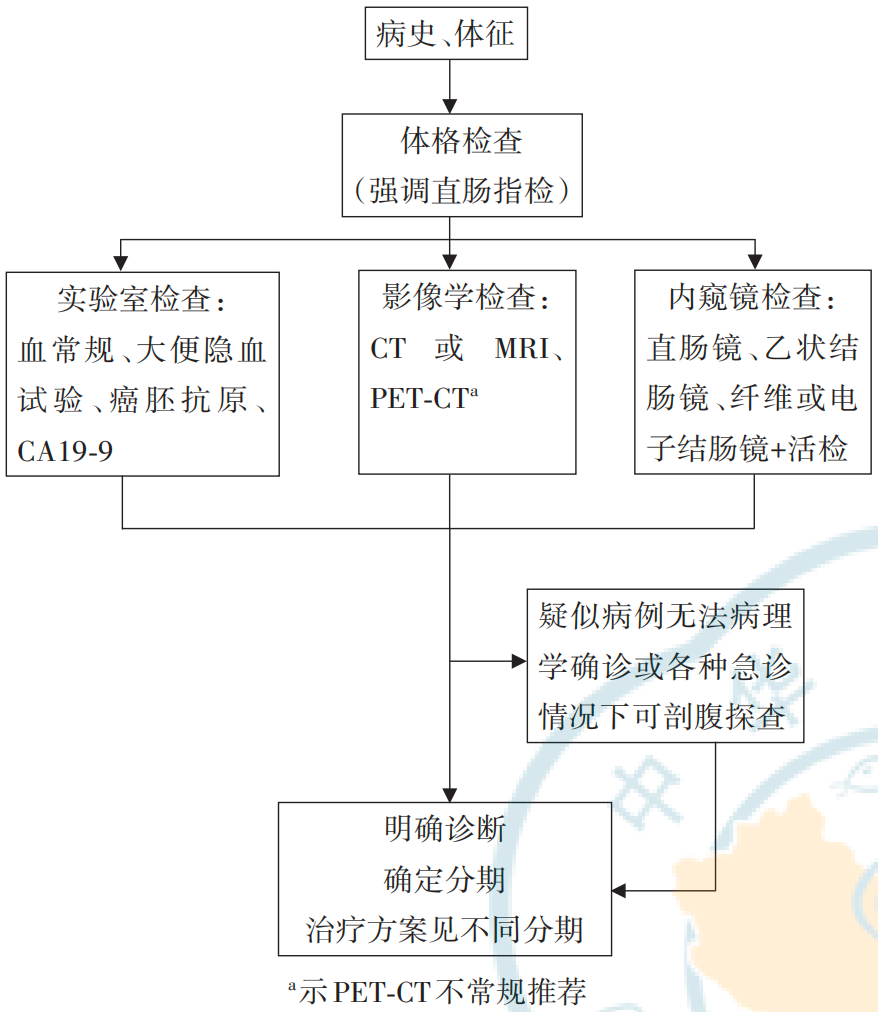
根据《中国结直肠癌诊疗规范(2023年版)》[20],结直肠癌患者的诊断流程是一个系统而全面的过程。首先,医生应通过详细的病史询问和体格检查,了解患者的症状、家族遗传史及全身状况。随后安排一系列实验室检查,如血常规、尿常规、粪便常规及隐血试验,以及生化、电解质和肝肾功能等常规检查,以评估患者的整体健康状态。在影像学方面,结肠镜检查是核心,用于直接观察肠道内情况并取活检。同时,CT、MRI等影像学检查也必不可少,它们能帮助医生判断肿瘤的位置、大小、分期及是否存在转移。特殊检查如直肠指检和三合诊则针对特定情况进行补充评估。最终,结肠镜下活检病理检查是确诊结直肠癌的“金标准”,通过对可疑病变组织的活检,医生能够明确肿瘤的性质和分期。这一系列规范筛查流程确保了结直肠癌诊断的准确性和全面性,为后续制定个性化的治疗方案提供了坚实基础。
案例中李某按照以上流程进行检查,这为后续精准诊疗的方案选择提供了依据。但该患者是一位先征者,后续通过遗传筛查确诊患者是幼年性息肉病综合征,这为患者及直系亲属进行遗传易感筛查及健康管理提供了明确的信息,相信后续患者及直系亲属通过遗传咨询和健康管理随访可以降低/预防胃肠道癌症的发生。因此,遵循规范的筛查流程,对于控制结直肠癌的流行、减轻社会医疗负担具有重要意义。
[1] 郭兰伟, 张兴龙, 蔡林, 等. 全球结直肠癌流行和防控现状[J]. 中华肿瘤杂志, 2024, 46(1):57-65.
[2] CICHY W,KLINCEWICZ B,PLAWSKI A.Juvenile polyposis syndrome [J]. Areh Med Sci, 2014, 10(3):570-577.
[3] WATANABE A,NAGASHIMA H,MOTOI M,et al. Familial juvenile polyposis of the stomach [J].Gastroenterology,1979,77 (1) :148-151.
[4] BROSENS L A, VAN HATTEM A, HYLIND L M, et al. Risk of coloretal cancer in juvenile polyposis[J]. Gut, 2007,56(7):965-967.
[5] MA C,GIARDIELLO F M, MONTGOMERY E A. Upper traetjuvenile polyps in juvenile polyposis patients: dysplasia and malignaney are associated with foveolar, intestinal, and pyloric differentiation[J]. Am J Surg Pathol, 2014, 38(12):1618-1626.
[6] HOWE JR, MITROS F A, SUMMERS R W. The risk of gastro-intestinal carcinoma in familial juvenile polyposis[J]. Ann Surg0ncol, 1998,5(8):751-756.
[7] VAN HATTEM W A, BROSENS L A, DE LENG W W, et al.Large genomie deletions of SMAD4, BMPRlA and PTEN in juvenile polyposis[J]. Gut, 2008,57(5):623-627.
[8] ARETZ S,STIENEN D, UHLHAAS S, et al. High proportion of large genomic deletions and a genotype phenotype update in 80 unrelated families with juvenile polyposis syndrome[J].J MedGenet,2007, 44(11):702-709.
[9] HOWE JR,SAYED MG,AHMED A F,et al. The prevalence of MADH4 and BMPRlA mutations in juvenile polyposis and absence of BMPR2, BMPR1B, and ACVRl mutations[J]. J MedGenet,2004, 41(7) :484-491.
[10] HEALD B, MESTER J, RYBICKI L, et al. Frequent gastrointestinal polyps and coloretal adenocareinomas in a prospective series of PTEN mutation carriers[J].Gastroenterology, 2010,139 (6): 1927- 1933.
[11] DELNATTE C,SANLAVILLE D, MOUGENOT J F, et al. Contiguous gene deletion within chromosome arm 10q is associatedJoumnal of Colorectal & Anal Surgery with juvenile polyposis of infaney, reflecting cooperation between the BMPRlA and PTEN tumor suppressor genes[J]. AmJ Hum Genet, 2006,78(6):1066-1074.
[12] GAO XH,LJ,ZHA0 ZY,et al. Juvenile polyposis syndrome might be misdiagnosed as familial adenomatous polyposis:a case report and literature review[J]. BMC Gastroenterol, 2020,20(1):167.
[13] CAIRNS S R,SCHOLEFIELD JH, STEELE R J, et al. Guidelines for colorectal cancer sereening and surveillance in moderate and high risk g:(update from 2002)[J]. Gut, 2010,59groups(5):666-689.
[14] SYNGAL S,BRAND R E,CHURCH JM, et al. ACG clinicalguideline: genetie testing and management of hereditary gastrointestinalcancer syndromes[J].Am J Gastroenterol, 2015, 110(2):223-262;quiz 263.
[15] FAUGHNAN M E,PALDA V A,GARCIA-TSA0 G, et al. In-ternational guidelines for the diagnosis and management of hereditaryhaemorrhagie telangiectasia[J]. J Med Genet, 2011. 48(2):73-87.
[16] ONCEL M, CHURCH JM, REMZI F H, et al. Colonie surgeryin patients with juvenile polyposis syndrome: a case series[J].Dis Colon Rectum,2005,48(1):49-55;discussion 55-46.
[17] SCOTT-CONNER C E, HAUSMANN M, HALL T J, et al. Famil-ial juvenile polyposis: patterns of recurrence and implications forsurgical management[J].J Am Coll Surg,1995, 181(5):407-413.
[18] BROSENS L A,VAN HATTEM A,HYLIND L M, et al. Riskof coloreetal cancer in juvenile polyposis[J]. Gut, 2007, 56(7):965-967.
[19] 中国抗癌协会大肠癌专业委员会遗传学组.遗传性结直肠癌临床诊治和家系管理中国专家共识.中华肿瘤杂志2018年1月第40卷第1期 Chin J Oncol,January 2018,Vol.40,No.1
[20] 中华人民共和国国家卫生健康委员会,中华医学会肿瘤学分会. 中国结直肠癌诊疗规范(2023年版). 中华外科杂志,2023,61(08):617-644.
排版编辑:栗子











 苏公网安备32059002004080号
苏公网安备32059002004080号


