第二代ALK-TKI已在临床上得到广泛应用,关于ALK-TKI的进展模式、耐药机制和后续治疗一度被广泛研究,但已发布的相关的数据较少。由中国医学科学院肿瘤医院李峻岭、邢镨元教授团队开展的一项回顾性研究分析了第二代ALK-TKI治疗后的相关机制和策略[1]。【肿瘤资讯】特邀邢镨元教授、李峻岭教授进行解读。

研究简介
本研究是一项单中心、回顾性研究,纳入第二代 ALK-TKI 治疗后进展的ALK阳性晚期NSCLC患者。队列1(n=20)为一线接受第二代ALK-TKI治疗并发生疾病进展的患者,队列2(n=53)为第一代ALK-TKI耐药后序贯第二代ALK-TKI治疗出现疾病进展的患者。研究要求所有入组患者在基线时接受全面的放射学检查,并在随访期间每2-3个月接受一次放射学评估。研究者分析入组患者人口统计学和临床特征,并收集和分析了ALK-TKI耐药后的再活检结果,54.8%(40/73)的患者在对第二代ALK-TKI治疗产生耐药性后进行了再次活检。
耐药机制明显不同,二代ALK-TKIs主要机制为二次突变
ALK-TKI耐药机制大体包括三种类型:中枢神经系统(CNS)药物暴露不足、ALK信号通路依赖性耐药机制和非依赖性耐药机制(包括旁路激活和病理类型转化)。第一代ALK-TKI克唑替尼耐药的主要机制是其血脑屏障渗透率低(脑脊液与血浆药物浓度比为0.26%),导致药物在中枢神经系统暴露不足。第二代 ALK-TKI获得性耐药的主要机制是ALK激酶结构域的二次突变。
本研究二次基因检测结果显示,第二代ALK-TKI治疗进展后有56.8%的患者出现ALK激酶结构域的二次突变,其中G1202R突变是最常见的突变位点,占所有突变类型的48%,其他ALK激酶域二次突变包括I1171N、F1174L、L1196Q等以及复合突变。此外,第二代ALK-TKI的其他耐药机制包括小细胞转化(4.5%)、KRAS扩增(4.5%)、KRAS G12A突变(2.3%)、BRAF V600E突变(2.3%)、BRAF融合(2.3%)、MET扩增(2.3%)(图1)等。
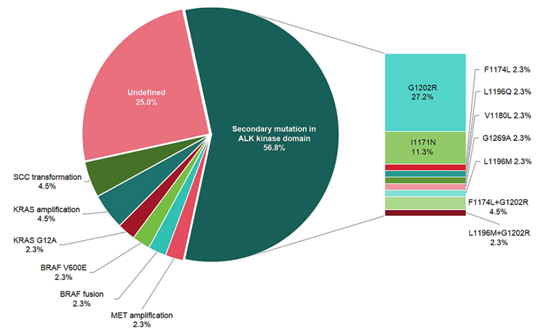
图1 第二代ALK-TKI耐药机制模式图
总体上,G1202R突变是第二代ALK-TKI最常见的获得性耐药突变。其他类型ALK二次突变在不同药物间的发生率有所不同,不同的ALK耐药突变会对第二代ALK-TKI产生不同的敏感性,这为第二代ALK-TKI耐药后的治疗模式提供了更多可能性。
ALK-TKI寡转移患者可优先进行局部治疗
寡进展的定义在病变部位的数量方面仍存在一定争议,本研究将寡进展定义为疾病进展时出现不超过三个靶病灶。寡进展是介于局部和广泛进展之间的中间状态,与更晚期疾病阶段相比,寡进展更具有惰性,可能更适合局部治疗。
本研究针对进展模式的分析发现,ALK-TKI 治疗后约有30%的患者会出现寡进展(队列1:30%,队列 2克唑替尼阶段:34.6%,队列2克唑替尼耐药后阶段:30.2%)。总体可见,约有30%的患者在ALK-TKI耐药性后会出现寡进展。同时,在真实世界队列中, 50%(20/40)的寡进展患者接受了局部治疗,局部治疗可延长靶向治疗时间约6.4个月;而根据进化理论,局部治疗几乎不会诱发复杂的突变。因此,在临床实践中,针对ALK-TKIs 治疗后出现寡进展的患者,联合局部治疗可能是延长患者靶向治疗时间的有效措施。
不同ALK-TKIs耐药后的差异化管理策略
克唑耐药颅内进展以及颅外进展的差异化管理
本研究发现,在总人群中,与初始接受克唑替尼的患者相比,初始接受第二代ALK-TKI的CNS进展率和症状性CNS进展率显著降低,分别为15.0% vs 56.6%(P=0.002)、5.0% vs 32.1%(P=0.016)。因此,克唑替尼治疗后颅内进展,这类患者可序贯具有较好CNS活性的第二代ALK-TKI进行治疗。此外,在经克唑替尼治疗出现颅外进展的个别患者中序贯使用二代ALK-TKIs 发生了原发耐药(包括 1 例病理类型转化为鳞癌的患者,以及 1 例出现I1171N突变,对阿来替尼产生原发性耐药)。
本研究全面分析了克唑替尼耐药后不同疾病进展模式,提出有效的临床管理策略(图 2)。针对克唑替尼耐药后仅出现中枢神经系统进展的患者,第二代ALK-TKI具有更高的CNS渗透率,可发挥显著疗效。而针对克唑替尼耐药后颅外进展患者,临床上仍需再次活检并进行NGS检测,需要根据耐药位点选择有效的第二代ALK-TKI。
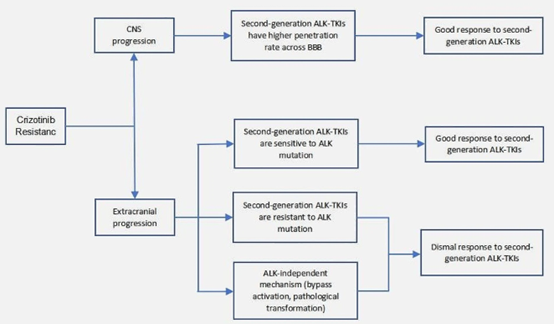 图2 治疗策略图
图2 治疗策略图
第二代ALK-TKI耐药后的后续治疗选择
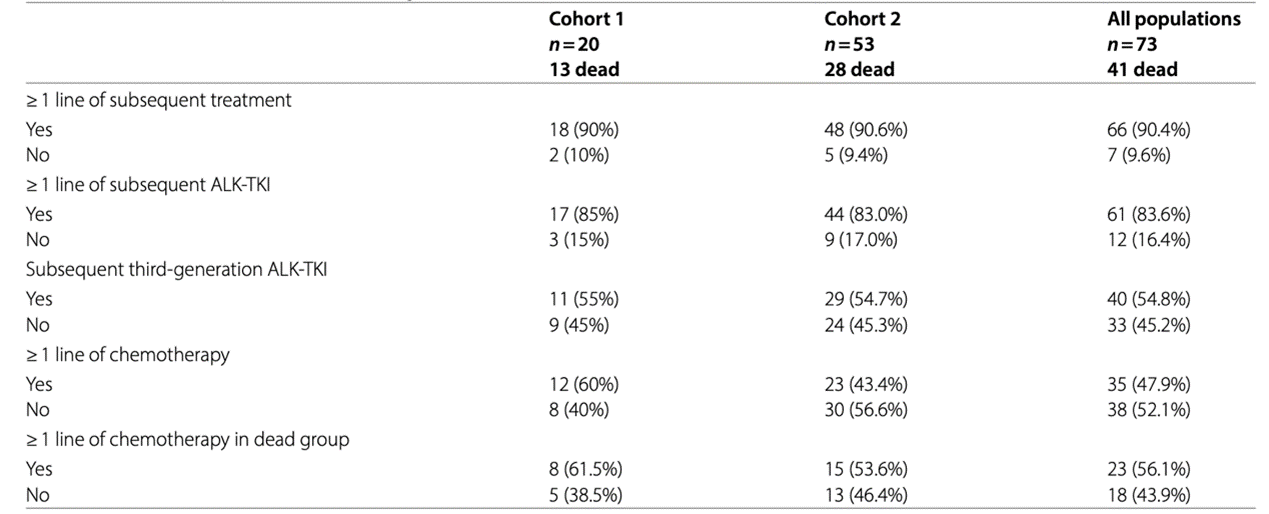
本研究中,第二代ALK-TKI产生耐药后的治疗情况如表1。总体而言,83.6%的患者在二代ALK-TKI治疗进展后接受了至少一种替代ALK-TKI治疗。
表1 真实世界中第二代ALK-TKI耐药后的治疗选择
对于第二代ALK-TKI治疗后出现进展的患者,通常根据ALK耐药位点选择合适的 ALK-TKI,本研究中结合再次活检的结果分析(图4),在对第二代ALK-TKI产生耐药的患者中,共有35名再次活检的患者随后接受了其他ALK-TKI治疗,其中包括22名携带ALK激酶结构域二次突变的患者和13名未检测到ALK耐药突变的患者。不同突变患者选择使用的ALK-TKI的类型如图所示。对于无ALK 耐药突变的患者,目前最佳的后续治疗策略仍缺乏相关报道。
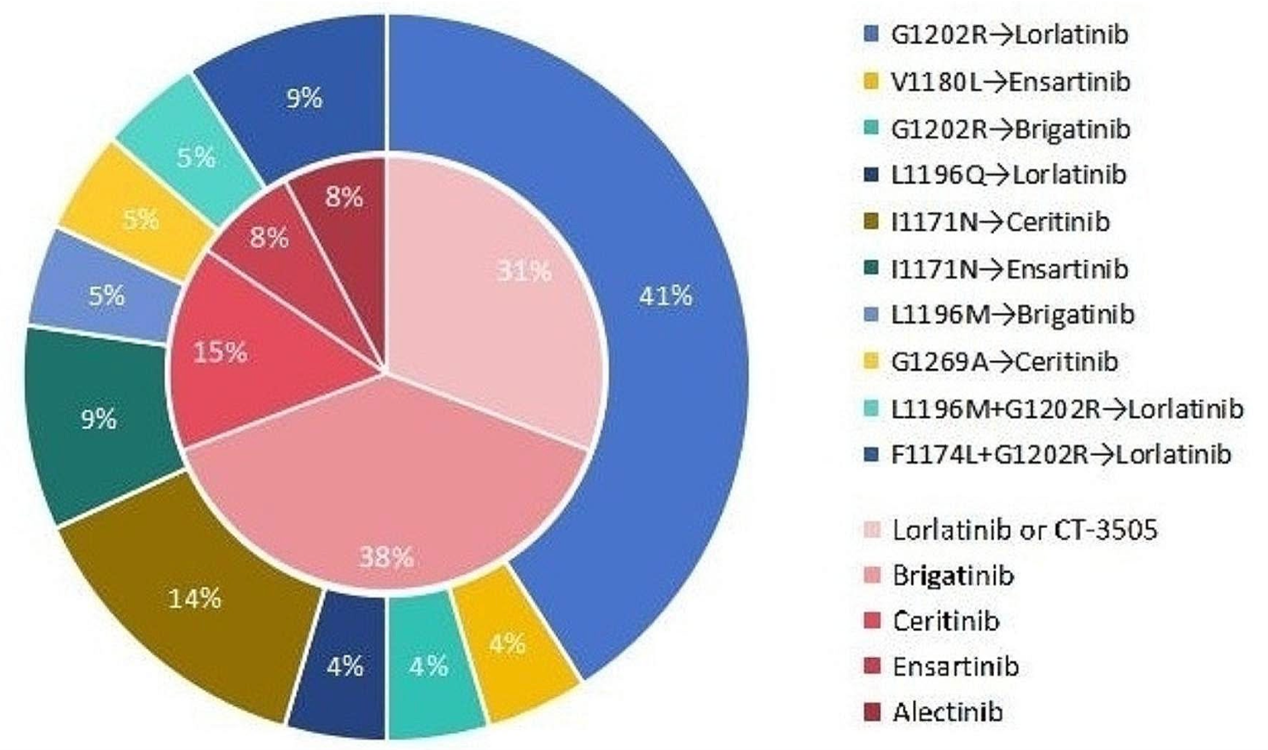
图 3再次活检后再给予ALK-TKI治疗
(外层表示:ALK二次耐药突变患者(n=22)接受后续ALK-TKI;内层表示:未检测到ALK耐药突变患者(n=13)接受后续ALK-TKI)
本研究结果显示,与无ALK二次突变患者相比,ALK二次突变患者序贯其他ALK-TKI治疗时显示出明显延长的PFS(8.6个月 vs 2.7个月,P=0.021,HR=0.43),和数值上更长的OS(NA vs 11.9个月,P=0.132,HR = 0.50)(图 4)。
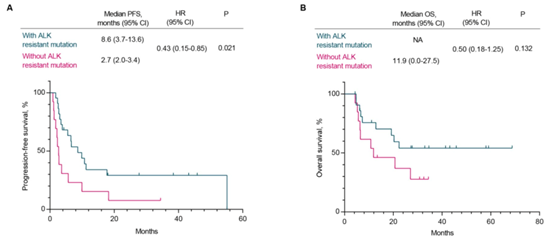
图 4 第二代ALK-TKI耐药后患者接受其他ALK-TKI疗法的PFS和OS结果。A)PFS;B)OS
排除3例复合突变患者后重新分析发现,ALK二次突变患者的中位PFS为10.8个月,中位OS尚未达到。无ALK二次突变患者的中位PFS为2.7个月,中位OS为11.9个月(图5)。
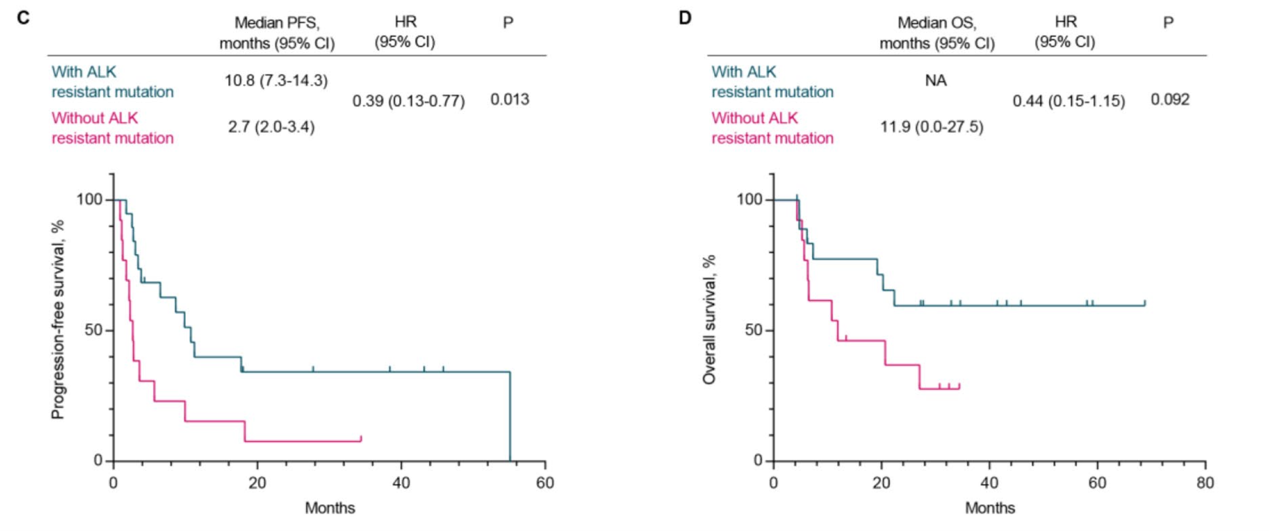
图5 第二代ALK-TKI耐药后患者接受其他ALK-TKI疗法的PFS和OS结果(排除ALK复合突变)。A)PFS;B)OS
结语
在精准诊疗的时代,ALK-TKI的进展模式及后续治疗是临床医生重点关注的问题。这项真实世界研究结果显示,第二代ALK-TKI进展后的主要耐药机制为ALK激酶域二次突变;ALK阳性晚期NSCLC患者接受第二代ALK-TKI后,有超过80%的患者至少接受了替代ALK-TKI治疗;而相比无ALK耐药突变患者,ALK耐药突变患者接受替代ALK-TKI显示出更优的PFS和OS。关于局限性,由于本研究样本量不足,第二代ALK-TKI作为一线治疗和二线治疗的耐药机制,文中未做进一步分层分析。整体而言,基于临床治疗模式,识别耐药机制及选择更有效的ALK-TKI是此类患者治疗的关键点之一,有望为患者带来“精准化”全程管理。有研究显示,布格替尼及洛拉替尼对17种ALK突变体具有较优的抑制作用,包括G1202R、L1152R、I1171N、V1180L、L1196M、G1269A等耐药突变[2,3]。期待未来有更多针对ALK阳性晚期NSCLC的真实世界研究,为临床治疗提供指引和参考依据。
专家介绍
中国医学科学院肿瘤医院
北京协和医学院 肿瘤学博士
中国抗癌协会肿瘤临床化疗专业委员会青委会 副主任委员
北京肿瘤防治研究会转化医学分会 候任主委
北京整合医学学会肺癌专业委员会 副主任委员
中国老年学会肿瘤专业委员会靶向治疗分会 常委
中国医药教育协会头颈肿瘤专业委员会 常委
中国医疗保健国际交流促进会肿瘤内科分会 委员
中国研究型医院学会分子肿瘤与免疫治疗专业委员会 委员
中国女医师协会肿瘤专业委员会 委员北京乳腺病防治学会肿瘤免疫治疗专业委员会 委员
中国医学科学院北京协和医学院肿瘤医院内科
北京协和医学院研究生院 博士生导师
美国临床肿瘤学会(ASCO)会员
欧洲肿瘤内科学会(ESMO)会员
国际肺癌研究协会(IASLC)会员
北京肿瘤防治研究会转化医学分委会 首任主任委员
2011年被遴选为首批北京健康科普专家
主要从事肺癌的内科治疗,包括化疗、靶向及免疫治疗。擅长解决临床具体问题,倡导对肺癌患者治疗中的全方位照护。关注肺癌真实世界的临床研究及转化医学研究,在该领域以第一/通讯作者发表SCI论文70篇,累计影响因子245。
[1]Wu L, Zou Z, Li Y, Hao X, Ying J, Li J, Xing P. Progression patterns, resistant mechanisms and subsequent therapy for ALK-positive NSCLC in the era of second-generation ALK-TKIs. J Transl Med. 2024 Jun 20;22(1):585. doi: 10.1186/s12967-024-05388-0. PMID: 38902768; PMCID: PMC11191366.
[2] Popat, S., Liu, G., Lu, S., et al. Brigatinib Versus Alectinib in Crizotinib-Resistant Advanced Anaplastic Lymphoma Kinase-Positive Non-Small-Cell Lung Cancer (ALTA-3). Future Oncology, 17(32), 4237–4247.https://doi.org/10.2217/fon-2021-0608
[3]Horn L, Whisenant JG, Wakelee H, et al. Monitoring Therapeutic Response and Resistance: Analysis of Circulating Tumor DNA in Patients With ALK+ Lung Cancer. J Thorac Oncol. 2019 Nov;14(11):1901-1911. doi: 10.1016/j.jtho.2019.08.003. Epub 2019 Aug 22. PMID: 31446141; PMCID: PMC6823161.
责任编辑:肿瘤资讯-Yuno
排版编辑:肿瘤资讯-LWT











 苏公网安备32059002004080号
苏公网安备32059002004080号


