内分泌治疗在激素受体阳性乳腺癌中扮演着至关重要的角色,并与患者的绝经状态密切相关。本文旨在深入探讨关于乳腺癌患者绝经状态判断的两个关键问题。第一,针对绝经前患者添加卵巢功能抑制(ovarian function suppression,OFS)治疗后,雌二醇(estradiol,E2)数值仍超标,可能存在“真性”超标和“假性”超标两种情况,氟维司群、阿贝西利、依西美坦及他莫昔芬等内分泌治疗药物可能干扰E2测定结果,需要警惕检测性“假性”超标的可能性。第二,在判断OFS治疗下患者是否已进入生理性绝经状态时,需考虑化疗对绝经状态的影响、围绝经期内分泌变化的复杂性等因素。建议根据患者年龄及内分泌治疗方案,考虑转换治疗并定期监测血清E2和卵泡刺激素(follicle-stimulating hormone,FSH)水平,针对疑难情况可综合抗缪勒管激素(anti-Mullerian hormone,AMH)、抑制素B(inhibin B,INHB)和雄激素等指标进行评估。
张 剑. 关于女性乳腺癌患者绝经状态判断两个关键问题的临床思考[J]. 中国癌症杂志, 2024, 34 (7): 619-627.
内分泌治疗是激素受体阳性乳腺癌患者的重要治疗手段,其具体实施的形式及有效性与患者绝经状态密切相关。绝经前中高危女性乳腺癌患者在原有内分泌治疗的基础上添加卵巢功能抑制(ovarian function suppression,OFS)治疗可进一步降低复发风险并改善生存,同时在特定人群中可部分满足卵巢功能保护需求。《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)》[1]发布后,受到广泛关注和认可,该共识梳理了OFS的获益人群、用药方式及安全管理等重要信息,并提供了“早期/局部晚期乳腺癌患者OFS药物应用的全程管理路径”,使临床医师对OFS药物应用有了更深刻的认识。但在共识解读和推广的过程中,发现有一些关键问题仍值得推敲,例如,如何看待绝经前患者OFS药物使用后E2数值仍超标,OFS药物使用中如何判断患者已经进入生理性绝经状态。针对这些临床实践中的疑惑,笔者尝试用通俗易懂的语言分享自己的经验和思考,供同行们参考,希望对临床实践有所裨益。
关于女性乳腺癌患者绝经状态判断的两个关键问题
问题1:如何看待绝经前患者OFS药物使用后E2数值仍超标
笔者认为这个问题要分2个方面讨论:① E2超标(意味着OFS逃逸)的“标”应当使用什么数值;② 这个E2超标是“真性”超标,还是 “假性”超标。
首先第1个方面,2024年V4版美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[2]将绝经定义为月经永久停止,包括显著性和永久性的卵巢雌激素合成减少。这个定义突出了绝经的本质:性腺轴抑制后的卵巢功能衰竭。对绝经状态的评价需结合年龄、闭经时长、E2和卵泡刺激素(follicle-stimulating hormone,FSH)水平综合判断(表1)[3-10]。在临床研究中,接受OFS药物干预患者的绝经状态通常用E2水平来判断,但E2的界值判定缺乏统一标准,SOFT-EST研究[3]和Smith等[4]的研究采用了严格的2.72 pg/mL作为界值,少数研究将10、20 pg/mL甚至50 pg/mL作为界值,更多研究将30 pg/mL(即110 pmol/L)作为OFS逃逸与否的界值,笔者依据多年的临床实践经验建议将E2的界值定为30 pg/mL,也符合《中国绝经前女性乳腺癌患者辅助治疗后绝经判断标准及芳香化酶临床应用共识(草案修正案)》[11]的推荐。

其次第2个方面,任何临床上不合常理的E2超标都应警惕检测性“假性”超标的可能性,无论是否使用OFS药物。E2的检测灵敏度和特异度会因仪器不同而产生差异,使用部分方法检测时,某些常见的乳腺癌治疗药物可能会干扰E2的测定,混淆评估结果(表2)。笔者将检测性 “假性”超标分类如下,供临床参考。
⑴ 氟维司群引起的E2检测性“假性”超标:笔者在既往工作中,经常遇到或被咨询关于使用氟维司群的患者出现不合理的E2增高的问题,笔者通过查阅文献,并采用不同检测方法复核,鉴定出一部分免疫测定法测得的 “假性”超标案例,同时,文献也显示,Owen等[12]的对照试验评估了化学发光免疫分析仪器Siemens Centaur XP(SC,检测限为70 pmol/L)和Abbott Architect(AA,检测限为92 pmol/L)对氟维司群治疗下乳腺癌患者E2水平的测量准确度,以液相色谱串联质谱法(liquid chromatography-mass spectrometry,LC-MS/MS)(检测限为10 pmol/L)作为参考,在未发生肿瘤的女性队列(年龄17~50岁)中,SC和AA对E2的检测结果与LC-MS/MS具有较高的相关性(R2=0.98和0.99),验证了无药物干扰时SC和AA仪器的准确度,在晚期乳腺癌的氟维司群治疗队列中,SC测量的中位E2为356 pmol/L,AA为186 pmol/L,LC-MS/MS为<14 pmol/L,SC和AA测得的E2始终比LC-MS/MS更高,提示氟维司群会引起E2免疫测定值偏高。体外试验证明氟维司群可能直接对E2测定产生影响,Samuel等[13]将氟维司群加入到男性血浆样本中,使用SC测定,结果显示,样本基线E2和加入氟维司群后(药物浓度达到50 μg/L时)E2的测量结果差异较大(34.7 pmol/L vs 289.0 pmol/L),说明在该免疫测定方法下,氟维司群直接引起E2测定结果偏高。加拿大卫生部曾发布药物警戒称,由于氟维司群与E2在结构上相似,因此可能干扰基于抗体的E2测定[14]。
⑵ 阿贝西利引起的E2检测性“假性”超标:在OFS联合内分泌治疗的基础上,CDK4/6抑制剂可进一步降低激素受体阳性早期乳腺癌的复发风险[15]。自阿贝西利在国内开展研究及上市以来,笔者发现了数十例E2超预期升高的案例,在与检验科沟通后,尝试使用不同检测方法进行复核,特别是使用金标准—质谱分析法后,证实E2恢复到了绝经后范围,提示阿贝西利对E2的特定免疫测定方法存在潜在影响,从而导致E2“假性”超标。不同检测方法的复核能够有效地减少对绝经状态的误判,保障患者得到充分的强化内分泌治疗,避免不良预后。之后,通过查阅文献,发现2023年Kessler等[16]使用美国Abbott公司Alinity通过化学发光微粒免疫测定(chemiluminescent microparticle immunoassay,CMIA)方法测得阿贝西利治疗的手术去势乳腺癌患者的E2水平升高,但使用LC-MS/MS测得的E2水平较低,该研究随后纳入22例接受OFS联合阿贝西利治疗的绝经前早期乳腺癌患者,比较CMIA与LC-MS/MS的E2测量差异及随后的治疗方案变化,结果显示,高达91%的患者使用CMIA测定的E2水平出现假阳性,错误地提示卵巢功能抑制不足,这篇文献也是对笔者现有发现的一个有力佐证,提示特定检测试剂可能是导致阿贝西利引起E2假性超标的重要原因。
⑶ 依西美坦引起的E2检测性“假性”超标:依西美坦是常用的甾体类AI药物,Mandic等[17]报告了1例接受依西美坦治疗的乳腺癌患者在免疫测定中出现E2“假性”升高,该患者血清样本使用ARCHITECT i1000SR分析仪(美国Abbott公司)通过CMIA方法测得E2为124.0 pmol/L,使用COBAS E411分析仪(瑞士Roche公司)通过电化学发光免疫分析方法测得E2为89.4 pmol/L,而使用LC-MS/MS测得E2低于限定值(<37 pmol/L),LC-MS/MS测得的E2水平与该患者的临床检查结果一致,因此判断免疫测定中E2“假性”升高。此外,该研究还评估了依西美坦是否直接对E2测定产生影响,将依西美坦加入血浆样本,使用瑞士Roche公司免疫分析仪,基于电化学发光免疫分析方法检测E2水平,结果没有检测到交叉反应,推测依西美坦不会直接影响E2检测。依西美坦通过结合芳香化酶并不可逆地使其失活,从而阻止雌激素的生物合成。依西美坦代谢过程中17-酮基还原后与E2的17-羟基相似。结合上述研究,依西美坦导致E2“假性”超标的原因可能是其代谢产物引起免疫测定仪器的交叉反应。
⑷ TAM引起的E2检测性“假性”超标:笔者在临床实践中,偶尔会发现围绝经期使用TAM的患者即使联合OFS仍出现E2严重超标,考虑到OFS的使用会消减负反馈机制,除TAM直接影响卵巢颗粒细胞导致E2超标[12]的原因之外,可能还存在一部分检测的原因。陈祎霏等[9]的研究中提及1例患者曾将OFS联合AI调整为OFS联合TAM治疗,出现E2水平升高后改回OFS联合AI治疗,监测期间未再次出现OFS逃逸,研究人员推测,因TAM结构与雌激素相似,有引起E2水平“假性”升高的可能。目前尚无研究针对性鉴别TAM引起E2的升高是否源于其结构对仪器的干扰,此问题有待进一步探讨。

同样,在排除了检测性“假性”超标后,也要认识到“真性”超标有特定的生理学基础,并需要判断这种“真性”超标是否会影响目前的内分泌治疗决策。
⑴ 周期波动性、一过性E2水平超标:乳腺癌患者的E2水平存在生理学周期性波动[2],即使生理性绝经后的患者激素水平也会发生变化[21]。在乳腺癌内分泌治疗中,OFS可抑制患者的E2水平。临床应用的OFS药物主要包括促性腺激素释放激素类似物(gonadotropin releasing hormone analog,GnRHa)。GnRHa有3个月和1个月给药剂型,两者均可有效地降低雌激素水平并达到卵巢抑制的效果[22]。近期一项中国真实世界研究[23]回顾性分析了1个月或3个月GnRHa联合选择性雌激素受体调节剂(selective estrogen receptor modulator,SERM)或AI类药物治疗早期绝经前激素受体阳性乳腺癌患者的有效性和安全性,结果显示,所有年龄组,无论联合SERM或AI,3个月剂型GnRHa的OFS均非劣于1个月剂型,且1个月剂型和3个月剂型组在24个月内E2抑制率均>90%。在随访期间,该研究的950例患者中有60例(6.3%)至少经历过1次不完全的OFS(E2>30 pg/mL),且完全的OFS患者和不完全的OFS患者的无病生存期和总生存期无显著差异[23]。这一结果提示,偶尔发生的卵巢去势逃逸,即雌激素水平超标或不影响预后。然而, OFS在首次给药时,由于高活性的GnRHa对垂体-性腺系统的刺激作用,可能导致E2水平的一过性升高[24]。笔者认为,需谨慎解释E2单次检测的结果,以避免对治疗决策产生误导。
⑵ 个体因素导致的E2水平超标:接受OFS或已自然绝经的患者可能会出现由于个体因素(如高体重指数)而出现E2抑制不足的情况。由于血清雌激素的主要来源是脂肪组织,超重患者可能有更多的雌激素前体储备供芳香化酶代谢,即使接受OFS治疗,患者也可能因脂肪组织的贡献而导致E2水平高于绝经后范围[25]。笔者认为,这类患者在接受内分泌治疗时,即使应用OFS药物,也应尽量在联合用药时选择SERM,而非AI或氟维司群。当然,减重降脂对下调E2也会起到积极作用。
⑶ SERM类药物负反馈机制导致的E2水平超标:在乳腺癌内分泌治疗中如未添加OFS药物,只使用TAM,TAM可能通过阻断雌激素对下丘脑的负反馈机制来增加GnRH分泌,继而引起垂体过度分泌促性腺激素,刺激卵巢产生大量E2。Kim等[26]的横断面研究显示,在TAM治疗期间,9.3%的乳腺癌患者出现血清E2超生理水平现象(>400 pg/mL,高于单个卵泡产生的正常E2水平),多变量分析显示,此现象与年龄<40岁有关(P=0.015)。目前,尚无证据表明TAM引起的E2升高对患者预后有何影响,针对TAM引起E2升高应给予何种处理仍缺乏明确指导[27]。笔者认为,虽然基于负反馈机制及TAM直接影响卵巢颗粒细胞都可能导致E2超标,但考虑到TAM本身能通过竞争性结合雌激素受体(estrogen receptor,ER),阻止ER天然配体结合域募集共激活因子,进而减少生理ER信号介导的转录激活,且绝大部分ER会被TAM动态占据,这种E2的超标实际上无法发挥其相应的生物学效能,并不影响TAM的继续使用,临床医师也可尝试加用GnRHa药物来抑制该负反馈机制进而降低E2。
问题2:OFS药物使用中如何判断患者已经进入生理性绝经状态?
笔者认为,OFS治疗中判断生理性绝经的动力在于:如果能明确患者的绝经状态,可以避免不必要的后续OFS药物治疗,也可避免不必要的双侧卵巢切除。对于普通人群而言,绝经通常在闭经12个月后才可诊断,而乳腺癌化疗对绝经前乳腺癌患者的影响增加了判断其是否处于稳定绝经状态的难度。化疗往往会引起卵巢损伤乃至功能衰竭,并导致月经周期不规律甚至闭经。然而,闭经并不完全代表着绝经,闭经可能只是临时性月经暂停的表现。ASTRRA研究[28]纳入年龄<45岁的患者,发现81.4%的患者在化疗结束1年后恢复了卵巢功能,95.1%的患者在化疗结束2年后恢复了卵巢功能,说明对于绝大多数年轻患者,化疗后闭经只是暂时的,等待月经恢复将延误OFS药物应用时机,尤其会影响中高危患者的生存获益。因此,《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)》[1]推荐GnRHa用药根据激素受体阳性乳腺癌患者化疗前的卵巢功能状态进行决策,不推荐化疗前未绝经的中高危患者在化疗后长期等待确认卵巢功能后再使用OFS。国内外指南中关于绝经状态的判断标准见表3[2,11,29-31]。
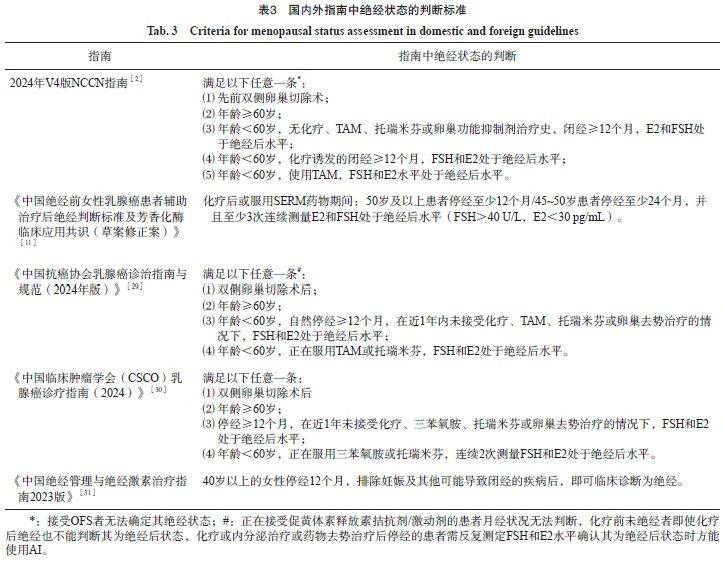
除化疗对绝经状态的影响外,围绝经期也会增加绝经判断的难度。在临床实践中,笔者经常遇到45~50岁的患者在接受OFS药物治疗2~3年后因不良反应、经济条件等原因考虑更换治疗方案,但无法确定实际的月经情况,进而无法确定是否需要继续联用OFS药物。由于乳腺癌的发病高峰年龄为48~55岁,正处于围绝经期范围,因此围绝经期乳腺癌患者的绝经状态判断是临床常见的难题。尤其对于使用AI类药物治疗的围绝经期患者,由于AI类药物的疗效会受到卵巢功能的影响,因此临床上需要判断OFS药物治疗下的围绝经期患者是否已实际处于生理性绝经状态,以指导后续内分泌治疗的决策。目前并无针对全身治疗诱导闭经和本身处于围绝经期患者进行内分泌治疗的单独指南,国内外指南对围绝经期的推荐处理多与绝经前一致。实际上,在OFS药物的作用下,确定全身治疗诱导闭经或围绝经期患者是否已达到生理性绝经状态是一个概率问题。笔者基于临床经验提供一些思路和建议。首先,可基于患者年龄进行初步判断,对于开始OFS药物治疗时年龄小于45岁的女性,我们不建议在OFS药物使用过程中轻易作出生理性绝经状态的判断,除非患者具有卵巢早衰家族史,或患者OFS药物已经使用5年且年龄已接近50岁。其次,中国女性开始进入围绝经期的平均年龄为46岁,约90%的女性在45~55岁之间绝经[31],当患者年龄超过该范围或超过其母亲的绝经年龄,可推测患者有一定概率处于生理性绝经状态。围绝经期患者的绝经判断需考量合适的时机和患者的个体需求。对于>45岁且正在使用OFS药物的患者,完成2~3年甚至5年的内分泌治疗且有调整方案需求时,是判断患者是否已进入生理绝经状态较为理想的时机。同时,也需要充分考虑患者需求,如患者在接受OFS药物治疗时出现了难以耐受的不良反应(如注射部位皮肤疼痛或出血)或经济负担较重。在综合考虑上述因素后,结合个体差异和妇科建议,可根据内分泌治疗方案的不同进行以下尝试。
⑴ 针对AI联合OFS药物治疗的患者,有两种思路可供参考:① 停用OFS,并定期(如每月1次)监测患者的E2和FSH水平,若E2仍处于绝经后水平超过至少半年,可基本判断已进入生理性绝经状态,此时FSH不强求一定存在反馈性增高(如可能合并垂体反馈功能不佳);② 可转换为单用SERM类药物,并定期监测E2和FSH水平,考虑到SERM类药物可通过负反馈机制和直接影响卵巢颗粒细胞增加E2水平,如E2在这种情形下也持续处于绝经后水平,则更大概率表明患者已经进入生理性绝经状态。
⑵ 针对OFS联合SERM类药物或氟维司群治疗的患者,也可以直接停用OFS,并参照针对AI联合OFS药物治疗的路径管理和判断。
当然,上述判断过程并非100%准确无误,但据笔者观察,出现例外的情况很少。如有特殊情况,可结合反映卵巢功能的其他指标,如抗缪勒管激素(anti-Mullerian hormone,AMH)、抑制素B(inhibin B,INHB)和雄激素等综合判断。AMH是由卵巢内的窦前卵泡分泌的,可反映卵泡储备水平和卵泡质量[32];INHB主要是由中小窦状卵泡的颗粒细胞分泌的,可反馈性地抑制FSH,有研究[33]认为INHB水平可作为卵巢功能开始衰退进入围绝经期起点的标志。此外,临床上也可按照疾病需要放弃或延后判断患者的绝经状态,继续使用OFS。
总结
本文对乳腺癌绝经状态判断的2个重要问题进行了探讨和释疑,可以作为《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)》[1]的扩展解读。
需再次强调的是,绝经状态的准确评估对乳腺癌患者内分泌治疗方案的制订至关重要。然而,由于E2检测结果可能受到患者个体因素、检测仪器及使用药物等因素的影响,乳腺癌患者的绝经状态判断存在诸多挑战。建议当E2水平与临床诊疗过程不一致时,应考虑到E2“假性”超标的可能,排查是否存在一过性增高或药物引起E2“真性”“假性”超标的可能。患者体内不仅存在大量循环的雌激素,也包括治疗性的甾体化合物及其代谢物,而这些化合物的结构相似性会导致免疫测定受到干扰。此外,部分使用阿贝西利治疗的患者在E2免疫测定和金标准—质谱分析法(如LC-MS/MS或GC/MS/MS)测定结果上存在差异,而这些差异可能会导致绝经状态的误判和不必要的治疗方案调整。在临床实践中,笔者遇到过较多雌激素非预期超标的患者,比如在双侧卵巢切除术后仍显示E2显著超标,后通过质谱分析法确认,大多为假性超标。因此当怀疑存在假性增高时,如条件允许,建议采用金标准—质谱分析法进行复检,从而避免对治疗决策产生误导。
OFS药物使用过程中如何判定绝经一直是个颇具挑战性却又必须面对的问题,目前仍未达成共识。笔者强调,对于开始OFS药物治疗时年 龄<45岁的女性,不要轻易作判断,而对于围绝经期的患者,可尝试采用前文所述两种方式进行判断,特殊情况下可再综合反映卵巢功能的其他指标并参考妇科专家的意见进行判断。
随着未来国内外研究的进展,特别是涉及绝经状态判断方法和技术的发展,乳腺癌患者的绝经状态判断将逐渐成为一个更加明确和可靠的过程,从而为患者制订更精准的治疗方案创造有利条件。












 苏公网安备32059002004080号
苏公网安备32059002004080号


