近年来,非小细胞肺癌(NSCLC)治疗领域取得了显著进展,尤其是分子靶向疗法的兴起,为无数驱动基因突变阳性的患者带来了新的希望。其中,ROS1融合作为NSCLC的一个独特且关键的分子亚型,尽管其发生率较低,但其治疗策略正迅速演进。从克唑替尼的引入,到恩曲替尼等新一代ROS1酪氨酸激酶抑制剂(TKI)的问世,不仅极大地提高了治疗的有效性和安全性,还针对脑转移这一挑战性问题展现了卓越的控制能力。目前,针对ROS1融合阳性NSCLC患者,NCCN NSCLC临床实践指南推荐了恩曲替尼(首选)、克唑替尼(首选)、瑞普替尼(首选)、塞瑞替尼(可选)为一线治疗方案,恩曲替尼、克唑替尼、瑞普替尼、塞瑞替尼以及洛拉替尼为后线治疗方案1。在中国,ROS1融合NSCLC患者的治疗已迈入全新“四足鼎立”时代,克唑替尼、恩曲替尼、安奈克替尼以及瑞普替尼已相继获得国家药品监督管理局(NMPA)批准上市。在ROS1融合阳性NSCLC治疗领域百花齐放的背景下,【肿瘤资讯】特邀四川大学华西医院田攀文教授,分享ROS1融合阳性NSCLC的最新治疗进展,为临床决策提供参考。
四川大学华西医院肺癌中心 副主任
四川省学术与技术带头人
中国抗癌协会肺癌专业委员会青年委员
中国医师协会临床精准医疗委员会青年委员
四川省抗癌协会肿瘤呼吸病学专委会副主任委员
四川省医师协会呼吸医师分会青委会副主任委员
四川省医学会呼吸专委会肺癌学组副组长
ROS1融合阳性NSCLC治疗现状与挑战:从克唑替尼到高效入脑药物的迫切需求
在精准医疗的浪潮下,NSCLC以其独特的分子景观,成为了探索与创新的“热土”。随着对致病机制的不断挖掘,特定致癌驱动突变的逐一揭示,NSCLC的“复杂面貌”逐渐清晰。其中,EGFR突变与ALK融合突变作为两大关键靶点,其靶向治疗的显著疗效为NSCLC靶向治疗领域树立了标杆。
ROS1融合,作为NSCLC的又一特定分子亚型,虽然发生率相对较低(1-2%)2,但在特定患者群体中却具有显著的特征。ROS1融合阳性NSCLC患者通常较为年轻(年龄≤50岁),以女性为主,且普遍无吸烟史,病理类型多为腺癌。尤为引人关注的是,高达40%的晚期ROS1融合阳性NSCLC患者在初次诊断时便已被发现存在脑转移,这进一步增加了治疗的难度和挑战3-5。

图1:ROS1融合阳性NSCLC发生率以及人群特征
克唑替尼是首个经NMPA批准用于ROS1融合阳性晚期NSCLC的ROS1 TKI。I期PROFILE 1001研究显示,克唑替尼在治疗ROS1融合阳性晚期NSCLC患者中具有良好的疗效和可接受的安全性6。然而多数接受克唑替尼治疗的患者会因耐药或中枢神经系统转移而面临疾病进展的困境。特别是,约50%的ROS1融合阳性NSCLC患者在接受克唑替尼治疗后会发生中枢神经系统转移,这使得该类人群对高效入脑药物的临床需求变得尤为迫切7。
ROS1靶向治疗进展浪潮迭起,引领NSCLC治疗新篇章
恩曲替尼:ROS1融合阳性NSCLC治疗的新选择;ROS1融合阳性儿童患者的新希望
恩曲替尼,作为靶向泛TRK及ROS1酪氨酸激酶、具有中枢神经系统活性的强效选择性的抑制剂,在ROS1阳性晚期NSCLC中显示出显著疗效。一项包括3项I-II期临床试验(ALKA-372-001、STARTRK-1、STARTRK-2)汇总分析共纳入了161例ROS1 TKI初治的ROS1融合阳性NSCLC患者,患者接受恩曲替尼治疗。结果显示,客观缓解率(ORR)为68%,中位缓解持续时间(DoR)为20.5个月,中位无进展生存期(PFS)为15.7个月,中位总生存期(OS)为47.8个月。同时,对于基线存在中枢神经系统转移的患者,颅内ORR高达80%,进一步彰显了恩曲替尼在控制脑转移病灶方面的强大能力8。
此外,恩曲替尼在探索ROS1融合的颅外实体瘤或原发性中枢神经系统肿瘤儿童患者治疗中也取得了突破性进展。ASCO 2024年会报道的STARTRK-NG、TAPISTRY和 STARTRK-2研究的汇总分析显示,在未接受TRK/ROS1抑制剂治疗的64例NTRK或ROS1融合儿童患者中,恩曲替尼治疗ROS1队列患儿的ORR为65.0%,且肿瘤应答快速持久,安全性与既往报道一致。这些数据不仅拓宽了恩曲替尼的应用范围,也为其在特定儿童肿瘤治疗中的进一步探索奠定了基础9。
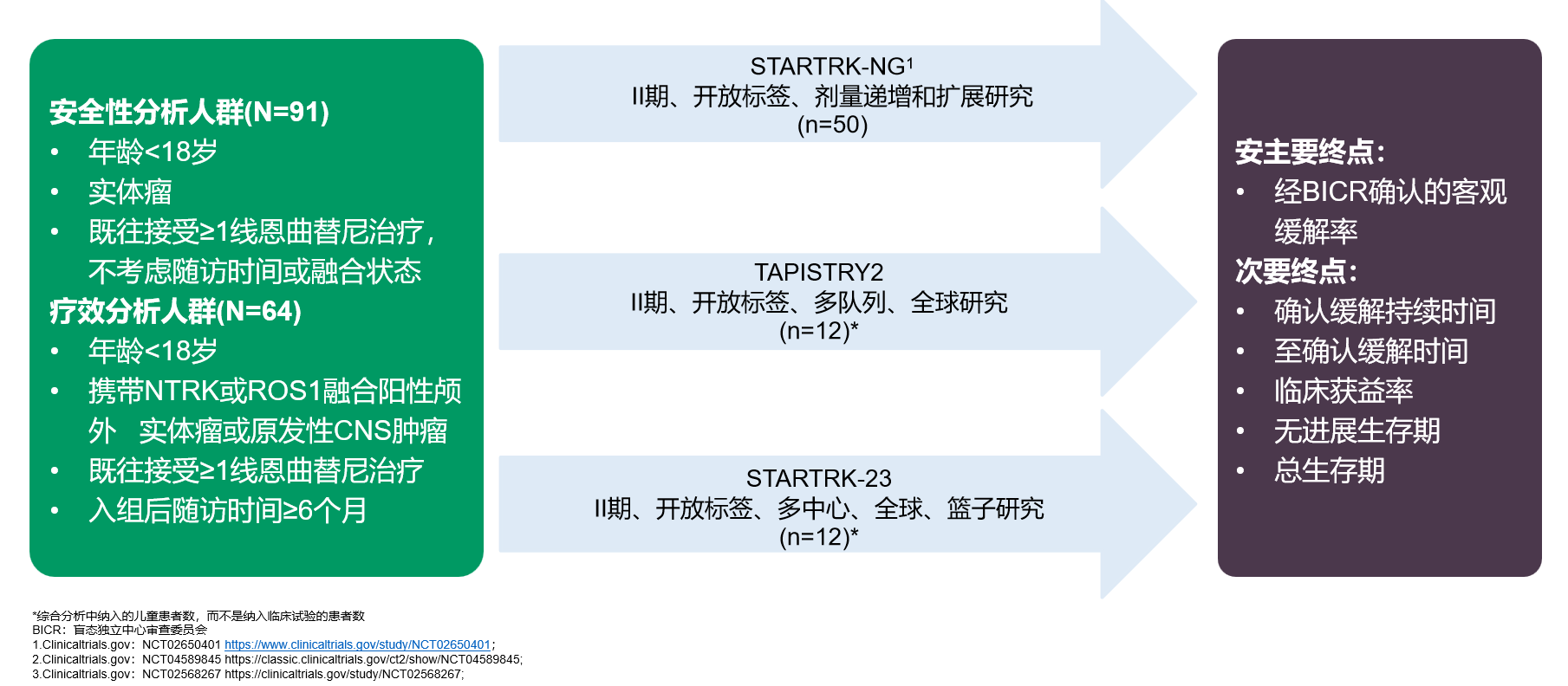
图2:恩曲替尼治疗ROS1融合的颅外实体瘤或原发性中枢神经系统肿瘤儿童患者的汇总分析设计

图3:恩曲替尼治疗ROS1融合的颅外实体瘤或原发性中枢神经系统肿瘤儿童患者的ORR结果
安奈克替尼:ROS1 TKI中国新星
安奈克替尼是一款中国自主研发的靶向ALK/ROS1/c-Met的新型小分子TKI。一项评估安奈克替尼单药治疗既往未经ROS1 TKI治疗的ROS1融合阳性NSCLC患者的疗效和安全性的单臂、多中心II期研究结果显示,在111例疗效可评估的患者中,ORR为80.2%,中位DoR为20.3个月,中位PFS为16.5个月。此外,在基线存在脑转移患者(n=33)中,安奈克替尼亦显示出令人鼓舞的疗效,ORR为72.7%,中位PFS为10.1个月。在基线有颅内靶病灶患者(n=11)中,颅内ORR为72.7%,颅内中位PFS为10.1个月10。
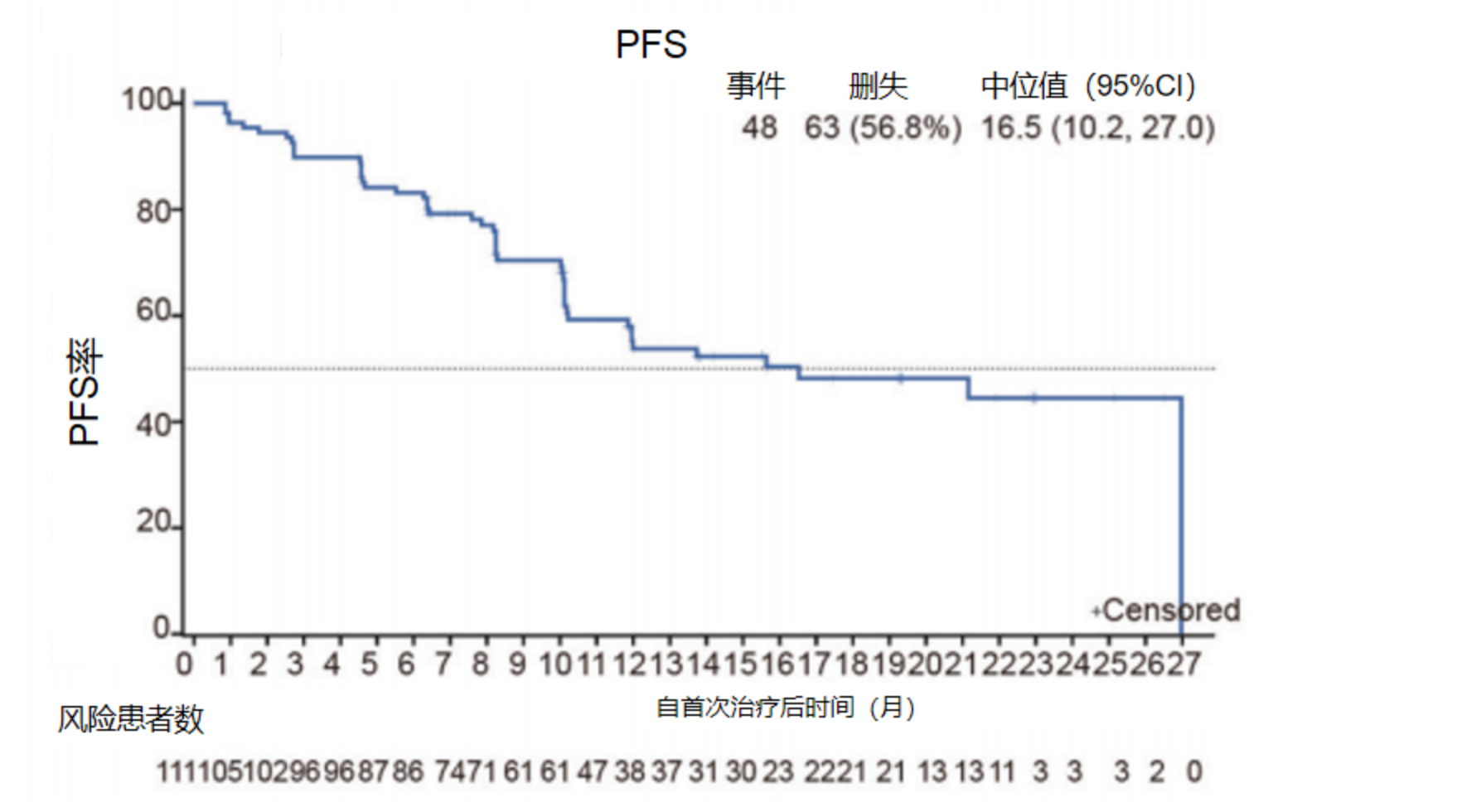
图4:安奈克替尼治疗ROS1融合阳性NSCLC患者的PFS结果
瑞普替尼:新一代ROS1 TKI的崛起
瑞普替尼是新一代ROS1和TRK TKI。ASCO 2024公布的一项1/2期TRIDENT-1研究初治队列(n = 71)的更新结果显示,TKI初治队列的确认的ORR为79%;中位DOR为34.1个月,中位PFS为35.7个月,2年PFS率为63%。在9名有可测量病灶的基线脑转移的患者中,颅内确认的ORR为89%11。
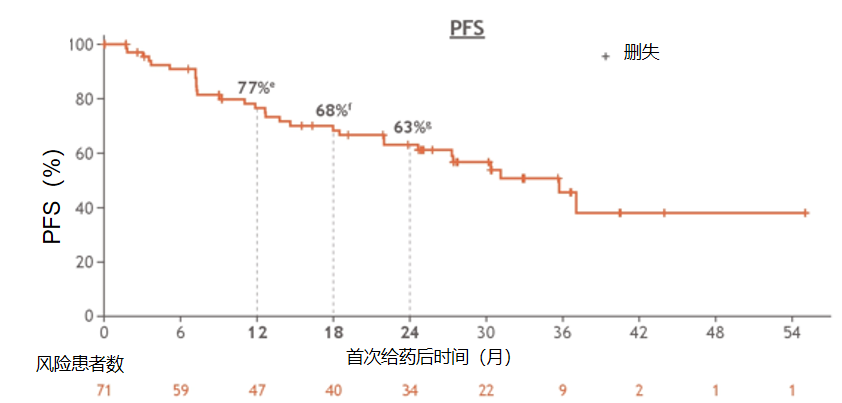
图5:瑞普替尼治疗TKI初治的ROS1融合阳性NSCLC患者的PFS结果
Taletrectinib、塞瑞替尼和洛拉替尼:积极探索的前行者
Taletrectinib是一种高效、具有中枢神经系统活性的、选择性新一代ROS1 TKI。一项在中国开展的多中心、单臂、开放标签、关键II期TRUST-I研究纳入了173例ROS1融合阳性NSCLC患者,患者分为两个队列:TKI初治队列和TKI经治队列。ASCO 2024更新的结果显示,Taletrectinib治疗TKI初治ROS1融合阳性NSCLC患者的确认的ORR达90.6%,中位PFS未达到;治疗既往克唑替尼经治的ROS1融合阳性NSCLC患者的确认的ORR达51.5%,中位PFS达7.6个月12。
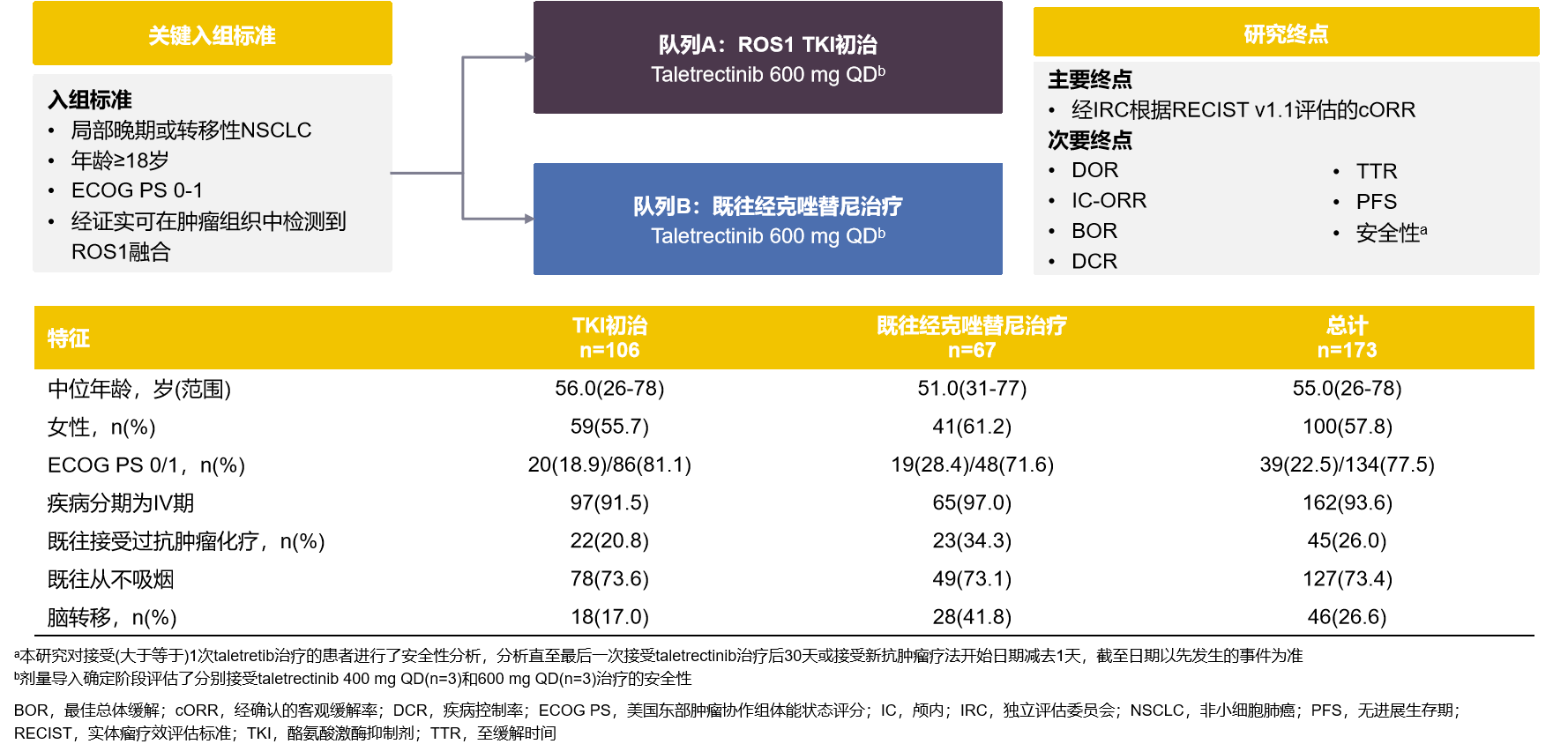
图6:TRUST-I研究设计和基线特征
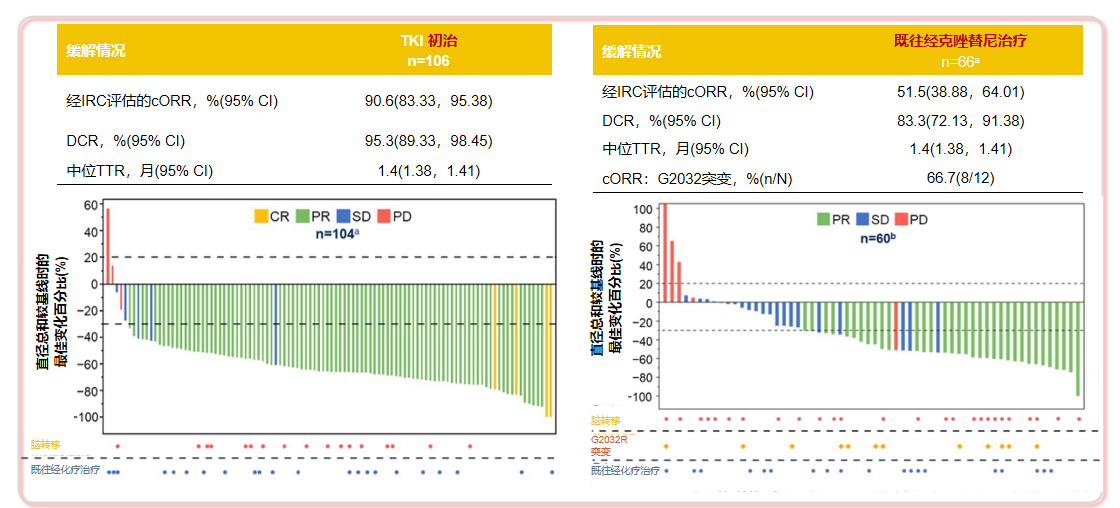
图7:TRUST-I研究的ORR结果
塞瑞替尼是一种可靶向ALK/ROS1的小分子TKI。一项 II 期前瞻性研究评估了塞瑞替尼用于既往未接受/接受克唑替尼治疗的ROS1融合阳性NSCLC患者(n=32)的疗效和安全性。结果显示,塞瑞替尼具有显著的临床活性。在全人群中,ORR为62%,中位PFS为9.3个月。在未接受克唑替尼治疗的患者(n=30)中,ORR为67%,中位PFS为19.3 个月,同时,在脑转移患者(n=8)中,颅内ORR为63%13。
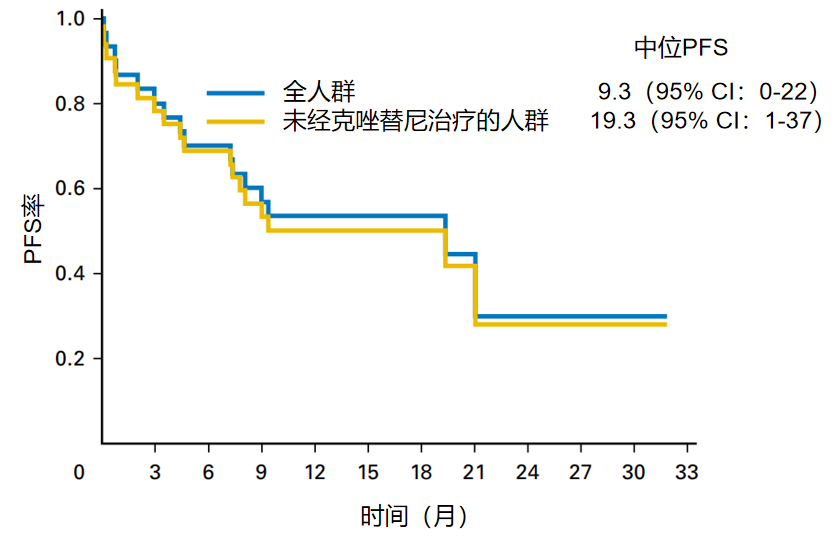
图8:塞瑞替尼治疗ROS1融合阳性NSCLC患者的PFS结果
洛拉替尼是一种具中枢神经系统穿透力的第三代ALK/ROS1 TKI。一项前瞻性、多中心、单臂、II 期研究共纳入了32例未接受TKI治疗的ROS1融合阳性 NSCLC患者(脑转移:n=28),患者接受洛拉替尼治疗,结果显示,ORR为80%,中位PFS和OS分别为53.7个月和未达到14。
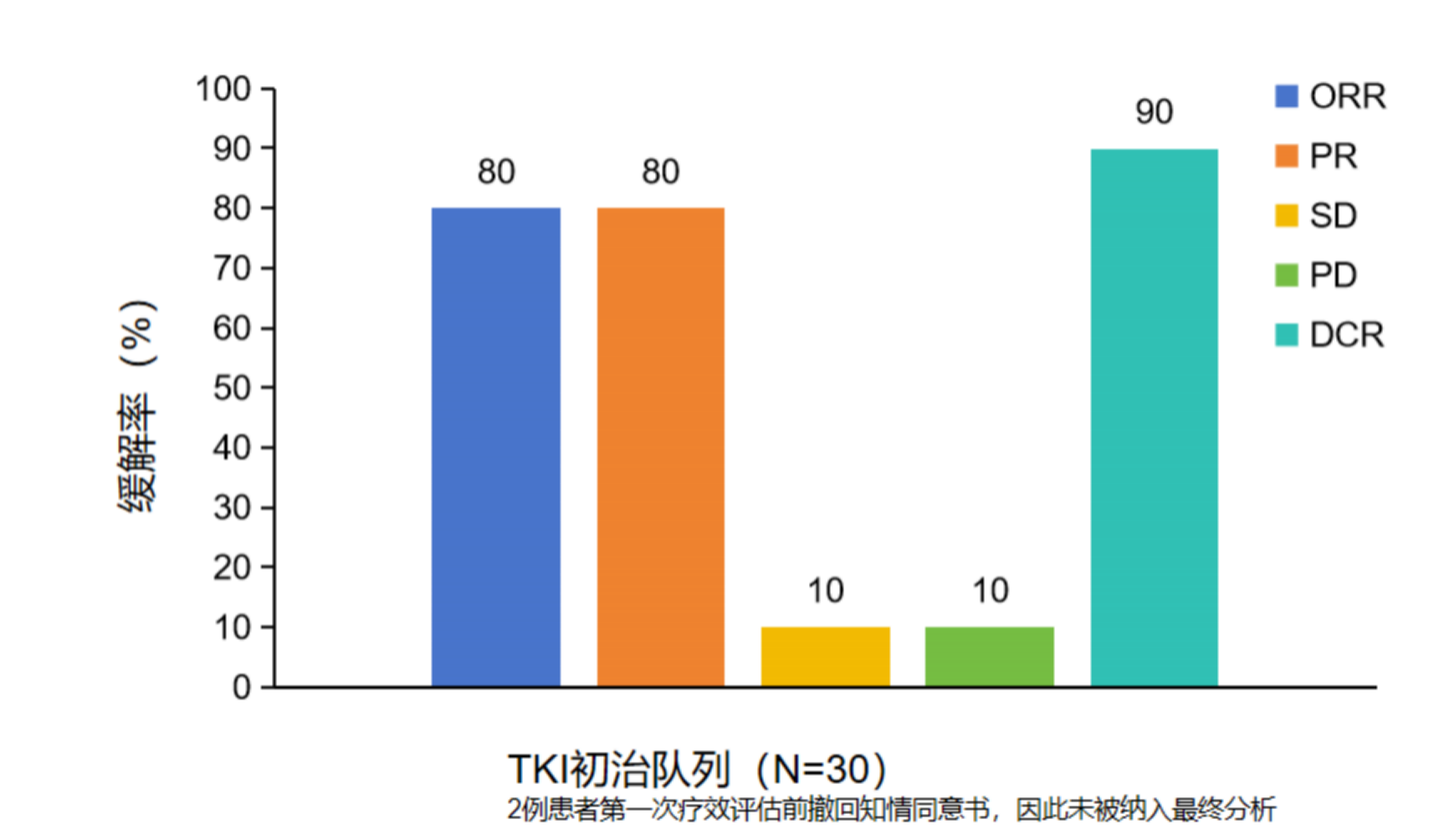
图9:洛拉替尼治疗TKI初治的ROS1融合阳性NSCLC患者的ORR结果
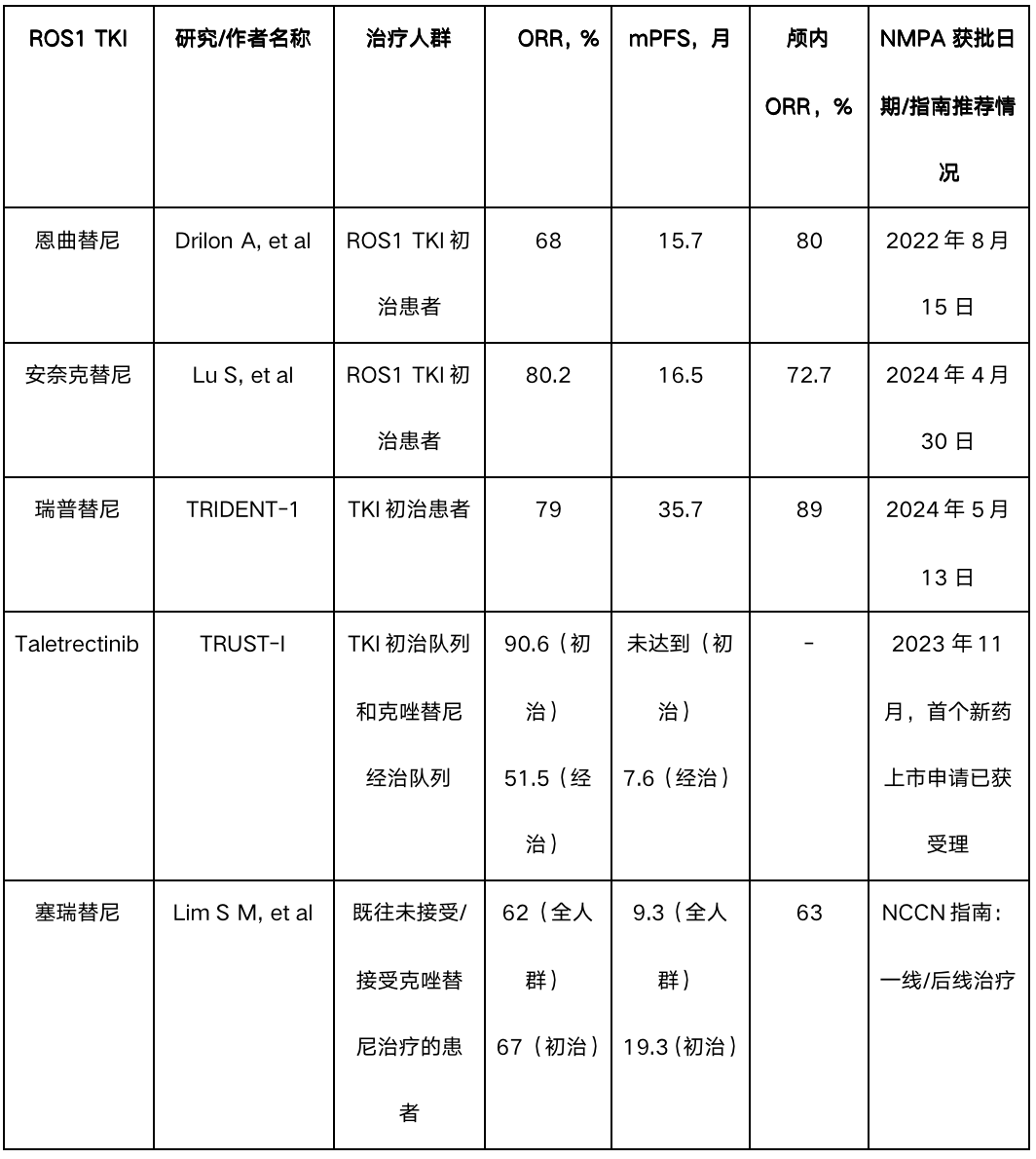
表1:ROS1融合阳性NSCLC靶向治疗进展汇总
非头对头研究,数据不可直接对比
结语
在精准医疗时代,ROS1融合阳性NSCLC的治疗迎来多元化发展。恩曲替尼、Taletrectinib及瑞普替尼等新型ROS1 TKI展现了卓越疗效,尤其在控制脑转移方面表现突出。这些药物的研发与应用,为治疗带来了新选择,标志着ROS1融合阳性NSCLC治疗进入了一个高效、精准的新阶段。随着研究的深入,未来将有更多创新疗法惠及该类患者。
参考文献
1. NCCN Guidelines. Non small cell lung cancer. 2024 v7
2. Transl Lung Cancer Res 2014;3(5):270-279
3. 中华病理学杂志, 2021,50(8) : 882-890
4. Marchetti, et al. JCO Precis Oncol 2017
5. Wilson, et al. ESMO 2019
6. Shaw A T, et al. Annals of oncology, 2019, 30(7): 1121-1126
7. Shen and Lu. WCLC 2017
8. Drilon A, et al. JTO Clinical and Research Reports, 2022, 3(6): 100332
9. Ami V. Desai, et al. 2024 ASCO 10000
10. Lu S, et al. Signal Transduct Target Ther. 2023;8(1):249
11. Alexander E. Drilon et al. 2024 ASCO 8522
12. Li W, et al. 2024 ASCO 8520
13. Lim S M, et al. Journal of clinical oncology, 2017, 35(23): 2613-2618.
14. Beung Chul AHN, et al. 2024 ASCO 8519











 苏公网安备32059002004080号
苏公网安备32059002004080号


