(以下内容仅供医学药学专业人士阅读参考,如您非前述专业人士,请离开本页。)
卡马替尼在携带EGFR野生型、ALK重排阴性(ALK-R−)、METex14跳跃突变(METex14)的中国成人晚期NSCLC患者中的研究:来自II期GEOMETRY-C研究的结果[1]
Capmatinib in Chinese adults with EGFR wt, ALK rearrangement negative (ALK-R−), MET exon 14 skipping mutation (METex14), advanced NSCLC: Results from the phase II GEOMETRY-C study
Yilong Wu, et al.
2022 ESMO Asia
背景:卡马替尼是一种选择性的MET抑制剂,已在全球40多个国家获批使用,包括美国和欧盟。我们报告了卡马替尼单药在中国未经治疗的METex14跳突晚期NSCLC患者中的疗效和安全性。
方法:在这项正在进行的、多中心、2队列研究中(初治[队列1]或经治[队列2]),年龄≥18岁的中国患者,携带野生型EGFR、ALK-R−、IIIB/IIIC/IV期,METex14 NSCLC,每天两次接受400毫克卡马替尼治疗。排除了之前接受过任何MET抑制剂治疗的患者。主要终点是盲法独立审查委员会(BIRC)根据RECIST 1.1评估的总缓解率(ORR)。次要终点包括缓解持续时间(DOR)、无进展生存期(PFS)、总生存期(OS)和安全性等。在这里,我们描述了队列1的主要分析结果。
结果:截至数据截止日期(DCO)2022年4月18日,共有15名患者(中位年龄[最小-最大]:66岁[61-74];女性:53.3%;从不吸烟者:66.7%;基线时脑转移:33.3%)在2021年6月至11月期间入组。主要终点已达到:BIRC评估的ORR为53.3%(8/15;95% CI:26.6,78.7)。截至DCO,DOR、PFS和OS的中位数尚未达到,中位随访时间分别为4.0、4.1和5.0个月。研究者评估的ORR为60%(9/15;95% CI:32.3,83.7);由BIRC和研究者评估的疾病控制率为86.7%(13/15;95% CI:59.5,98.3)。研究治疗的中位(最小-最大)暴露时间为21(1-42)周。治疗相关不良事件(TRAEs)的发生率是73.3%(11/15);3/4级TRAEs:20%(3/15);没有致命的TRAEs。最常见的TRAEs(≥20%;任何级别)是外周水肿(26.7%)、丙氨酸转氨酶升高和低白蛋白血症(各20%)。没有不良事件导致治疗药物中断。
结论: 基于这项初步分析显示,卡马替尼在中国患者中提供了较高的缓解率,且安全性可控。随访时间较短,无法对持久的抗肿瘤反应或其他与时间相关的参数得出结论。
点评专家
广州医科大学附属第一医院
在国际上率先提出“重症肺癌”的概念,并牵头发表第一版“重症肺癌国际共识”“肺癌合并COPD诊疗国际共识”
学术任职:
中华医学会呼吸分会肺癌学组副组长
中国呼吸肿瘤协作组(CROC)秘书长兼青委副主委
广东省医师协会肿瘤肿瘤重症专委会主委
第二届“人民好医生-金山茶花-肺癌领域杰出贡献奖
第五届“羊城好医生”第一届“广州实力中青年医生
GEOMETRY-C研究是卡马替尼治疗中国MET基因14号外显子(METex14)跳跃突变的前瞻性、开放标签的注册临床研究,基于此项研究结果,6月12日,卡马替尼片的上市申请已正式获中国国家药品监督管理局(NMPA)批准,用于未经系统治疗的携带间质上皮转化因子(MET)外显子14跳跃突变(METex14突变)的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
卡马替尼片是一种口服生物利用度高、高选择性的特异性MET受体酪氨酸激酶抑制剂,可有效抑制MET及MET介导的下游信号蛋白的磷酸化,从而抑制肿瘤细胞的增殖和迁移,并有效诱导细胞凋亡,展现出抗肿瘤活性。与其他MET抑制剂相比,卡马替尼对METex14+ Ba/F3细胞系的抑制效力IC50值为0.6nM,对体外c-MET激酶的抑制效力IC50 值为0.28 nM,无论细胞系还是酶学IC50 值均为同类产品最低 [2,3],对c-MET的抑制力更高,且能高效透过血脑屏障,具有良好的脑部抑瘤活性。
2020年5月美国FDA基于GeoMETry mono-1研究加速批准了卡马替尼治疗METex14跳突转移性NSCLC患者的治疗,随着验证性队列和长随访研究数据的公布,2022年8月卡马替尼又获FDA常规批准,再次成为首个获得常规批准的MET抑制剂。此外,基于充足明确的临床证据和可及性,目前国际权威指南如NCCN指南[4]和ASCO指南均将卡马替尼列为METex14跳突NSCLC的一线优先推荐(图1)。
 图1.NCCN Guidelines Version 6.2024 Non-Small Cell Lung Cancer.
图1.NCCN Guidelines Version 6.2024 Non-Small Cell Lung Cancer.
卡马替尼在全球范围内的获批依据的是一项国际多中心II期临床研究GeoMETry mono-1。该研究纳入了不同MET变异类型的NSCLC,其中队列4、5b、6、7分别纳入了经治及初治的METex14跳突患者。研究结果显示MET ex14跳突初治患者(队列5b和7,n=60)接受卡马替尼治疗ORR为68.3%,DCR为98.3%,中位PFS达12.5个月,中位OS达25.5个月[5]。无论从短期病灶缓解到长期生存获益,卡马替尼都展现出了令人惊艳的疗效。
约1/3的METex14跳突晚期NSCLC患者在疾病发展全周期中会出现脑部转移。伴随脑转移的患者生存预后明显更差,因此对于脑转移患者的治疗一直是临床关注的重点。卡马替尼作为一款能高效透过血脑屏障,具有良好的脑部抑瘤活性的小分子抑制剂,其在临床研究及真实世界中也展现出了对颅内病灶的优异疗效。 GeoMETry mono-1研究中纳入了13例基线有可测量颅内病灶的METex14跳突脑转移患者,其基于BIRC评估的颅内病灶缓解率iORR达54%,颅内病灶控制率iDCR达92.3%。在7例颅内病灶应答者中有4 例患者的所有脑部病灶完全消退,iCR率达到31% [5]。全部7例应答患者在首次评价时(治疗开始后6周)即有颅内缓解,提示卡马替尼不仅能强效抑瘤,且颅内应答迅速。在中国注册临床研究GeoMETry-C中同样观察到了卡马替尼突出的颅内疗效,一线初治队列中脑转移患者颅内病灶完全缓解率iCR高达50%,iDCR为100%[1]。这意味着有一半的患者颅内病灶完全消失,而全部患者的颅内病灶均未进展。METex14跳突患者多为老年患者,平均年龄为65-76岁,因此对于药物使用的便捷性和安全性有着更高的需求。临床研究显示,卡马替尼在体内的吸收代谢不受空腹或进食状态影响。因此卡马替尼的服用方式灵活,与食物同服或不同服均可,有助于提高患者的用药依从性。来自临床研究的安全性数据显示卡马替尼整体安全性良好,不良反应发生率低,严重程度低,且消退快。在亚洲人群中3/4级治疗相关不良事件(TRAEs)的发生率仅为20%,且无致死性TRAE。没有因不良事件导致患者停药。对于目前MET抑制剂常见的不良反应,卡马替尼的水肿发生率显著低于其他MET抑制剂,亚洲人群中治疗相关所有级别水肿发生率仅为26.7%,且无3/4级发生[1]。卡马替尼的肝毒性也较低,在卡马替尼的一项I期临床研究中探索了轻、中、重度肝损伤患者治疗的药代动力学,结果显示不同程度的肝损对卡马替尼的暴露量无临床显著影响[6],是目前唯一一个有证据支持可在重度肝损患者中使用,初始剂量无需调整的MET抑制剂 。其他一些特殊不良反应如血液毒性(贫血)、心脏毒性(QT间期延长)等,卡马替尼也无报道发生。
作为FDA批准的首个MET-TKI,卡马替尼经历了长期研发与临床验证后,终于来到国内,为METex14跳突NSCLC 患者提供更优选择。未来,期待卡马替尼能够在更广泛的的患者群体中得到应用,并进一步验证其疗效和安全性。同时,也希望能够有更多的研究探索卡马替尼和其他治疗手段的联合应用,以期为患者带来更深层次的个体化治疗策略。
BRAF V600E突变转移性NSCLC:疾病概述和治疗现状[7]
BRAFV600E-mutant metastatic NSCLC: disease overview and treatment landscape
David Planchard, et al.(通讯作者:David Planchard)
NPJ Precis Oncol
IF = 12.469
在这篇综述中,文章涵盖了目前对转移性NSCLC患者中BRAF突变及其相关临床特征、药物获批现状、新兴治疗选择、BRAF检测方法以及未满足的需求。BRAF V600E突变持续激活MAPK通路,促进肿瘤细胞生长、增殖和存活能力。检测出BRAF突变的患者可直接接受靶向BRAF V600E和MAPK通路的治疗,但在转移性NSCLC中,BRAF突变的检测仍落后于其他癌基因的检测。其他靶向BRAF V600E突变的治疗方案也为转移性NSCLC患者提供了新的治疗选择。正在研究中的新兴疗法和联合治疗对克服耐药,以及靶向非V600E突变治疗具有一定潜力。随着具有较高临床获益的靶向疗法的到来,在转移性NSCLC患者中检测BRAF突变变得尤为重要。
点评专家
河南省肿瘤医院呼吸内科主任,河南省医学科学院肿瘤研究所常务副所长
美国安德森癌症中心博士后,美国埃默里大学客座教授
美国AACR会员、国际肺癌研究会(IASLC) 会员
国家卫生健康突出贡献中青年专家,国务院特殊津贴专家
国家重点研发计划(科技部、卫健委)评审专家
全国第四届“白求恩式好医生”,“白求恩式好医生”奖章获得者
中原名医,河南省政府特殊津贴专家、河南省优秀省管专家
河南省肺癌诊疗中心主任、河南省肿瘤诊疗质量控制中心肺癌专家委员会主委
河南省医学会肿瘤医学分会候任主任委员
Cancer、 Annals of Oncology等36个SCI期刊审稿人
《中华医学杂志》、《中华肿瘤杂志》、《Chinese Medical Journal Pulmonary and Critical Care Medicine》编委
法国Gustave Roussy癌症研究所胸部肿瘤研究组主任David Planchard教授发表在NPJ Precis Oncol期刊上的这篇综述系统又全面的介绍了BRAF突变NSCLC的现状与未来探索方向。内容涉及BRAF突变转移性NSCLC患者的临床特征、BRAF突变分类、BRAF检测、治疗现状、新兴治疗方案以及未被满足的临床需求。详细探讨了BRAF/MEK抑制剂治疗BRAF突变实体瘤、转移性NSCLC的研究进展以及原发和获得性耐药问题,还包括免疫、化疗、免疫联合化疗方案在BRAF突变NSCLC中的治疗地位。非常全面且详实的阐述了BRAF突变NSCLC的临床诊疗全貌,对临床医生有诸多思考和启发。
BRAF突变是晚期NSCLC患者的不良预后因子之一,最常见于肺腺癌患者(>85%),与年龄、种族、性别等其他临床特征无明确的相关性,有研究显示有吸烟史的患者与BRAF突变的发生有关联,与KRAS、MET等其他突变相一致,也有研究显示BRAF V600E突变与吸烟的相关性不及其他BRAF突变。因此对于NSCLC患者建议不参考患者临床特征,均应进行包含BRAF突变检测[8]。
基于信号通路机制和激酶活性的不同,将BRAF突变非为3个不同的功能类别(图):I类为非RAS依赖型单体,具有高BRAF激酶活性,包括BRAF V600E、V600K、V600D、V600R、V600M,在NSCLC中BRAFV600E突变是最常见的I类突变,其激酶活性是野生型BRAF(WT BRAF)的500倍之多,占所有BRAF突变的30-50%[9]。600密码子以外区域发生的变异又分为II类和III类突变,形成非RAS依赖型二聚体,具有中等或高BRAF激酶活性为II类突变,如G464 到K601,以及BRAF融合从机制上也有II类突变相似的激酶活性。III类突变常发生在P-loop环、催化环等位置,激酶活性低或无活性的特点,依赖RAS信号并与野生型CRAF形成异源二聚体,与正常细胞信号通路相似,但合并有上游RAS基因突变更加常见,在黑色素瘤、CRC以及NSCLC中均有病例报道。目前绝大多数的临床研究均是针对BRAF V600的患者,未来对非V600突变的关注也将越来越多。
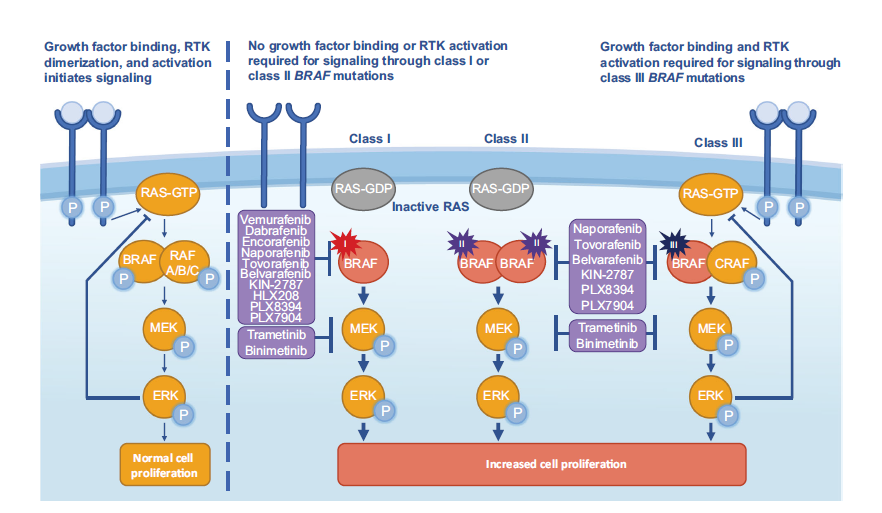 图:BRAF突变分类以及BRAF/MEK抑制剂作用机制
图:BRAF突变分类以及BRAF/MEK抑制剂作用机制
整体来看,目前对BRAF基因的检测不及其他biomarker,如EGFR、ALK、PD-L1等,主要限制因素包括组织标本的有限、检测策略以及医院可选的检测平台等因素,PCR检测虽快但通量不及NGS,IHC通过特异性抗体VE1能快速检测出BRAF V600E突变,但不能指导临床用药选择,随着液态活检技术的发展,目前已成为重要的补充手段。未来在肺癌分子诊断方面还有待更加优化和精进,尽可能给患者和临床治疗决策者提供全面完整的分子病理报告。
BRAF突变肿瘤治疗的研发故事,是一个非常经典的异病同治实例。最早在黑色素瘤中开始针对BRAF V600E突变单药治疗(维莫非尼、达拉非尼)的探索,并相继获FDA批准BRAF抑制剂单药治疗晚期BRAF V600E突变黑色素瘤,在随后的观察随访中多数患者6个月后出现了耐药和复发[10],迫使研究者们探索BRAF突变治疗的升级方案,在2015年-2018年期间,BRAF抑制剂联合MEK抑制剂的双靶方案脱颖而出,通过联合阻断MAPK信号通路中BRAF下游的MEK靶点,在黑色素瘤、NSCLC、ATC患者中的ORR达到了60%左右,受到鼓舞的研究者也将双靶组合从单瘤种应用带入了泛瘤种治疗探索,开展了NCI-MATCH、ROAR等篮子研究。从David Planchard教授综述中引用的参考文献看,囊括了包括《The Lancet Oncology》(《Lancet Oncol》IF=41.6)、《The New England Journal of Medicine》(《NEJM》 IF=96.2)、《Journal of Clinical Oncology》(《JCO》IF=42.1)、《Annals Of Oncology》(IF=56.7)等多篇顶刊研究, 稳扎稳打的构建出BRAF突变“异病同治”的治疗格局。
国内外指南目前对BRAF V600突变NSCLC的治疗均推荐首选靶向治疗,2024年v6版NCCN指南[4]中推荐达拉非尼联合曲美替尼或康奈非尼联合比美替尼,BRAF抑制剂单药治疗仅在特殊情况下作为治疗推荐。2024年CSCO指南[11]中,晚期BRAF V600突变NSCLC患者的一线首选方案是达拉非尼联合曲美替尼,且是唯一治疗推荐。综述中也针对两种治疗组合的安全性进行了阐述,达拉非尼联合曲美替尼最常见的AE为发热,而康奈非尼联合比美替尼最常见的AE为恶心、腹泻、疲乏和呕吐,两者的AE谱存在明显差异,值得关注。
BRAF V600E突变NSCLC合并共存基因突变的患者在接受靶向后约有20-30%会发生原发性耐药,常见预后较差的共突变基因包括TP53、PIK3CA、KRAS或PTEN,TP53和KRAS突变在BRAF II类和III类突变更加常见。达拉非尼联合曲美替尼治疗的临床研究中观察到合并PI3K共突变(n=4)患者的中位OS仅5.4个月,显著差于无共突变患者(n=34)的22.7个月[12]。PHAROS研究[13]中观察到最常见的共突变基因为SETD2和TP53,但均未观察到共突变与疗效之间的相关性。BRAF抑制剂单药或联合MEK抑制剂治疗发生获得性耐药的机制同样尚不明确,且没有标准的序贯治疗策略,部分研究显示与PI3K/AKT通路以及MAPK信号通路再激活有关,探明获得性耐药机制将有望为靶向耐药后的评估联合方案和开发新一代药物提供方向和洞见。
免疫治疗、化疗、免疫联合化疗在BRAF突变NSCLC患者中的疗效获益相对有限,对BRAF V600突变与非V600突变也存在差异,从研究数据以及国内外指南共识均推荐作为靶向治疗耐药后的选择。基础研究[14]显示,BRAF V600具有抑制MHC表达的作用,在经BRAF V600抑制剂处理后,IFNγ或IFNα2b对MHC分子的诱导作用增强。MHC表达增强可增加瘤内T细胞对肿瘤细胞的识别,预示免疫疗效的潜在获益。在临床上一线靶向能为患者带来足够的PFS获益,进展后由于靶向治疗带来的免疫源性增加,会进一步增加免疫治疗的效能,这对延长患者的总生存期至关重要。
针对非V600突变和BRAF V600抑制剂耐药的患者,多个新兴BRAF抑制剂的临床前研究以及I/II期临床研究正在进行之中。如下图所示,药物研发的方向包括靶向二聚化的新一代RAF抑制剂,如naporafenib [LXH254],tovorafenib [TAK-580], belvarafenib),以及能够抑制BRAF同源/异源二聚化以及避免MAPK通路的反常激活的Paradox breakers (如PLX8394, PLX7904)。此外,BRAF突变脑转移人群治疗治疗也存在未被满足的治疗需求,这类患者预后相对较差,一项维莫非尼治疗BRAF突变NSCLC患者的研究[15]显示,基线伴有脑转移患者(n=26)的中位PFS仅1.9个月,无脑转移(n=89)的中位PFS为5.4个月,在其他靶向治疗的临床研究纳入的脑转移患者数更是少之又少。目前针对BRAF V600E突变脑转移患者最大样本的III期前瞻性临床研究是来自黑色素瘤的数据,该研究[16]共纳入275例BRAF V600突变的不可切除或转移性黑色素瘤伴脑转移的患者,接受达拉非尼联合曲美替尼治疗的ORR达41.5%,中位PFS为5.68个月,初治患者的疗效显著优于经治患者(7.23个月 vs 4.96 个月,p=0.0061),另一项达拉非尼联合曲美替尼治疗BRAF V600突变伴脑转移的黑色素瘤患者(n=125)的II期研究[17]还纳入了76例活动性脑转移,患者的颅内缓解率(IC ORR)为58%,中位PFS为5.6个月,中位OS 10.8个月,安全性与既往研究一致。
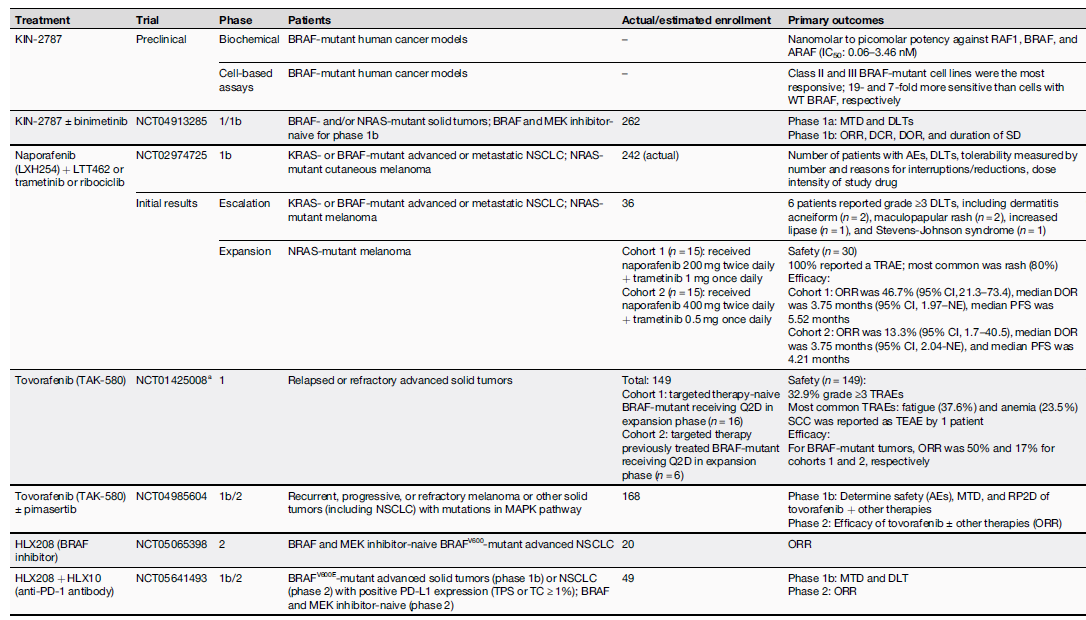 表:在研的BRAF抑制剂及其早期研究结果
表:在研的BRAF抑制剂及其早期研究结果
总之,BRAF突变NSCLC患者的靶向治疗探索之路依旧前路漫漫。当下诊疗实践中对BRAF V600突变NSCLC患者一线选择最有效的药物,尽可能的延缓耐药的发生至关重要。同时需关注耐药后的再活检和再测序,深入探究耐药机制,制定患者的全程管理策略,此外对非 V600E 突变靶向疗法的开发也是极其必要和极具前景的科研方向。
RICTOR/mTORC2在BRAF V600E黑色素瘤细胞中的下调促进了对BRAF/MEK抑制剂的耐药[18]
RICTOR/mTORC2 downregulation in BRAFV600E melanoma cells promotes resistance to BRAF/MEK inhibition
Luca Ponzone, et al.(通讯作者:Enzo Calautti)
Mol Cancer
IF = 37.3
背景: BRAF/MEK抑制剂(BRAF/MEKi)在治疗携带BRAF突变的转移性皮肤黑色素瘤(MM)中的一个主要缺点是治疗耐药的发展。我们的目标是在这种情况下评估mTORC2的作用,mTORC2是一个由必需的RICTOR亚基定义的信号复合体,被认为是包括MM在内的多种肿瘤类型的致癌驱动因素。
患者:在分析癌症基因组图谱MM患者数据库,探索与肿瘤内RICTOR水平相关的总生存率和分子特征后,我们研究了RICTOR在BRAF V600E MM细胞系中的下调对其对BRAF/MEKi反应的影响。研究进行了蛋白质组筛选,以识别RICTOR表达变化调节的蛋白质,并使用Seahorse分析评估RICTOR耗竭对线粒体呼吸的影响。将BRAFi与针对蛋白质组筛选中出现的蛋白质和过程的药物组合,在体外和体内异种移植模型中对RICTOR缺乏的细胞进行了研究。
结果:BRAF突变MM中RICTOR水平低与较差的临床结果相关。低RICTOR肿瘤的基因集富集分析显示,线粒体电子传递链(ETC)能量产生的激活基因特征。RICTOR缺乏的BRAF V600E细胞对BRAF/MEKi具有内在的耐受性,并在长期药物暴露后预期对BRAFi产生耐药。此外,在未用药的细胞中,我们在BRAFi暴露后不久观察到RICTOR表达的下降。在RICTOR耗尽的细胞中,线粒体呼吸和烟酰胺磷酸核糖基转移酶(NAMPT)的表达都增强了,它们的药理学抑制恢复了对BRAFi的敏感性。
结论:我们的工作揭示了mTORC2在BRAFV600E黑色素瘤细胞早期适应靶向治疗阶段的未预见的肿瘤抑制作用,并确定NAMPT-ETC轴作为低RICTOR肿瘤的潜在治疗脆弱性。重要的是,我们的发现表明,肿瘤内RICTOR水平的评估在转移性黑色素瘤中具有预后价值,并可能有助于指导个性化治疗策略。
恶性肿瘤中的c-MET通路及其通过天然化合物靶向治疗癌症[19]
c-MET pathway in human malignancies and its targeting by natural compounds for cancer therapy
Chakrabhavi Dhananjaya Mohan, et al.(通讯作者:Gautam Sethi)
Phytomedicine
IF =7.9
背景: c-MET是一种受体酪氨酸激酶,通常由肝细胞生长因子(HGF)激活,以激活其下游信号级联反应,如MAPK、PI3K/Akt/mTOR和STAT3。c-MET调节细胞增殖、上皮-间充质转化(EMT)、免疫反应、形态发生、凋亡和血管生成。c-MET已被证明在胚胎发生和早期发育中发挥重要作用。c-MET通路在广泛的恶性肿瘤中失调,这是由于配体或受体的过度表达、基因组扩增和MET突变。c-MET信号失调与肿瘤进展之间的相关性已有充分记录。c-MET的过度表达或过度激活与不良的临床结果和对靶向治疗的获得性耐药相关。由于c-MET激活导致致癌途径的触发,消除c-MET通路被认为是癌症治疗中的关键策略。在这里,我们分析了c-MET通路在癌症中的作用,以及其在骨转移和治疗抗性中的相关性,并尝试总结了选定的天然化合物对癌症中c-MET信号的抑制活性。
方法:我们从PubMed、Scopus和Google Scholar等数据库中获取了与c-MET通路在恶性肿瘤及其天然化合物调节剂相关的出版物,并根据PRISMA指南进行了总结。用于提取相关文献的一些关键词包括c-MET、c-MET的天然化合物抑制剂、肝癌中的c-MET、乳腺癌中的c-MET、肺癌中的c-MET、胰腺癌中的c-MET、头颈癌中的c-MET、骨转移中的c-MET、治疗抗性中的c-MET,以及c-MET抑制剂和化疗药物的组合。天然化合物的化学结构在PubChem数据库中进行了验证。
结果:搜索产生了3935篇出版物,其中195篇参考文献被用于分析。临床试验引用了ClinicalTrials.gov的标识符。c-MET通路已被确认为是抗击肿瘤生长、转移和化疗抗性的重要靶点。c-MET在骨转移和耐药中的关键作用已被详细阐述。此外,还讨论了选定的天然化合物对临床/临床前研究中c-MET通路的抑制效果。
晚期非小细胞肺癌中的罕见驱动突变:一项北意大利的真实世界注册经验[20]
Rare Driver Mutations in Advanced, Oncogene-Addicted Non-Small Cell Lung Cancer: A North Italian, Real-World, Registry Experience
Kalliopi Andrikou, et al.(通讯作者:Angelo Delmonte)
Diagnostics (Basel)
IF = 3.6
真实世界回顾性NEROnE注册研究调查了下一代测序(NGS)在2020年1月至2022年12月期间意大利北部三个中心晚期非小细胞肺癌(NSCLC)患者中的影响。我们专注于罕见突变的NSCLC的临床特征和结果:EGFR外显子20插入、非活化EGFR突变、BRAF V600E和非V600、ROS1和RET重排、MET、ErbB2和FGFR突变。总体而言,这些在常规实践中用NGS分析的患者中占6.4%(62/970)。最常见罕见变异是ROS1重排(15名患者-24%)和MET外显子14跳跃突变(11名患者-18%)。没有发现与人口统计学和临床特征的关联。49名患者接受了靶向治疗,其中38.8%是一线治疗,9.8%是二线治疗。其余患者接受了化疗和/或免疫治疗。在临床结果方面,尽管没有统计学意义,但当使用非特定靶向治疗时,似乎趋向于带来较短的总生存期(OS)(HR:1.84,95% CI:0.79-4.33,p = 0.158)。有共同突变的患者(19.4%)似乎从一线基于化疗的方案中获得了优势。最后,NLR评分(一个众所周知的炎症指数)≥4似乎与单独接受免疫治疗或与化疗联合治疗的患者的较短OS有关(HR:2.83,95% CI:1.08-7.40,p = 0.033)。需要进行前瞻性评估,以澄清这些指标是否可以帮助识别可能从免疫治疗中受益的携带成瘾性癌基因的NSCLC患者。
1. Y-L. W, J. Zhao, J. Hu, J. et al. 2022 ESMO Asia abstracts 388P
2. Toshio Fujino , Yoshihisa Kobayashi , Kenichi Suda , et al. Sensitivity and Resistance of MET Exon 14 Mutations in Lung Cancer to Eight MET Tyrosine Kinase Inhibitors In Vitro. J Thorac Oncol. 2019 Oct;14(10):1753-1765.
3. Jing Ai , Yi Chen , Xia Peng, et al. Preclinical Evaluation of SCC244 (Glumetinib), a Novel, Potent, and Highly Selective Inhibitor of c-Met in MET-dependent Cancer Models. Mol Cancer Ther. 2018 Apr;17(4):751-762.
4. NCCN Guidelines Version 6.2024 Non-Small Cell Lung Cancer.
5. Wolf J, Seto T, Han JY, et al. Capmatinib in MET exon 14-mutated or MET-amplified non-small-cell lung cancer. N Engl J Med. 2020, 383: 944-957.
6. Xinhui Chen , Xiaoming Cui , Nathalie Pognan, et al. Pharmacokinetics of capmatinib in participants with hepatic impairment: A phase 1, open-label, single-dose, parallel-group study. Br J Clin Pharmacol. 2022 Jan;88(1):91-102.
7. David Planchard, et al. BRAFV600E-mutant metastatic NSCLC: disease overview and treatment landscape. NPJ Precis Oncol. 2024; 8: 90.
8. Abdayem, P. A. & Planchard, D. Ongoing progress in BRAF-mutated non-small cell lung cancer. Clin. Adv. Hematol. Oncol. 20,662–672 (2022).
9. Dagogo-Jack, I. et al. Impact of BRAF mutation class on disease characteristics and clinical outcomes in BRAF-mutant lung cancer. Clin. Cancer Res. 25, 158–165 (2019).
10. McArthur GA, Chapman PB, Robert C, et al. Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol. 2014;15(3):323-332.
11. CSCO非小细胞肺癌诊疗指南(2024年)
12. Planchard, D. et al. Phase 2 study of dabrafenib plus trametinib in patients with BRAF V600E-mutant metastatic NSCLC: updated 5-year survival rates and genomic analysis. J. Thorac. Oncol. 17,103–115 (2022).
13. Riely, G. J. et al. Phase II, open-label study of encorafenib plus binimetinib in patients with BRAFV600-mutant metastatic non-smallcell lung cancer. J. Clin. Oncol. 14, 3700–3711 (2023).
14. Bishu Sapkota 1, Charles E Hill, Brian P Pollack. Vemurafenib enhances MHC induction in BRAFV600E homozygous melanoma cells. Oncoimmunology. 2013;2(1):e22890.
15. Mazieres, J. et al. Vemurafenib in non-small-cell lung cancer patients with BRAFV600 and BRAFnonV600 mutations. Ann. Oncol. 31,289–294 (2020).
16. Dutriaux, C. et al. An open label, non-randomised, phase IIIb study of trametinib in combination with dabrafenib in patients with unresectable (stage III) or distant metastatic (stage IV) BRAF V600-mutant melanoma: A subgroup analysis of patients with brain metastases. Eur. J. Cancer 175, 254–262 (2022).
17. Davies, M. A. et al. Dabrafenib plus trametinib in patients with BRAFV600-mutant melanoma brain metastases (COMBI-MB): a multicentre, multicohort, open-label, phase 2 trial. Lancet Oncol. 18,863–873 (2017).
18. Luca Ponzone, et al. RICTOR/mTORC2 downregulation in BRAFV600E melanoma cells promotes resistance to BRAF/MEK inhibition. Mol Cancer. 2024; 23: 105. Published online 2024 May 16.
19. Mohan CD, et al. c-MET pathway in human malignancies and its targeting by natural compounds for cancer therapy. Phytomedicine. 2024 Jun;128:155379.
20. Kalliopi Andrikou, et al. Rare Driver Mutations in Advanced, Oncogene-Addicted Non-Small Cell Lung Cancer: A North Italian, Real-World, Registry Experience. Diagnostics (Basel) 2024 May; 14(10): 1024.
审批码TAB0028757-68317,有效期至2025-07-30,资料过期,视同作废。
排版编辑: winnie











 苏公网安备32059002004080号
苏公网安备32059002004080号


