美国国立综合癌症网络(NCCN)每年发布的肿瘤临床实践指南,得到了全球临床医师的认可和遵循。2024年6月,NCCN发布了V.1版急性淋巴细胞白血病(ALL)临床实践指南,以期为ALL患者提供更精准高效的治疗方案。
ALL患者多依赖于传统化疗,但仍面临长期生存率不理想的困境。近10年内快速兴起的免疫新疗法指引了ALL新治疗方向。
其中,奥加伊妥珠单抗(InO)作为一款靶向CD22的抗体偶联药物(ADC),于早期在国内获批用于治疗复发/难治性B细胞急性淋巴细胞白血病(R/R B-ALL)成人患者,并于近期获得FDA批准用于1 岁及以上CD22阳性 R/R B -ALL儿童患者。这些进展也证实了InO在改善患者治疗效果、提高生存率、减少复发率以及良好的安全性方面具有显著的临床意义和应用前景。
不仅如此,在NCCN指南此次更新中,将InO纳入年龄≥65岁或伴有严重合并症Ph- B-ALL患者可选择的诱导治疗药物之一,将InO纳入微小残留病(MRD)阳性且Ph-/+ B-ALL患者的巩固治疗中。对于R/R Ph+/- B-ALL患者的治疗,NCCN指南(2024 V.1版)维持原有推荐,推荐含InO方案作为该类患者的治疗,为ALL患者的全程管理,改善其长期生存获益带来新希望。
此外,多项重磅研究显示InO在ALL治疗的不同阶段对不同类型的患者具有显著的疾病缓解和生存改善作用,为全程管理ALL患者提供了有力支持。【肿瘤资讯】特对NCCN指南(2024 V.1版)ALL诱导治疗相关更新要点及InO诱导治疗中的重磅研究进行整理,详情如下。
NCCN指南(2024 V.1版)R/R B-ALL治疗相关要点
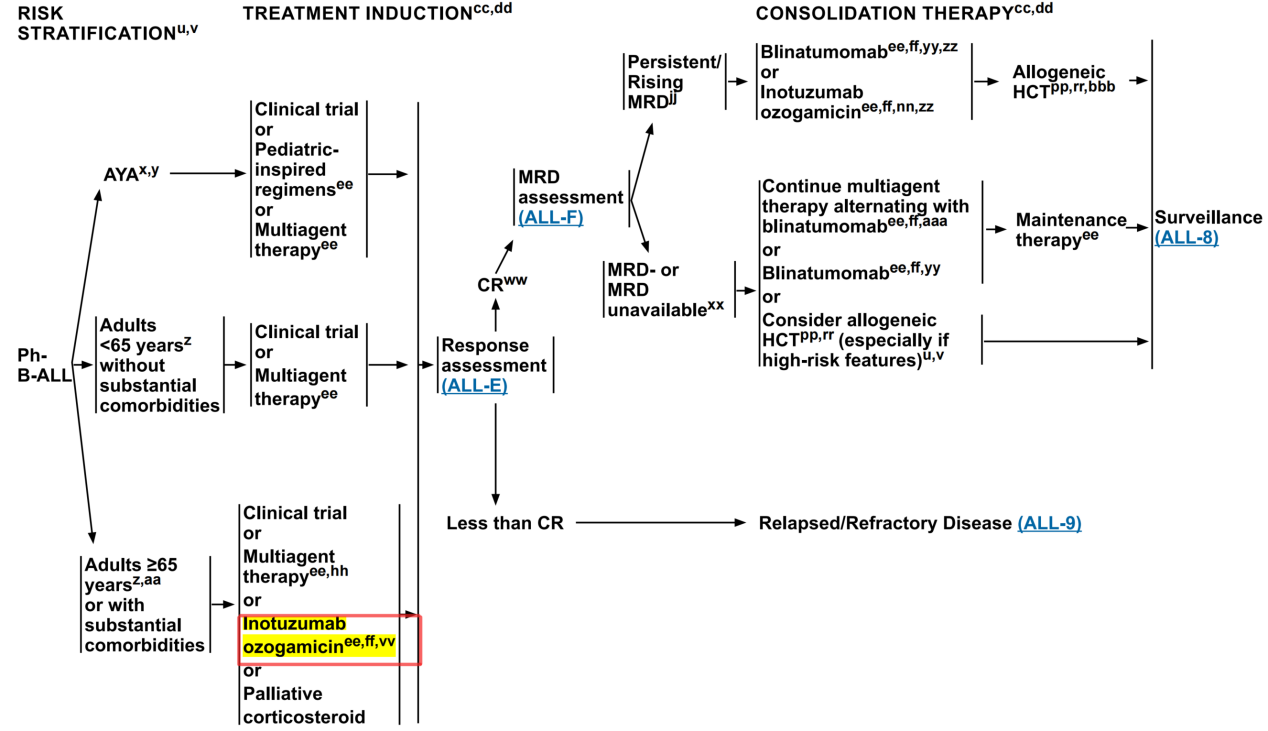
Ph- B-ALL患者诱导治疗更新要点[1]
在NCCN指南(2024 V.1版)中,新将InO纳入年龄≥65岁或伴有严重合并症Ph- B-ALL患者可选择的诱导治疗药物之一。
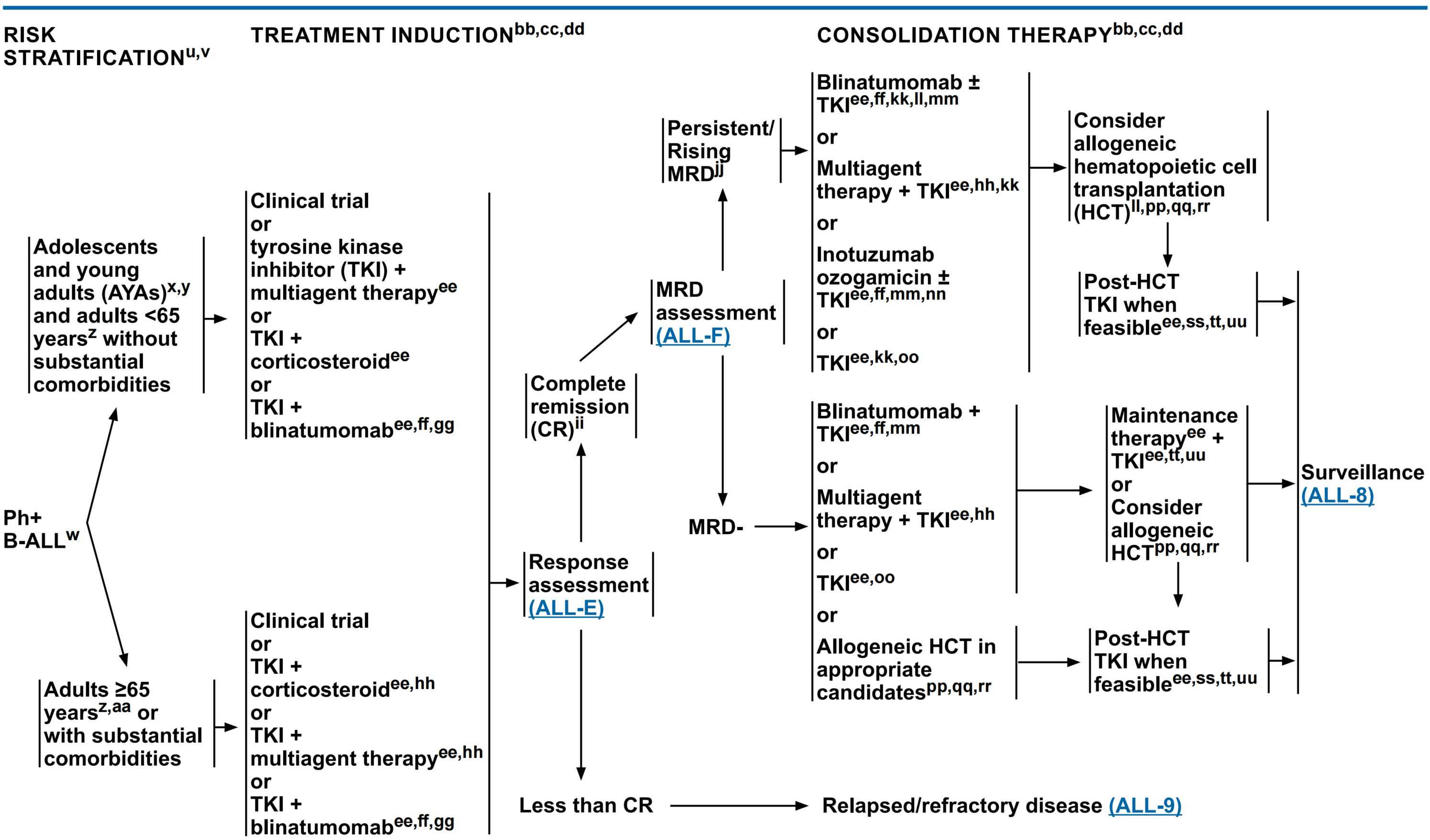
Ph+ B-ALL患者诱导治疗更新要点[1]
在NCCN指南(2024 V.1版)中,TKI联合BiTE作为Ph+ B-ALL患者可选择的诱导治疗方案之一。
InO作为ALL诱导治疗相关重要研究
InO作为一种新型药物,已在诸多重要杂志期刊上发表了其应用在老年人群、全人群诱导治疗阶段的多项关键研究。同时,基于最新研究结果,《CSCO恶性血液病诊疗指南2024》将InO联合mini-CVD方案作为Ph- B-ALL III级推荐诱导治疗,体现了InO在ALL全程管理中的潜力和瞩目的发展前景。
老年人群
● 2024JCO——2期INITIAL-1试验
研究目的
旨在评估InO/地塞米松(DEX)诱导治疗CD22+、BCR::ABL- ALL老年患者的疗效。
研究方法
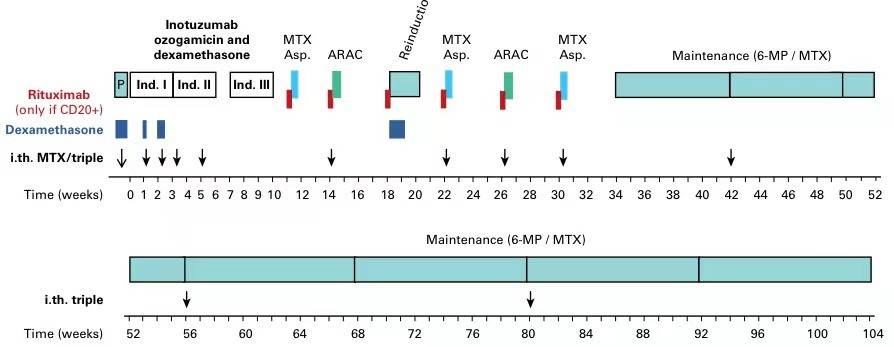
在43例可评估的CD22+、BCR::ABL- ALL老年患者中,患者接受了最多3个周期的InO/地塞米松治疗,以及最多6个周期的适应年龄的GMALL研究方案的巩固和维持治疗。
首次诱导治疗(21天):InO(0.8 mg/m2,D1每天1次;0.5 mg/m2+DEX10 mg/m2/天[D7-8 、D14-17],D8、D15每天1次;)+鞘内注射MTX联合阿糖胞苷和DEX
第2、3次诱导治疗(28天):D1、D8和D15各给予1次InO(0.5mg/m2)治疗,外加每个周期1次鞘内注射MTX联合阿糖胞苷和DEX
达到CR的患者:给予最多5个周期年龄匹配的巩固治疗和再诱导治疗
研究结果
首次诱导治疗结束后,患者的完全缓解 (CR)/CR伴不完全计数恢复(CRi)率为88%,MRD阴性率为29%。
第2、3次诱导治疗结束后,在43例可评估的患者中,所有患者均达到了CR/CRi。其中,分别有23例(53%)和30例(71%)患者达到了MRD阴性。
随访中位数为2.7年,1年和3年无进展生存率(PFS)分别为88%和55%,1年和3年总生存率(OS)分别为91%和73%。
在诱导期间的6个月内没有患者死亡。
研究结论
基于InO的诱导治疗方案在ALL老年患者中展现出显著的疗效和较好的安全性,显著提高了CR率和MRD阴性率,并延长了患者的生存时间[2]。这些数据为将InO引入 B-ALL 老年患者的一线治疗方案提供了依据。
● 2023ASH abstract 2878——一项2期研究
研究目的
探索InO和贝林妥欧单抗(Blina)联合低强度化疗治疗新诊断(ND)B-ALL老年患者的疗效。
研究方法
研究共纳入83例ND B-ALL患者,平均年龄为68岁。80%的患者具有高风险特征,如TP53突变、Ph样特征等。
Mini-Hyper-CVD治疗:C1-C4,最多8个周期
MTX/阿糖胞苷:鞘内给药8剂
InO治疗:最初为C1-Day3给予1.3-1.8mg/m2,C2-4的Day3给予1.0-1.3mg/m2。从第50例患者开始,以分次剂量给予InO,最大累积剂量为 2.7mg/m2 ( C1-Day2 给予0.6 mg/m2 ,C1-Day8 给予0.3 mg/m2,C2-4的Day2、Day8给予0.3 mg/m2)
Blina治疗:C5-C8,28µg/day
研究结果
99%的患者获得缓解,其中90%的患者达到CR。
在获得缓解的患者中,分别有60例(79%)和71例(94%)患者在C1和总体治疗后达MRD阴性。研究者暂时未观察到早期死亡。
中位随访时间88个月后,中位OS为56个月,中位PFS为47个月。5年持续缓解持续(CRD)率和OS率分别为78%和49%。
60~69岁无不良细胞遗传学(n=40)患者的5年OS率可达73%。
研究结论
Mini-Hyper-CVD联合InO方案可为ND Ph- ALL 老年患者包括伴有高风险特症患者带来较高的缓解率且多为深度缓解[3]。此外,研究中的5年OS率显示,该联合方案可改善ALL老年患者长期生存预后。
● 2022ASH abstract 212—— 2期GMALL-Initial1研究
研究目的
评估了InO联合化疗作为诱导方案治疗年龄>55岁,ND Ph/BCR-ABL阴性B-ALL患者中的疗效及安全性。
研究方法
在该研究中,42例年龄>55岁的ND Ph/BCR-ABL阴性B-ALL患者完成了全部3个周期的诱导治疗。
首次诱导治疗(21天):InO(0.8 mg/m2,Day1每天1次;0.5 mg/m2+DEX10 mg/m2/天 [Day7-8 、Day14-17],Day8、Day15每天1次)+鞘内注射MTX联合阿糖胞苷和DEX
第2、3次诱导治疗(28天):Day1、Day8和 Day15各给予1次InO(0.5mg/m2)治疗,外加每个周期1次鞘内注射MTX联合阿糖胞苷和DEX
达到CR的患者:给予最多5个周期年龄匹配的巩固治疗和再诱导治疗,随后进行6-MP/MTX维持治疗。
研究结果
所有患者均达到CR/CRi,大部分患者在第1周期治疗后即缓解。
接受2或3周期InO诱导治疗后获得MRD阴性的患者比例分别为53%和74%。
中位随访时间697天,1年和2年的OS率分别为91%和81%,1年和2年的无事件生存率(EFS)为 88%和73%。
在诱导治疗开始后的前6个月内没有患者死亡。
研究结论
3个周期的InO诱导治疗为新诊断的B-ALL老年患者带来了显著的治疗效果,不仅达到了极高的缓解率,还实现了较高的MRD阴性率,充分展现了其在该类患者治疗中的优势[4]。
● 2022ASH abstract 6114–6116——EWALL-InO 2期研究
研究目的
旨在评估低强度化疗联合InO治疗ND的CD22+Ph- BCP-ALL老年患者的疗效。
研究方法
2017年12月至2022年3月期间,共有131例ND CD22+Ph-BCP-ALL患者入组并接受至少1剂InO。研究中的MRD阴性评估标准为<10-4。
首次诱导治疗:鞘内注射长春新碱(VCR,2mg;70 岁以上患者为1mg)联合DEX(20mg),同时注射3次InO(Day1:0.8 mg/m2、Day8和Day15:0.5mg/m2)
第2次诱导治疗:DEX(20mg D1~D8),环磷酰胺(CY,300mg/m² Day1~Day3),D2进行1次三联鞘内注射和2次InO注射(0.5mg/m²Day1和Day8)。
CR/CRp患者计划接受6个疗程的巩固治疗
研究结果
在首次诱导治疗后,CR/部分缓解(CRp)率为88.5%,4例患者(3%)死亡。在97例达到CR/CRp且接受检测的患者中,56例(56.6%)达到MRD阴性。120例患者接受了第2次诱导治疗,最终115例患者达到CR/CRp。在达CR/CRp90例接受检测的患者中,80.8%的患者达到MRD阴性。两次诱导治疗后的CR/CRp率为90%。
中位随访时间为15个月,研究1年OS率为72.5%,2年OS率为53.6%。而1年和2年无白血病生存率分别为64.9%和49.8%。

研究结论
分次注射InO联合低强度化疗为CD22+ Ph- BCP-ALL老年患者带来持续较高的MRD阴性CR率和令人鼓舞的OS率,是该类患者有效且耐受性良好的一线治疗选择[5]。
除在ALL老年患者中,在其他年龄组及全人群中,含InO诱导治疗表现同样优异,不仅为ALL患者带来快速且深度的缓解,还能够显著改善患者的长期生存,为患者带来持久的获益。
全人群
● 2023ASH abstract 4245—— 一项2期研究(NCT02877303)
研究目的
评估Hyper-CVAD联合序贯Blina使用或不使用InO在ND B-ALL患者中的疗效。
研究方法
截至2023年6月,75例ND Ph- B-ALL患者接受治疗(37例患者接受含有InO的治疗)。36例患者在入组时具有≥1种高风险治疗前特征,16例患者在入组时处于CR状态。患者接受Hyper-CVAD与高剂量MTX/阿糖胞苷交替治疗(最多4个周期),随后接受4个周期标准剂量的 Blina 治疗。CD20+ ND Ph-B-ALL患者将接受 8 剂CD20 单抗治疗。
Hyper-CVAD和MTX+阿糖胞苷交替治疗:C1-C4,最多4个周期
标准剂量Blina:C5-C8,4个周期
InO治疗:从#39患者开始,将剂量为0.3 mg/m2(Day1、Day8)的InO添加至2个周期的 MTX/阿糖胞苷治疗中和2个周期的Blina巩固治疗中(共4个周期InO治疗)
POMP和Blina:维持治疗
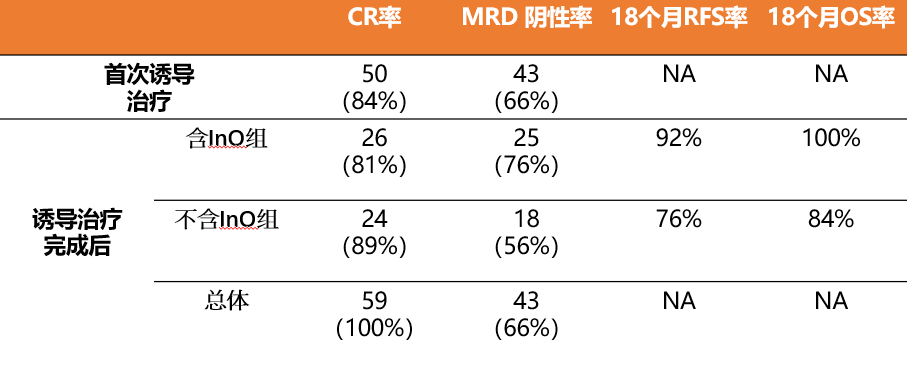
研究结果
59例活动性疾病患者均达到CR(84%在第1周期后)。65例可评估患者中,92%达到MRD阴性(66%的患者在第1周期后达到MRD阴性)。36例评估患者中,69%达到10-6水平的MRD阴性。含和不含InO组的18个月RFS率分别为92%和76%,18个月OS率分别为100%和84%。
研究结论
在Hyper-CVAD序贯Blina方案中引入InO可以为B-ALL患者带来更深、更持久的治疗缓解。此外,研究还发现,含InO的诱导治疗可减少B-ALL患者的复发情况并提高长期生存率[6]。
● 2023ASH abstract 1500
研究目的
评估InO 和/或Blina作为伴有高风险细胞遗传学 (HR-CTG) Ph- B-ALL患者一线治疗的疗效。
研究方法
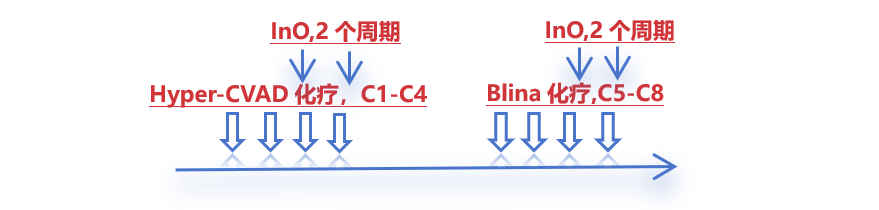
2014年10月-2023年2月,研究纳入了71例Ph- B-ALL患者,其接受了一线治疗包括InO和/或Blina以及Hyper-CVAD化疗。治疗方案的强化阶段包括4个疗程的Hyper-CVAD,随后是4个疗程Blina。在Hyper-CVAD化疗和Blina治疗的第3、4个周期的第1和第8天引入InO(剂量为0.3 mg/m2,共4个周期,#39患者开始)。
Hyper-CVAD化疗:C1-C4,最多4个周期
标准剂量Blina治疗:C5-C8,4个周期
InO治疗:在Hyper-CVAD化疗和Blina治疗的C3、4的Day1、8天引入InO(剂量为0.3 mg/m2,共 4个周期)
研究结果
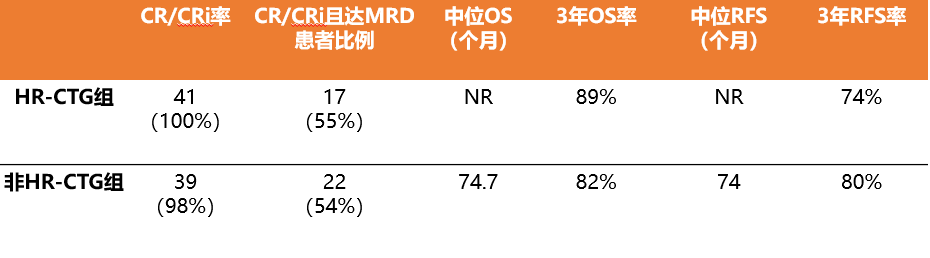
HR-CTG组中,100%患者达到CR/CRi,其中55%的患者达到MRD阴性。而非HR-CTG组中,98%的患者达到CR,1例达到PR,54%的患者达到MRD阴性。
全组中位随访31个月(HR-CTG组43个月,非HR-CTG组28个月),中位OS未达到,3年OS率为85%。
HR-CTG组的中位OS和3年OS率分别为未达到(NR)和89%,非HR-CTG组为74.7个月和82%(p=0.64)。
HR-CTG组中位RFS为NR,非HR-CTG组为74个月,两组3年RFS率分别为74%和80%。根据患者缓解评估时的MRD状态,两组的RFS和OS无显著差异。
两组中均无患者出现肝窦阻塞综合征或继发性髓系肿瘤。
研究结论
研究发现,使用含InO方案作为一线治疗能够使所有ALL患者包括HR-CTG患者达到CR/CRi。不仅如此,在HR-CTG ALL患者中,MRD阴性率达到55%,表明含InO方案可显著控制疾病进展,在高危患者中同样表现出色[7]。
结合最新的研究和临床数据,ALL的治疗格局正迎来一次深刻的变革。在EHA大会的报道中,InO作为靶向CD22的ADC,在ALL的诱导治疗中展现出了显著的潜力。
通过多项临床试验,InO不仅显示出良好的安全性和耐受性,而且在提高患者治疗效果、降低复发率以及改善生存率方面取得了显著进展。这些数据不仅为ALL患者带来了新的治疗选择,也为未来的治疗策略和研究方向指明了明确的路径。
自2021年在中国上市以来,InO已累计惠及数千位患者,发生VOD比例约为2%*,其卓越的疗效和安全性已在中国真实世界中得到验证。期待ADC药物的广泛应用,以改变治疗结局的ALL全程管理,能为更多中国患者带来生存获益。
*据临床医生上报统计
1. NCCN GUIDELINE 2024 V1 ACUTE LYPHOMABLASTIC LEUKEMIA
2. Matthias Stelljes et al., Inotuzumab Ozogamicin as Induction Therapy for Patients Older Than 55 Years With Philadelphia Chromosome–Negative B-Precursor ALL. JCO 42, 273-282(2024).DOI:10.1200/JCO.23.00546
3. Wei-Ying Jen, Elias Jabbour,et al; Phase 2 Trial of Mini-Hyper-CVD Plus Inotuzumab Ozogamicin, with or without Blinatumomab, in Older Patients with Newly Diagnosed Philadelphia Chromosome-Negative B-Cell Acute Lymphoblastic Leukemia. Blood 2023; 142 (Supplement 1): 2878. doi: https://doi.org/10.1182/blood-2023-182982
4. Matthias Stelljes, Nael Alakel, Ralph Wäsch, et al. InOtuzumab Ozogamicin Induction Followed By Standard Chemotherapy Yields High Remission Rates and Promising Survival in Older (>55 Years) Patients with De Novo B-Lymphoblastic Leukemia (GMALL-Initial1 Trial). Blood 2022; 140 (Supplement 1): 510–512. doi: https://doi.org/10.1182/blood-2022-162235
5. Patrice Chevallier, Thibault Leguay, Rathana KIM, et al. Fractionated InOtuzumab Ozogamicin Combined with Low-Intensity Chemotherapy in Older Patients with Newly Diagnosed CD22+ Philadelphia Chromosome (Ph)-Negative B-Cell Precursor (BCP) Acute Lymphoblastic Leukemia (ALL): Results of the EWALL-InO Study. Blood 2022; 140 (Supplement 1): 6114–6116. doi: https://doi.org/10.1182/blood-2022-166035
6. Nicholas James Short et al., A phase II study of hyper-CVAD with Blinatumomab (Blina) and inotuzumab ozogamicin (INO) for newly diagnosed Philadelphia chromosome (Ph)–negative B-cell acute lymphoblastic leukemia (ALL).. JCO 41, e19017-e19017(2023).DOI:10.1200/JCO.2023.41.16_suppl.e19017
7. Jayastu Senapati, Elias Jabbour, Nicholas J. Short,et al; Impact of High-Risk Cytogenetics (HR-CTG) on the Outcome of Newly Diagnosed Adult Patients with Philadelphia Negative B-Cell Acute Lymphoblastic Leukemia (B-ALL) Treated with Frontline Blinatumomab (Blina) and/or Inotuzumab Ozogamicin (Ino) Containing Hypercvad (HCVAD) Therapy. Blood 2023; 142 (Supplement 1): 1500. doi: https://doi.org/10.1182/blood-2023-181379
排版编辑:肿瘤资讯-陈湘钰











 苏公网安备32059002004080号
苏公网安备32059002004080号


