作为肿瘤领域最高水平的世界级学术盛会之一,美国临床肿瘤学会(ASCO)年会在近期成功召开,为全球肿瘤领域专家学者带来了丰富的学术盛宴。
本届会议期间,曲氟尿苷/替匹嘧啶(TAS-102)贡献了4项最新研究成果,夯实了TAS-102在转移性结直肠癌(mCRC)治疗领域的基石地位。此前,TAS-102顺利进入我国最新版医保药品目录,并在最新更新的《中国临床肿瘤学会结直肠癌诊疗指南(2024版)》获三线治疗的I级推荐。可以预见,TAS-102未来将以更高的药物可及性、更广泛的循证医学证据惠及我国更多mCRC患者。
为了更好地指导临床实践,我们特邀昆明医科大学第一附属医院董超教授分享TAS-102在2024 ASCO期间公布的最新研究成果,以期促进TAS-102在临床的合理应用。
昆明医科大学第一附属医院 肿瘤内科 科主任
云南省兴滇人才 名医专项,青年拔尖人才,肿瘤学科带头人
中国临床肿瘤学学会(CSCO)青年专家委员会 常委
中华医学会肿瘤学分会 青年委员
中国临床肿瘤学学会(CSCO)胃癌专家委员会 委员
中国临床肿瘤学学会(CSCO)老年肿瘤防治专业委员会 委员
中国临床肿瘤学学会(CSCO)肿瘤心脏病学专家委员会 委员
中国研究型医院学会精准医学与肿瘤MDT专委会青委会 副主委
中国抗癌协会整合肿瘤学分会委员会 委员
中国医师协会结直肠肿瘤专委会肠外与肠内营养专委会 委员
中国医师协会结直肠肿瘤专委会多学科诊疗MDT专委会 委员
中国抗癌协会肿瘤支持治疗青委会 委员
国家胃癌质控专家委员会 委员
主持国家自然科学基金项目和云南省基础研究重点项目
研究一(摘要号3536)
呋喹替尼联合曲氟尿苷/替匹嘧啶(TAS-102)三线治疗mCRC患者的疗效和安全性:一项单臂、多中心、2期研究结果
研究背景及设计:
呋喹替尼和TAS-102是全球范围内用于经治mCRC患者的标准三线用药。SUNLIGHT试验显示,与单独使用TAS-102相比,TAS-102联合贝伐珠单抗可以改善无进展生存期(PFS)和总生存期(OS)。该研究旨在评估呋喹替尼联合TAS-102三线治疗mCRC的疗效和安全性。
在这项开放标签、单臂、多中心、2期试验(NCT05004831)中,招募了至少两种标准治疗方案失败的mCRC患者。符合条件的患者每4周口服呋喹替尼(4mg,每日一次,第1-21天)和TAS-102(35mg/m²,每日两次,第1-5天,第8-12天),直至疾病进展或出现不可接受的毒性。主要终点是无进展生存期(PFS)(RECIST v1.1)。次要终点包括总生存期(OS)、客观缓解率(ORR)、疾病控制率(DCR)和安全性(NCI-CTCAE v5.0)。
研究结果:
患者基线:从2022年3月至2023年8月,共招募了50例符合条件的患者。中位年龄为60岁(39-76岁),男性占比58.0%。82%的患者为左半结肠和直肠癌。42.0%的患者有RAS突变,58.0%有肝转移。
既往用药:既往5-FU经治比例为100%,抗VEGF和抗EGFR的经治比例分别为88.0%和26.0%。
疗效评估:截至2024年1月10日,46名患者至少进行了一次肿瘤评估,7名患者仍在治疗中。10.9%(5/46)的患者实现了部分缓解(PR),63.0%(29/46)的患者最佳评效为疾病稳定(SD)。中位PFS为6.46个月(95%CI:4.20-8.62)。6个月、9个月和12个月的PFS率分别为50.9%、25.4%和21.8%。
亚组分析1:RAS突变患者(n=21)、RAS野生型患者(n=16)和RAS状态未知患者(n=13)的中位PFS分别为5.51个月(95%CI:2.43-不可估计)、5.84个月(95%CI:3.97-不可估计)和6.59个月(95%CI:4.79-不可估计)。
亚组分析2:有肝转移(LM)和无肝转移患者的中位PFS相当[6.59个月(95%CI:4.07-8.62])vs. 6.46个月(95%CI:3.74-不可估计),p=0.77]。中位OS在15.5个月的中位随访时间内尚未成熟。
安全性终点:与治疗相关的不良事件(TRAEs)通常是可管理且可耐受的。最常见的血液学TRAEs(任何级别,3-4级)包括中性粒细胞计数减少(80.0%,52.0%)、白细胞计数减少(70.0%,24.0%)和贫血(54.0%,20.0%)。非血液学TRAEs主要是1-2级,包括食欲减退(22.0%)、乏力(14.0%)、腹痛(12.0%)、腹泻(12.0%)和呕吐(10.0%)。研究报告了1例3级高血压。未观察到与治疗相关的死亡。
研究结论:该研究初步结果表明,呋喹替尼联合TAS-102作为mCRC患者的三线治疗具有良好的耐受性,并显示出令人鼓舞的临床活性。目前研究招募已经结束,未来将展示更长随访时间的OS数据。
研究二(摘要号3558)
曲氟尿苷/替匹嘧啶(TAS-102)联合卡培他滨和贝伐珠单抗一线治疗mCRC:1期TriComB研究结果
研究背景及设计:
对于未经治疗的、不适合一线双药化疗且不可切除的mCRC患者而言,卡培他滨联合贝伐珠单抗是临床治疗的标准选择。体外和体内研究已经显示出卡培他滨序贯TAS-102的协同效应。这项1/2期开放标签、多中心试验评估了TAS-102与卡培他滨和贝伐珠单抗联合治疗mCRC患者的安全性和初步活性。
研究纳入未经治疗、不适合奥沙利铂和/或伊立替康方案的mCRC患者。使用3+3剂量递增设计,以确定TAS-102(第15-19天和第22-26天)与卡培他滨(1000 mg/sqm/BID,第1-14天)和贝伐珠单抗(第1、15天,5 mg/kg)联合使用的推荐剂量(RD),每28天一个周期。根据CTCAE 5.0报告不良事件(AEs),依照RECIST 1.1评估肿瘤反应。
研究结果:
确定RD:研究共招募了11例患者(5例男性,6例女性;中位年龄:77岁,范围:47-84岁)。在前3例患者中(TAS-102,25mg/m2 BID剂量水平),未观察到剂量限制性毒性(DLTs)。在30 mg/m2 BID剂量水平,5例患者中有3例报告了DLTs:2例患者经历了超过7天的剂量延迟,1例患者无法在第一周期内接受至少75%的研究药物剂量。因此,研究人员降低了TAS-102剂量,3例患者接受了25 mg/m2 BID治疗。由于1/6的患者经历了DLT(4级结肠穿孔),RD为25 mg/m2 BID。
初步活性:截至2024年1月,整体人群和推荐剂量人群的ORR分别为72.7%(8/11)和66.7%(4/6)。
表 3/4级不良反应汇总
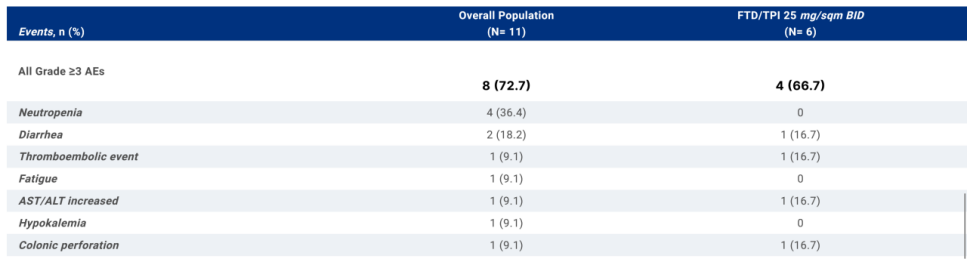
研究结论:卡培他滨和TAS-102与贝伐珠单抗的序贯组合是可行的。2期研究正在进行中,以评估这种方案在同一患者群体中的抗肿瘤活性。
研究三(摘要号3584)
SUNLIGHT研究事后分析:结直肠癌肝转移(CRLM)对接受曲氟尿苷/替匹嘧啶(TAS-102)联合或不联合贝伐珠单抗治疗的mCRC患者的影响
研究背景及设计:
结直肠癌(CRC)患者在疾病发展过程中可能会出现CRLM,并与患者的预后不良有关。在3期SUNLIGHT研究中,无论肿瘤突变状态、肿瘤侧别和其他与预后不良相关的因素如何,TAS-102联合贝伐珠单抗与单独使用TAS-102相比,都可显著改善难治性mCRC患者的OS。基于此,此项事后分析评估了基线CRLM对SUNLIGHT试验中接受治疗的患者疗效结果的影响。
在这项事后分析中,对有和没有CRLM的患者进行了OS、PFS和DCR的评估。使用Kaplan-Meier方法和对数秩检验比较TAS-102与贝伐珠单抗联合组和TAS-102单药组在每个亚组中的生存差异;使用Fisher精确检验比较DCRs。使用Cox比例风险模型估计OS和PFS的风险比(HRs)。
研究结果:
在SUNLIGHT研究中招募的492例患者中,有382例(77.6%)存在基线CRLM,其中194例被随机分配至TAS-102联合贝伐珠单抗组,188例被随机分配至TAS-102单药组。
在TAS-102联合贝伐珠单抗组中(n=246),有和没有CRLM患者的中位OS分别为10.4个月和不可评估(NE)[风险比(HR)为1.88,P=0.005]。在TAS-102单药组中(n=246),有和没有CRLM患者的中位OS分别为6.5个月和10.9个月(HR为1.75,P=0.002)。
在比较各亚组的治疗效果时,无论患者是否有CRLM,与单独TAS-102单药相比,TAS-102联合贝伐珠单抗可实现更长的OS和PFS。在有CRLM的患者中,OS和PFS的HRs分别为0.61(95% CI: 0.48, 0.77; P<0.001)和0.44(95% CI: 0.35, 0.55; P<0.001)。在没有CRLM的患者中,OS和PFS的HRs分别为0.60(95% CI: 0.35, 1.0; P=0.052)和0.38(95% CI: 0.24, 0.58; P<0.001)。
与TAS-102单药相比,接受TAS-102和贝伐珠单抗联合治疗患者的DCR更高(有CRLM的患者为68.6% vs.38.3%,没有CRLM的患者为73.1% vs.53.5%)。
研究结论:这项分析的结果表明,无论患者基线时是否有CRLM,接受TAS-102联合贝伐珠单抗联合治疗的患者比TAS-102单药治疗的患者有更长的OS和PFS以及更高的DCR。但是由于是否存在CRLM的患者数量不平衡,数据需要谨慎解释。
研究四(摘要号3623)
在MD Anderson INTERCEPT项目中,TAS-102治疗ctDNA定义的微小残留疾病(MRD)的CRC患者与合成对照队列的比较:2期试验结果
研究背景及设计:
循环肿瘤DNA(ctDNA)作为一种具有高特异性和阳性预测价值的新型标志物,用于识别CRC患者中放射学隐匿的MRD。开发以根除MRD并提高疾病治愈率为目标的治疗策略是当下CRC领域未被满足的广泛需求。目前多项研究正在评估MRD作为决定术后辅助疗法强度的生物标志物。然而,在监测期间(包括辅助化疗在内的所有治疗完成后)MRD+患者的治疗可行性和有效性尚不清楚。
在这项2期研究中,监测期间MRD+的II-IV期CRC患者(ctDNA+,但在最近30天内的影像学上无疾病证据)接受了6个月的TAS-102治疗(TAS-102组)。患者来源于MD Anderson INTERCEPT项目,该项目将患者MRD检测与组织信息检测(Signatera)整合到CRC患者的标准治疗中。研究主要终点是6个月ctDNA清除率,次要终点包括3个月ctDNA清除率和无病生存期(DFS)。为了进行比较,通过MD Anderson INTERCEPT项目创建了一个回顾性合成队列(SC),由未参加MRD试验的MRD+患者组成。SC组患者的分期、BRAFmt状态、MSI-H状态和治疗历史与TAS-102组进行了匹配。
研究结果:
从2022年7月22日至2023年11月7日,共有15例MRD+患者接受了TAS-102治疗。基线特征:中位年龄62岁(37-73岁)、可切除IV期患者(80%)、MSS型(100%),BRAF野生型(100%)、接受新辅助疗法(87%)。SC组纳入30例患者,基线特征:中位年龄57岁(32-79岁)、可切除IV期患者(80%)、MSS型(100%),BRAF野生型(100%)、接受新辅助疗法(90%)。
在数据截止时,TAS-102组和SC组3个月时ctDNA不可检测率分别为50%(7/14)和6.7%(2/30)(P=0.0022)。TAS-102组有12例患者ctDNA水平下降(86%),相比之下SC中只有5例(17%)(P<0.0001)。在6个月时,TAS-102组82%患者的ctDNA水平处于或低于先前水平。5例患者(45%)在6个月时维持了ctDNA不可检出,相比之下SC组中只有2例(6.7%)(P=0.0096)。
TAS-102组的中位DFS为9.4个月,SC组为5.8个月。
研究结论:通过监测期间的筛查,可以识别MRD+患者并将他们纳入治疗试验。初步结果表明,TAS-102治疗在短期内诱导ctDNA清除是有效的,并且可能会延长与SC组相比接受额外治疗患者的DFS。然而,如果没有持续清除的证据,治愈分数可能不会进一步提高。未来,研究将展示包括生存数据在内的更新结果。
排版编辑:肿瘤资讯-SY











 苏公网安备32059002004080号
苏公网安备32059002004080号


