约25%~30%的非小细胞肺癌(NSCLC)患者初诊时为I~IIIA期,手术是这部分患者的主要根治性治疗方式[1]。尽管术后辅助化疗相较单纯手术显著提高了5.4%的5年总生存率[2],仍有部分患者会出现疾病复发。越来越多的数据表明,基于ctDNA的微小残留病灶(MRD)在多个早期实体瘤中显示出对疾病复发的预测作用[3]。相关研究显示,在可切除NSCLC患者中,与术前ctDNA阴性患者相比,术前ctDNA阳性患者的无复发生存期(RFS)更差;且术后ctDNA阳性可作为预测疾病复发的标志物[4]。此外,术后ctDNA动态监测有助于辅助治疗策略的制定。在驱动基因阳性且术后ctDNA阳性NSCLC患者中,与单纯观察相比,术后接受辅助靶向治疗患者的RFS更优[5]。近期,发表于《J Thorac Oncol》杂志(IF: 20.4)的研究提示,在I-IIIA期EGFR突变NSCLC患者中,基线ctDNA阳性患者的预后更差,且ctDNA动态监测可早于影像学检查发现疾病复发[6]。【肿瘤资讯】现邀中山大学肿瘤防治中心林勇斌教授特此点评,深入解读ctDNA在可切除EGFR突变NSCLC患者中的价值。
研究介绍
本研究是一项前瞻性、非干预、观察性研究,旨在评估ctDNA状态或清除率与早期EGFR突变NSCLC临床预后的相关性,以及ctDNA作为检测MRD的可行性。研究纳入2015年10月至2017年12月期间接受根治性手术切除的I-IIIA期EGFR突变(ex19del/L858R)NSCLC患者,其中IB-IIIA期患者接受4个周期含铂辅助化疗,所有患者均未接受EGFR-TKI辅助治疗。分别在以下时间节点采集患者的血液样本:手术当天(基线)、手术后4周(术后)、术后第1年每3个月、术后第2年每4个月、术后第3年每6个月,之后每年1次,直至5年或出现临床明确的疾病复发。预计纳入274例患者,其中82例患者将在3年随访期间出现疾病复发,考虑12%脱落率,最终需纳入311例患者。所有P值均为双侧,P<0.05认为具有统计学意义。生存分析的数据截止日期为2022年3月30日。DFS定义为从完全手术切除日期开始至疾病复发或任何原因死亡的日期。
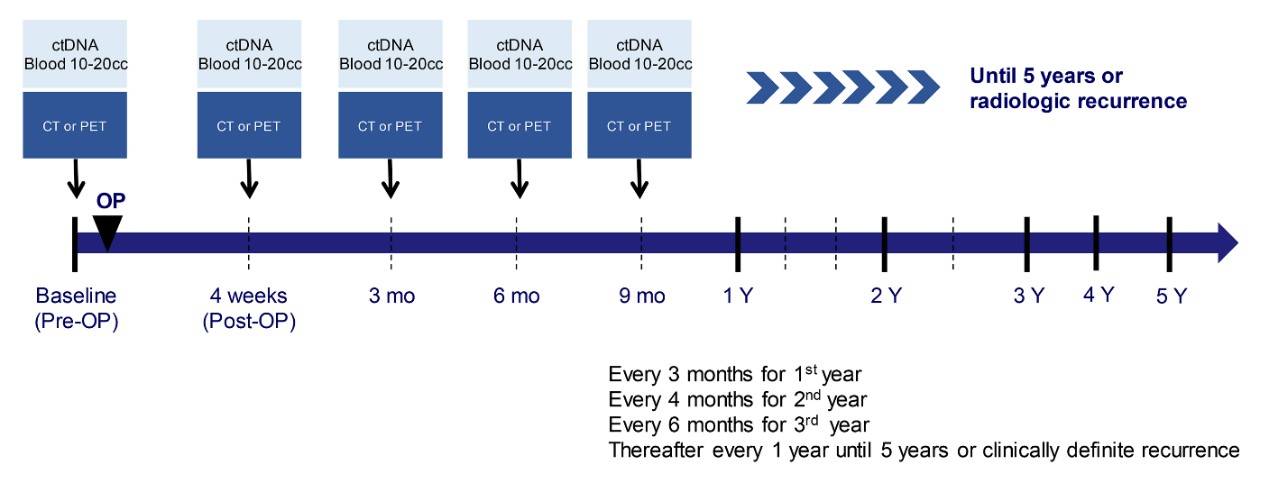 图1 研究设计
图1 研究设计
研究结果
患者基线特征
在311例I-IIIA期NSCLC患者中,共278例患者有ddPCR结果。在278例患者中,中位年龄为61岁(范围:19-90岁);75%为非吸烟者;EGFR ex19del患者占比60%;最常见的组织学亚型为腺泡(88%)、乳头状(23%)、微乳头状(20%)和鳞状(19%)。此外,6%的患者接受了新辅助同步放化疗,19%接受了辅助化疗。具体基线特征见表1。
表1 患者基线特征
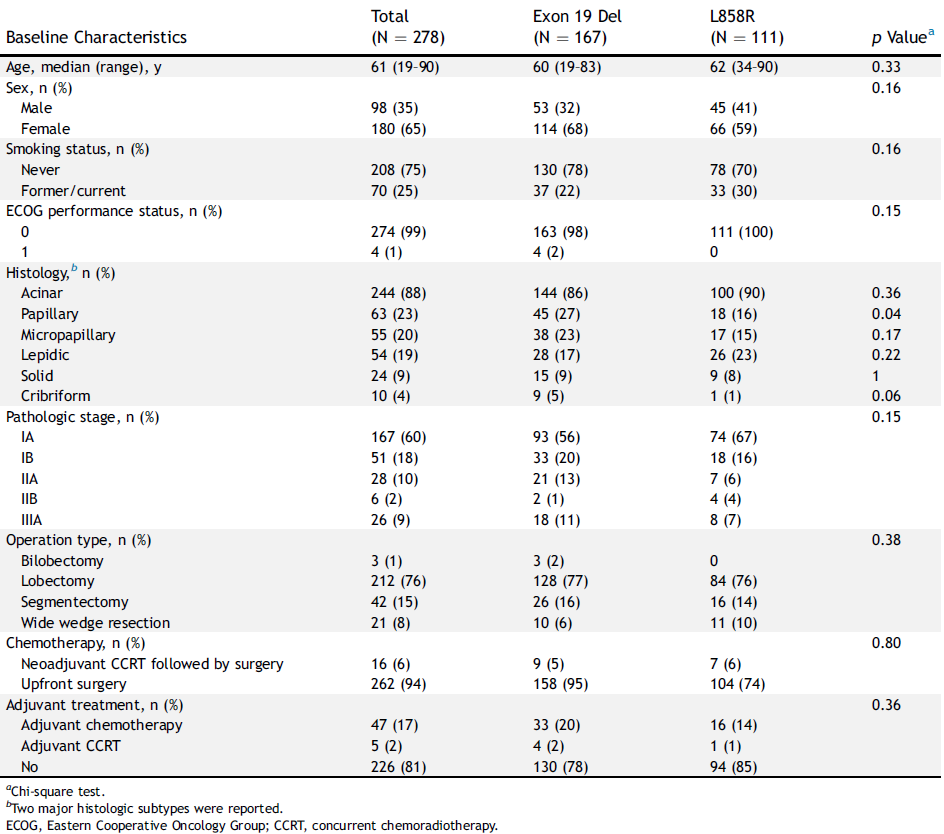
基线ctDNA阳性率和术后ctDNA清除率
在278例患者中,共24%的患者基线ctDNA阳性,其中IA期、IB期、IIA期、IIB期和IIIA期患者基线ctDNA阳性率分别为23%、18%、18%、50%和42%(P=0.06)(图1A)。不同分期患者的ctDNA拷贝数存在差异(P<0.001)(图1B)。此外,在基线ctDNA阳性患者中(N=67),51例(76%)患者在术后4周ctDNA达到清除;不同分期ctDNA清除率无显著差异(图1C)。不同EGFR突变亚型患者的ctDNA阳性率、平均ctDNA浓度或ctDNA清除率无显著差异
 图1 不同分期患者的ctDNA监测情况
图1 不同分期患者的ctDNA监测情况
基于基线和术后ctDNA状态的DFS
截止数据分析,中位随访时间为62个月(范围:2-77)。IA期、IB期、IIA期、IIB期和IIIA期患者的3年DFS率分别为95%、76%、57%、50%和31%;中位DFS分别为NR、NR、65个月、47个月和19个月(P<0.0001)。
根据患者基线和术后ctDNA状态将其分为3组:A组(基线ctDNA阴性,N=211)、B组(基线ctDNA阳性,但术后MRD阴性,N=51)和C组(基线ctDNA阳性且术后MRD阳性,N=16)。A组、B组和C组的3年DFS率分别为84%、78%和50%(图2A)。此外,在IB-IIIA期患者中,A组、B组和C组分别有16.6%、21.6%和37.5%的患者接受了辅助化疗,这部分患者的3年DFS率分别为65%、50%和25%(P=0.01)(图2B)。在IA期患者中,A组、B组和C组的3年DFS率分别为96%、97%和88%(P=0.17)(图2C)。
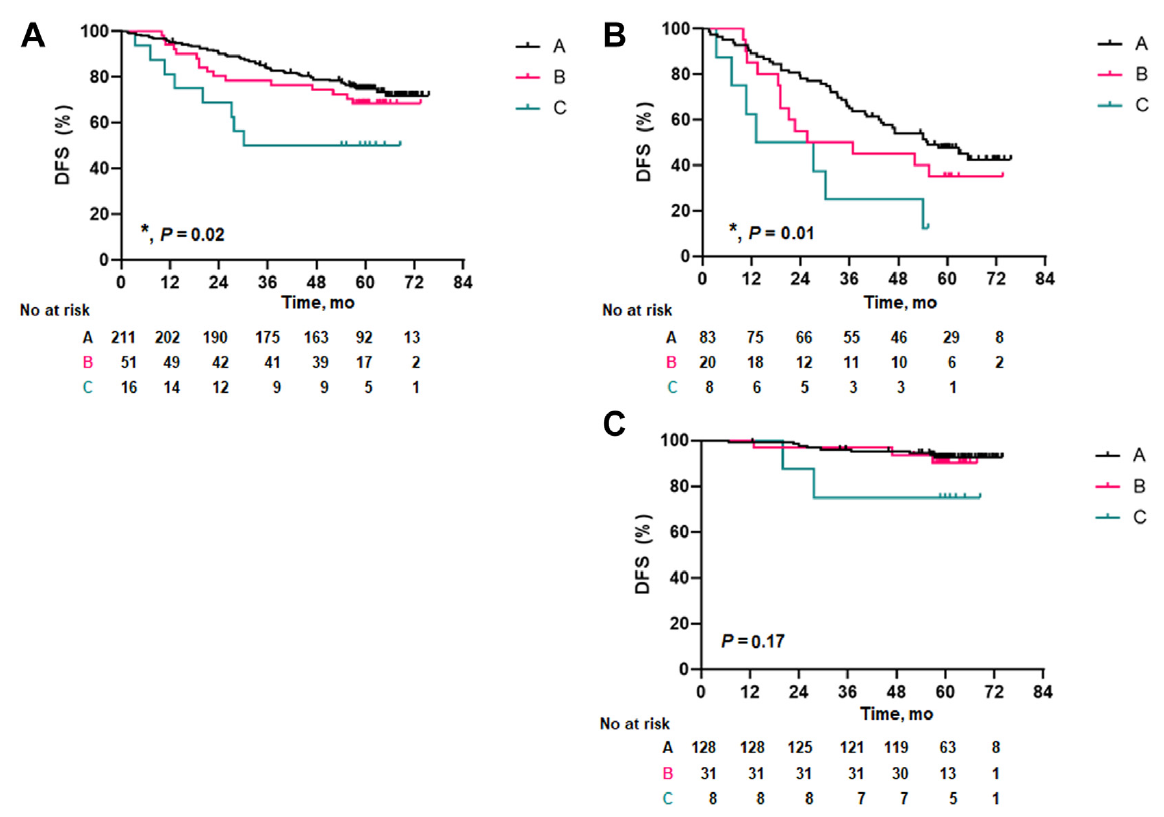 图2 ctDNA的预后价值
图2 ctDNA的预后价值
单因素分析显示,ctDNA状态、组织学类型、病理分期和EGFR突变亚型与DFS相关。经调整的多因素分析显示,微乳头状亚型(P=0.02)、病理分期(P<0.001)和ctDNA状态(P=0.02)是DFS的独立风险因素(表2)。
表2 DFS的单因素和多因素分析
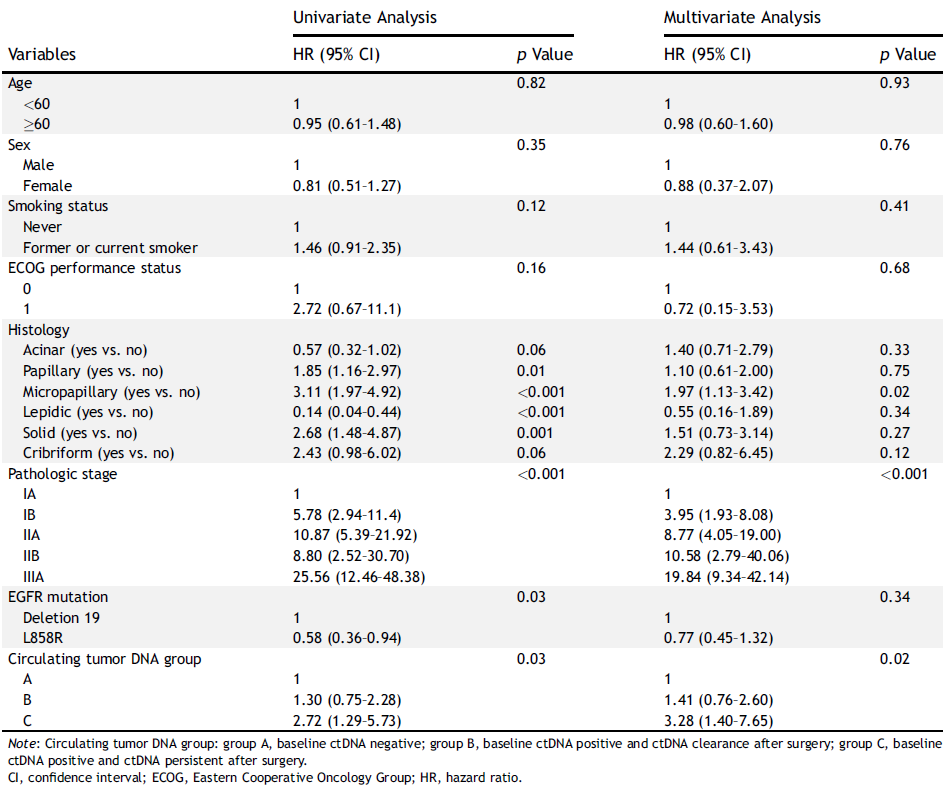
MRD动态监测可预测影像学进展
在ex19del突变亚组中,基线ctDNA阴性患者为127例,基线ctDNA阳性为40例。在基线ctDNA阴性患者中,有30例在随访期间MRD转阳。在基线ctDNA阳性患者中,有30例患者在术后MRD转阴,这30例患者在随访期间有16例MRD转阳,14例患者术后MRD持续阴性(图3)。此外,在46例术后MRD阴性但随访期间MRD转阳的患者中,中位至MRD转阳的时间为19个月(范围:0.4-44.3)。在术后任意时间节点检测到MRD的56例患者中,54%的患者在影像学复发前检测到MRD;对于术后MRD持续阴性的患者(N=111),77%未出现影像学进展。
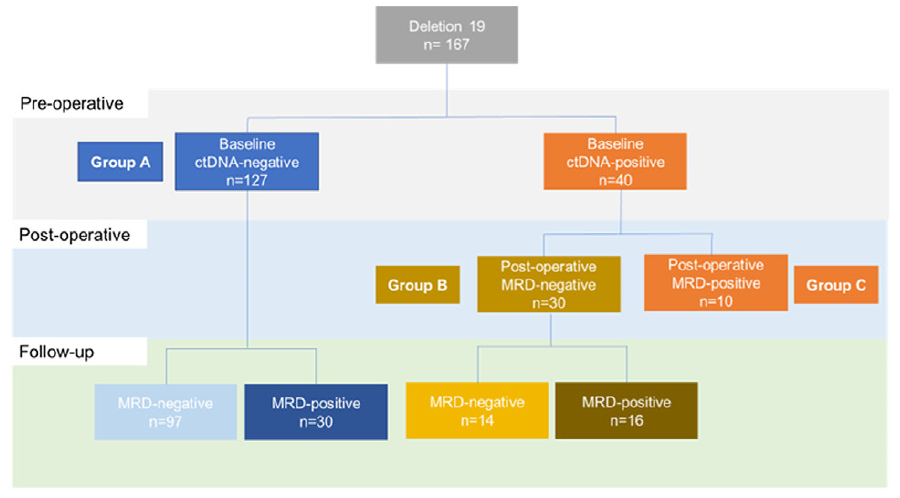 图3 ex19del突变亚组ctDNA动态分析
图3 ex19del突变亚组ctDNA动态分析
在L858R突变亚组中,基线ctDNA阴性患者为84例,基线ctDNA阳性为27例。在基线ctDNA阴性患者中,有23例在随访期间MRD转阳。在基线ctDNA阳性患者中,有21例患者在术后MRD转阴,这21例患者在随访期间有9例MRD转阳,12例患者术后MRD持续阴性(图4)。在术后MRD阴性但随访期间MRD转阳的32例患者中,中位至MRD转阳的时间为33个月(范围:0.4-44.0)。在术后任意时间节点检测到MRD的38例患者中,11%的患者在影像学复发前检测到MRD;在73例术后任何时间节点MRD均为阴性的患者重,75%未出现影像学进展。
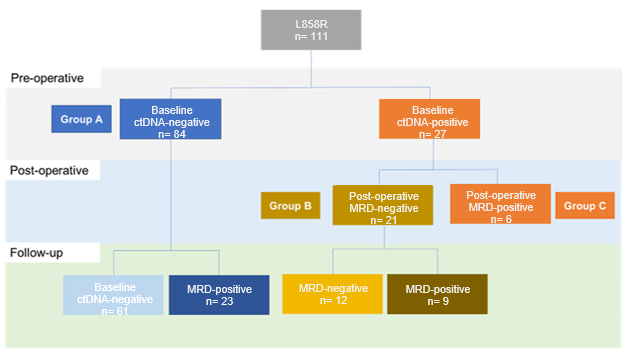 图4 L858R突变亚组ctDNA动态分析
图4 L858R突变亚组ctDNA动态分析
小结
研究结果显示,在I-IIIA期EGFR突变NSCLC患者中,基线ctDNA阳性或MRD阳性患者的DFS更差;且ctDNA动态监测有助于在影像学进展前监测到疾病复发。
[1] Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016 Jan;11(1):39-51. doi: 10.1016/j.jtho.2015.09.009. PMID: 26762738.
[2] Pignon JP, Tribodet H, Scagliotti GV, et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008 Jul 20;26(21):3552-9. doi: 10.1200/JCO.2007.13.9030. Epub 2008 May 27. PMID: 18506026.
[3] Chen H, Zhou Q. Detecting liquid remnants of solid tumors treated with curative intent: Circulating tumor DNA as a biomarker of minimal residual disease (Review). doi: 10.3892/or.2023.8543. Epub 2023 Apr 13. PMID: 37052271.
[4] Xia L, Mei J, Kang R, et al. Perioperative ctDNA-Based Molecular Residual Disease Detection for Non-Small Cell Lung Cancer: A Prospective Multicenter Cohort Study (LUNGCA-1). Clin Cancer Res. 2022 Aug 2;28(15):3308-3317. doi: 10.1158/1078-0432.CCR-21-3044. PMID: 34844976.
[5] Liang Xia et al., Dynamic ctDNA to inform the precise management of resected NSCLC: LUNGCA-2 study.. JCO 41, 8528-8528(2023). DOI:10.1200/JCO.2023.41.16_suppl.8528
[6] Jung HA, Ku BM, Kim YJ, et al. Longitudinal Monitoring of Circulating Tumor DNA From Plasma in Patients With Curative Resected Stages I to IIIA EGFR-Mutant Non-Small Cell Lung Cancer. J Thorac Oncol. 2023 Sep;18(9):1199-1208. doi: 10.1016/j.jtho.2023.05.027. Epub 2023 Jun 10. PMID: 37308037.
[7] NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) Non-Small Cell Lung Cancer. Version 5.2024.
[8] 中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南. 2024 / 中国临床肿瘤学会指南工作委员会组织编写.——北京:人民卫生出版社,2024.04.
[9] Saw SPL, Zhou S, Chen J, et al. Association of Clinicopathologic and Molecular Tumor Features With Recurrence in Resected Early-Stage Epidermal Growth Factor Receptor-Positive Non-Small Cell Lung Cancer. JAMA Netw Open. 2021 Nov 1;4(11):e2131892. doi: 10.1001/jamanetworkopen.2021.31892. PMID: 34739062.
[10] Tom John, Christian Grohe, Jonathan Goldman, et al. Molecular residual disease (MRD) analysis from the ADAURA trial of adjuvant (adj) osimertinib in patients (pts) with resected EGFR‑mutated (EGFRm) stage IB–IIIA non-small cell lung cancer (NSCLC). 2024 ASCO. Abstract 8005.
本材料由阿斯利康提供,仅供医疗卫生专业人士参考,不可用于推广目的。
审批编号:CN-136158
过期日期:2024-8-22
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


