肺癌是目前发病率及死亡率最高的恶性肿瘤,是人类健康的主要威胁之一。外科手术切除是II-III期NSCLC主要的治疗手段,但超过50%的患者会在术后5年内发生局部复发或远处转移,生存预后仍有极大提升空间。近年来,免疫治疗在NSCLC围术期治疗取得突破性进展,围术期免疫联合化疗新辅助+辅助治疗已成为可手术II-III期NSCLC的新标准。随着围术期免疫治疗的广泛应用,该领域的一些热点问题引发关注,包括围术期治疗的人群选择、方案选择、时长选择、病理评估、pCR患者是否需要继续辅助治疗以及围术期患者全程管理等,亟需规范化指导和建议。聚焦以上临床问题,《非小细胞肺癌围手术期免疫规范化治疗专家共识》的制定旨在为中国临床医师的围术期免疫治疗应用提供规范化引导。

专家组组长
王长利 教授
天津医科大学肿瘤医院肺部肿瘤科
主任医师,教授,博士生导师
天津医科大学肿瘤医院外科教研室主任
天津市肺癌诊治中心主任
中国抗癌协会肺癌专业委员会名誉主任委员
国家卫生健康委能力建设和继续教育肿瘤学专家委员会副主任委员
CSCO非小细胞肺癌专业委员会副主任委员
非小细胞肺癌围手术期免疫规范化治疗专家共识
肺癌是引起人类恶性肿瘤相关性死亡的首要原因,2022年中国肺癌新发病例约106万例,死亡病例约73万例,其发病率和死亡率位居恶性肿瘤首位[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌的主要亚型,占所有肺癌病例的80%~85%。对于早、中期NSCLC,手术是主要的治疗手段。然而,尽管有根治性切除机会,52%~75%的Ⅱ~Ⅲ期NSCLC患者会在术后5年内发生局部复发或远处转移[2]。为改善可切除NSCLC患者的预后,辅助化疗和新辅助化疗已被用于围手术期治疗,但5年生存率仅能提升5%[3-4],生存改善不佳。
近年来,以程序性细胞死亡蛋白-1/程序性细胞死亡配体-1(programmed death-1/programmed death-ligand 1,PD-1/PD-L1)抑制剂为代表的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)在NSCLC围手术期治疗取得了突破性进展。随着多项Ⅲ期临床研究相继取得阳性结果,新辅助、辅助、“新辅助+辅助”围手术期免疫治疗3种模式,已被证实可以显著降低可切除NSCLC术后复发风险,成为Ⅱ~Ⅲ期NSCLC围手术期治疗新标准。随着围手术期免疫时代的来临,围手术期治疗的人群选择、方案选择、时长选择、病理评估、pCR患者是否需要继续辅助治疗以及围手术期患者全程管理等临床问题引发大家关注,亟需规范化指导和建议。
为响应《“健康中国2030”规划纲要》[5],推动中国NSCLC免疫治疗规范化发展,共识专家组针对NSCLC围手术期免疫治疗的临床热点问题进行深入探讨,形成“非小细胞肺癌围手术期免疫规范化治疗专家共识”(简称“共识”),以期为NSCLC围手术期免疫治疗的临床应用提供规范化指导。
01
方法学
共识的制定主要基于近期8项围手术期免疫治疗Ⅲ期临床研究结果[6-15](CheckMate-816、IMpower-010、KEYNOTE-091、KEYNOTE-671、AEGEAN、CheckMate-77T、RATIONALE-315、Neotorch),执笔专家主要参考Ⅲ期临床研究的高水平证据进行临床问题梳理和文章初稿撰写,于共识研讨会与专家组成员进行讨论,并针对共识要点进行投票,最终由执笔专家汇总专家意见和投票结果完成定稿。根据证据级别及共识投票的一致性,本共识的共识级别分类如表1。

02
可切除早期及局晚期NSCLC术前新辅助免疫治疗
新辅助免疫治疗通过2种潜在途径激活全身抗肿瘤免疫反应。1)在原发肿瘤部位,PD-1/PD-L1抑制剂可诱导肿瘤特异性T细胞克隆“原位”扩增,直接杀伤肿瘤细胞。2)起源于肿瘤的树突状细胞能够携带肿瘤特异性抗原至肿瘤引流区淋巴结,PD-1/PD-L1抑制剂可在此处诱导肿瘤特异性T细胞的产生,激活的肿瘤特异性T细胞通过淋巴管进入血液循环和组织,寻找并消除微转移灶。可切除早期及局晚期NSCLC患者由于术前更多新抗原的存在、完整的淋巴系统、以及患者良好的身体状态可能有利于更好地激活抗肿瘤免疫反应,有效控制远处微转移,降低疾病复发风险[16]。
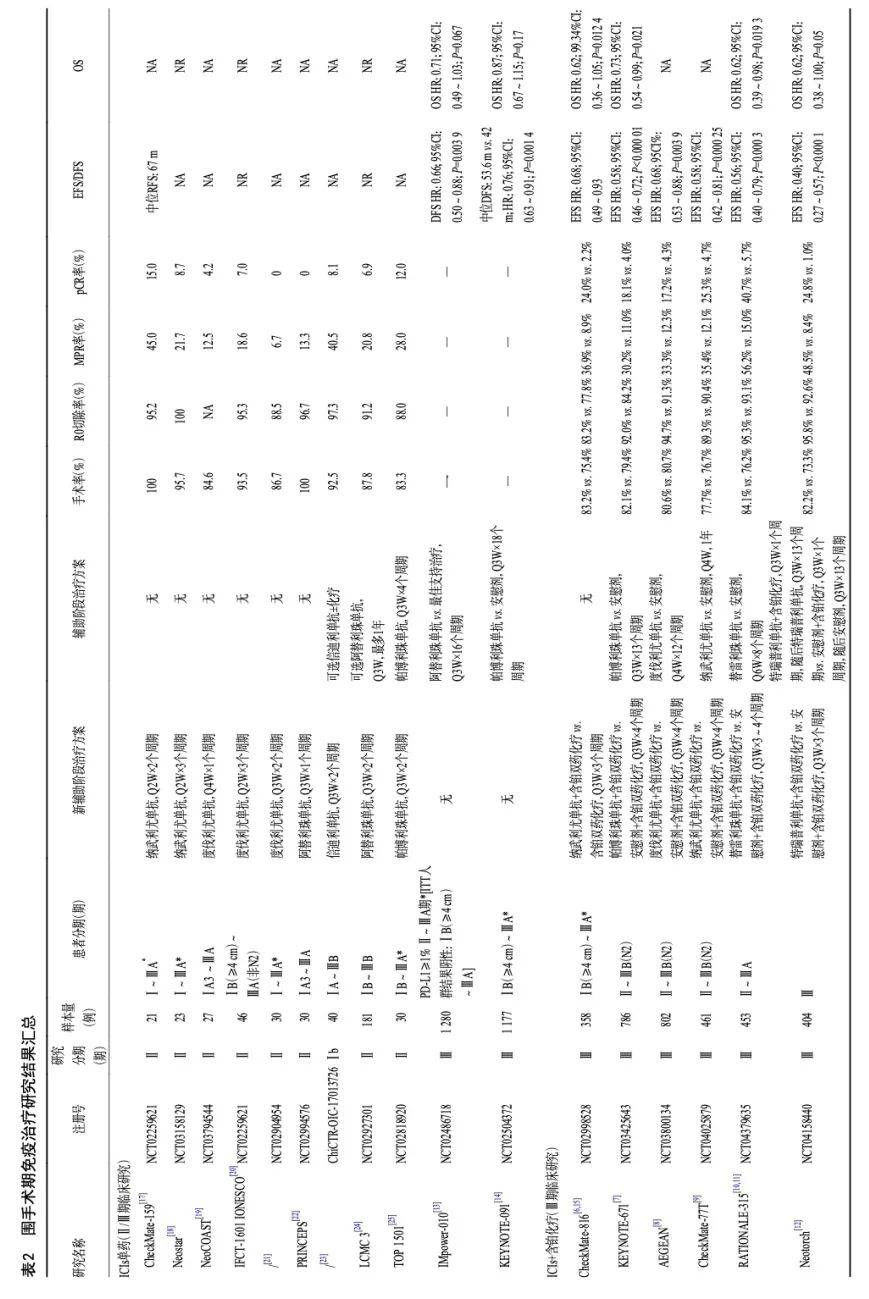
目前,多项Ⅲ期临床研究证实与传统新辅助化疗相比,新辅助免疫治疗能够显著改善可切除Ⅱ~Ⅲ期NSCLC的病理完全缓解率(pathological complete response,pCR)和主要病理缓解率(major pathological response,MPR),并延长无事件生存期(event-free survival,EFS)。CheckMate-816研究[6]证实了纳武利尤单抗联合含铂双药化疗新辅助治疗的临床获益,KEYNOTE-671(帕博利尤单抗)、AEGEAN(度伐利尤单抗)、CheckMate-77T(纳武利尤单抗)、RATIONALE-315(替雷利珠单抗)和Neotorch(特瑞普利单抗)研究[7-12]证实了ICIs联合含铂化疗新辅助治疗,辅以ICIs单药辅助治疗的临床获益(表2)。但当前临床实践中,仍然存在诸多临床问题亟待回答,包括:新辅助免疫治疗的人群选择,方案选择、治疗时长及病理评估。
2.1 新辅助免疫治疗的人群选择
目前已取得成功的ICIs联合化疗新辅助治疗的Ⅲ期临床研究大多广泛地纳入了Ⅱ期和Ⅲ期可切除的NSCLC患者,没有进行PD-L1表达水平的筛选,多项研究进一步分析了不同PD-L1表达水平、临床分期和病理类型与临床获益的关系。
1) PD-L1 表达水平与新辅助免疫治疗的获益
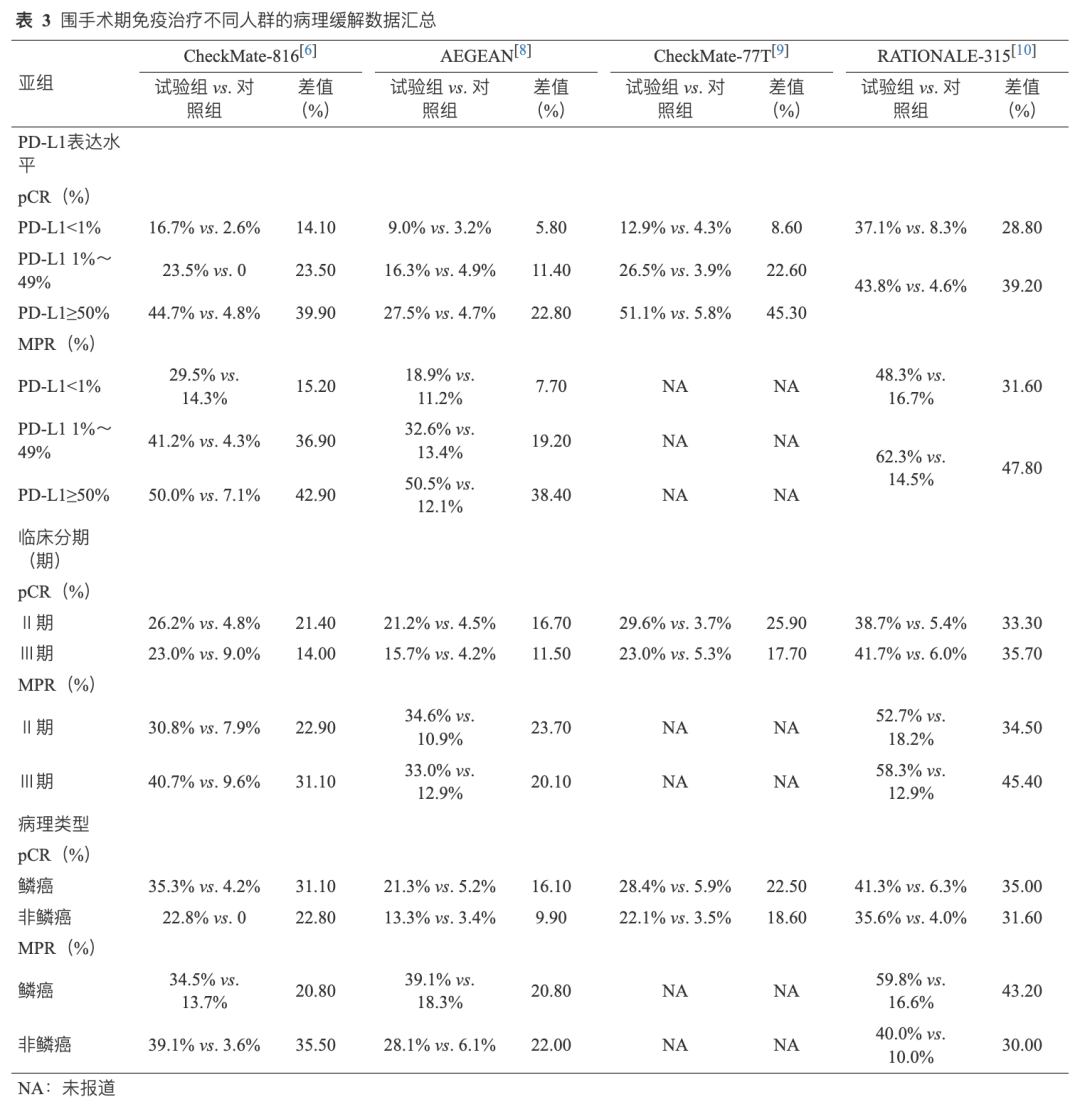
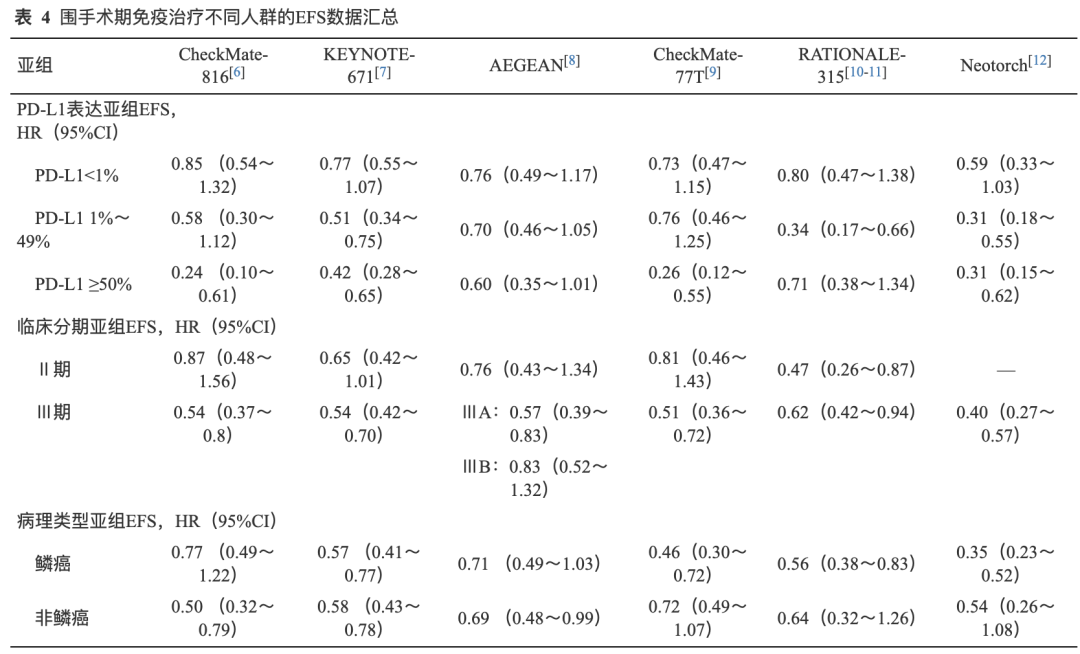
目前新辅助免疫治疗Ⅲ期临床研究均预设PD-L1表达水平为关键分层因素,并分析了不同PD-L1表达水平与临床获益的关系。各研究中PD-L1表达分布相似,PD-L1阳性率为53.7%~66.7%[6-12]。CheckMate-816、AEGEAN、CheckMate-77T和RATIONALE-315研究[6,8-10]分析了PD-L1表达水平和病理缓解(pCR/MPR)获益的关系,在不同的PD-L1表达水平均观察到pCR率(PD-L1<1%:5.8%~14.1%;PD-L1 1%~49%:11.4%~23.5%;PD-L1≥50%:22.8%~45.3%)和MPR率(PD-L1<1%:7.7%~15.2%;PD-L1 1%~49%:19.2%~36.9%;PD-L1≥50%:38.4%~42.9%)的提升,且PD-L1表达水平和病理缓解(pCR/MPR)的提升呈正相关趋势(表3)。进一步分析PD-L1表达与EFS获益的关系发现,在不同PD-L1表达水平下观察到不同程度的EFS获益(HR PD-L1<1%:0.59~0.85; PD-L1 1%~49%:0.31~0.76; PD-L1≥50%:0.24~0.71),且PD-L1表达水平和EFS获益呈正相关趋势[6-12](表4)。综上所述,PD-L1表达水平与新辅助免疫治疗的病理缓解和EFS获益呈正相关趋势,PD-L1的表达水平高提示患者潜在从新辅助免疫治疗中获益更大。
2) 临床分期与新辅助免疫治疗的获益
CheckMate-816、AEGEAN、CheckMate-77T和RATIONALE-315研究[6,8-10]均分别报道了Ⅱ期和Ⅲ期患者病理缓解(pCR/MPR)的获益,结果一致显示,Ⅱ期和Ⅲ期患者均观察到pCR率(Ⅱ期:16.7%~33.3%;Ⅲ期:11.5%~35.7%)和MPR率(Ⅱ期:22.9%~34.5%;Ⅲ期:20.1%~45.4%)的提升,且临床分期与新辅助治疗病理缓解的获益程度无关(表3)。多项Ⅲ期临床研究均分别报道了Ⅱ期和Ⅲ期患者的EFS获益情况,其中CheckMate-816[HR:0.87(Ⅱ期),0.54(Ⅲ期)]和CheckMate-77T[HR:0.81(Ⅱ期),0.51(Ⅲ期)]研究[6,9]亚组分析显示Ⅲ期患者EFS获益大于Ⅱ期患者,而KEYNOTE-671[HR:0.65(Ⅱ期),0.54(Ⅲ期)]、AEGEAN[HR:0.76(Ⅱ期),0.57(ⅢA期),0.83(ⅢB期)]和RATIONALE-315[HR:0.47(Ⅱ期),0.62(Ⅲ期)]研究[7-8,11]亚组分析结果显示Ⅱ期患者和Ⅲ期患者EFS获益相似或无关(表4)。综上所述,临床分期(Ⅱ期 vs. Ⅲ期)与新辅助免疫治疗的病理缓解获益无关,与EFS获益的关系尚未明确。
3) 病理类型与新辅助免疫治疗的获益
CheckMate-816、AEGEAN、CheckMate-77T和RATIONALE-315研究[6,8-10]均分别报道了鳞癌和非鳞癌患者病理缓解(pCR/MPR)的获益,其中CheckMate-816[31.1%(鳞癌),22.8%(非鳞癌)]、AEGEAN[16.1%(鳞癌),9.9%(非鳞癌)]研究[6,8]显示鳞癌患者pCR提升更高,但CheckMate-77T[22.5%(鳞癌),18.6%(非鳞癌)]和RATIONALE-315[35.0%(鳞癌),31.6%(非鳞癌)]研究[9-10]显示鳞癌和非鳞癌患者pCR提升相似;然而,CheckMate-816研究[6][20.8%(鳞癌) vs. 35.5%(非鳞癌)]显示非鳞癌患者MPR率提升更高,RATIONALE-315研究[10][43.2%(鳞癌) vs. 30.0%(非鳞癌)]显示鳞癌患者MPR率提升更高,AEGEAN研究[8][20.8%(鳞癌) vs. 22.0%(非鳞癌)]显示鳞癌和非鳞癌MPR率提升相似;提示病理类型与新辅助免疫治疗的病理缓解的关系尚未明确(表3)。
多项Ⅲ期临床研究均分别报道了鳞癌和非鳞癌患者的EFS获益情况,其中Neotorch[EFSHR:0.35(鳞癌),0.54(非鳞癌))和CheckMate-77T[EFS HR:0.46(鳞癌),0.72(非鳞癌)]研究[9,12]亚组分析显示鳞癌患者EFS获益大于非鳞癌患者,而CheckMate-816[EFS HR:0.77(鳞癌),非鳞癌:0.50(非鳞癌)]研究[6]中却提示非鳞癌患者有着更好获益,KEYNOTE-671[EFS HR 鳞癌:0.57(鳞癌),0.58(非鳞癌)]、AEGEAN(EFS HR:0.71[鳞癌], 0.69[非鳞癌])和RATIONALE-315[EFS HR:0.56(鳞癌),0.64(非鳞癌)]研究[7-8,11]显示非鳞癌和鳞癌患者EFS获益相似(表4)。综上,病理类型(鳞癌 vs. 非鳞癌)与新辅助免疫治疗的病理缓解和EFS获益的关系尚未明确。
4)驱动基因状态与新辅助免疫治疗的获益
多项围手术期免疫治疗Ⅲ期临床研究中对于入组患者驱动基因状态要求存在差异,CheckMate-816、CheckMate-77T、RATIONALE-315和Neotorch研究纳入了EGFR/ALK阴性或未知的NSCLC患者,而KEYNOTE-671和AEGEAN研究纳入了部分EGFR突变或ALK易位患者。KEYNOTE-671和AEGEAN研究进一步分析了EGFR突变阳性人群接受围手术期免疫治疗的EFS获益,但显示不一致的结果[33-34]。在KEYNOTE-671研究中,EGFR突变阳性NSCLC(33例)与EGFR阴性(238例)/状态未知患者(526例),接受围手术期免疫治疗EFS获益一致(EGFR突变阳性:HR=0.09,EGFR阴性:HR=0.48,EGFR未知:HR=0.64);而在AEGEAN研究中,EGFR突变阳性NSCLC(51例)接受围手术期免疫治疗相较化疗未改善EFS(HR=0.86)。综上所述,对于EGFR突变阳性人群最佳新辅助治疗方案的选择还需更多研究探索。
共识意见1:
ICIs联合化疗新辅助治疗可切除的Ⅱ~Ⅲ期NSCLC患者:
√ 无论PD-L1表达水平均可观察到病理缓解和EFS获益,PD-L1表达水平与新辅助免疫治疗的临床获益呈正相关趋势,PD-L1表达水平高提示患者潜在从新辅助免疫治疗中获益更大,因此建议患者在条件允许的情况下进行PD-L1检测。
(共识级别:1A)
√ Ⅱ期和Ⅲ期患者均显示病理缓解和EFS获益,临床分期与新辅助免疫治疗的病理缓解获益无关,与 EFS获益的关系尚未明确,期待更多研究验证。
(共识级别:1A)
√ 鳞癌和非鳞癌患者均显示病理缓解和EFS获益,病理类型与新辅助免疫治疗的病理缓解和 EFS获益的关系尚未明确,期待更多研究验证。
(共识级别:1A)
2.2 新辅助免疫治疗的方案选择
多项临床研究探索了不同的新辅助免疫治疗方案,包括ICIs单药、ICIs联合化疗、ICIs联合放疗、ICIs联合抗血管治疗和ICIs联合其他免疫调节药物等,其中ICIs联合化疗方案已在多项Ⅲ期临床研究中取得成功。
1) ICIs单药治疗
CheckMate-159、LCMC-3、IONESCO等[17-25]多项早期研究探索了不同的ICIs单药新辅助治疗在NSCLC的应用(表2),证实了ICIs新辅助治疗能够诱导外周血中突变相关的新抗原特异性T细胞克隆扩增,奠定了ICIs新辅助治疗的理论基础。由于早期研究病例数较小,不同研究间的病理缓解率波动范围较大,但整体MPR(6.7%~45.0%)和pCR(0~15.0%)均明显低于后续ICIs联合化疗新辅助方案的探索。基于早期的研究结果,ICIs单药新辅助治疗并未进一步开展Ⅲ期临床研究。
2) ICIs联合含铂化疗
多项Ⅲ期临床研究探索了不同的ICIs联合含铂化疗新辅助治疗,术后联合或不联合ICIs辅助治疗在NSCLC的应用,证实了ICIs 与化疗联合可加强新抗原的释放,促进更强大的免疫反应(表2)。
全球Ⅲ期临床研究KEYNOTE-671、AEGEAN和CheckMate-77T研究[7-9]分别探索了帕博利珠单抗、度伐利尤单抗和纳武利尤单抗联合含铂化疗新辅助治疗,辅以相应ICIs单药辅助治疗在NSCLC的应用,CheckMate-816研究[6]探索了纳武利尤单抗联合含铂化疗单纯新辅助治疗在NSCLC的应用,结果一致证实,相较新辅助化疗,ICIs联合化疗新辅助治疗可显著提高pCR、MPR率,并延长EFS。其中CheckMate-816研究报道了中国亚组数据(试验组:44例,对照组:53例),亚组分析显示出与总人群一致的pCR(25.0% vs. 1.9%)和EFS(mEFS:NR vs. 13.9个月,HR=0.47,95%CI:0.25~0.88)获益趋势[35]。
RATIONALE-315和Neotorch研究[10-12]均是针对中国患者开展的Ⅲ期临床研究。RATIONALE-315研究[10-11]纳入453例Ⅱ~ⅢA期NSCLC患者,研究显示替雷利珠单抗联合含铂化疗,辅以替雷利珠单抗单药辅助治疗相较新辅助化疗,可显著提高pCR(40.7% vs. 5.7%)、MPR率(56.2% vs. 15.0%),并延长EFS(HR=0.56;95%CI:0.40~0.79; P=0.0003)和OS获益(HR=0.62;95%CI:0.39~0.98;P=0.0193)。Neotorch研究[12]纳入了404例ⅢA~ⅢB期可切除的NSCLC患者,研究显示特瑞普利单抗联合含铂化疗,辅以特瑞普利单抗单药辅助治疗相较新辅助化疗,可显著提高pCR(24.8% vs. 1.0%)、MPR率(48.5% vs. 8.4%),并延长EFS(HR=0.40;95%CI:0.27~0.57;P<0.000 1)和OS获益(HR=0.62;95%CI:0.38~1.00;P=0.05)。以上研究进一步证实了ICIs联合化疗新辅助治疗在中国NSCLC患者中的临床获益。
对于新辅助ICIs联合化疗方案的选择,非鳞癌患者选择联合培美曲塞和铂类方案的证据最为充分,Ⅲ期临床研究CheckMate-816、RATIONALE-315、AEGEAN、KEYNOTE-671和Neotorch对于非鳞癌患者均选择联合培美曲塞+铂类化疗方案[6-8,10-12]。鳞癌患者选择联合紫杉类化疗方案的证据更为充分,Ⅲ期临床研究RATIONALE-315[10]对于鳞癌患者选择联合紫杉醇+铂类化疗方案,CheckMate-77T和Neotorch研究[9,12]对于鳞癌患者选择联合紫杉醇或多西他赛+铂类化疗方案,CheckMate-816和AEGEAN研究[6,8]对于鳞癌患者选择联合紫杉醇或吉西他滨+铂类化疗方案。
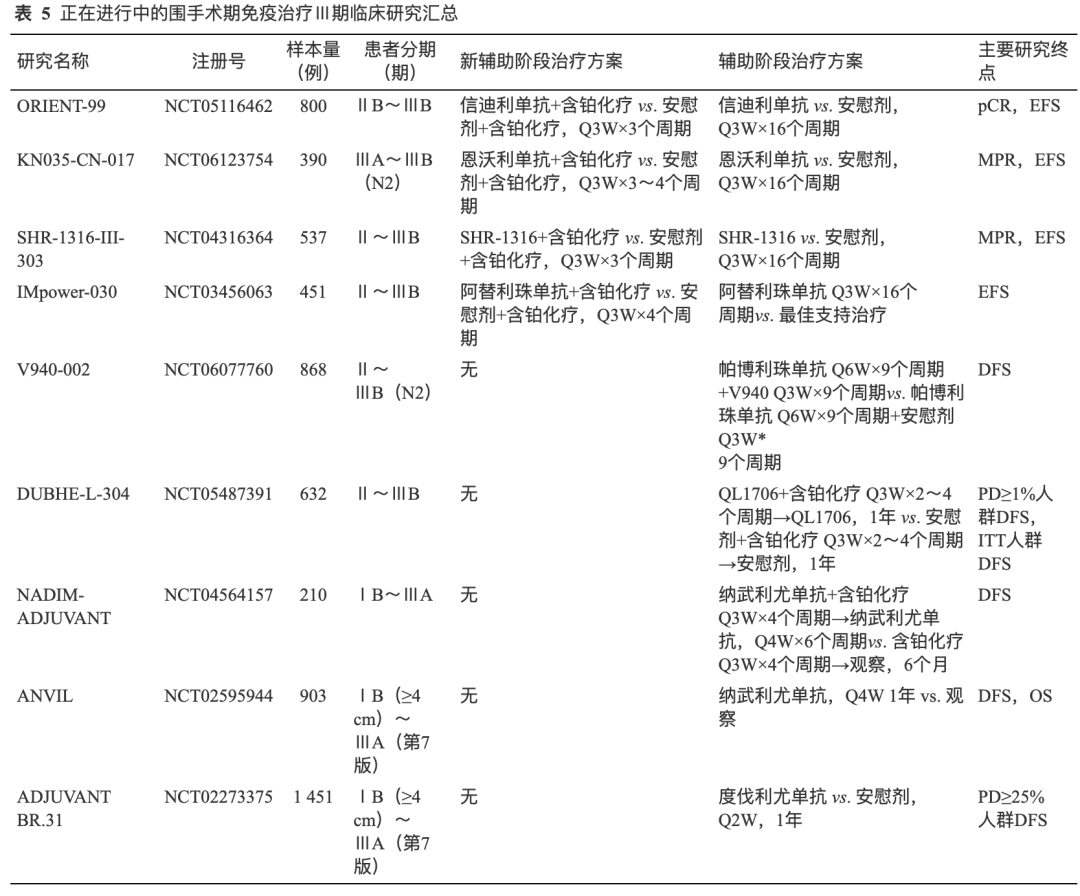
目前还有多项ICIs联合化疗的Ⅲ期临床研究正在进行中,未来有望为临床提供更多药物选择(表5)。
3)ICIs联合其他治疗策略
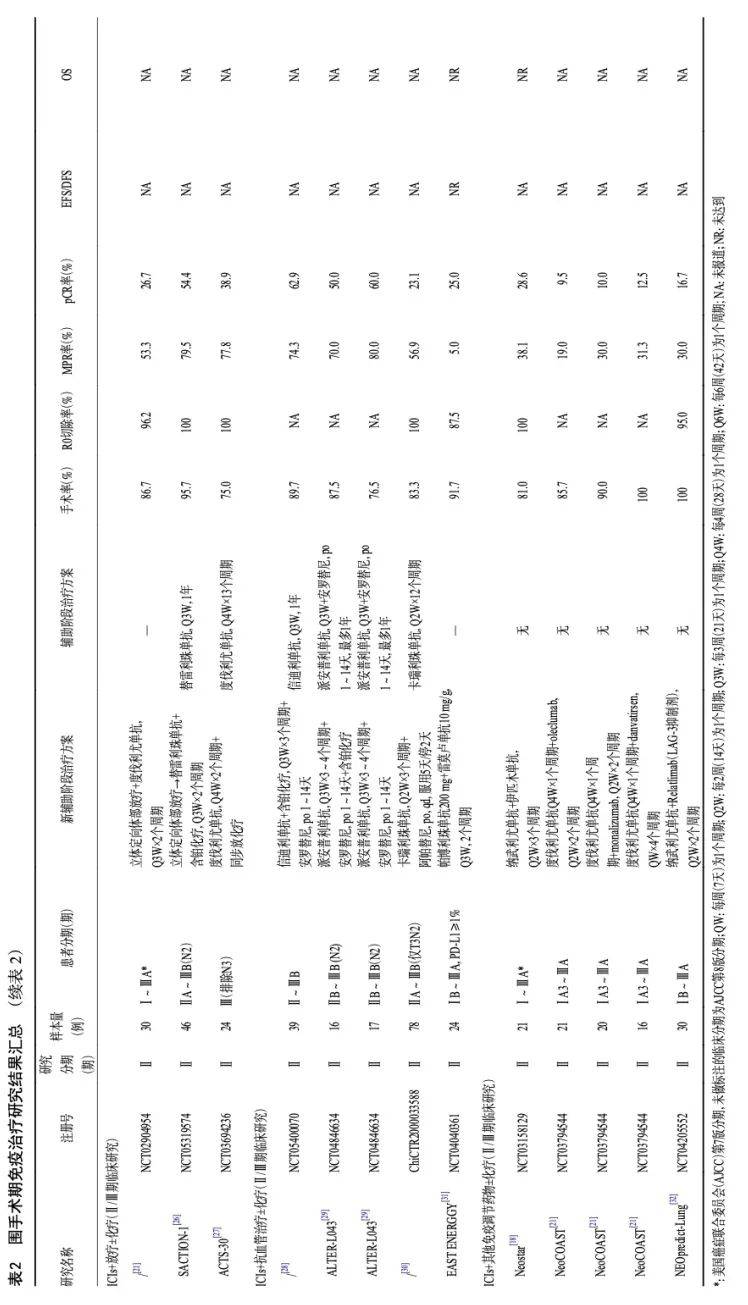
ICIs联合多种药物或治疗手段被证实能够调节免疫微环境,已成为新辅助治疗的研究热点,其中ICIs联合放化疗,ICIs联合抗血管以及ICIs联合新型免疫检查点抑制剂的探索已公布早期研究结果(表2)。SACTION-01和ACTS-30等早期研究[26-27]提示ICIs+化疗基础上联合放疗整体安全性良好且有望进一步提升新辅助疗效。既往研究[36]提示放疗在新辅助治疗中的应用可能增加手术的难度,因此仍需关注新联合策略对手术的影响。早期研究[28-31]提示ICIs联合抗血管治疗联合或不联合化疗新辅助治疗显示出初步的治疗活性,且安全性良好,其中ALTER-L043研究[29]患者随机分为3组,接受派安普利单抗+化疗+安罗替尼、派安普利单抗+化疗或派安普利单抗+安罗替尼新辅助治疗,MPR率分别为 70.0% vs. 37.5%vs. 80.0%,pCR率分别为50.0%vs. 37.5%vs. 60.0%。多项早期研究还探索了ICIs联合其他免疫调节药物在新辅助中的应用[18-19,32],包括联合relatlimab(LAG-3抑制剂),oleclumab(CD73抑制剂)、monalizumab(NKG2A 抑制剂)或danvatirsen(STAT3抑制剂),部分联合方案显示出一定协同治疗作用,但还需更多研究验证。
共识意见2:
√ 对于可切除的Ⅱ~Ⅲ期NSCLC,术前推荐首选新辅助ICIs联合含铂化疗方案,临床证据最为丰富;新辅助ICIs单药疗效有限;其他多种ICIs联合新策略正在探索中。(共识级别:1A)
√ 对于新辅助ICIs联合化疗方案的选择,鳞癌患者推荐首选紫杉类药物联合铂类化疗方案,非鳞癌推荐首选培美曲塞联合铂类化疗方案。
(共识级别:1A)
2.3 新辅助免疫治疗的治疗时长
目前新辅助/围手术期免疫治疗Ⅲ期临床研究中,术前均采用了3~4个周期新辅助ICIs+化疗。其中,CheckMate-816、KEYNOTE-671、AEGEAN、CheckMate-77T和RATIONALE-315研究[6-11]将3~4个周期新辅助ICIs+化疗放在术前应用,术后辅助阶段不再联合化疗,而Neotorch研究[12]则将4个周期ICIs+化疗放在术前(3个周期)+术后(1个周期)应用。以上Ⅲ期临床研究一致显示,3~4个周期的术前新辅助ICIs+化疗能够实现高pCR/MPR率和EFS获益,且不影响手术的开展(表2)。
既往晚期NSCLC研究显示,ICIs+化疗的中位起效时间(time to response,TTR)约为2个月(每21天为1个周期,即3个周期左右);探索性研究显示,免疫治疗后达到客观缓解的晚期NSCLC患者,在治疗的3~4个周期可在外周血中观察到PD-1+CD8+T细胞的增殖[37],提示术前应用3~4个周期ICIs+化疗新辅助治疗潜在能够最大程度发挥免疫治疗作用。此外,既往指南推荐围手术期化疗使用3~4个周期,因此将3~4个周期新辅助ICIs+化疗放在术前既可兼顾疗效,同时术后辅助ICIs阶段无需再联合化疗,更有利于提高患者依从性,方便患者管理。
共识意见3:
√ 对于可切除的Ⅱ~Ⅲ期NSCLC患者,推荐术前完成3~4个周期ICIs联合含铂化疗,治疗2个周期后进行首次疗效评估,最大化新辅助治疗获益的同时可以灵活把握手术时机。(共识级别:1A)
2.4 新辅助免疫治疗的病理评估
新辅助化疗时代的病理缓解率有限,新辅助免疫治疗因其独特的作用机制,显示出优异的病理缓解获益。以大量免疫细胞浸润为主的肿瘤消退是新辅助免疫治疗后的组织学特征[17],提示病理缓解(pCR/MPR)是免疫激活杀伤肿瘤细胞的直接指标,更够早期反应新辅助免疫治疗的获益。
1)新辅助免疫治疗的病理缓解(pCR/MPR)评估标准
(1)IASLC病理评估建议
为了更好地在临床试验中评估和对比不同新辅助治疗方案的病理反应,分析病理缓解与生存的关系,2020年国际肺癌协会(IASLC)提出了针对NSCLC新辅助治疗后切除标本的病理评估多学科建议(简称IASLC病理评估建议)[38],同时也希望能在临床试验之外更好地指导临床实践,提高病理评估反应的一致性。IASLC病理评估建议采用标准化方法评估:存活肿瘤细胞的百分比,坏死的百分比和间质(包括炎症和纤维化)的百分比总和达到100%。这一标准适用于包括免疫治疗在内的所有系统治疗,包括单药治疗和不同疗法的联合治疗,因此目前被临床研究广泛采用,如KEYNOTE-671、AEGEAN和RATIONALE-315研究。同时,2021年由国家肿瘤质控中心肺癌质控专家委员会发表的《非小细胞肺癌新辅助治疗疗效病理评估专家共识》[39]也以IASLC病理评估建议为参考标准,以指导中国临床实践。
IASLC病理评估建议和中国专家共识对于标本取材的建议:对于原发肿瘤,如果直径≤3 cm,建议提交整个肿瘤进行评估;如果直径>3 cm,应将肿瘤横切成0.5 cm厚的连续切片,选取代表性层面评估(通常为最大切面,如最大切面未见肿瘤残存,则选取肿瘤残存最多的层面)。对于送检淋巴结,如果直径≤2 cm应尽量全部取材;如果直径>2 cm可沿最大面剖开,如切面肉眼可见明确瘤床,需要测量肿瘤大小,并且按照原始瘤床取材原则评估。
IASLC病理评估建议和中国专家共识对于pCR和MPR的定义:pCR是指新辅助治疗后切除的原发灶和淋巴结中均无残存活肿瘤细胞,即美国癌症联合委员会(AJCC)分期第8 版为ypT0N0。MPR是指新辅助治疗后切除的原发灶中残存活肿瘤细胞百分比≤10%,无论淋巴结内有无活肿瘤细胞残存。此外,当原发灶为pCR,淋巴结显示有存活肿瘤细胞时也属于MPR,即AJCC分期第8 版为ypT0N1,2或3。
(2)免疫相关病理反应标准(irPRC)
2018年Cottrell等基于CheckMate-159研究[17](纳武利尤单抗单药治疗)手术样本的分析,提出了免疫相关病理反应标准(irPRC)[40],评估存活肿瘤面积占总瘤床面积的百分比,其中总瘤床面积包括:存活肿瘤,坏死和退缩瘤床,即irPRC标准使用“退缩瘤床”代替“间质”,并首次描述了免疫介导的“瘤床退缩”的3个特征:①免疫激活-3级淋巴结构、密集的肿瘤浸润淋巴细胞和浆细胞、肉芽肿形成;②大量肿瘤细胞死亡-胆固醇裂隙、间质泡沫样巨噬细胞;③组织修复-血管新生和增生性纤维化。由于该标准是基于纳武利尤单抗的一项小样本研究提出,因此目前Ⅲ期临床研究中仅CheckMate-816,CheckMate-77T研究应用了该标准,临床实践中使用有限。irPRC标准对于pCR的定义为术后标本中无存活肿瘤,MPR定义为术后标本中存活肿瘤占比≤10%,术后标本评估包括原发灶和淋巴结。
目前新辅助免疫治疗Ⅲ期临床研究均采用了独立中心病理评估,在病理评估的各个环节(包括手术标本的取材、残留活肿瘤细胞的计算、pCR/MPR的判读)能实现严格遵循上述病理评估标准,保证了结果的准确性和一致性。临床实践中病理评估存在主观性和复杂性,可能会导致pCR/MPR结果被高估,因此建议临床实践中能够形成标准化的操作规范并严格执行,推荐参考IASLC病理评估建议和中国《非小细胞肺癌新辅助治疗疗效病理评估专家共识》。
2)新辅助免疫治疗的病理缓解(pCR/MPR)对生存获益的预测价值
尽管总生存期(overall survival,OS)是NSCLC新辅助治疗疗效评估的金标准,但由于观察时间过长,研究探索了病理缓解率作为替代指标对生存获益的预测作用。
2020年欧洲肿瘤学会(ESMO)大会报道的CA209-8Y9荟萃分析[41]提示,NSCLC新辅助化疗的pCR/MPR与患者更好的EFS和OS获益相关(pCR vs. non-pCR:OS HR=0.49,95%CI:0.42~0.57,EFS HR=0.49,95%CI:0.41~0.60;MPR vs. non-MPR:OS HR=0.36,95%CI:0.29~0.44, EFS HR=0.52,95%CI:0.42~0.66),提示pCR/MPR可作为可切除NSCLC生存获益的替代终点。
多项Ⅲ期临床研究进一步探索了新辅助ICIs联合化疗的pCR/MPR率与生存结局的相关性。CheckMate-816研究中,纳武利尤单抗联合化疗组的pCR/MPR患者较non-pCR/non-MPR患者EFS获益更多(pCR vs.non-pCR: HR=0.18,95%CI:0.07~0.46;MPR vs. non-MPR:HR=0.26, 95%CI:0.14~0.50)[42],Neotorch研究试验组显示相同的趋势(pCR vs. non-pCR:HR=0.16,95%CI:0.05~0.51;MPR vs. non-MPR:HR=0.24,95%CI:0.13~0.45)[12]。KEYNOTE-671[33]和CheckMate-77T研究[9]同样显示,pCR/MPR患者围手术期免疫治疗的EFS获益更多(帕博利珠单抗+化疗vs.化疗:pCR患者EFS HR=0.33,non-pCR患者EFS HR=0.69;MPR患者EFS HR=0.54,non-MPR患者EFS HR=0.73。纳武利尤单抗+化疗vs.化疗:pCR患者EFS HR=0.33, non-pCR患者EFS HR=0.79;MPR患者EFS HR=0.40,non-MPR患者EFS HR=0.85)。综上所述,新辅助免疫治疗的pCR/MPR率与EFS获益正相关,可作为预测EFS获益的近期疗效指标,但已有Ⅲ期临床研究OS结果尚不成熟,pCR/MPR率与OS的相关性尚未明确,还需进一步随访。
共识意见4:
√ 病理缓解(pCR/MPR)是反应免疫激活杀伤肿瘤细胞的直接指标,已有证据显示病理缓解率与新辅助免疫治疗的EFS获益正相关,是潜在的近期疗效指标,因此推荐接受新辅助免疫的患者在术后进行病理缓解评估。(共识级别:1A)
√ 病理缓解评估推荐参考IASLC病理评估建议及中国《非小细胞肺癌新辅助治疗疗效病理评估专家共识》,但在实际操作中仍存在许多主观性和复杂性,需要更多的经验和研究来加以完善。
(共识级别:1A)
03
可切除早期及局晚期NSCLC术后辅助免疫治疗
手术创伤及术后应激反应会介导持续的免疫抑制,辅助免疫治疗可逆转术后免疫抑制的微环境,恢复受损的T细胞功能,激活T细胞消除微转移灶,达到降低术后复发和转移风险,延长患者生存的目的[43]。
目前多项Ⅲ期临床研究证实了辅助免疫治疗在可切除Ⅱ~Ⅲ期NSCLC的临床获益。对于术前已接受过ICIs联合化疗新辅助治疗的患者,KEYNOTE-671(帕博利珠单抗)、AEGEAN(度伐利尤单抗)、CheckMate-77T(纳武利尤单抗)、RATIONALE-315(替雷利珠单抗)和Neotorch(特瑞普利单抗)研究证实术后继续进行ICIs辅助治疗能够进一步降低术后复发风险,显著改善EFS(HR=0.40~0.68)[7-12]。对于术前未接受过新辅助免疫治疗的患者,IMpower-010(阿替利珠单抗)和KEYNOTE-091(帕博利珠单抗)研究[13-14]证实术后给予化疗序贯ICIs辅助治疗,可显著延长无病生存期(disease-free survival,DFS)(HR=0.66~0.76)。但当前临床实践中,仍然存在着诸多临床问题亟待回答,包括:辅助免疫治疗的人群选择、pCR患者是否需要继续辅助治疗、辅助治疗的方案及时长选择。
3.1 辅助免疫治疗的人群选择
对于术前已接受过新辅助免疫治疗的患者,CheckMate-816研究[6]中纳武利尤单抗联合化疗组患者的3年EFS率为57%,提示单纯新辅助免疫治疗术后仍面临一定复发风险(3年复发率43%)。CheckMate-77T研究[9]在新辅助纳武利尤单抗联合化疗的基础上,术后继续进行纳武利尤单抗辅助治疗,总人群复发风险显示进一步降低趋势(CheckMate-77T EFS HR=0.58, CheckMate-816 EFS HR=0.68);CheckMate-77T研究亚组分析进一步提示,与未接受辅助治疗的患者相比,接受了纳武利尤单抗辅助治疗的患者EFS获益趋势更佳(辅助治疗组EFS HR=0.45,未接受辅助治疗组EFS HR=0.55)。LCMC3研究[44]在接受阿替利珠单抗新辅助治疗后病理缓解情况可评估的137例患者中,比较了接受(53例)与未接受(84例)阿替利珠单抗±化疗辅助治疗患者的临床获益。结果显示,与未接受辅助免疫治疗患者相比,接受了术后辅助免疫治疗患者DFS改善显著(3年DFS率:83% vs. 64% ,HR=0.44,95%CI:0.21~0.91),OS同样显示出改善的趋势(3年OS率:89% vs. 77%, HR=0.48,95CI:0.19~1.21)。以上证据提示,对于术前已接受过新辅助免疫治疗的患者,术后继续接受辅助免疫治疗潜在为患者带来更大生存获益。
对于术前接受过新辅助免疫治疗实现pCR患者,是否需要继续进行术后辅助治疗是临床关注的热点问题。CheckMate-816研究[6]试验组接受新辅助纳武利尤单抗联合化疗达到pCR的患者3年EFS率约为75%,意味着原发病灶的pCR不能代表远处微小转移灶已被完全清除,部分患者仍存在一定术后复发风险(3年复发率25%),因此仍有治疗的需求。CheckMate-77T研究[9]新辅助治疗后获得pCR的患者中,试验组术后继续ICIs辅助 vs. 对照组术后仅安慰剂治疗显示更佳的EFS获益(HR=0.22,95%CI:0.04~1.08),提示pCR患者术后继续免疫辅助治疗生存获益潜在进一步提升。此外,Ⅲ期临床研究均采用了独立中心病理评估,严格遵循方案规定的病理评估标准,保证了结果的准确性和一致性;而临床实践中病理缓解评估的标准化和规范化在不同区域和医院尚存差异,病理评估的不充分可能会导致pCR/MPR结果被高估。
有证据显示,NSCLC根治性术后MRD状态与生存预后相关,术后MRD能够预测复发风险,且 MRD阳性患者辅助治疗潜在获益更大[45-46]。但MRD检测仍处于临床探索阶段,对于辅助免疫治疗的指导价值还有待Ⅲ期临床研究验证。
对于术前未接受过新辅助免疫治疗的患者,PD-L1是探索较多的术后辅助免疫优势人群筛选的指标,但PD-L1表达与DFS的相关性在IMpower-010和KEYNOTE-091研究中显示不一致的结果。IMpower-010研究[13]提示 PD-L1表达水平更高的患者显示更大的DFS获益趋势,PD-L1<1%、1%~49%和≥50%人群DFS HR分别为0.97(95%CI:0.72~1.31)、0.87(95%CI:0.60~1.26)和0.43(95%CI:0.27~0.68)。KEYNOTE-091研究[14]在整体人群显著获益的情况下,PD-L1≥50%人群却显示阴性结果,PD-L1<1%、1%~49%和≥50%人群DFS HR分别为0.78(95%CI:0.58~1.03)、0.67(95%CI:0.48~0.92)和0.82(95%CI:0.63~1.05)。目前PD-L1的预测价值尚未明确,已有两项Ⅲ期临床研究的结论尚不足以外推指导其他ICIs药物的应用,需要正在开展的两项Ⅲ期辅助免疫治疗ANVIL和ADJUVANT BR.31研究未来提供更多的证据参考(表5)。
共识意见5:
√ 对于术前接受过新辅助免疫治疗的患者,目前5项Ⅲ期“新辅助+辅助”免疫治疗临床研究提示,术后继续接受辅助免疫治疗可能有进一步获益,因此推荐条件允许的情况下继续进行辅助免疫治疗。(共识级别:1A)
√ 对于术前接受过新辅助免疫治疗实现pCR患者仍有一定的复发风险,且证据显示pCR患者术后辅助免疫治疗可能进一步提升EFS获益。此外,临床实践中还需注意病理评估不充分可能会高估pCR结果,因此建议pCR患者在条件允许的情况下继续进行辅助免疫治疗,同时可参考MRD等标志物检测结果。(共识级别:2A)
√ 对于术前未接受过新辅助免疫治疗的患者,IMpower-010研究仅PD-L1阳性患者获益,KEYNOTE-091研究尽管全人群获益,但PD-L1高表达人群显示阴性结果。鉴于两项Ⅲ期临床研究中PD-L1预测作用不同,因此研究结果不建议外推指导其他ICIs药物应用。(共识级别:1A)
3.2 辅助免疫治疗的方案和时长选择
1) 辅助免疫治疗的方案选择
对于术前已接受过新辅助免疫治疗的患者,术后辅助治疗方案的选择需要根据患者情况和术前治疗情况综合决定。已有Ⅲ期临床研究中,辅助治疗阶段的方案选择主要包括两类:(1)ICIs单药辅助治疗:为多项“新辅助+辅助”围手术期免疫治疗Ⅲ期临床研究主要应用的模式,术前ICIs联合化疗3~4个周期,考虑到术前化疗使用充足,术后选择ICIs单药辅助治疗[7-11]。(2)ICIs联合化疗序贯ICIs单药辅助治疗:Neotorch研究[12]采用了术前3个周期特瑞普利单抗联合化疗,术后继续1个周期特瑞普利单抗联合化疗,序贯特瑞普利单抗单药辅助治疗至最长13个周期,将4个周期的ICIs联合化疗分别在术前+术后应用。
对于术前未接受过新辅助免疫治疗的患者,根据患者情况,辅助免疫治疗阶段的方案选择主要包括两类情况:(1)化疗序贯ICIs单药辅助治疗:Ⅲ期IMpower-010和KEYNOTE-091研究[13-14]均采用了术后辅助化疗序贯辅助免疫维持的治疗方案。其中KEYNOTE-091研究[14]尽管未限制辅助化疗的应用,但探索性分析显示,术后未经化疗的患者从帕博利珠单抗辅助治疗中获益有限(接受了辅助化疗:DFS HR=0.73,95%CI:0.60~0.89;未接受辅助化疗 DFS HR=1.25,95%CI:0.76~2.05)。(2)化疗同步联合ICIs辅助治疗:临床实践中患者情况更为复杂,有研究探索了术后将免疫提前至与辅助化疗同步给药。Ⅲ期NADIM-ADJUVANT研究计划在接受了R0切除的ⅠB~ⅢA期NSLCC患者中,探索纳武利尤单抗联合含铂化疗4个周期序贯纳武利尤单抗单药辅助治疗模式的可行性,研究正在进行中(表5)。
多种ICIs联合其他治疗策略的强化辅助治疗方案正在探索中,Ⅲ期V940-002和DUBHE-L-304研究分别探索了帕博利珠单抗联合V940(mRNA疫苗)和QL1706(PD-1/CTLA-4双抗)联合化疗强化辅助治疗方案的治疗获益(表5)。ALTER-L043研究[29]探索了ICIs联合抗血管强化辅助方案的可行性,希望进一步改善辅助治疗的获益。
2)辅助免疫治疗的治疗时长
关于辅助免疫治疗的时长选择,AEGEAN、CheckMate-77T、RATIONALE-315、IMpower-010和KEYNOTE-091研究[8-11,13-14]中为术后ICIs单药辅助治疗最长持续至1年,KEYNOTE-671和Neotorch研究为新辅助(3~4个周期)+辅助阶段ICIs治疗最长持续至1年[7,12];以上Ⅲ期临床研究的设计均显示辅助免疫治疗需要持续用药,约1年的辅助治疗可以保证患者的临床获益。此外,对于不同人群(术后不同分期、PD-L1表达水平、病理缓解情况)最佳的辅助免疫治疗时长,还需更多研究验证。
辅助免疫阶段的持续治疗需要同时关注给药便捷性,其中AEGEAN和CheckMate-77T研究[8-9]探索了Q4W辅助治疗给药方案,RATIONALE-315研究[10-11]辅助阶段探索了400 mg Q6W延长给药间隔的剂量方案,减少了患者反复用药的次数,并显示良好的安全性和治疗获益,同时帕博利珠单抗Ⅲ期V940-002研究也正在探索400 mg Q6W辅助治疗给药方案的可行性。
共识意见6:
√ 对于术前接受过新辅助免疫治疗的患者,术后推荐ICIs联合或不联合化疗辅助治疗。建议围手术期化疗共使用3~4个周期,ICIs共使用1年。
(共识级别:1A)
√ 对于术前未接受过新辅助免疫治疗的患者,基于IMpower-010和KEYNOTE-091研究术后推荐辅助化疗序贯ICIs;辅助化疗同步联合ICIs临床应用更便捷,但仍有待研究结果验证。建议化疗共使用3~4个周期, ICIs共使用1年。(共识级别:2A)
√ 术后辅助免疫治疗阶段,AEGEAN和CheckMate-77T研究采用了Q4W给药方案,RATIONALE-315研究采用了Q6W给药方案,延长给药间隔有望提高患者治疗依从性,保证辅助治疗的临床获益,期待更多研究验证。(共识级别:1A)
04
围手术期免疫治疗的手术结局及免疫相关不良反应管理
4.1 围手术期免疫治疗的手术结局
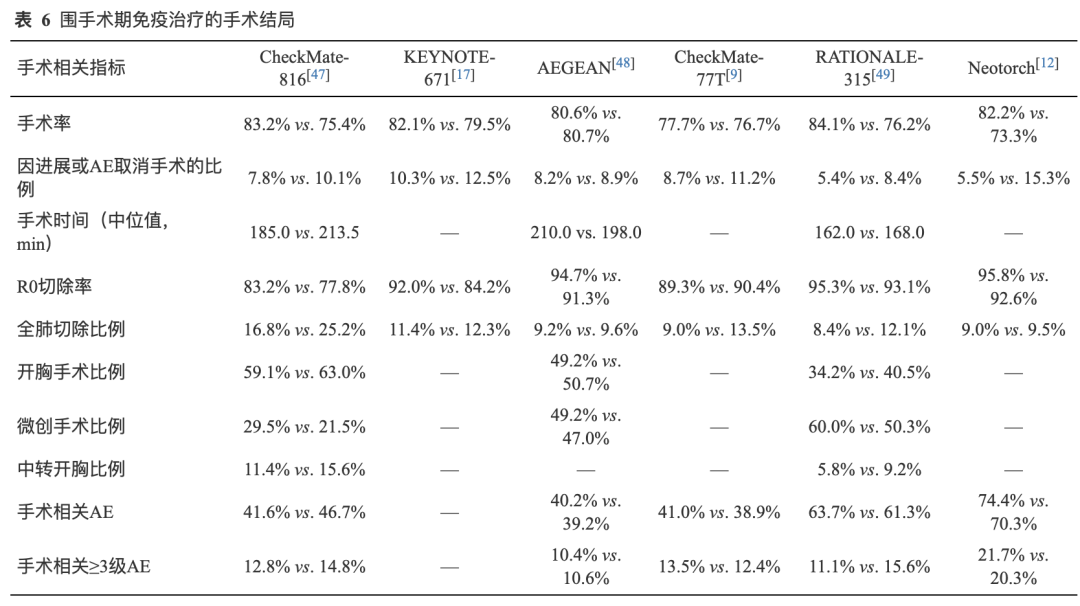
多项Ⅲ期临床研究分析了新辅助免疫治疗对于手术的影响,证实新辅助免疫治疗未对手术可行性、手术入路、切除方式、切除完整性、手术时间造成不利影响,且未增加手术相关不良事件(adverse events, AE)(表6)。
1)手术可行性:
Ⅲ期临床研究中新辅助ICIs联合化疗组患者手术率略高于新辅助化疗组(两组分别为:77.7%~84.1%和73.3%~80.7%),其中,试验组归因于新辅助免疫治疗原因(疾病进展和AE)导致手术取消的比例为5.4%~10.3%,化疗组比例为8.4%~15.3%,证实新辅助免疫治疗不影响手术可行性[9,12,17,47-49]。
2)手术入路、切除方式、切除完整性及手术时间: CheckMate-816、RATIONALE-315和AEGEAN研究中[47-49],新辅助ICIs联合化疗组微创手术率均略高于化疗组(分别为:29.5% vs. 21.5%, 60.0% vs. 50.3%, 49.2%vs.47.0%),同时CheckMate-816和RATIOANLE-315研究[47,49]的ICIs联合化疗组术中微创转开胸手术比例也略低于化疗组(11.4% vs. 15.6%,5.8% vs. 9.2%)。多项Ⅲ期临床研究汇总发现新辅助ICIs联合化疗患者全肺切除比例为8.4%~16.8%,略低于新辅助化疗的9.5%~25.2%[9,12,17,47-49],表明新辅助免疫治疗潜在可降低全肺切除、提高微创手术的可能性。在切除完整性方面,新辅助ICIs联合化疗患者R0切除率为83.2%~95.8%[9,12,17,47-49],略高于新辅助化疗或与新辅助化疗相当。手术时间在ICIs联合化疗组与化疗组中未见明显差异,CheckMate-816、AEGEAN和RATIOANALE-315研究[47-49]试验组和对照组患者中位手术时间分别为185 min vs. 213 min、210 min vs. 198 min和162 min vs. 168 min。从现有证据来看,新辅助免疫治疗不影响手术入路,切除方式、切除完整性和手术时间。
3)手术相关AE: ICIs联合化疗和单纯化疗组患者的手术相关AE发生率分别为40.2%~74.4%和39.2%~70.3%,≥3级手术相关AE发生率分别为10.4%~21.7%和10.6%~20.3%,ICIs联合化疗对比单纯化疗未增加手术相关AE[9,12,47-49]。ICIs联合化疗组患者中发生率≥5%的手术相关AE包括贫血、疼痛、创口并发症、操作性疼痛、发热和肺炎,AE类型与化疗患者一致,可控且可管理。
4.2 围手术期免疫治疗的免疫相关不良反应管理
随着ICIs联合化疗逐渐成为围手术期NSCLC标准治疗,ICIs联合化疗的安全性值得关注。多项Ⅲ期临床研究评估了围手术期免疫治疗的安全性,研究显示ICIs联合化疗对比单纯化疗并未明显增加不良反应的发生。围手术期免疫相关不良反应(immunotherapy-related adverse events,irAEs)的发生率为23.7%~42.1%,大部分为1~2级,≥3级irAE发生率为4.2%~11.9%[6-12]。尽管围手术期免疫治疗总体相对安全,≥3级irAE的发生率低,但一旦发生仍然可能会对后续治疗带来影响。因此规范的围手术期irAE管理不但能保证治疗的顺利实施,也会带来患者生存获益的提升,临床上应给予足够重视。
1)围手术期irAE的评估与监测: 术期治疗前的评估和筛查是irAE管理的重要组成部分,有助于筛选出特殊人群,判断潜在获益与风险。对于合并自身免疫性疾病、器官移植患者、慢性病毒感染患者、肺功能较差的患者,需充分评估围手术期免疫治疗的安全性和手术本身的安全性。所有患者都应该在治疗开始前被告知免疫治疗潜在的不良反应。在出现不良反应时,患者应该直接向治疗团队报告症状。一旦出现irAE,需要及时治疗,防止加重或恶化。开启围手术期免疫治疗后,监测不良反应同样重要。不良反应监测包括治疗中监测和治疗后随访。在治疗过程中,应定期监测患者机体功能状态和器官功能(实验室检测和影像学检查、肺功能、心电图、甲状腺功能等),其中发生甲状腺功能减退的患者可能增加手术和术中麻醉的风险,需要关注和进一步明确甲状腺功能减退对手术的影响;在治疗完成后一段时间,也需要定期或不定期监测机体功能状态和器官功能,尤其是肾功能、甲状腺功能、垂体功能等指标。目前认为在ICIs结束治疗后,应至少监测随访1年。监测有助于早期,及时发现不良反应[50]。
2)围手术期irAE的治疗: irAE的治疗遵循分级管理原则。通常,如发生1级irAE,患者无需住院,可继续ICIs治疗。如发生2级irAE,患者无需住院,但需暂停使用ICIs,推荐局部或全身使用糖皮质激素治疗。如发生3级irAE,患者需住院,接受全身糖皮质激素治疗,若2~5天后irAE未有好转,可考虑在专科医生指导下使用其他免疫抑制剂同时停用ICIs,能否恢复ICIs治疗应基于患者获益/风险比讨论后决定。如发生4级irAE,考虑将患者收入ICU,接受全身糖皮质激素治疗,若2~5天后irAE未有好转,可考虑在专科医生指导下使用其他免疫抑制剂,同时需永久停用ICIs。多数irAEs只要诊治及时,通常应用糖皮质激素或其他免疫抑制剂后患者毒性均可恢复。当发生irAE时,鼓励与特定疾病的专科医生密切协商,符合转诊指征的严重irAEs患者应尽快转院/转诊(至拥有合格的irAEs MDT团队的医疗机构),避免延误最佳治疗时机。
共识意见7:
√ 已有Ⅲ期临床研究证据表明,新辅助免疫治疗相较新辅助化疗不会影响手术的进行或增加手术相关AE。(共识级别:1A)
√ 围手术期irAE管理坚持预防、评估、检查、治疗和监测的原则,确保及早发现,及早治疗。推荐采用MDT管理irAE,同时注重irAE相关的患者教育。(共识级别:1A)
4.3 围手术期患者一体化全程管理
NSCLC的围手术期涉及到的诊断、治疗和随访是较长期的过程,患者可能需要多学科诊疗团队(multidisciplinary team,MDT)评估是否适合新辅助和手术、先后接受化免新辅助治疗、手术、术后继续化免或免疫单药的长期治疗、期间还可能接受放射治疗、并发症及合并症的处理,过程中可能出现各种各样的症状,评估标准也复杂多样,涉及多个科室的协作,特别是治疗过程中外科、内科、放疗科和日间病房的高效协作实现一体化全程管理,有助于NSCLC的围手术期诊疗工作的开展。通过患者管理与教育,可帮助患者对肺癌围手术期全程诊疗建立清晰的认识,更好地配合诊疗及全程管理。同时关注改善肺癌患者术后康复的心理情绪状态,通过加强肺癌术后的心理辅导干预等,帮助患者术后康复,提高患者的预后和生存质量。
共识意见8:
√ 围手术期患者一体化全程管理,通过治疗过程中外科、内科、放疗科和日间病房的高效协作,建立患者对疾病全程诊疗的清晰认识,有助于实现围手术期治疗的规范化,给患者带来最大的获益。
(共识级别:2A)
05
结语与展望
NSCLC围手术期治疗已全面进入免疫治疗时代,多项Ⅲ期临床研究证实围手术期ICIs联合化疗新辅助+辅助治疗能够显著改善可切除Ⅱ~Ⅲ期NSCLC的生存获益,成为了Ⅱ~Ⅲ期NSCLC围手术期治疗新标准。共识专家组针对当前临床实践中的热点问题进行了深入地研讨,在多个临床问题上达成了共识,旨在为NSCLC患者的围手术期临床诊疗提供规范化指导。
未来还有更多问题有待进一步研究探讨:1)对于方案选择,以ICIs为基础的新联合策略、新型免疫药物的应用能否进一步提升疗效?2)基于免疫治疗在可切除NSCLC围手术期治疗的突出获益,能否为部分初始不可切除NSCLC患者带来转化手术的机会,实现生存获益的提升?3)多项围手术期免疫治疗Ⅲ期研究已显示OS延长趋势,但目前数据成熟度较低,对于OS结果,以及近期指标pCR/MPR能否预测OS获益,期待更长时间随访数据。随着循证医学证据的不断积累,专家组也会不断更新和丰富此项共识,以更好地反映NSCLC围手术期免疫治疗临床治疗理念的更新及临床实践的快速发展,让肺癌患者距离治愈的目标不再遥远。
End
参加共识撰写的专家
专家组组长:
王长利 天津医科大学肿瘤医院
专家组成员(按姓名首字母顺序排序):
陈海泉 复旦大学附属肿瘤医院
陈 椿 福建医科大学附属协和医院
陈奇勋 浙江省肿瘤医院
程 颖 吉林省肿瘤医院
韩宝惠 上海交通大学附属胸科医院
韩 光 湖北省肿瘤医院
胡 坚 浙江大学医学院附属第一医院
黄云超 北京大学肿瘤医院云南医院
姜 杰 厦门大学附属第一医院
李单青 北京协和医院
刘宏旭 辽宁省肿瘤医院
刘伦旭 四川大学华西医院
孙蕾娜 天津医科大学肿瘤医院
王文祥 湖南省肿瘤医院
王 勐 天津医科大学肿瘤医院
吴 军 海南省肿瘤医院
徐世东 哈尔滨医科大学附属肿瘤医院
杨 帆 北京大学人民医院
杨 跃 北京大学肿瘤医院
喻本桐 南昌大学第一附属医院
张兰军 中山大学肿瘤防治中心
张连民 天津医科大学肿瘤医院
张 鹏 上海市肺科医院
张 毅 首都医科大学宣武医院
周彩存 上海市东方医院
赵国芳 宁波市第二医院
执笔人:
张真发 天津医科大学肿瘤医院
岳东升 天津医科大学肿瘤医院
引用本文:
非小细胞肺癌围术期免疫规范化治疗共识专家组. 非小细胞肺癌围手术期免疫规范化治疗专家共识[J]. 中国肿瘤临床. DOI: 10.12354/j.issn.1000-8179.2024.20240170
D











 苏公网安备32059002004080号
苏公网安备32059002004080号


