多灶性/多中心性乳腺癌 (multifocal/multicentric breast cancer, MMBC)是指发生在同侧乳房的 2 个及以上的乳腺恶性肿瘤,是乳腺癌中较少见的一种类型,具有独特的影像学、病理学特性。传统观念认为,相较于单灶性乳腺癌 (unifocal breast cancer, UBC),MMBC 的局部复发 (local recurrence, LR)风险更高,不宜行保乳手术,整体生存预后更差。近年来针对MMBC 的研究愈发深入,使得临床医生在诊治 MMBC 方面积累了更多经验,推动其诊断和治疗方式循证化、个体化、精准化发展。本文围绕 MMBC 流行病学特征、术前影像学评估、病理异质性与分子标志物、手术方式等多方面展开论述,以期帮助临床医师快速了解该领域的最新进展,并为临床进行 MMBC 诊治提供参考意见。
 刘佳,周星彤,孙强.多灶性/多中心性乳腺癌研究进展[J/OL].协和医学杂志,1-12[2024-05-07].http://kns.cnki.net/kcms/detail/11.5882.R.20240426.1518.003.html.
刘佳,周星彤,孙强.多灶性/多中心性乳腺癌研究进展[J/OL].协和医学杂志,1-12[2024-05-07].http://kns.cnki.net/kcms/detail/11.5882.R.20240426.1518.003.html.
MMBC 定义与流行病学特征
MMBC 定义
MMBC 被用于描述在同一侧乳房发生的 2 个或 2 个以上的恶性肿瘤,每个肿瘤在物理状态上存在确切的分隔。MMBC 最常用的定义如下:从解剖学角度出发,多灶性乳腺癌(multifocal breast cancer, MFBC)是指单侧乳腺的同一象限内存在 2 个或多个恶性病灶,病灶可能为同源;多中心性乳腺癌 (multicentric breast cancer, MCBC)则表示发生在单侧乳腺的不同象限内的 2 个或多个恶性病灶,肿瘤病灶可能为不同起源[1]。一般认为,MMBC 的多个病灶中,至少有 1 个为浸润性乳腺癌,其他病灶可为导管原位癌(ductal carcinoma in situ, DCIS)或浸润性癌。此外,一些研究也使用病灶间距定义 MMBC,认为 MFBC 病灶间距小于某临界值,而 MCBC 病灶间距超过该值,这一数值为 20~50 mm 不等[2-3]。由于缺乏统一定义,且出于研究便利性考虑,MFBC、MCBC 常被统一归为 MMBC 进行整体研究。
MMBC 流行病学特征
相比 UBC,MMBC 在临床上较为少见。在涉及同侧乳腺多个病变的研究中,早期文献存在 MFBC 和 MCBC 两个术语被混用或混淆的问题,一定程度上导致报告发病率失真[4]。2014 年,Vera-Badillo 等[5]在一项纳入 24 篇研究共 67557 名女性的 Meta 分析中报告,MMBC发病率为 9.5%。近年来,随着成像技术精度的提升,MMBC 检出率呈上升趋势,近期文献中报道的 MMBC 发病率分布于 4%~60%[6-7]。提示,MMBC 实际发病率可能比既往认知中的更高,且随着影像学和病理学技术的进步,MMBC 检出能力将会进一步提升,其发病率可能较早期研究中的数据明显升高。
MMBC 术前影像学评估
由于起病隐匿,病程初期可能无明显特异性临床特征,因此乳腺癌的早期诊断高度依赖于影像学检查。高质量的影像学检查可在术前发现乳腺多病灶的存在,从而在 MMBC 个体化治疗策略的制定过程中发挥关键作用,因此,在发现有手术指征的乳腺病灶后,采用适当的影像学检查是实现精准诊疗的重要途径。乳腺疾病常用的 3 种影像学技术包括乳腺 X 线检查、超声 (ultrasonography, US)和 MRI。
乳腺 X 线检查
乳腺 X 线摄影(mammography,MG)也称乳腺钼靶检查,通常特指在临床广泛应用的全视野数字乳腺 X 线摄影(full-field digital mammography,FFDM)。MG 是乳腺疾病筛查和乳腺癌诊断的常规方法,可探测乳腺组织病变情况,并为良恶性结节性质的判定提供参考信息,但其在致密型乳房中检测癌灶的能力受限。文献显示,MG 在脂肪型乳房中检出 MMBC 的灵敏度可高达 100%,而在腺体纤维型或致密型乳房中仅为 45.5%[8]。近年来随着医疗新技术的发展,新兴的乳腺 X 线检查手段如数字化乳腺断层摄影(digital breast tomosynthesis, DBT)、对比增强光谱乳腺摄影 (contrast-enhanced spectral mammography, CESM)逐渐应用于临床,并一定程度上提高了 MMBC 检出率。DBT 是一种基于传统二维 MG 基础开发的 X线三维断层成像技术,可在不同角度重复曝光乳腺后经软件生成重建图像,有助于识别乳腺隐匿病变。Lameijer 等[9]分析发现,在对 MG 筛查患者进行召回复核时,近半数额外发现的同侧乳房恶性病变为通过联合 MG 与 DBT 而检出。大量研究显示,虽然 DBT 识别 MMBC的灵敏度仍不如 MRI,但与 MG 相比,已具有显著提升[10-12]。CESM 通过使用螯合碘基 X线造影剂显示肿瘤新生血管情况,可提高 MMBC 的检出率和诊断准确率。Lorek 等[13]基于999 例行手术治疗的乳腺癌患者临床资料,评定了 CESM 在 MMBC 识别中的应用价值,结果显示 CESM 检测 MMBC 的特异度与 MG 相当(94.90%比 99.01%),灵敏度显著高于 MG(87.63%比 38.51%)。Lee 等[14]研究认为,与 MRI 相比,CESM 在 MMBC 的诊断中具有更高的特异度和阳性预测值,且成本更低、检测速度更快,具有良好的应用前景。
超声
US 是诊断乳腺疾病不可或缺的工具,对于我国女性而言尤为重要。相较于白种女性群体,我国女性中致密腺体型乳腺的占比显著升高,其乳房中致密组织所占比例比白种女性高出 20%[15]。而致密型腺体相比 MG 更适合行 US 筛查[16]。Rehman 等[17]报道显示,US 鉴别诊断乳腺癌卫星肿块良恶性的灵敏度、特异度分别为 88.2%、73.6%,提示其可为 MMBC的术前诊断提供重要参考信息。此外,US 对隐匿性乳腺肿瘤具有较高的敏感性,可作为MG 的有效补充。Moon 等[18]研究发现,除 MG 检测结果外,US 在 201 名疑似乳腺癌患者中额外发现了 5%的 MFBC 和 9%的 MCBC。但有研究者持不同观点,其研究数据表明,仅使用乳腺 X 线检查和 US 进行 MMBC 术前诊断的灵敏度仅为 50.8%,可导致近一半的病例漏诊 [19]。自动乳腺容积超声成像(automated breast ultrasound, ABUS)是一种新兴的高分辨率三维超声技术,可自动扫描覆盖全乳腺的多层次结构,还可同屏对比左右两侧乳腺,克服了传统 US 成像面积小、对操作者经验依赖性高等缺点,或可进一步提高 MMBC 的检出率。
Helal 等[20]在一项纳入 562 例乳腺癌患者的研究显示,ABUS 在评估 MMBC 方面显示出良好的诊断一致性(Kappa 值为 0.64),识别 MMBC 的灵敏度、特异度分别为 84%和 80.6%,明显优于 MG 与传统 US 联合应用(灵敏度为 32.1%,特异度为 67.6%)。
MRI
MRI 已成为乳腺癌患者术前的重要辅助评估手段[21]。对于 MMBC 患者而言,是否常规进行 MRI 尚存争议,这是由于该检查对良恶性病变的鉴别能力有待提升,其高灵敏度、低特异度的特点可能将导致更多的良性病灶被检出,进而使患者承受非必要的手术创伤。一项Meta 分析[22]显示,0.8%~11.1%的 MMBC 假阳性患者由于 MRI 的诊断而接受了乳房全切等更大范围的手术。动态增强核磁共振扫描 (dynamic contrast-enhanced magnetic resonance imaging, DCE-MRI) 联合弥散加权成像(diffusion-weighted imaging, DWI) 有望解决上述问题。DCE-MRI 是最灵敏的乳腺癌影像诊断技术,可连续监测病灶对造影剂的摄取情况,在MMBC 检出方面具有比 MG、US 更高的灵敏度(96.6%~100%)[11,23]。DWI 则通过计算表观弥散系数,可定性分析病灶的结构和成分,二者联合应用可提高诊断 MMBC 的准确率。
报道显示,相较于单一 DCE-MRI,DWI 与 DCE-MRI 联合应用诊断 MMBC 在保持较高灵敏度的同时,还可提高检测的特异度(MFBC:78.5% 比 21.4%;MCBC:60.8% 比 17.3%)和总体准确率 (MFBC:87.8%比 83.3%;MCBC:73.1% 比 51.2%)[24]。
对于拟行保乳手术的乳腺恶性病灶,术前避免对多病灶的漏诊尤为重要。目前,临床常规联合应用 US 和 MG 进行乳腺病灶检测,必要时引入 MRI,以期通过多种手段实现 MMBC的精准识别,但仍存在无法完全检出 MMBC 病灶的风险。虽然乳腺 X 线摄影、US、MRI设备经过不断迭代,MMBC 检出率大为提升,但单一影像学手段仍未能兼备满意的灵敏度和特异度,而随着 ABUS、DCE-MRI、DWI 等新兴技术的应用,相信可为 MMBC 的临床诊断提供更多机遇。
MMBC 病理异质性与生物标志物
MMBC病理异质性
约 24%~29.2%的 MMBC 患者在不同病灶间具有病理类型、组织学分级、免疫组化与分子亚型等方面的异质性[25-27]。对于 MMBC 而言,通常认为多个病灶中经病理证实的最大浸润性肿瘤灶为主灶,原位癌、大小次之的浸润性肿瘤则为次要病灶。Tong 等[28]对 121 例MMBC 患者研究发现,12 例(9.9%)患者的多个病灶间病理类型不同,其中 10 例患者的主灶为浸润性导管癌,次要病灶为导管原位癌;5 例患者(4.1%)的主灶与次要病灶组织学分级不同。Janeva 等[25]报道雌激素受体 (estrogen receptor, ER)、孕激素受体 (progesterone receptor, PR)、人表皮生长因子受体 2 (human epidermal growth factor receptor 2, HER2)和增殖指数Ki-67 在 MMBC 多灶间的异质率分别为 2.7%、19.1%、7.7%和 16.9%,灶间分子亚型不一致率为 26.7%,其中 37.5%为次要病灶较主灶更富侵袭性,最常见的分型组合为 luminal A/luminal B HER2-(主灶/次要病灶)。以上研究表明,MMBC 的多个病灶间普遍存在一定的病理异质性,在当下仅以主灶特征指导 MMBC 治疗的临床背景下,可能对疗效产生重大影响,值得临床关注。
灶间病理异质性可导致次要病灶对针对主灶的治疗策略反应不敏感,或由于灶间异质性未被发现致使治疗不足,因此具有灶间病理异质性的 MMBC 或与更差的生存预后相关。Li等[27]根据多病灶之间的 ER、PR、HER2 和 Ki-67 状态将 MMBC 患者分成同质组和异质组,中位随访时间 35 个月时,与同质组相比,异质组无病生存期 (disease-free survival, DFS) (81.2% 比 96.5%, P=0.041) 和总生存期 (overall survival, OS) (95.8%比 99.5%, P=0.059) 明显更差。
目前,多学科诊疗(multi-disciplinary team, MDT)对 MMBC 灶间病理异质性的主要应对方式为升级治疗。Buggi 等[29]针对 113 例浸润性 MMBC 患者的研究中,1.8%患者主灶 ER 阴性,而次要病灶 ER 阳性,临床予以其内分泌治疗;2.6%的患者主灶 ER 阳性,而次要病灶 ER阴性,此部分患者在内分泌治疗的基础上额外进行了辅助化疗。对于 HER2 与 Ki-67 指数存在灶间差异的患者,同样需进行升级治疗,临床可根据具体亚型予以针对性干预[25]。此外,MMBC 多病灶之间可能具有不同的基因检测结果,并进而影响治疗决策。既往研究显示,对存在灶间异质性的 MMBC 患者行 Oncotype Dx 检测后发现,27%(6/22)患者的灶间复发评分差异显著,建议此部分患者实施辅助化疗[30]。上述证据表明,MMBC 灶间病理异质性值得被纳入治疗考量体系之中,尤其对于激素受体及 HER-2 表达不一致的 MMBC,适当升级治疗或可提升治疗效果。
MMBC 特异生物标志物
传统生物标志物如 ER、PR、HER-2 已广泛用于指导乳腺癌治疗策略,目前尚缺乏针对MMBC 的特异性生物标志物。MMBC 与 UBC 间的差异基因与蛋白可能提示着多发性疾病的独特特征。Lang 等[31]使用基因芯片对 MMBC 患者和 UBC 患者标本中的差异表达基因进行筛选,并采用 RT-PCR 法证实 MMBC 样本中 ABCB 5 基因表达水平显著下调,ABCC 11基因显著上调,二者分别与上皮-间质转化、肿瘤耐药有关,可能参与了 MMBC 的发生和疾病进展。该研究团队亦报道了 MMBC 患者和 UBC 患者标本中具有差异表达的 4 种长链非编码 RNA,分别为 C19orf33、C3orf52、C15orf48 和 C4orf19,为 MMBC 分子标志物的筛选提供了新思路[32]。在预后生物标志物方面,Zehni 等[33]观察到甲状腺激素受体 (thyroid hormone receptor, THR)等核激素受体与UBC和MMBC具有不同的关联性:UBC组中THRα1阳性与更差的 DFS 相关,而 MMBC 组中 THRα2 阳性却与更满意的 DFS 相关,提示 THR有望作为 MMBC 预后的潜在预测因子。该研究团队既往发现维生素 D 受体 (vitamin D receptor, VDR)高表达是 MMBC 患者 OS 的独立危险因素,对于 MMBC 的预后具有提示作用[34]。上述文献为筛选 MMBC 相关生物标志物提供了初步证据,但还需进一步明确各分子指标与 MMBC 的独特相关性,并在临床试验层面验证其应用价值,以期为早期识别临床和影像学隐匿性的 MMBC 及其预后转归提供有益指导。
MMBC 外科治疗
目前存在的手术方式
对于 MMBC 这一特殊类型的乳腺癌,既往学术界认为其比 UBC 具有更高的侵袭性和更差的临床预后,由于保乳手术会增加其局部复发的风险,因此将其视作保乳手术的禁忌证,并推荐采用全乳切除术进行治疗。近年来,随着外科手术的精进、综合治疗手段的多元化发展,以及由于发病群体呈年轻化趋势所致保乳需求的增加,MMBC 行保乳治疗成为该领域研究热点及发展趋势。保乳手术的传统术式包括肿瘤局部广泛切除、乳房象限切除等,而肿瘤整形术 (oncoplasty)是一种更为追求美学效果的新兴保乳术式,其结合肿瘤外科和整形手术的原理,使用容量移位等技术可同时实现肿瘤切除与外观重塑,有望成为 MMBC 患者的新选择。
MMBC 行保乳手术的可行性
1 当前证据和学术界态度
目前,MMBC 保乳相关证据主要集中于近 30 年间的队列研究、病例对照研究、病例报告、系统综述与 Meta 分析、指南与共识,由于多中心随机对照研究 MIAMI 试验尚未公布结果,因此尚缺乏来自随机对照试验的研究证据(图 1)。Houvenaeghel 等[35]和 Patani 等[36]在综述中总结了 MMBC 相关文献结果,并积极支持保乳手术治疗。Fang 等[37]和 Winters 等[2]对相关文献进行 Meta 分析后发现,MMBC 患者行保乳手术治疗的 LR 率与全乳切除术无显著差异,虽然该结论受纳入文献缺乏高质量前瞻性研究的掣肘,但仍初步提示,经过评估的 MMBC 患者行保乳手术具有可行性。队列研究多为回顾性研究,详细结果将于下一小节进行论述。来自病例对照研究和病例报告的证据较少,且研究结果不一:2015 年 Shaikh 等 [38]在一项纳入 110 例 MMBC 患者和 263 例与之相匹配 UBC 患者的研究中发现,MMBC 患者无论是行保乳手术还是全乳切除术,其 LR 率均高于同种术式的 UBC 患者,其认为 MMBC需在手术的基础上予以放疗、内分泌治疗等其他综合治疗手段。Silverstein 等 [39]则报告了 2例成功完成极端肿瘤整形保乳术 (extreme oncoplastic breast conserving surgery, EOBCS) 的MMBC 案例,认为该术式具有良好的应用前景。近年来,专家意见和临床经验亦逐渐趋向于保乳手术。2017 年圣加仑会议专家小组对 MMBC 保乳治疗持鲜明的赞成态度,认为只要达成美观效果、切缘阴性并辅以放疗即可行保乳手术[40]。2022 年美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南[41]不再将 MMBC 视为保乳手术的相对禁忌证。综合而言,适当条件下 MMBC 患者行保乳手术是安全且可行的,但病例应经过严格的评估与筛选。期待该观点经前瞻性随机对照试验予以进一步论证。
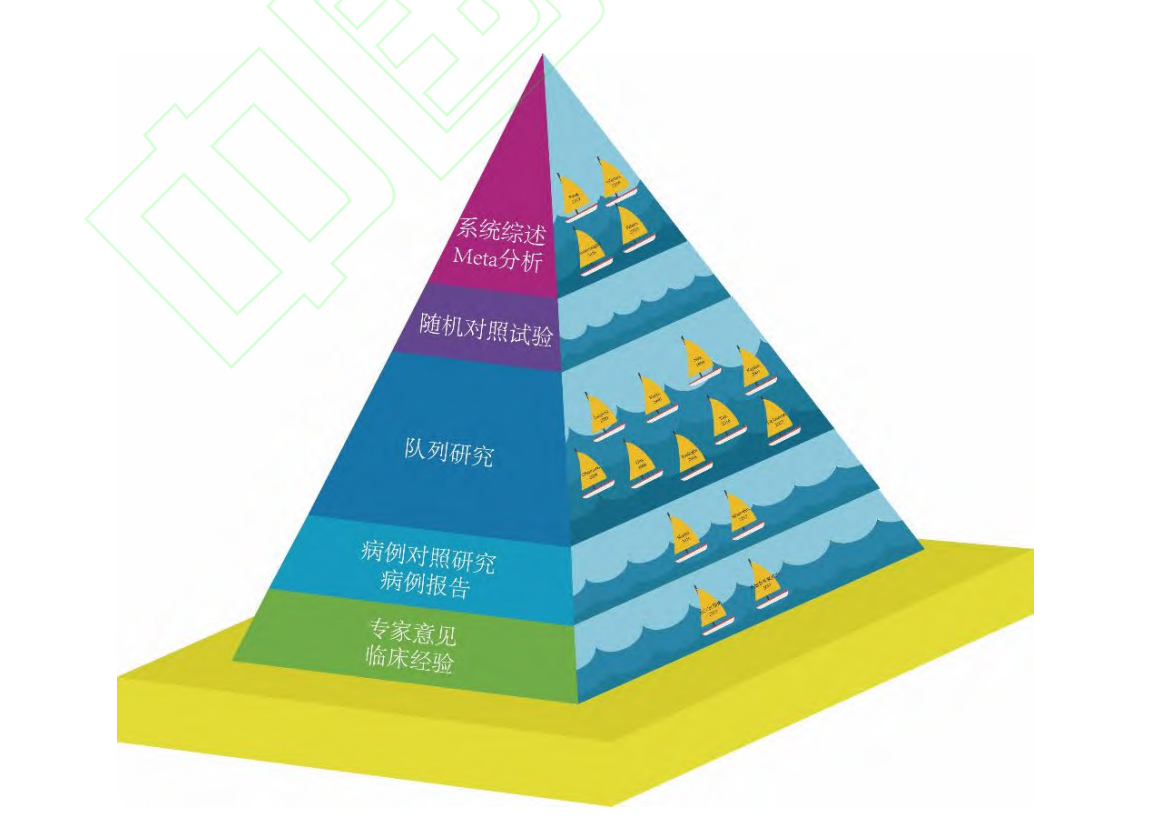
图 1 MMBC 保乳手术证据等级金字塔
Fig. 1 Evidence pyramid of breast-conserving surgery for MMBC MMBC(multifocal/multicentric breast cancer):多灶性/多中心性乳腺癌
2 MMBC 保乳手术的安全性
1994 年发表的一项单臂研究[42]报道了 1977—1989 年间接受保乳手术和辅助治疗的 27例 MMBC 患者的治疗效果,中位随访时间 53 个月时仅 1 例(3.7%)出现 LR。2009 年 Gentilini 等[43]在单臂研究中回顾了保乳手术的应用价值,结果显示 476 例 MMBC 患者的 5 年累积LR率为5.1%。上述两项研究提示MMBC患者接受保乳治疗在肿瘤学意义上可能是安全的。为进一步验证 MMBC 保乳手术的安全性,对比研究从两个方面着手,即 MMBC 与 UBC 保乳手术的预后差异、MMBC 保乳治疗与全乳切除术的预后差异。早期的系列报道认为,相较于 UBC,MMBC 行保乳手术的复发风险更高:1989 年 Leopold 等[44]比较了 10 例 MMBC患者与 707 例 UBC 患者接受保乳手术及放疗的疗效,发现 MMBC 患者的 LR 率高于 UBC患者(40%比 11%)。1990 年 Kurtz 等[45]对接受保乳手术和放疗的 586 例单侧 I~III 期乳腺癌患者中位随访 71 个月后发现,15 例(25%) MMBC 患者和 56 例(11%) UBC 患者出现 LR,其建议 MMBC 患者应谨慎行保乳手术。但该两项研究发表于保乳手术尚未成熟的年代,且存在样本量较小/未妥善管理肿瘤切缘的局限性。随着临床对保乳治疗认知的进一步深入,肿瘤切缘管理逐步得到重视。2004 年 Okumura 等[46]仅对保乳切缘与肿瘤组织距离较近 (≤ 5mm) 或切缘阳性患者给予瘤床加强放疗,中位随访 58 个月时,MMBC 组与 UBC 组 LR率无统计学差异。在保乳手术体系日渐规范后,保乳手术切缘阳性病例通常需进行再切除或改行全乳切除术。在此标准下,2009 年 Lim 等[47]对接受保乳治疗的 0~II 期 MFBC 患者与UBC 患者进行长期随访(中位随访时间 59 个月),结果显示二者的 LR 率亦无统计学差异(2.0%比 1.3%)。2016 年 Tan 等[48]纳入了 40 例 MMBC 和 120 例 UBC 患者,其中 34 例(85%)MMBC患者和 103 例(85.7 %)UBC 患者接受了保乳手术,中位随访 55 个月时 UBC 组 LR 率为 3%,而 MMBC 组无 LR 病例。综合上述数据看来,相较于 UBC 患者,MMBC 患者接受规范的保乳手术并无局部控制不良的确凿证据。
另一方面,相较于全乳切除术,MMBC 患者行保乳手术的安全性如何?1999 年的一项回顾性研究[49]比较了 56 例行保乳手术的 MFBC 患者与 132 例行全乳切除术的 MFBC 患者的临床预后,发现二者 5 年 OS 率、LR 率均无统计学差异。Kaplan 等[50]在一项纳入 55 例MMBC 患者的研究中发现,保乳手术和全乳切除术具有相似的 LR 率和无远处转移生存期。
Kadioglu 等[51]、Lim 等[47]亦得出类似结论,即未发现 MMBC 患者的 LR 风险在保乳手术和全乳切除术间存有差异,甚至行保乳手术者的 OS 更理想。但上述研究纳入的 MMBC 病例主要为 MFBC,尚缺乏 MCBC 患者的可参考信息,故保乳手术治疗 MCBC 的安全性尚需积累更多数据予以验证。
近十年来,肿瘤整形术在 MMBC 保乳手术实践中得到了广泛认可,尤其是 EOBCS 可进一步挽救传统观念上需通过全乳切除术治疗的 MMBC。EOBCS 是指对大多数医生认为需行全乳切除术的乳腺癌患者(MMBC 或肿瘤直径>50 mm)使用肿瘤整形技术、避免使用假体的保乳手术。2019 年 Crown 等[52]在一项纳入 111 例接受 EOBCS 的患者(其中 MMBC患者 82 例)队列研究中发现,中位随访 36 个月时,完成 EOBCS 和辅助放疗的患者中 LR率仅为 1.1%,且未发现任何区域/远处复发。2021 年 Savioli 等[53]报道了 EOBCS 治疗 MMBC及大型 UBC 的随访数据,5 年 DFS 为 91.5%,且 MMBC 患者未出现复发。欧洲肿瘤研究所于 2022 年发表的最新证据[54]进一步论证了肿瘤整形术的安全性:将 100 例接受肿瘤整形术和 100 例接受全乳切除术的 MMBC 患者按肿瘤直径、淋巴结转移状态、组织学分级等指标进行匹配,肿瘤整形术全组和 50%的全乳切除术患者接受了辅助放疗,随访显示两组 10年 LR、区域复发、远处复发情况以及 DFS、OS 均无统计学差异。
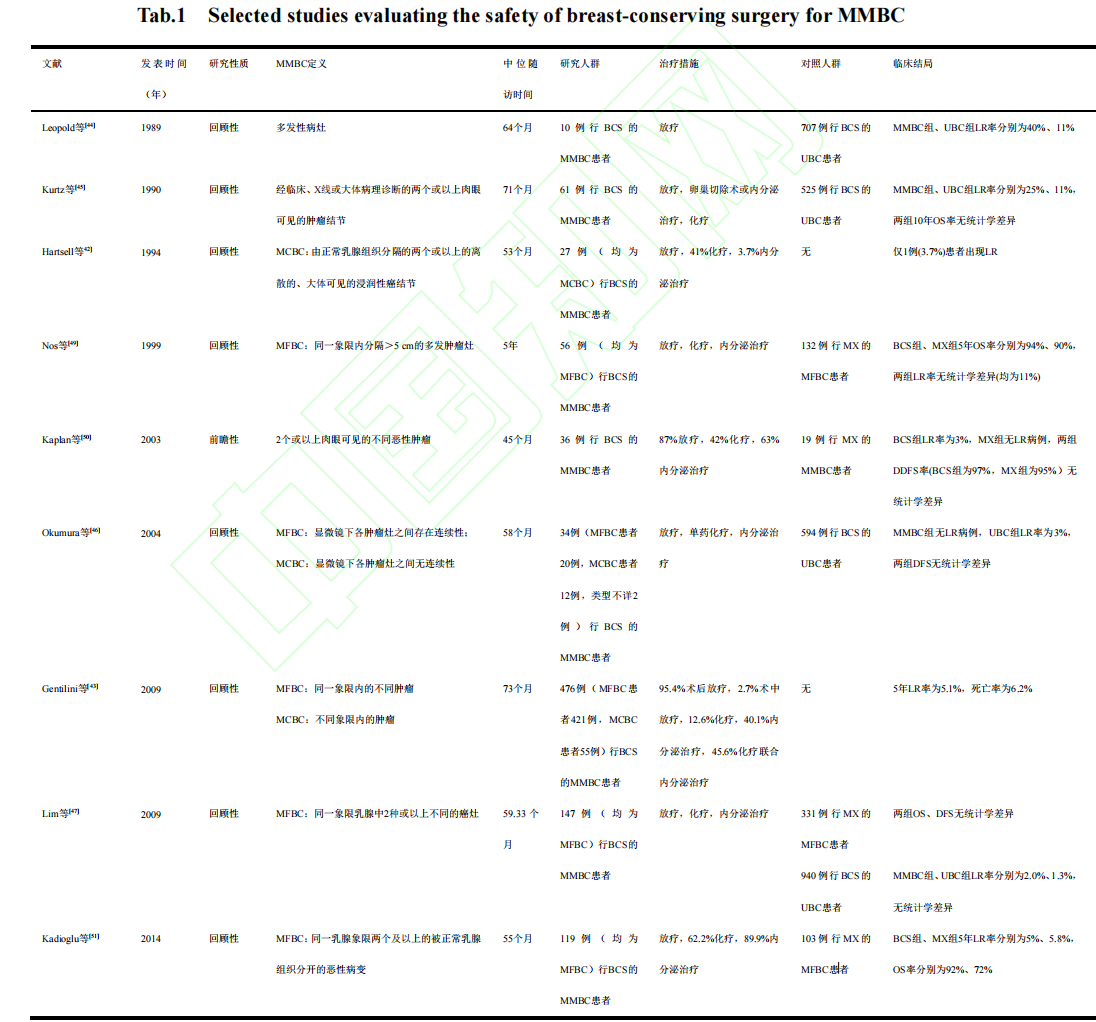
上述结果表明,MMBC 保乳治疗的临床结局与全乳全切术相比无显著劣势。虽然早期文献显示,MMBC 行保乳手术具有较高的 LR 风险,但随着医疗水平的进步,近 20 年的研究则多数认为 MMBC 选择保乳手术治疗不会对生存时间与局部控制情况产生不利影响,奠定了当前对 MMBC 进一步尝试保乳治疗的证据基础。相关文献虽多为回顾性研究,不可避免地受选择偏倚的影响,但最新公布的前瞻性试验进一步提升了支持 MMBC 保乳治疗的证据质量。备受瞩目的前瞻性临床试验 ACOSOG Z11102 于 2023 年公布了最新结果[55]:中位随访 66.4 个月时,接受保乳手术及术后全乳放疗、瘤床增强的 204 例 MMBC 患者中仅 6 名出现 LR,估计的 5 年累积复发率为 3.1%,满足临床可接受标准(5 年累积局部复发率<8%);探索性分析提示,术前接受 MRI 检查患者的 5 年 LR 率仅为 1.7%,显著低于未行 MRI 者(22.6%),进一步说明经过充分评估的 MMBC 患者行保乳手术可取得满意疗效。部分评估MMBC 保乳手术安全性的研究见表 1。
表 1 评估 MMBC 保乳手术安全性的部分研究

3 MMBC 保乳手术的局限性
切缘情况是制约 MMBC 保乳手术是否成功的一大因素。早期研究中 MMBC 保乳手术患者具有较高的 LR 率被认为与切缘状态不明或阳性有关[44-45]。Okumura 等[46]研究认为,若MMBC 保乳手术在镜下切缘为阴性,则可实现良好的局部控制,反之则不然。Kaplan 等[50]的研究中虽报告 MMBC 保乳手术与全乳切除术患者具有相似的预后,但其中 56%的保乳手术患者接受了至少 1 次的再切除手术以获得阴性切缘,提示切缘阴性是保障 MMBC 保乳手术疗效的关键,且在技术层面上实现切缘阴性具有一定难度。除广泛微钙化等不适宜接受保乳手术的情况外,存在 DCIS 的 MMBC 病例切缘阳性风险较高,术前决策时需慎重评估。
目前,MMBC 保乳手术的切缘宽度尚未达成共识。2014 年以来,“no ink on tumor”(墨染切缘处无肿瘤)被认为是浸润性癌应采取的恰当切缘及切缘阴性标准。2017 年圣加仑会议专家小组亦推荐 MMBC 保乳手术遵循此原则。Lim 等[47]报告了 1 例较特殊的 MMBC 病例,其 1 处 DCIS 病灶的 5 个切缘中有 1 个距肿瘤小于 1 mm,尊患者意愿未行再切除手术,仅接受术后化疗、放疗和激素治疗,随访 60 个月时未见肿瘤复发,研究者认为虽然受累的切缘是 MMBC 出现 LR 的危险因素,但通过放疗或可消除微小残留肿瘤。但,2022 年 BMJ发表的一篇 Meta 分析却不支持此结论[56]。该研究发现,相较于阴性切缘(距肿瘤≥2 mm),接近切缘(距肿瘤<2 mm)与浸润性乳腺癌保乳手术的远处复发(HR=1.38, 95% CI:1.13~1.69)和局部复发(HR=2.09, 95% CI:1.39~3.13)增加有关;相较于切缘距肿瘤超过 1 mm,切缘在 1 mm 以内患者的 LR 风险亦更高,所以建议保乳手术应达到至少 1 mm 的清晰边缘。
因此,鉴于足够干净的阴性切缘是确保 MMBC 保乳手术安全性的重中之重,建议临床医生参照“1 mm”的切缘宽度标准,并结合临床实际情况,谨慎控制切缘,预留一定的风险缓冲区域。
为充分达到清晰、干净的保乳手术切缘,提高术中切缘评估的精确性成为迫切需求。基于组织生化差异原理的拉曼光谱、基于组织电特性差异原理的 MarginProbe 等多元化新技术正在开发中。其中 MarginProbe 是美国 FDA 批准的用于辅助分析保乳手术切缘的唯一设备,临床试验证实其可有效提升保乳手术切缘评估的灵敏度[57]。此外,将术中冰冻切片与细胞学印片相结合,亦可有效降低切缘评估的假阳性率,以避免不必要的再切切除手术[58]。
MMBC 保乳术后外形及生活质量评价
除安全性考虑外,传统观念不支持 MMBC 保乳手术的理由之一,即是认为 MMBC 存在多处病灶,术中需切除较多的组织,使得美容效果大打折扣。但近 10 年来,已有多篇MMBC 保乳手术相关研究达成了可接受的美学结果。Tan 等[48]报告显示,仅通过单一切口和局部组织重排对 MMBC 进行保乳治疗即可获得满意的美容效果:19 例 MMBC 患者均给出 3 分(满意)或更高的评价,其中 52.6%的评价为 5 分(优秀)。此外,乳腺肿瘤切除术等传统保乳术无法处理的更小的乳房-肿瘤体积比、更大的切除体积损失等极端病例,均可通过肿瘤整形术应对。Silverstein 等[39]报道了 2 例采用 EOBCS 治疗并实现出色美学效果的MMBC 病例。该团队采取 wise pattern 术式成功完成 1 例病灶间隔 81mm 的 3 灶 MCBC 保乳手术和 1 例病灶间隔约 90 mm 的 65 岁 MMBC 患者保乳手术,术后双乳均对称、美观。一项临床研究采用 Breast-Q 量表报告了 MMBC 与大型肿瘤等病例接受 EOBCS 的结局[59]。术后 12 月时,患者对乳房满意度、结局满意度、心理健康和性健康自我评分分别为(78.0±16.6)分、(85.7±13.7)分、(90.8±11.5)分、(75.8±11.7)分,表明患者呈积极的认知态势;在术后并发症方面,未出现感染、乳头坏死等严重并发症,仅需保守治疗的伤口开裂等轻度并发症发生率为 7.7%。Savioli 等[53]亦报告了类似结果,有 4%的 MMBC 保乳手术患者需再次手术干预。上述研究表明,通过合理评估病灶、联合肿瘤整形技术,MMBC 保乳手术有望在实现肿瘤根治的同时,兼顾美观和器官功能,提升患者对于保乳手术的外形满意度。
小结与展望
近年来,MMBC 相关研究在术前影像学评估、分子标志物与病理特征、外科治疗等多方面均取得了新进展。MMBC 术前评估除传统 US、MG 外,必要时加入 MRI 或联合 DWI、DCE-MRI,有助于提高诊断的准确性,为手术方案提供更多参考信息。影像组学如进一步对 MMBC 特征进行深度挖掘,结合人工智能图像识别技术,将有望成为 MMBC 早期精准诊断的一大助力。鉴于 MMBC 病灶之间存在一定的病理异质性,对次要病灶进行充分评估有助于制定个体化治疗决策,并在必要时考虑适当升级治疗手段。在基础研究方面,结合MMBC 灶间异质性和潜在的分子标志物,筛选出潜在的药物靶点,或将推动治疗策略的更新。在外科治疗方面,笔者认为在达到外形美观和阴性切缘的前提下,采用保乳手术治疗MMBC 具有可行性,且契合“最小有效治疗”外科治疗模式。切缘阴性是制约 MMBC 保乳手术成败的重要瓶颈,为保证手术安全性,需选择适当的切缘宽度,充分确保切缘阴性。在美学追求方面,肿瘤整形技术可优化 MMBC 保乳手术的美容结果,新术式如双层旋转法亦不断在 MMBC 保乳治疗中得到成功实践,为守护健康之美领航。尽管前瞻性试验 ACOSOG Z11102 最新结果为 MMBC 保乳手术提供了强有力的支持,但未来尚需追踪更多高质量证据以论证该治疗策略的安全性。研究者应避开既往研究缺陷,纳入合理的样本、避免选择偏倚、确保长时间随访,尽可能量化潜在的影响因素如乳房-肿瘤体积比、以肿瘤总尺寸评定的 T分期、肿瘤所处位置(是否位于内上象限),以期探索出适用于更加理想的 MMBC 个体化疗法。
略
本文仅供专业人士参看,文中内容仅代表协和医学杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。版权归文章作者所有,作者拥有所有法定权利。











 苏公网安备32059002004080号
苏公网安备32059002004080号


