三阴性乳腺癌(triple-negative breast cancer,TNBC)是雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体 2(human epidermal growth factor receptor 2,HER-2)表达均为阴性的乳腺癌,具有侵袭性强、易在早期出现复发转移、预后不良等特征,约占全部乳腺癌的 15%~20%[1]。 TNBC 患者无法获益于内分泌治疗和 HER-2 靶向治疗,目前化疗仍然是该类患者的主要治疗选择,但是其有效性十分有限,晚期 TNBC 患者的总生存时间只有 13~18 个月[2]。虽然部分患者可以获益于靶向多聚 ADP 核糖聚合酶(poly ADP ribose polymerase,PARP)治疗,但是 TNBC 的新型靶向治疗仍处于早期阶段[3]。进一步探索 TNBC 的精准治疗策略,提升 TNBC 患者的疗效和生存是未来研究的方向。
TNBC被认为是最具免疫原性的乳腺癌亚型,其肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)数目、程序性死亡受体-配体 1(programmed cell death-ligand 1,PD-L1)表达水平和肿瘤突变负荷(tumor mutation burden,TMB)等指标高于其他亚型乳腺癌,提示 TNBC 的肿瘤微环境(tumor microenvironment,TME)免疫活性较强,这为免疫治疗在 TNBC 中的应用和推广提供了一定基础[4]。目前乳腺癌免疫治疗的相关研究主要集中在 TNBC,免疫疗法正在变革当前 TNBC 的治疗模式,本文就 TNBC 的免疫治疗研究进行总结和展望。
 何李华,朱秀之,江一舟.三阴性乳腺癌免疫治疗研究进展[J].中国临床药理学与治疗学,2023,28(08):842-853.
何李华,朱秀之,江一舟.三阴性乳腺癌免疫治疗研究进展[J].中国临床药理学与治疗学,2023,28(08):842-853.
三阴性乳腺癌免疫治疗的种类
肿瘤免疫治疗旨在增强机体的免疫系统,恢复机体的抗肿瘤免疫反应,进而控制与清除肿瘤[5]。TNBC的免疫疗法可大致分为四类:免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)、过继性细胞免疫疗法(adoptive cell transfer therapy,ACT)、肿瘤疫苗(cancer vaccines,CVs)和溶瘤病毒(oncolytic virus,OVs)。免疫检查点是定位在细胞表面的抑制性分子,用于调节 T 细胞的功能,在正常情况下作为免疫系统的“刹车装置”防止其过度激活。当免疫检查点分子过表达或功能过强则易导致机体的免疫力下降,易患肿瘤或其他疾病[6-7]。ICIs 是靶向免疫检查点的单克隆抗体,可以有效结合免疫检查点并阻断其功能。 ACT的原理是分离出驻留在肿瘤或外周血中的免疫活性细胞,在体外修饰并增殖后转输至患者体内,以介导抗肿瘤功能,转输的免疫细胞包括 TILs,表达嵌合抗原受体的 T 细胞(chimeric antigen receptor T cell,CAR-T)或自然杀伤细胞(natural killer cells,NK cells)等[8-9]。CVs 是一种主动免疫疗法,通过向患者体内输入具有免疫原性的物质,激活辅助性 T 细胞 1(T helper 1,Th1)型 CD4+T 细胞、CD8+T细胞等肿瘤反应性T细胞以诱导或增强机体抗肿瘤免疫反应,从而达到控制或清除肿瘤的目的[10-11]。溶瘤病毒疗法利用基因工程或天然存在的病毒通过选择性地感染肿瘤细胞,造成肿瘤细胞裂解,并刺激机体产生特异性肿瘤免疫反应[12]。
三阴性乳腺癌免疫治疗的临床探索
免疫检查点抑制剂
程序性死亡受体-1(programmed cell death-1,PD-1)、PD-L1、细胞毒性 T 淋巴细胞相关抗原 4(cytotoxic T lymphocyteassociated antigen-4,CTLA-4)是目前研究最多的免疫检查点抑制剂靶点。迄今为止,多种 ICIs 已被美国食品药品监督管理局批准使用,包括PD-1 抑制剂 Pembrolizumab、Nivolumab、Cemiplimab, PD - L1 抑制剂 Atezolizumab、Avelumab 和 Durvalumab,以及 CTLA-4 抑制剂 Tremelimumab、Ipilimumab[13]。我国自主研发的 Camrelizumab、Toripalimab 等 PD-1 抑制剂也陆续获批上市。在 TNBC中研究较多的ICIs包括Pembrolizumab、Atezolizumab、Camrelizumab、Durvalumab等。
1.PD-1/PD-L1抑制剂
PD-1分子存在于CD4+T细胞、CD8+T细胞、NK细胞、B细胞以及激活的单核细胞和树突状细胞表面,PD-L1 分子则表达于肿瘤细胞与少数健康组织中的巨噬细胞表面[14-15]。肿瘤细胞表面的 PD-L1 分子可与 T 细胞表面的 PD-1 分子相互作用,以逃避 T 细胞介导的免疫监视[16]。利用特异性抗体阻断PD-1与PD-L1 之间的相互作用,可增强 T 细胞的增殖和杀伤功能,从而发挥抗肿瘤作用,研究显示PD-1或PD-L1 的拮抗型抗体在非小细胞肺癌、黑色素瘤等恶性肿瘤中具有良好的抗肿瘤活性和安全性[17]。TNBC的免疫细胞浸润水平与PD-L1表达水平显著高于其他亚型乳腺癌,提示 PD-1/PD-L1 抑制剂在TNBC中具有潜在应用价值[18]。
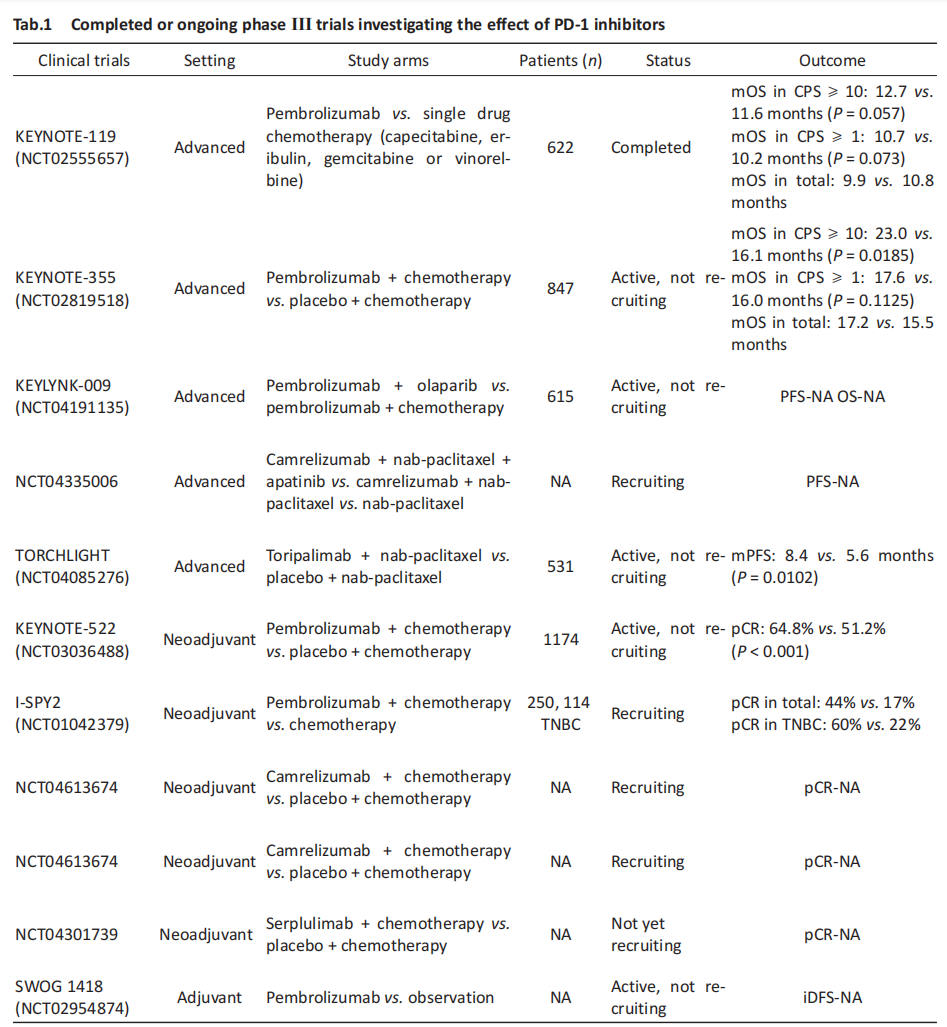
KEYNOTE 系列研究是有关 Pembrolizumab 在乳腺癌、非小细胞肺癌、胃癌等实体瘤免疫治疗领域的系列研究,其中 KEYNOTE-355、KEYNOTE522 等研究证实了 TNBC 患者使用 Pembrolizumab 联合化疗的获益。KEYNOTE-355 是第一项评估 PD-1 抑制剂一线治疗晚期 TNBC 的 III 期临床试验,研究入组 847 例局部复发不可手术或远处转移的 TNBC 患者,2︰1 随机接受 Pembrolizumab 联合标准化疗或安慰剂联合化疗,结果显示,PD-L1 高表达(CPS≥10)患者中免疫治疗组的中位无进展生存时间(progression-free survival,PFS)与中位总生存时间(overall survival,OS)显著高于对照组(9.7 months vs. 5.6 months,23.0 months vs. 16.1 months)[19-20]。KEYNOTE-522 III 期研究则证实早期 TNBC 患者使用 Pembrolizumab 联合化疗新辅助治疗及辅助治疗的获益,研究入组 1 174 名II/III期 TNBC 患者并按 2︰1 随机分为两组,实验组应用 Pembrolizumab 联合常规新辅助化疗,并且在术后辅助阶段接受 Pembrolizumab 治疗。 2020年初公布的数据显示,免疫治疗组病理完全缓解(pathologic complete response,pCR)率相比对照组显著提高,分别为 64.8% 和 51.2%,同时观察到无事件生存(event-free survival,EFS)呈现改善的趋势。2022年公布的最新数据显示两组的3 年 EFS 率分别为 84.5% 和 76.8%,差异具有统计学意义[21-22]。KEYNOTE-012、KEYNOTE-086 两项 I/II 期研究提示单药 Pembrolizumab 在晚期 TNBC 中具有较好的抗肿瘤活性和安全性,基于上述研究结果,KEYNOTE-119 III 期研究将单药 Pembrolizumab 用于转移性 TNBC 的一/二线治疗,但是结果显示,与单药化疗相比,单药 Pembrolizumab 组的 OS 并未显著改善(9.9 months vs. 10.8 months)[23–26]。综上所述,相比 PD-1 单药治疗, PD-1 联合治疗能带来更可观的生存获益,目前 ISPY-2、KEYLNK-009 等多项III期研究正在评估抗 PD-1 联合多种治疗策略在早/晚期 TNBC 的疗效,结果值得期待(Tab.1)。
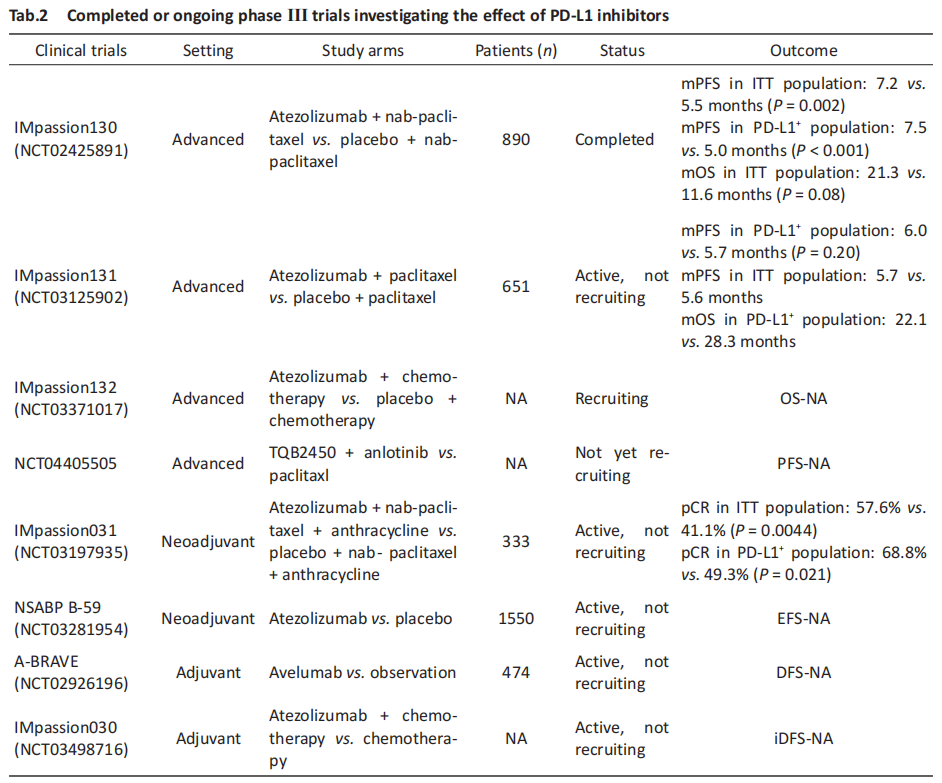
IMpassion 系列研究首次探索 PD-L1 抑制剂 Atezolizumab 在 TNBC 中的应用,该系列第一项III 期研究IMpassion130入组902名不可手术的局部晚期或转移性 TNBC 患者,按 1︰1 随机接受Atezolizumab 联合白蛋白紫杉醇或安慰剂联合白蛋白紫杉醇治疗。结果显示,意向性治疗(intention-to-treat,ITT)人群中实验组的 PFS 与 OS 均显著高于对照组(7.2 months vs. 5.5 months,21.0 months vs.18.7 months),2020年更新的总生存数据显示 PD-L1阳性人群中实验组的死亡风险下降 33%,OS 获益 7.5 个月[27–29]。Miles 等后续开展了 IMpassion131 III期研究,该研究发现在晚期TNBC 患者一线治疗中,Atezolizumab 联合紫杉醇并不能提升 TNBC 患者 PFS,探索性分析甚至显示 Atezolizumab 治疗组的 OS 可能会降低[30]。两项研究结果相悖可能与 TNBC 高异质性,紫杉醇类药物的剂型与剂量,类固醇的使用等因素有关[31]。正在进行的 IMpassion132 III期研究则关注新辅助化疗后 12 个月内复发的局部进展不可切除或转移性 TNBC 患者,比较 Atezolizumab 联合化疗组与安慰剂联合化疗组的 OS 等[32]。IMpassion031 是一项探索 Atezolizumab 联合标准化疗新辅助治疗早期 TNBC 的III期临床试验,该研究结果显示,ITT 人群中 Atezolizumab 治疗组的 pCR 率相比安慰剂组显著提升 16.5%(57.6% vs. 41.1%),并且PD-L1阴性与阳性人群中均存在pCR 率的提升,该全人群获益现象提示 Atezolizumab 联合化疗在早期 TNBC 中的巨大潜力[33]。IMpassion030 III 期研究旨在评估 Atezolizumab 联合化疗辅助治疗 TNBC 的效果,研究预计入组 2 300 名可手术的 II/III 期 TNBC 患者,随机接受 Atezolizumab 联合辅助化疗或单纯辅助化疗,拟对比两组患者的无侵袭性疾病生存时间(invasive disease-free survival,iDFS)、OS 等[34]。综上,IMpassion 系列研究提示 PD-L1 抑制剂在 TNBC 晚期解救、新辅助、辅助阶段治疗中具有广阔应用前景,与此同时,多项 III 期临床试验正在评估 Durvalumab、TQB2450等PD-L1抑制剂对TNBC的疗效(Tab.2)。
2.CTLA-4 抑制剂
CTLA-4 是位于 T 细胞表面的跨膜蛋白,T 细胞活化后,CTLA-4 的表达上调,与抗原呈递细胞表面的 CD80/CD86 结合,抑制 T 细胞对肿瘤细胞等多种细胞的免疫杀伤,故阻断 CTLA-4可能增强T细胞介导的抗肿瘤免疫。Peng 等分析公共数据后发现,CTLA-4 在 TNBC 中的表达高于 Luminal 亚型和 HER2 阳性亚型乳腺癌,提示CTLA-4是TNBC潜在免疫治疗靶点[35]。多项前期临床试验探索了 CTLA-4 抑制剂在 TNBC 中的疗效。KN046-203 是一项开放标签、Ⅰb/Ⅱ期、多中心的临床研究,旨在评估 PD-L1/CTLA-4 双特异性抗体 KN406 在晚期 TNBC 患者中的有效性和耐受性。研究入组 27 例局部进展不可切除或转移性 TNBC 患者,接受 KN046 联合紫杉醇治疗,结果显示 KN046 耐受性良好,在 PD-L1 阳性的 TNBC 患者中显示出良好的抗肿瘤活性,中位 PFS 为 7.36 个月,12 个月 PFS 率为 49.4%[36]。一项 I 期研究(NCT02536794)使用 Tremelimumab 联合 Durvalumab治疗转移性乳腺癌,研究入组11名ER阳性患者和 7 名 TNBC 患者,该疗法在 TNBC 患者中显示出明显的临床获益,客观缓解率(objective response rate,ORR)为 43%,但是鉴于总体 ORR 未达到预设终点,研究未进入第二阶段[37]。目前,BreastImmune03、NCT02527434、NCT03650894 等将 CTLA-4 抑制剂应用于 TNBC 等实体瘤治疗的研究正在进行中,其中大部分属于I/II期临床试验且处于招募阶段或者刚招募结束,故尚无证据明确指出CTLA-4抑制剂对TNBC有显著疗效。
不难看出,CTLA-4 抑制剂在 TNBC 免疫治疗的地位不及 PD- 1/PD-L1 抑制剂,两者在 ICIs 的地位差异源于两者的疗效差异,KEYNOTE、IMpassion 系列临床试验提示 PD-1/PD-L1 抑制剂在早/ 晚期 TNBC,尤其是 PD-L1 阳性患者中具有良好的疗效和安全性,而相关临床试验结果显示 CTLA-4 抑制剂在 TNBC 中疗效并不优于 PD-1/PD-L1 抑制剂,且需要与其他药物联用。尽管如此,研发 CTLA-4 抑制剂仍是必要的,因为 TNBC 中仍存在部分患者对 PD-1/PD-L1 抑制剂无反应,CTLA-4 抑制剂有望用于耐药 TNBC 的后线治疗。
过继性细胞免疫疗法
虽然多项研究指出ICIs 联合化疗可为 TNBC 患者带来生存获益,但仍有部分患者对该治疗策略反应不佳,此现象推动研究人员致力于开发新的免疫治疗方法,过继性细胞免疫疗法便是其中之一,主要包括 CAR-T 疗法、TILs 疗法、TCR-T 疗法。上述三种疗法都旨在增强T细胞的抗肿瘤能力,而TILs疗法中的T细胞来源于患者肿瘤组织,CAR-T和TCR-T疗法则来源于患者外周血并需要对 T 细胞进行人工改造。 CAR-T和TCR-T的区别在于CAR-T一般靶向肿瘤细胞表面抗原,而 TCR-T 能识别肿瘤细胞表面和细胞内抗原[38]。
嵌合抗原受体(chimeric antigen receptors, CARs)是一种合成受体,能够使T细胞不依赖于主要组织相容性复合体识别肿瘤相关抗原(tumorassociated antigens,TAAs),多项研究表明 CAR-T 疗法对 B 细胞性恶性肿瘤有显著疗效[39]。目前至少有 12 项早期临床研究正在评估 CAR-T 疗法在 TNBC 中的疗效与安全性[40]。ROR1 是受体酪氨酸激酶家族成员之一,在 TNBC 细胞表面高度表达,一项I期研究入组 4 例多线治疗的晚期 TNBC 患者,向患者体内输送靶向 ROR1 的 CAR-T,结果显示 CAR-T 能安全有效地植入患者体内并扩增,1 例获得部分缓解,2 例获得疾病稳定[41]。一项I期、单臂、多中心临床试验正在招募受试者测试靶向 ROR1 的 CAR-T 的 LYL797 的安全性和耐受性[42]。MUC1是一种跨膜黏蛋白,以突变形式TnMUC1 分布于乳腺癌、胃癌等癌组织,Gutierrez 等利用靶向 TnMUC1 的 CAR-T 治疗 6 例实体瘤患者(包括 1 例 TNBC),该研究目前处于剂量摸索阶段,初步结果显示尚无患者出现剂量限制性毒性事件,安全性较好[43]。除上述靶点,潜在的 CAR 靶点还包括 AXL、TEM8、EGFR 等。CAR-T 疗法在 TNBC 治疗中的推广仍存在诸多困难,包括选择合适的靶点以控制脱靶毒性,克服因抗原丢失或肿瘤异质性造成的肿瘤逃逸等[40]。
TILs 疗法是体外扩增患者肿瘤组织的 T 细胞后回输至患者体内的治疗方式,该疗法在黑色素瘤和部分实体瘤(如膀胱癌、结直肠癌等)中被证实具有一定疗效[44]。Zacharakis等收集42例晚期乳腺癌患者的 TILs 并测试其识别突变的能力,发现有28例患者的TILs至少能识别一种新抗原,后续入组 6 例患者接受 TILs 疗法联合 Pembrolizumab 治疗,2 例患者的肿瘤明显缩小,1 例患者获得病理完全缓解[45]。一项由安德森癌症中心牵头的多中心、开放标签II期临床试验旨在评估 TILs 疗法在 TNBC、骨肉瘤等多种实体瘤治疗中的安全性和有效性,研究人员利用CD-137激动型抗体联合T细胞受体激动剂体外刺激并扩增TILs制得 LN-145/LN-145S 细胞,该细胞可能具有特异性识别并杀伤肿瘤细胞的功能,目前该研究仍在招募受试者[46]。
TCR-T 疗法利用基因工程技术将特异性识别肿瘤抗原的TCR序列导入患者外周血来源的T细胞,再将改造后的 T 细胞回输至患者体内。经过 20 多年的发展,多项临床前期研究提示 TCR-T 细胞可以有效杀死肿瘤细胞,若干临床试验表明靶向 NY-ESO-1、MAGE、GP100 等肿瘤特异性抗原的 TCR-T 疗法对黑色素瘤、结直肠癌和滑膜肉瘤具有一定疗效[47]。目前,将TCR-T应用于TNBC治疗的临床试验较少,一项 I 期临床试验(NCT04639245)欲探索靶向 MAGE-A1 的 TCR-T 疗法的安全性,但是因入组太慢被终止。
综上所述,ACT治疗TNBC仍处于早期探索阶段,目前CAR-T疗法、TILs疗法等细胞疗法离TNBC 临床标准治疗还为时尚早,仍需更多临床前研究的支撑和临床试验的论证。同时,如何有效延长 T 细胞的寿命并在体外高效扩增,是 ACT 疗法仍待解决的技术难题。未来,ACT 疗法可能成为新辅助化疗或ICIs耐药患者的一种治疗选择[48]。
肿瘤疫苗
肿瘤疫苗是肿瘤免疫治疗研究热点之一,其原理是通过多肽、核酸、细胞等多种形式将肿瘤抗原导入患者体内,诱导机体免疫反应,达到预防或治疗肿瘤的目的。目前进入临床研究的 TNBC 疫苗包括 NeuVax、Adagloxad Simolenin疫苗、α-乳清蛋白疫苗等。
NeuVax 是来源于 HER2 的多肽类疫苗,一项 IIb期临床试验入组275例HER-2低表达早期乳腺癌患者,按1︰1分组随机接受NeuVax联合免疫佐剂 GM-CSF、Trastuzumab 或 GM -CSF 联合 Trastuzumab辅助治疗,结果显示ITT人群中疫苗组有无病生存(disease-free survival,DFS)获益趋势。在 TNBC 患者中,疫苗组的 DFS 则显著高于对照组,提示 NeuVax 联合 Trastuzumab 可作为早期 TNBC 的辅助治疗策略[49]。多糖类肿瘤相关抗原 Globo-H 在乳腺癌、胰腺癌、胃癌等上皮细胞来源的肿瘤中高表达,是潜在的疫苗靶点。GLORIA是一项随机、多中心、开放标签的III期临床试验,旨在评估 Globo-H 疫苗 Adagloxad Simolenin 辅助治疗 Globo-H 阳性早期高危 TNBC 的疗效,研究的主要终点为受试人群的 iDFS,目前该研究处于招募受试者阶段[50]。正常情况下α-乳清蛋白仅在妊娠晚期或哺乳期表达于乳腺组织,但 Touhy 等发现约70%TNBC组织也存在该蛋白,于是研究人员研发了一种针对α-乳清蛋白的多肽疫苗,前期动物实验表明该疫苗可以安全有效地预防小鼠乳腺肿瘤复发。2021 年启动的一项 I 期研究将纳入 18~24 例已治愈的早期 TNBC 患者进行疫苗接种,旨在评估疫苗的耐受剂量,后续将评估该疫苗预防 TNBC 复发的效果[51]。一项开放标签的I 期研究入组 18 例 TNBC 患者,随机接受 DNA 疫苗联合Durvalumab治疗或DNA疫苗单独治疗,研究将对比评估两种疫苗接种策略的安全性,预计于2023年结束试验[52]。
近二十年来,乳腺癌疫苗并未带来明显的临床获益,只有少数乳腺癌疫苗进入了III期临床试验。为了提升 TNBC 疫苗的有效率,研究者们开始转向疫苗与 ICIs 的联合治疗策略。同时,以脂质体、工程外泌体等新兴技术为基础的肿瘤细胞疫苗、DC 细胞疫苗在 TNBC 动物模型中表现出良好的抗肿瘤活性,有望下一步进入临床研究[53-54]。
溶瘤病毒
溶瘤病毒疗法是一种新型的免疫疗法,利用天然或基因修饰的病毒选择性复制并杀死肿瘤细胞。多项临床前期研究显示溶瘤病毒可以促进 TNBC 细胞凋亡、诱导抗肿瘤免疫反应等[55],但进入 TNBC 临床研究的溶瘤病毒疗法寥寥无几。近期,一项II期临床试验的结果提示溶瘤病毒在 TNBC 新辅助治疗中具有良好的应用前景。
Talimogene laherparepvec(T-VEC)是基于改良的 1 型单纯疱疹病毒的溶瘤病毒疗法,该疗法于2015年获得FDA批准用于治疗晚期黑色素瘤。 2021 年的一项I期临床试验探索了 T-VEC 联合化疗用于 TNBC 新辅助治疗的最大耐受剂量和安全性,其结果提示 T-VEC 毒性可控,安全性较好[56]。同一研究团队所开展的II期临床试验进一步探索了T-VEC的疗效,该临床试验入组37名II-III期 TNBC 患者,在手术前接受 T-VEC 溶瘤病毒联合标准化疗,治疗后使用残余肿瘤负荷(residual cancer burden,RCB)来评估疗效。结果显示,45.9% 的患者在治疗后获得完全缓解,两年无复发率约为 89%,提示 T-VEC 联合标准化疗可以提升高危早期TNBC患者的治疗反应[57]。
溶瘤病毒在 TNBC 治疗中仍处于早期探索阶段,T-VEC 的相关临床研究结果提示该疗法具有一定应用前景。在 KEYNOTE-522 中,PD-1 抑制剂联合化疗用于 TNBC 新辅助治疗的 3 年无复发率约为 84%,如果 T-VEC 后续III期临床试验能延续较高的无复发生存率,TNBC 新辅助治疗将会有更多选择。
三阴性乳腺癌免疫治疗的疗效标志物
虽然免疫治疗改善了众多患者的预后,但是只有部分患者能从中获益。TNBC 是一种高度异质性肿瘤,多组学测序数据揭示 TNBC 三种肿瘤微环境特征:免疫荒漠型,其微环境内免疫细胞浸润程度较低;固有免疫未激活型,微环境内主要有静止的固有免疫细胞和非免疫基质细胞;免疫炎症型,微环境内有大量固有和适应性免疫细胞。免疫炎症型对应俗称的“热肿瘤”,以往研究提示该亚群对免疫治疗敏感[58]。利用合适的疗效生物标志物,筛选免疫治疗获益人群,是实现精准免疫治疗的重要环节。研究发现多种生物标志物具有预测免疫治疗疗效的潜质,如 PD-L1 表达水平、TILs、免疫细胞基因标志、TMB等[3]。
PD-L1 表达水平是目前临床上应用最广泛的疗效标志物之一,黑色素瘤、进展期非小细胞肺癌等相关研究提示 PD-L1 水平与 PD-1/PD-L1 抑制剂的疗效及患者预后密切相关[59]。多项研究提示 PD-L1 可预测晚期 TNBC 患者 ICIs 疗效。IMpassion130 研究中,研究者利用 Ventana SP142 抗体检测PD-L1阳性肿瘤细胞并计算肿瘤细胞阳性比例分数(tumor cell proportion score,TPS),PD-L1 阳性(TPS>1%)患者中,Atezolizumab 联合化疗组患者的 PFS、OS 相比单药化疗组显著升高。KEYNOTE - 355 则采用 22C3 抗体和综合阳性评分(combined positive score,CPS)标准量化肿瘤/免疫细胞上 PD-L1 的表达,Pembrolizumab 显著延长 CPS≥10 转移性 TNBC 患者的 PFS。在早期 TNBC, PD-L1 表达水平作为疗效标志物仍具争议,如 KEYNOTE-522 研究,Pembrolizumab 联合化疗对 PD-L1 阴性 TNBC 患者也有生存获益,PD-L1 表达在早期 TNBC 中的疗效预测效能仍需要在大样本中进一步验证[22]。
TILs是分布在肿瘤内或肿瘤微环境中的免疫细胞,包括促炎的 CD8+细胞毒性 T 细胞、CD4+Th1 细胞、NK 细胞等,以及抑炎的 B 细胞、调节性 T 细胞(regulatory T cells,Tregs)等。TILs 的测定主要依靠镜检苏木精-伊红染色后的玻片样本,测量时遵循国际免疫肿瘤学生物标记物工作组制定的 TILs 占比评估方法[60]。研究显示,TILs,尤其是 CD8+ T 细胞浸润水平与 TNBC 患者 ICIs 反应率相关。例如 IMpassion130 研究,探索性分析提示 CD8+T 细胞浸润可预测 Atezolizumab 治疗转移性 TNBC 后的 OS 获益[29]。KEYNOTE-086 中,较高的 TILs 与 Pembrolizumab 治疗组 ORR 的显著提高有关。KEYNOTE-119 中,TILs 水平也与患者对 Pembrolizumab的反应率有关。虽然目前临床常规检测尚未纳入 TILs,但它在辅助 PD-L1 鉴别 TNBC 免疫治疗获益人群上具有一定价值[61]。
通过分析转录组数据,我们可以获得肿瘤的免疫基因表达特征并对肿瘤进行免疫分型,进而探索各亚型与免疫治疗反应率的相关性。在 ISPY-2 新辅平台研究中,Campbell 等利用微阵列芯片检测了14种免疫细胞基因标志的表达水平,并用逻辑回归评估了各基因标志对Pembrolizumab 疗效的预测效能,最终发现树突状细胞、辅助性 Th1 细胞标志与治疗组的 pCR 显著相关[62]。 Wolf 等在后续的回顾性分析中利用树突状细胞基因标志将 TNBC 患者分为免疫阳性/阴性,发现 Pembrolizumab 治疗组中免疫阳性人群的 pCR 预测值为87%,而免疫阴性人群仅为29%,提示该基因标志可用于鉴别 Pembrolizumab 的获益人群[63]。但是,上述研究作为探索性研究,并不具有普遍性,基因表达特征对免疫治疗疗效的预测效能还需在更多前瞻性临床试验队列中进一步验证。
TMB 是指采用高通量测序测得的每百万碱基中发生置换、插入/缺失突变的总数(mut/ Mb)。肺癌、结直肠癌和黑色素瘤的相关数据显示 TMB 是 ICIs 疗效的独立生物预测标志物,但是有关乳腺癌的 TMB 数据较少[64]。Barroso-Sousa 等整合分析 3 969 例原发或转移乳腺癌样本的全外显子测序或基因 Panel 测序数据后发现,TMB 在乳腺癌中相对较低,为 2.63 mut/Mb。高突变的样本(≥10 mut/Mb)出现率仅为 5%,但有 8.5% 富集于在转移性乳腺癌中。研究者同时发现, 59.2%高突变样本存在APOBEC突变特征,提示该突变特征是一种潜在的生物标志物[65]。
三阴性乳腺癌免疫治疗的耐药机制
TNBC 免疫治疗的耐药机制可以从肿瘤内在因素与肿瘤外在因素两方面概括。肿瘤内在因素包括原癌/抑癌基因异常表达、肿瘤细胞抗原水平下调、细胞自噬的缺陷等。肿瘤外在因素主要包括浸润 T 细胞的功能减弱、TME 中的免疫抑制成分等。
原癌/抑癌基因的异常表达可能与免疫治疗耐药相关。研究显示原癌基因 SOX4 的激活诱导 TNBC 细胞对细胞毒性 T 细胞产生抗性,敲低αvβ 6-TGFβ-SOX4 信号通路则可上调多个免疫相关基因表达,有利于肿瘤细胞的生存,提示该通路可能为 TNBC 免疫治疗耐药的机制之一[66]。约 1/3 乳腺癌患者存在抑癌基因 BRCA1 表达的显著下调,且大部分为 TNBC 患者,研究发现 BRCA1 的缺失激活 TNBC 小鼠体内 S100A9-CXCL12 信号通路,促进免疫抑制性的髓源性抑制细胞的增殖,使小鼠对免疫治疗产生耐药[67]。一项 TNBC 患者样本的多组学分析,揭示 TNBC 中对免疫治疗反应较差的亚型存在 PI3K-AKT 信号通路、抑癌基因 MYC 的异常激活[58]。肿瘤细胞表面抗原水平下调也可能导致免疫治疗耐药。最近一项研究指出, LCOR可以激活抗原加工和呈递体系(antigen processing and presentation machinery,APM)基因的转录,APM 包括 MHC-1 等抗原呈递的关键因子,低表达 LCOR 的 TNBC 干细胞因 APM 体系的瘫痪产生对ICIs的耐药[68]。自噬缺陷也可能影响免疫治疗的效果,Li等在体内/体外试验发现自噬缺陷通过阻断 Tenascin-C 的降解抑制 T 细胞介导的免疫清除,有利于 TNBC 的进展,敲低小鼠 TenascinC 表达可恢复 T 细胞介导的肿瘤杀伤,并提升 PD-1/PD-L1抑制剂的疗效[69]。
T 细胞功能减弱可能是导致 TNBC 免疫治疗耐药的因素之一。2019年的一项研究表明,随着年龄的增长,TNBC 小鼠体内抗原提呈、炎症、IFN 通路相关基因表达下调,该现象可能导致抗原提呈细胞对T细胞的诱导作用减弱,CD8+T细胞功能下降,ICIs 的疗效也相应减弱[70]。肿瘤微环境内的免疫抑制成分可通过多种机制影响免疫应答,包括 M2 型肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)、Tregs、中性粒细胞和髓源性抑制细胞等。Bao等整合分析单细胞RNA测序和批量 RNA 测序的数据后发现,TNBC 微环境中的巨噬细胞主要为 M2 型 TAMs,并且 M2 型 TAMs 与 TNBC 预后较差相关[71]。M2 型 TAMs 不仅可以促进多种免疫抑制性细胞因子的分泌,抑制 TILs 的功能,促进 Tregs 的增殖,还可以调节微环境内 PD-1/PD-L1 的表达水平,TNBC 中较多的 M2 型 TAMs 可能抑制 TNBC 对免疫治疗的反应[72]。Kim 等从大量动物模型及临床试验数据中分析得出 TNBC存在一种富含中性粒细胞的NES亚型,该亚型肿瘤微环境内存在较多的免疫抑制性中性粒细胞或髓源性抑制细胞,体外实验显示 NES 亚型的TNBC细胞易对ICIs产生耐受[73]。
总结与展望
一直以来,缺乏治疗靶点是难以有效治疗 TNBC 的主要原因,免疫疗法有望为 TNBC 治疗带来新的希望。针对 TNBC 的免疫治疗主要包括经典的免疫检查点抑制剂,新型的过继性细胞免疫疗法、肿瘤疫苗、溶瘤病毒疗法。目前,多项临床试验正在探索 ICIs 与化疗、分子靶向治疗联合的治疗方案,并不断探索新兴的免疫治疗靶点。尽管免疫治疗在 TNBC 中取得重要突破,但仍存在一部分患者对免疫治疗耐药。我们一方面需要寻找疗效标志物更精准地识别免疫治疗获益人群,另一方面需要关注免疫治疗疗效不佳的 TNBC患者,探索耐药机制并寻求新的治疗策略以逆转耐药。
略
本文仅供专业人士参看,文中内容仅代表中国临床药理学与治疗学立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。版权归文章作者所有,作者拥有所有法定权利。











 苏公网安备32059002004080号
苏公网安备32059002004080号


