摘要: 三阴性乳腺癌(TNBC)是缺乏雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER-2)的乳腺癌亚型,具有复发早、进展迅速、预后较差的临床特征,因缺乏相关靶点,治疗选择有限[1]。近年来随着各项研究的进展,免疫治疗成为TNBC患者新的治疗选择,KEYNOTE-522研究显示,新辅助免疫联合化疗为乳腺癌患者治疗带来显著疗效获益[2],本文通过分享一例免疫联合化疗新辅助治疗局晚期TNBC患者诊疗过程,为临床实践提供参考。
病例提供者:
咸宁市中心医院甲乳外科
湖北省临床肿瘤学会肿瘤整形专委会委员
ESCO甲状腺癌专业委员会委员
ESCO 乳腺癌青年委员会委员
湖北微循环甲乳专业委员会常委
从事甲状腺乳腺相关临床工作,发表核心期刊多篇。
病史简介
基本情况: 女性 38岁 体重60KG
首诊日期:2023.05.20
主诉:发现左侧乳房鸭蛋大小肿块半月余
既往史:无特殊
个人史:无特殊
婚育史:G2P2剖腹产
家族史:无特殊
查体:
T:36.5℃ P:80次/分 R:20次/分 BP:110/65mmHg, ECOG 0分,全身皮肤粘膜无异常,五官正常;全身浅表淋巴结未触及肿大。
双乳对称,左乳外上象限可触及一大小约5.0cmx3.5cm包块,肿块质硬,边界不清,活动度差;肿块皮肤无橘皮征,右乳未及明显肿块,双乳头无内陷及溢液。左侧腋窝可扪及肿大淋巴结,大小约2.5cmx2.0cm,质硬、活动度差,局部皮肤无红肿及粘连;
右侧腋窝未扪及肿大淋巴结。余无特殊。
肿瘤标志物:
2023-5-24:糖类抗原CA-199 32.75 U/mL;糖类抗原CA-125 80.20 U/mL ↑;糖类抗原CA-153 17.20 U/mL;甲胎蛋白 0.39 ng/ml;癌胚抗原 1.57 ng/mL。
影像学检查:
2023-5-21乳腺B超:左侧乳腺2-3点钟方向距乳头约15.6mm一大小约46.9×17.6×32.0mm结节,边界欠清,形态欠规则;右侧乳腺3-点钟方向乳头旁一个大小约4.4×2.3mm结节,6点钟方向距乳头约22.4mm处一个大小约4.8×2.6mm结节。左侧腋下可见数个低回声,形态失常,形态欠规则,皮髓质分界不清,淋巴门结构消失,其中一个大小约21.1×11.8mm;右侧腋下可见数个椭圆形淋巴结回声,其中一个大小约11.8×4.6mm。 CDFI:上述淋巴结回声内可见少许血流信号,左侧腋下低回声内可见血流信号,其中一支动脉频谱RI:0.77。侧腋下低回声灶(异型淋巴结可能)右侧腋下淋巴结可见。
2023-5-25乳腺MRI(图1):左乳内侧中线区可见小结节状等T1长T2信号,病灶大小约1×1.1cm,边界欠清,增强后呈不均匀中等强化,绘制其时间-信号曲线呈速升--缓降型表现,双侧乳腺散在斑点状、小结节状强化灶,直径约5mm,绘制其时间-信号曲线呈渐升型表现;左侧腋窝可见多发淋巴结增大。
2023-5-25 头部CT、胸部CT、腹部超声均未见明显异常。
病理结果:
2023-5-25 左侧腋窝淋巴结细针穿刺活检可见癌细胞。
2023-5-26 "左乳肿块Mammotome活检”,术后病检左侧乳腺浸润性癌,浸润性小叶癌(WHO 3级),可见较多脉管内癌栓。
免疫组化:2023-6-1 ER(0)、PR(0)、HER-2(1+)、Ki-67(70%+)。
临床诊断:左侧乳腺浸润性癌 TNBC(T2N2M0-ⅢA)。
治疗经过:
新辅助第一阶段治疗:
2023-6-2、6-23 新辅助化疗2个周期,具体方案为:环磷酰胺0.765g+吡柔比星76mg+多西他赛115mg Q3W。
影像学评估:
2023-6-25乳腺彩超:左侧乳腺2-3点钟方向距乳头约15.6mm一大小约35.6×36.4×11.8mm,边界欠清,形态不规则(肿块大小与前次超声对照有减小),CDFI:左侧乳腺2-3点钟方向结节可见血流信号,其中一支动脉频谱RI:0.63、0.62,余结节内未见明显血流信号。
疗效评估:SD
新辅助第二阶段治疗:
两周期新辅助化疗疗效欠佳, 2023-7-14、8-4、8-26、9-16行4周期TAC化疗联合斯鲁利单抗(300mg)治疗。
影像学评估:
2023-8-4(3周期后)乳腺MRI(图1):双侧乳腺形态基本对称,腺体分布欠均匀。左乳外侧上部可见小结节状等T1长T2信号,病灶大小约0.9×1.2cm,内部信号不均匀,边界欠清,可见毛刺增强后呈不均匀中等强化,绘制其时间-信号曲线呈速升--缓降型表现,双侧乳腺散在斑点状、小结节状强化灶,直径约5mm,绘制其时间-信号曲线呈渐升型表现;双侧腋窝未见明显增大淋巴结。
2023-10-9(6周期后)乳腺彩超:左侧乳腺2-3点钟方向距乳头约20mm处见一稍低回声结节,边界不清,形态欠规则,大小约22.0×6.3mm。
2023-10-12(6周期后)乳腺MRI(图1): 双侧乳腺形态基本对称,腺体分布欠均匀。左乳外侧上部可见小结节状等T1长T2信号,病灶大小约0.9×1.2cm,内部信号不均匀,边界欠清,可见毛刺增强后呈不均匀中等强化,绘制其时间-信号曲线呈速升--缓降型表现,双侧乳腺散在斑点状、小结节状强化灶,直径约5mm,绘制其时间-信号曲线呈渐升型表现;双侧腋窝未见明显增大淋巴结。
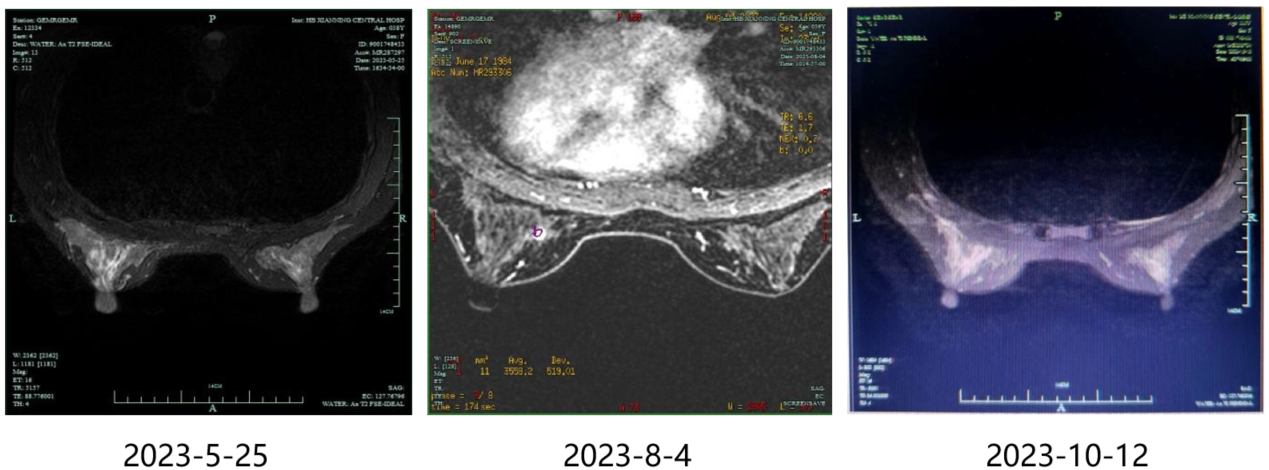 图1、基线及治疗3周期和6周期后乳腺MRI
图1、基线及治疗3周期和6周期后乳腺MRI
疗效评估:PR
手术治疗:
2023-10-11腔镜下行左侧乳腺癌保乳根治+左侧腋窝淋巴结清扫术。
术后病理:2023-10-16术后病理结果:左侧乳腺腺病,间质广泛玻璃样变性,未见癌组织残留。新辅助化疗反应(Miller-Payne分级):V级,RCB(残留癌负荷分级):0级。腋窝淋巴结23枚未见癌转移,其中6枚见纤维化。
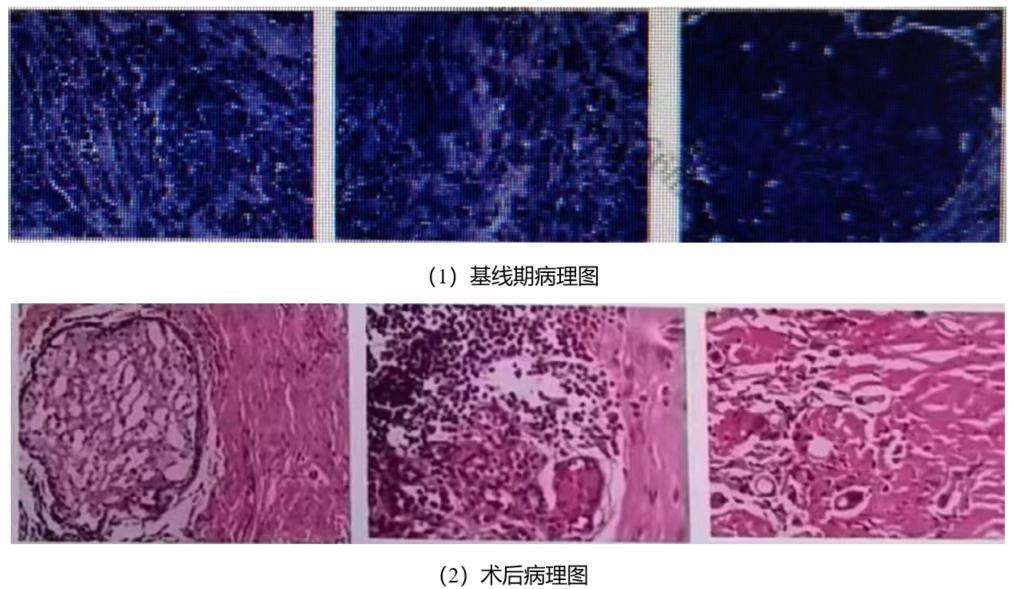 图2、基线期及术后病理图
图2、基线期及术后病理图
疗效评价:病理完全缓解(pCR)。
辅助治疗:
2023-10-21至今行斯鲁利单抗300mg Q3W术后辅助治疗。
不良反应:
化疗后出现骨髓抑制,II度胃肠道反应,心率加快,对症处理后恢复正常。
定期复查肝肾功能等未见明显异常。
病例小结:

该患者初诊为局部晚期三阴性乳腺癌,根据《2023年CSCO乳腺癌诊疗指南》[3],新辅助治疗Ⅰ级推荐以化疗(6周期)为主。该患者行2周期TAC化疗,肿瘤退缩不明显,效果欠佳,依据KEYNOTE-522研究结果,化疗联合免疫新辅助治疗可为患者带来显著疗效获益。综合评估患者体力状况,并取得患者家属同意后,行4周期TAC化疗联合斯鲁利单抗(300mg)治疗,乳腺MRI提示病灶较前明显缩小,后实行保乳及淋巴结清扫术,术后病理结果显示,切除组织中未查见肿瘤细胞,免疫联合化疗新辅助治疗疗效达pCR。治疗过程中患者未出现明显irAE,手术顺利进行,且术后恢复良好,整体治疗过程患者具有良好的耐受性。同患者充分沟通后,继续给予免疫辅助治疗,期待带来长久生存获益。
专家点评:
咸宁市中心医院甲乳外科主任
湖北省乳腺甲状腺生物委员会常委
湖北省抗癌协会食管癌专业委员会常委
湖北省抗癌协会乳腺专业委员会常委
湖北省抗癌协会肿瘤分子标志与转化医学专委会委员
湖北省抗癌协会第七届理事会理事
武汉医师协会甲状腺乳腺医师分会副主任委员
TNBC约占所有乳腺癌的10%-20%,具有特殊的生物学行为和临床病理特征,而且多发生在年轻女性,远处转移风险较高。既往针对TNBC的治疗以化疗为主,近年来,免疫治疗在TNBC中取得不错的成绩,KEYNOTE-355研究结果显示[4],在CPS≥10的先前未治疗、局部复发、不能手术或转移性TNBC患者中,帕博利珠单抗联合化疗相对于化疗显著改善OS(23.0个月vs 16.1个月,HR=0.73),延长PFS(9.7个月 vs 5.6个月,HR=0.65)。KEYNOTE-522研究结果提示,新辅助免疫联合化疗相对于化疗治疗TNBC患者显著提高pCR(64.8% vs 51.2%),试验组较对照组5年EFS率提高9%(81.3% vs 72.3%),此外,达到pCR患者,试验组和对照组的5年EFS率分别为92.2%和88.2%,未达到pCR患者,试验组较对照组的5年EFS率提高10.3%(62.6% vs 52.3%),结果表明,免疫联合化疗新辅助治疗能改善患者的EFS,达到pCR患者预后更好。该治疗模式为更多早期及局晚期TNBC患者带来新的治疗选择,免疫治疗为TNBC患者提供了长期生存获益的可能性。
该患者诊断为局晚期三阴性乳腺癌,采用指南推荐的常规化疗TAC方案,疗效不显著,化疗联合斯鲁利单抗治疗后,患者病灶较前明显缩小,术后病理提示未见肿瘤细胞,疗效达pCR。参照《2023年CSCO乳腺癌诊疗指南》[3],TP联合PD-1抑制剂新辅助治疗TNBC患者,可以显著提高患者pCR,达到pCR患者预后更优,术后继续使用PD-1抑制剂可以进一步改善患者的EFS。目前患者正在进行斯鲁利单抗辅助治疗,期望患者从后续免疫治疗中获得良好的持久获益。该病例提示斯鲁利单抗在局晚期三阴性乳腺癌临床实践表现出优秀的疗效和安全性,扩大了斯鲁利单抗真实世界用药人群。
[1] Jiang YZ, Ma D, Suo C, et al. Genomic and transcriptomic landscape of triple-negative breast cancers: subtypes and treatment strategies[J]. Cancer Cell, 2019, 35(3): 428-440.
[2] Schmid P, Cortes J, Dent R, et al. Event-free survival with pembrolizumab in early triple-negative breast cancer[J]. N Engl J Med, 2022, 386(6):556-567.
[3] 中国临床肿瘤学会指南工作委员会.中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2023.
[4] Cortes J, Cescon DW, Rugo HS, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial[J]. Lancet, 2020, 396(10265): 1817-1828.
排版编辑:DND











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


