北方的柳树发芽,南方的樱花盛开,生机勃勃的景象总让人感到心潮澎湃、斗志昂扬!GIST月评小组在大家的陪伴下,迄今走过了7年多的学习时光,为了更好的进行GIST文献学习、并开展基于文献学习的GIST科研工作,月评小组正式即日起正式更名为“胃肠间质瘤中国研学社”,工作内容仍以GIST文献学习、IIT研究、疑难病例MDT讨论为主要内容,希望在学习的同时,能够进一步开展科研课题的协作与疑难病例的义诊,更好的服务大家!
本期GIST月评检索了来自Pubmed 2024.02.25-2024.03.25的GIST相关文献,排除仅发表英文摘要与非英文的论文,共35篇,中国学者发表论文22篇,其中北京大学肿瘤医院郝纯毅教授团队、青岛大学附属医院周岩冰老师团队、重庆医科大学张军教授团队、南京医科大学鼓楼医院王峰教授团队发表高质量科研论文,向四位教授表示祝贺! 本期选取9篇论文进行解读,26篇进行列表,本月关于瑞派替尼耐药机制的重磅研发发表于Journal of Clinical Oncology期刊,鉴于研究的重要性,本期特别邀请四位重量级专家高静教授、刘秀峰教授、张信华教授、邱海波教授分别从基础研究、药物治疗与外科视角分别对这篇文章进行解读,也欢迎大家对这篇重要文献发表自己的观点!
本期文献月评检索与文字排版得到了范雯霏女士的大力帮助,同时感谢再鼎医学GI团队协助进行论文标题首页的排版与编辑,最后感谢刘丹博士的校审!

GIST重量级

1. 胃肠间质瘤中KIT ATP结合口袋/活化环突变:激酶抑制剂逃逸新机制 ⭐⭐⭐⭐⭐
KIT ATP-Binding Pocket/Activation Loop Mutations in GI Stromal Tumor: Emerging Mechanisms of Kinase Inhibitor Escape

东部战区总医院肿瘤中心
刘秀峰教授
【正文背景】:
伊马替尼耐药主要由KIT继发突变导致,这些继发突变具有克隆异质性。瑞派替尼是KIT活化环(AL)继发突变的有效抑制剂,但四线临床获益有限,瑞派替尼耐药的分子机制未知。研究团队通过对25例瑞派替尼难治的GIST进展病灶进行了KIT耐药突变测序,并用新型细胞系模型和计算机建模表征耐药基因型。结果显示,瑞派替尼进展的GIST在ATP结合口袋(AP)中富集了继发突变,这种突变经常与先前存在的AL突变一起顺式发生,导致高度耐药的AP/AL基因型。瑞派替尼之前很少观察到AP/AL突变,而瑞派替尼耐药的患者中,AP/AL突变占继发性KIT突变的50%。AL突变的GIST细胞系中,瑞派替尼干预过程中唯一的基因组逃逸机制就是AP/AL突变。瑞派替尼和舒尼替尼对继发性AP或AL突变的混合克隆有协同作用,但对AP/AL基因型的克隆没有抑制作用。研究结果强调,KIT仍然是主流的致癌驱动因素。KIT抑制剂的组合可以抑制继发耐药,但AP/AL基因型需要开发新策略。
【述评】:
1、既往的基础和临床研究显示,一线伊马替尼仅对外显子9和11敏感,对AP(13/14)及AL(17/18)耐药;二线舒尼替尼对AP敏感,但对AL耐药;三线瑞戈非尼对AL部分敏感;瑞派替尼同时结合于开关口袋和活化环,将激酶锁定在非活化的状态,广泛抑制KIT外显子突变。温故而知新,今天再次与图1(GIST领域的学者都铭刻在心,为了便于笔者描述,抱歉再次占用篇幅展示)相遇,视觉突然变得模糊起来。INVICTUS(≥4L)和INTRIGUE(2L)研究结果都公布了,同时也带来了GIST领域的新话题—异质性。肿瘤的异质性包括空间和时间两个层面,时间异质性是由于肿瘤的自然进展或由于受到临床干预产生的选择性压力影响而导致的分子事件,各突变位点丰度此消彼长,从而导致单一药物很难达到有效控制。本研究站在“后瑞派替尼”的高度,回答了一个新的时间异质性问题,同时也是一个空间异质性问题,因为AP和AL联手了,构成了新的AP/AL基因型!
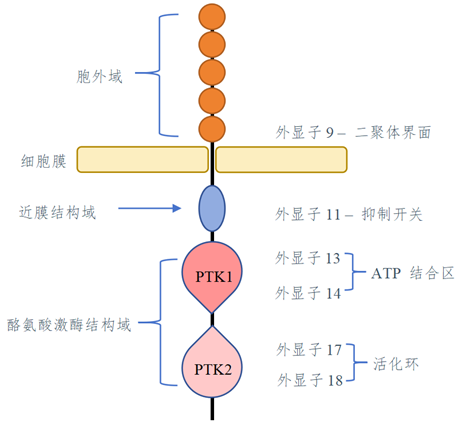
图1. KIT结构示意图
2、研究从体外细胞系模型和体内试验均证实,AP/AL突变在瑞派替尼之前罕见,AP或AL的发生多为驱动突变。而瑞派替尼导致耐药的AP/AL基因型,AP和AL突变均为在同一等位基因上,为顺式突变。在非小细胞肺癌领域,我们都知道EGFR TKI的耐药机制包括T790M和C797S,当两个基因在同一条DNA链上,称之为顺式突变,而发生在不同DNA链上称之为反式突变,这对治疗的指导意义不同。反式可以TKIs联合用药,顺式需要另辟蹊径。顺式突变的AP/AL新基因型对GIST领域学者来说(至少笔者)是一个新概念,相关的对策还有待深入研究。本文提供了可能的解决方案,如尼达尼布(VEGFR2抑制剂) 或HSP90抑制剂17-AAG,但临床数据几乎为零。
3、借此机会,推荐一篇笔者如痴如醉的文献:The coming decade in precision oncology: six riddles(Nat Rev Cancer . 2023 Jan;23(1):43-54. )。肿瘤精准治疗的6个谜团之首就是:时间是最好的杀手(Time is the best killer,源于Agatha Christie的侦探推理小说)。作者以慢性髓性白血病(CML)为例(图2)展开,CML治疗的成功有三个要素:发现驱动基因BCR-ABL(a)、发现可靶向驱动的药物伊马替尼(b)以及在疾病的早期布局治疗(c)。当克隆在各种压力下不断进化,并出现时空异质性后(d),TKI的疗效大打折扣。就瑞派替尼而言,面对新的三种场景:E11+AP、E11+AL以及E11+AP/AL,作者规划了不同的诊疗路径,其实也是“时间是最好的杀手”的诠释。对本文的解读,笔者与研究者、患者感觉在时空邂逅,犹如文学作品里读者、作者和作品主人公之间的共鸣。GIST患者都是“heavily pretreated patients”,这项回顾性研究能登上JCO的舞台,临床价值不言而喻。解读过程中也时时扪心自问,我肯定也从这样的时空里穿梭过,但却从来没有驻足过。
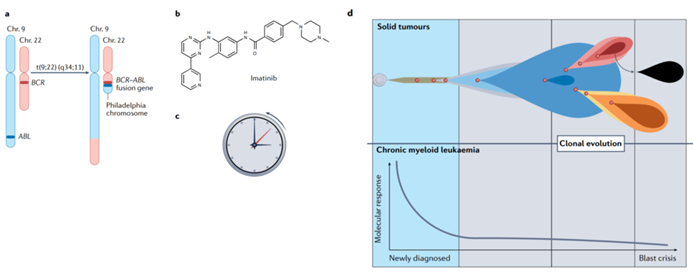
图2.时间是最好的杀手
中山大学肿瘤医院胃肠外科
邱海波副主任医师
【述评】
给瑞派替尼破案啦~~作为pan-KIT PDGFRA抑制剂,也会耐药,但耐药到底是什么机制呢?业内一直很好奇,早在中国患者对瑞派替尼可及的时候,笔者就曾想在实验室探索其耐药机制,后来得知Fletcher实验室也在探索,而且已经取得了进展,觉得自己终究做不过导师,遂放弃,一直都在等待这项研究的结果,现在终于公开发表在JCO杂志了。文章信息量大,新姿势很多,有以下亮点:
1. 理解耐药机制:说到底,胃肠间质瘤的研究主线仍然是KIT突变。研究者首先通过分析对瑞派替尼治疗产生耐药的GIST患者的样本,发现耐药性主要与KIT基因的ATP结合口袋(AP,外显子13,14)和活化环(AL,外显子17,18)区域的二次突变有关。这些AP/AL突变导致了对瑞派替尼的耐药性,因此理解这些突变的分子机制对于开发新的治疗策略至关重要。25例病人,无论之前突变位点是什么,一旦出现了AP突变就表现为临床耐药。结合INVICTUS研究(与舒尼替尼对比的二线研究)的基因突变报告(发表于Nature Medicine,2024),笔者认为AP突变是瑞派替尼治疗耐药的主要原因,尤其是Gatekeeper mutation V654和T670的出现。这也是INSIGHT研究继续进行下去的基础,而且笔者相信,经过筛选优势人群(AL突变),最终瑞派替尼能够获得二线治疗的适应症。根据患者肿瘤突变类型来定制治疗方案,肺癌已经走在了前面,未来间质瘤领域也一定能够跟上。
2. 药物组合治疗:尽管瑞派替尼对AL突变具有前所未有的活性,但对于AP突变的抑制作用有限。因此,研究者探索了使用瑞派替尼(针对AL突变)和舒尼替尼(针对AP突变)的组合治疗,以期抑制由于混合克隆导致的耐药性。这种组合治疗策略可能对于某些患者有效,但对于具有AP/AL突变的克隆并不有效。
3. 药物筛选:为了找到能够克服AP/AL突变导致的耐药性的药物,研究者进行了针对55种FDA批准的激酶抑制剂的药物筛选。虽然大多数药物对AP/AL突变细胞的活性较低,包括现在研的Pan-KIT/PDGFRA抑制剂NB003也不敏感。但研究发现Nintedanib(一种多激酶抑制剂,主要用于抑制VEGFR2)对某些AP/AL突变细胞系表现出活性。此外,一些KIT通路的下游信号通路抑制剂,比如mTOR抑制剂,具有一定的作用,或许在临床上,四线耐药无药可用的时候,可以尝试一下依维莫司等药物。
4. 下一代KIT抑制剂的开发:由于现有的KIT抑制剂对AP/AL突变的活性有限,因此开发新一代KIT抑制剂的具有重要意义。这些新的抑制剂需要能够有效地抑制AP/AL突变,从而克服耐药性。瑞派替尼的母公司Deciphera,似乎是朝着这个方向去研发的,官网上可以看到有几个DCC的药物仍旧以GIST作为研究重点,未来值得期待。
5. 局部治疗的潜在作用:对于携带AP/AL突变的GIST患者,如果系统性治疗无效,局部治疗(如手术或放疗)可能是控制这些克隆的唯一可行选项。然而,也需要看到,即使进行了局部治疗,大多数患者的预后仍然不佳。外科医生选择去手术,仍然需要谨慎评估。
文章最后的通讯作者Sabastian是德国的肿瘤内科医生,在笔者之前去了Fletcher实验室,使用了INTRIGUE研究的样本做了各种测序,再与Fletcher实验室深度合作,完成了一系列的细胞学体外实验,最终成为了一个相对圆满的故事。为什么说是相对圆满,因为在笔者看来,还有些疑惑:(1)瑞派替尼治疗前的突变,文章并未描述,这个突变是什么时候获取的,因为前面治疗线数很多,是所有病人在瑞派替尼治疗前做了一次测序,还是在伊马替尼、舒尼替尼等药物治疗前的基因类型,我们不得而知,可能会影响最后的结果。(2)瑞派替尼提前至前线(如二线)治疗,会不会对其他TKIs治疗有影响,尤其是同样把AL作为优势人群的瑞戈非尼。
综上所述,该研究涉及了对耐药机制的深入理解、药物组合治疗的探索、新药物的筛选和开发,以及局部治疗和系统性基因分型的潜在作用。这些策略的实施需要进一步的临床研究和药物开发,以期为GIST患者提供更有效的治疗选择。
原单位:北京大学肿瘤医院;
现单位:北京大学深圳医院
高静研究员
【摘要】:
目的:胃肠间质瘤(GISTs)对伊马替尼耐药主要由KIT继发突变引起,而这些继发突变的克隆异质性是主要的治疗瓶颈。伊马替尼耐药后应用KIT抑制剂虽然获益有限,但还是有一定治疗效果。对于KIT继发性激活环(AL)突变患者,瑞派替尼是一种强效抑制剂。然而,临床用于四线治疗,患者获益依然受限,且瑞派替尼的耐药机制知之甚少。
患者与方法:留取25例瑞派替尼耐药的GIST患者进展病灶组织,对KIT耐药突变进行测序。用特异的细胞系模型及计算机模拟对耐药基因型进行验证与特征鉴定。
结果:瑞派替尼治疗进展后组织发生的继发突变主要富集在ATP结合口袋(AP),且这些突变与原来携带的AL突变是顺式突变,便产生了高耐药性的AP/AL突变基因型。在GIST尚无瑞派替尼治疗的时代,GIST进展组织中AP/AL突变基因型很罕见,但瑞派替尼耐药患者中,AP/AL突变占据KIT继发突变的50%。在携带KIT继发性AL突变的GIST细胞系中,瑞派替尼药物筛选过程中出现的唯一基因组逃逸机制是AP/AL突变。对于携带继发AP或AL突变体的混合克隆来讲,瑞派替尼联合舒尼替尼具有协同作用,但对AP/AL突变基因型的克隆无抑制作用。
结论:该研究结果证实,KIT仍然是GIST后线治疗的主要驱动分子。由于出现了KIT继发突变,KIT抑制剂联用可能具有抑制效果。但瑞派替尼治疗后出现的AP/AL突变基因型需要研发下一代KIT抑制剂以提供新型治疗策略。
【简评】
这篇文章能发表在JCO,肯定有其道理,我们都很清楚,文章展示的都是关键结果,发表文章的背后都有很长的故事。为了对得起这么高分的文章,也担心漏掉重点之处,点评之前,笔者还特地开展了小型讨论会,从不同角度看看大家的读后印象。总体上,该结果给我们带来的关键信息和笔者思考有:1)要攻下GIST这座城,围绕KIT猛打准没错,即便KIT之外也有部分“小恶魔”蹦跶,短时内尚不足以带来很大威胁;2)虽然该研究并未检测瑞派替尼治疗前基线的继发突变情况,结合其他报道发现,诱导KIT AP/AL突变基因型不是瑞派替尼独家专长(其他TKI偶尔也会引发该基因型),但该结果说明瑞派替尼诱导该突变型的作用强大;3)顺式或反式突变在多种肿瘤的多个药物耐药后均有发现,如肺癌、血液肿瘤等,说明肿瘤经过越多线的治疗,累积的突变会越多;4)我们目前检测继发突变的样本要求及方法有待完善了,最好影像学明确的进展病灶组织(并非患者疾病进展后,随便获取的肿瘤组织)联合循环DNA(cDNA,注意这里所指cDNA并非我们平常说的ctDNA)一起检测,而且需要三代测序或纳米孔进行长读长测序;5)瑞派替尼对AL突变者敏感,对AP突变者或KIT 9突变者敏感性欠佳,而舒尼替尼对AP突变者或原发KIT 9突变者敏感,但对于 AP/AL突变者瑞派替尼和舒尼替尼均不敏感;6)瑞派替尼诱导的继发突变大多是AP位点,综合所有信息,对于一线伊马替尼耐药后样本进行突变检测意义重大,根据现有的CSCO指南,二线治疗中瑞派替尼是II级推荐,在选择二线治疗时,根据一线耐药后基因分型选择二线药物的推荐未来是否纳入指南,有待商榷;7)对于继发AP/AL突变患者的治疗,根据检测结果,虽然部分药物展示出一定的中等活性,但基于曾经的临床探索,已有的药物几乎不可选,新型治疗策略研发势在必行,对于AP逃逸的患者,可以尝试下舒尼替尼再挑战,但前提是基因检测要跟上;8)该研究提示,动态检测GIST治疗全过程的突变情况对于治疗选择很有用,但传统的液体活检技术的确对GIST的动态监测效能不高,第三代测序或纳米孔测序有必要提上日程;9)要说各种耐药后GIST样本,月评小组成员所在团队都已经很多了,非常有必要样本队列整合联合攻关,结果意义肯定超过该JCO结果。
中山大学一附院胃肠外科
张信华教授
【摘要】:
目的 :GIST的伊马替尼耐药性主要由继发性 KIT 突变引起,这些继发性突变的克隆异质性是治疗的主要障碍。在伊马替尼之后使用的KIT抑制剂具有临床活性,但疗效有限。瑞派替尼是活化环(AL)继发突变的强效抑制剂。然而,其在四线治疗的临床获益仍然有限,而且瑞派替尼耐药的分子机制在很大程度上还不清楚。
患者与方法:对25例瑞派替尼耐药的GIST患者的进展病灶进行了KIT耐药突变测序。利用新型细胞系模型对耐药基因型进行了验证。
结果:使用瑞派替尼治疗的GIST患者中,ATP结合袋(AP)继发突变增多,这些突变常与先前存在的AL突变顺式发生(位于同一等位基因),形成AP/AL高耐药基因型。AP/AL突变在未经瑞派替尼治疗的一组进展中的GIST样本中很少检测到,但在对瑞派替尼耐药的肿瘤患者中,AP/AL突变占继发性KIT突变的50%。在携带继发性KIT AL突变的GIST细胞系中,瑞派替尼药物选择过程中唯一的基因组逃逸机制是AP/AL突变。瑞派替尼和舒尼替尼对具有继发性 AP 或 AL 突变的混合克隆有协同作用,但对具有 AP/AL 基因型的克隆没有抑制作用。
结论:我们的研究结果表明,即使在 GIST 治疗的后线阶段,KIT 仍是核心致癌驱动因子。KIT抑制剂联合用药可抑制继发性KIT突变导致的耐药。然而,瑞派替尼治疗后出现的KIT AP/AL突变要求在开发下一代KIT抑制剂时采用新策略。
【述评】:
自从去年AACR年会出来这个研究的摘要,就已经引起不少同行的高度重视。这是首次明确瑞派替尼的耐药机制的研究。主要结论是证实新发的ATP结合口袋(AP)突变是瑞派替尼(继发)耐药的主要因素。这种新的基因型AP/AL(apple)突变,由激活环和AP的同一等位基因(顺式)上的复合突变组成。常发生于瑞派替尼瘤控时间较长的患者,是KIT11+AL突变的瑞派替尼治疗后的最重要的获得性耐药机制。研究发现,126例既往未经瑞派治疗的TKI耐药标本中仅发现4%的AP/AL突变,但瑞派治疗后耐药克隆中AP/AL突变可达50%。这类突变的细胞系与55个FDA批准的TKI共培养,发现尼达尼布(一种VEGFR/PDGFR/FGFR抑制剂)、以及KIT下游通路的MET抑制剂(如依维莫司)都表现与较明显的抑瘤效应,而舒尼替尼、阿伐替尼也对AP/AL突变细胞系有部分抑制效应。作者并未进一步验证上述药物在体内研究的结果,也指出MET抑制剂单药临床研究已经证实对于伊马替尼耐药GIST治疗效果有限,似乎显示细胞增殖试验阴性预测价值大,阳性预测价值需要进一步验证。同时,对于热衷于尝试联合治疗在末线探索的当下,研究者选择了瑞派替尼+舒尼替尼与AP/AL突变细胞系共培养--结果证实无效。我其实比较好奇,为什么没有同时选择其他的联合方案,例如KIT+MET抑制剂,伊马替尼联合TAS116 或者 SU联合PLX9486等。这些组合可能从机制上、从前述细胞增殖试验中更能提示对AP/AL突变体可能有一定效果。
另外,对于原发9或继发AP突变的GIST,在INTRIGUE研究(瑞派替尼对比舒尼替尼的二线研究)已经证实,其瘤控时间有限(平均<5月)。作者提出这类人群瑞派耐药进展与上述机制无关,应该是构型本身影响了瑞派与KIT的结合,而加大剂量可能能够提升疗效。我觉得有必要对瑞派I期以及四线临床试验中加量病人的基因突变特征进行分析,寻找其中可能的加量获益人群。
最后,本文的体外研究证实KIT 9+AL突变,显示瑞派替尼有良好表现。提示AL突变会盖过原发9突变而成为耐药克隆的主要驱动因素。我觉得,这似乎提示最后出现的获得性的KIT耐药突变应该成为下一步针对性治疗(如果有的话)首先考虑的因素。作为外科医生,深感耐药的后线GIST治疗的复杂性。这个研究出来之后,才知道,这个顺式AP/AL突变,并非只见于GIST,在肺癌、白血病的靶向治疗耐药中也存在。提示与异病同治一样,异病TKI耐药可能也有类似机制。GIST后线治疗,应该也要参考其他发病率更高的、类似耐药机制瘤种的治疗策略。
2. 单细胞水平解析晚期胃肠间质瘤与伊马替尼耐药相关的肿瘤免疫微环境特征 ⭐⭐⭐⭐
Deciphering the tumor immune microenvironment of imatinibresistance in advanced gastrointestinal stromal tumors at single-cell resolution
【摘要】:
肿瘤异质性引起的治疗阻碍在晚期胃肠道间质瘤(GIST)的伊马替尼耐药中扮演着重要的角色。针对这一障碍,研究者对局部晚期或晚期GIST的患者的原发肿瘤、腹膜转移和肝转移病灶进行了单细胞RNA测序,分析了肿瘤微环境(TME)的单细胞转录组特征,并进一步使用免疫组化和多重免疫荧光染色进行验证。该研究揭示了GIST具有独特的肿瘤进化模式、转录组特征、细胞状态动态演变和代谢重编程,结果表明在伊马替尼耐药的肿瘤微环境中,具有免疫应答活化特征的肿瘤细胞通过TIGIT-NECTIN2轴与更多调节性T细胞(Treg)发生相互作用,因此靶向Treg的免疫治疗策略可能在未来成为克服伊马替尼耐药的治疗新方向。此外,相比伊马替尼敏感的微环境,伊马替尼耐药微环境中具有更多IDO1+树突状细胞(DC)富集,其通过BTLA-TNFRSF14信号轴与各种髓样细胞发生相互作用。总之,该研究揭示了晚期GIST的转录水平异质性和免疫抑制性的微环境特征,为伊马替尼耐药提供了新的治疗策略。
北京大学肿瘤医院
消化肿瘤内科 章程副研究员
【简评】:
近年来单细胞测序的工作不断涌现,推动对肿瘤的了解从样本整体(bulk)水平进入单细胞分辨率水平,由此不断涌现出大量成果,解析了免疫微环境中除肿瘤细胞之外的其他成分对肿瘤发生发展和治疗耐药的影响,并启迪了包括免疫治疗和靶向治疗在内的多种方案的优化。相比其他患者人数众多的“大”癌种,胃肠间质瘤患者较为稀少,因此对免疫微环境的多组学研究进展也相对滞后。另一方面,现阶段除了伊马替尼之外其他可用的胃肠间质瘤精准治疗方案依然欠缺,因此亟待获得能够从单细胞和微环境角度指导胃肠间质瘤伊马替尼治疗的研究发现。本研究从单细胞测序层面解析GIST异质性,发现了肿瘤细胞、Treg和IDO1+DC在伊马替尼耐药肿瘤微环境中的存在,并通过IHC和mIHC手段进行验证,为GIST伊马替尼耐药提供了新的阐释。
但本研究也具有一定的缺陷。首先,研究采用来自7例患者的9个组织样本,且涵盖了原发灶、腹膜转移病灶和肝转移灶,因而可能具有较大的异质性。此外较小的样本量使得无法分析同一患者不同部位病灶标本之间的免疫微环境特征差异,是本研究的一处遗憾。其次,作者虽然从免疫组化和多色免疫荧光水平对单细胞测序发现的微环境特征进行了印证,但并未开展功能机制实验验证特殊类群细胞(包括Treg和DC)和伊马替尼疗效的相关性,也未能验证对其进行干预是否的确能够克服伊马替尼耐药。最后,免疫微环境中具有大量间质细胞,以肿瘤相关成纤维细胞为代表,而研究者的单细胞测序结果也提示成纤维细胞在各个患者之间具有明显差异,但研究者并未深入分析成纤维细胞与伊马替尼疗效和耐药的关联。但总的来说,本研究仍然不失为一篇较优秀的工作。

病理版块

1. 低危胃肠间质瘤术后复发或转移的临床特征及预后分析 ⭐⭐⭐
Clinical characteristics and prognostic analysis of postoperative recurrence or metastasis of low-risk gastrointestinal stromal tumors

【摘要】:
背景:GIST是消化道最常见的软组织肿瘤。本文阐述低危GIST患者的临床特点和术后的复发或转移的关系,建议对于伴有高复发风险的低危患者给于个体化治疗。
方法:回顾性分析了在2010.3-2021.12于南京鼓楼医院接受手术切除的282例未接受伊马替尼辅助治疗低危GIST患者的临床和随访数据。应用单因素和多因素Cox分析和生存曲线阐明临床病理和复发转移间相关性。
结果:共有282例患者纳入本研究,14例(4.96%)患者出现转移或复发。肿瘤复发或转移和肿瘤大小、原发部位、切除类型、Ki67指数、中淋比例及CD34表达相关(P<0.05)。多因素分析提示肿瘤原发部位、肿瘤大小和ki67指数是独立的预后因素(P<0.05)。Kaplan-Meier分析发现非胃肿瘤,肿瘤体积较大及高Ki67指数提示预后不良。
结论:肿瘤部位、肿瘤大小和Ki-67是低危GIST患者的独立预后因素。建议对于伴有不良预后因素者给于个体化的治疗方案及随访建议。
复旦大学肿瘤医院胃外科
周烨教授
【简评】:
随着诊断技术及患者体检意识的增强,低危GIST患者的比例越来越高,特别是发生在胃的GIST。根据现有应用比较广泛的改良NIH危险度标准定义的低危人群,本文随访发现约5%的患者出现了肿瘤的复发和转移,和肿瘤的部位及大小相关。在基于1000多例的随访数据的AFIP也可以看到肿瘤的部位和复发率相关。除了常见的预后因素,提示肿瘤细胞增殖活性的Ki-67在多篇报道中提示对预后还是有一定的提示意义的。所以对于处于临界值的,特别是非胃的低危患者应该高度重视,若同时伴有其他预后不良的因素者,医患双方应对于患者术后治疗方案的推荐或者随访频率等进行深入沟通,可做适当调整,在CSCO GIST指南中的脚注部分也对这部分患者有所强调。

手术版块

1. 局部晚期胃肠间质瘤多脏器切除术后的手术结局:一项单中心64例患者的回顾性研究 ⭐⭐⭐
Surgical outcomes of locally advanced gastrointestinal stromal tumors after multivisceral resection: A retrospective study of 64 patients at a single institution

【摘要】
目的:这篇文章主要分析局部晚期胃肠道间质瘤患者接受多脏器切除术(MVR)治疗的疗效,并确定肿瘤复发和术后并发症发生相关的风险因素。
方法:研究对象为2013年至2021年期间在北京大学肿瘤医院癌症中心接受MVR手术治疗的64例局部晚期GIST患者。对临床病理特征、手术效果、复发率、5年无复发生存率和总生存率进行评估。
结果:患者的平均年龄为60岁,肿瘤平均大小为 11.1 厘米。所有患者都实现了完全切除。5年无复发生存率和总生存率分别为86.6%和90.0%。单因素和多因素分析显示核分裂象是术后复发的独立因素。术后并发症总发病率为53.1%(n=34),严重发病率为21.9%(n=14)。其中最常见的严重并发症是临床相关的胰瘘(12 例,18.8%),其次是吻合口漏(4 例,6.3%)和腹腔内脓肿(4 例,6.3%)。多变量分析显示,术前予以伊马替尼治疗可降低术后并发症的发生。手术时间长、联合结肠切除术和胰腺切除术是术后严重并发症发生的独立危险因素。与胰腺部分切除术相比,胰十二指肠切除术显著增加了严重并发症发生。
结论:总之,与单纯系统治疗相比,局部晚期GIST经MVR治疗后的疗效更佳。尽管术后并发症总的发病率较高,但MVR的术后严重并发症发生率和死亡率是可以接受的。应尽可能推荐术前伊马替尼治疗。联合胰腺切除术和结肠切除术与术后严重并发症发生率有关。术前应对胰十二指肠切除术进行充分讨论,并采用多学科治疗小组(MDT)方法。
中国科学院大学附属肿瘤医院结
直肠外科 朱玉萍教授
【简评】:
局部晚期GIST无法切除的病例预后极差,该项研究证实了MVR能使选定的患者获益。其中MVR 的常见适应症包括缩瘤失败、急诊手术和切缘判断困难患者。GIST 的既定预后因素包括肿瘤部位、肿瘤大小、核分裂象计数和肿瘤破裂。然而,在该研究的多变量分析中,只有高核分裂象与复发相关。此外, 该研究发现术前服用伊马替尼可以大大降低术后并发症总体发生率,可能是因为大多数 GISTs 脆弱且血管丰富,导致出血和肿瘤破裂的风险很高,而伊马替尼能减少血液供应,使肿瘤变得坚固,从而有利于手术过程,减少术后并发症。该研究还发现胰腺切除术与 MVR 的严重并发症发病率有关。在此基础上,联合结肠切除术会增加胰漏的发生。总的来说,局部晚期GIST经MVR治疗后的疗效更佳。尽管术后并发症总的发病率较高,但MVR的术后严重并发症发生率和死亡率是可以接受的。应尽可能推荐术前伊马替尼治疗。联合胰腺切除术和结肠切除术与术后严重并发症发生率有关。术前应对胰十二指肠切除术进行充分讨论,并采用多学科治疗小组(MDT)方法。作为国内学者的一篇文章,提供了很好的临床实践,大家也可以通过同类分析针对其他瘤种做相关的深入研究,可以达成部分晚期或者疑难病人的诊疗共识。

药物版块

1. 一项扩大用药项目中瑞派替尼治疗晚期胃肠间质瘤的疗效和安全性:一项队列研究 ⭐⭐⭐⭐
Efficacy and Safety of Ripretinib in Advanced Gastrointestinal Stromal Tumors within an Expanded Access Program: A Cohort Study

【概述】:
瑞派替尼是一种用于治疗晚期胃肠道间质瘤的新药。在英国的一组含45名患者的真实世界研究中调查了它的有效性和安全性。研究了该药的安全性及其在引起肿瘤缩小和延缓肿瘤进展或死亡方面的作用。重要的是,还调查了治疗的总持续时间,包括基于临床获益的放射学进展后继续治疗的时间,这在真实世界中是一种常见的做法。研究结果显示,瑞派替尼在这组患者中的疗效和安全性与已有临床试验报道的结果相当,支持其在晚期胃肠道间质瘤患者中的应用。
【摘要】:
瑞派替尼(Ripretinib)是一种新型酪氨酸激酶抑制剂,用于治疗对标准治疗耐药的晚期胃肠道间质瘤(GIST),在英国的扩展准入研究(Expanded Access Program, EAP)中对其进行评估。本中心对2020年1月至2021年10月接受瑞派替尼治疗的EAP患者进行了回顾性分析。收集临床信息和根据mRECIST 1.1的疗效评估结果。主要终点是无进展生存期(PFS)和治疗停止时间(TTD)。此外,对进展后治疗(TBP)、总生存期(OS)、客观缓解率和安全性数据也进行了分析。采用Kaplan-Meier法构建生存曲线,并进行单因素和多因素Cox回归分析。所有分析均采用R软件进行。总共纳入了45名患者。在中位随访24.2个月(95% CI 19.7-29.7)后,接受瑞派替尼150mg每日一次(OD)组的中位PFS为7.9个月(95% CI 5.6-19.3)。在因肿瘤进展而剂量增加至150mg每日两次(BD)的22例患者队列中,中位PFS为5.4个月(95% CI 2.8-9.3)。总体而言,接受瑞派替尼治疗患者的中位PFS和OS分别为9.7个月(95% CI 8.3-18.1)和14.0个月(95% CI 9.9-NA)。TTD与PFS相似。约三分之一的患者展后继续接受瑞派替尼治疗TBP。瑞派替尼两种剂量治疗OD组和BD组的客观缓解率分别为16.7%和10.0%,没有发现新的安全性问题。总之,在英国EAP中接受瑞派替尼治疗的晚期GIST患者生存得到获益,与最近的III期临床研究结果一致。
中山大学附属肿瘤医院
伍小军教授、肖斌毅、李伟豪博士
【简评】:
伊马替尼等酪氨酸激酶抑制剂的靶向治疗极大地改变了GIST的治疗格局及改善了患者预后,但耐药是晚期胃肠道间质瘤的治疗中面临的首要问题。瑞派替尼作为一种新型的靶向广泛c-KIT突变的开关控制TKI,在既往针对四线以上治疗的INVICTUS研究及二线治疗与舒尼替尼直接对比的INTRIGUE研究中均表现出良好的临床疗效及耐受性。
该研究提供了有关英国扩大准入计划(EAP)中瑞派替尼在晚期胃肠道间质瘤(GIST)患者中的疗效和安全性的真实世界证据。结果表明,瑞派替尼能够带来生存获益,且安全性良好,结果与III期INVICTUS 临床研究结果基本一致,瑞派替尼常规剂量150mg qd治疗的中位PFS甚至还略高一些(7.9月vs. 6.3月)。进展后剂量升级(150mg bid)的整体队列患者的中位PFS可达5.4个月,整体队列患者的中位PFS可达9.7个月,而OS可达14.0个月,支持瑞派替尼在晚期 GIST 患者中的使用,且进展后加量部分患者有效 。在研究中,作者也提及了队列中小肠GIST的比例明显偏高(51.1%),对整体预后和瑞派替尼疗效等结果是否有影响难以评估。总体而言,该研究结果为瑞派替尼在晚期 GIST 患者中的使用提供了支持证据。我们也期待瑞派替尼中国研究包括根据基因类型、部位、ctDNA等分层数据的结果,瑞派替尼加量或联合其他线靶向药物治疗的真实研究结果指导治疗。
2. 晚期胃肠间质瘤:通过机器学习对伊马替尼谷浓度进行可靠分类⭐⭐⭐
Advanced gastrointestinal stromal tumor: reliable classification of imatinib plasma trough concentration via machine learning

【摘要】:
目的:晚期胃肠间质瘤患者伊马替尼血浆谷浓度(IM Cmin)低于1100 ng/ml时的疗效可能下降,因此建议监测IM Cmin。本研究旨在为中国晚期GIST患者创建一个个体化的IM Cmin分类模型。
方法:收集晚期GIST患者的初始数据和实验室指标,并将上述信息按6:2:2的比例分割成训练集、验证集和测试集。识别与IM Cmin相关的关键变量,使用最小绝对收缩和选择算子(LASSO)回归和前向逐步二元逻辑回归构建分类模型。在训练集和验证集中,通过重抽样方法构建了九个机器学习(ML)分类模型,并通过Brier分数、AUROC、决策曲线和PR曲线进行比较,确定适合该数据集的最佳模型。采用十折交叉验证和随机分割样本验证(测试集)两种内部验证方法来评估最适合模型的分类性能,测试集AUROC值用于评估模型的分类性能。
结果:最终选择了六个关键变量(性别、IM剂量、转移部位、红细胞计数、血小板计数和中性粒细胞百分比)来构建分类模型。通过验证集的比较发现,极限梯度提升(XGBoost)模型具有最大的AUROC、最低的Brier分数、最大的决策曲线下面积和最大的AUPR值。此外,通过内部验证评估,该模型在测试集中表现良好(AUROC = 0.725)。
结论:对于接受IM治疗的晚期GIST患者,临床信息和实验室指标可用于准确估计IM Cmin是否低于1100 ng/ml。XGBoost模型可能有助于指导临床医生调整IM的管理。
南京医科大学一附院
胃肠外科 徐皓教授
【简评】:
本研究是基于临床信息和血液学指标,以Cmin是否达到1100ng/ml为终点,利用机器学习方法建立的首个个体化评估模型。该模型最终纳入性别、IM剂量、转移部位、红细胞、血小板以及中性粒细胞百分比6个关键变量。XGBoost模型在训练集、测试集和验证集中的AUROC分别为0.881、0.669和0.725。国内同道在利用基本患者临床信息以及相对简单、经济实惠、便捷的检查手段进行个体化评估方面的尝试令人振奋。这种方法不仅对广大患者经济有效,也为临床医生提供了方便的决策辅助。然而,研究仍存在一些潜在不足之处。首先,模型中血液学指标采集时间不够明确,这些指标易于波动,同一患者不同时间血液学检测在该模型下是否得出不同的结论?另外,每位患者仅纳入基线的一次血液学检查是否足够,是否可以考虑多次结果取平均值以提高模型有效性。谷浓度1100ng/ml是所有GIST专科医生的一根”心弦”,是否有更适合中国人群的cutoff值一直是笔者心心所念。希望可以利用机器学习的手段寻找到最佳cutoff值。最后,研究共纳入212例GIST患者的890个IM Cmin数据,对于大规模模型而言,患者数量仍显不足。期待后续扩大样本后更优秀的模型的到来,为GIST个体化治疗带来更经济有效的指导。

影像版块

1.在术前静脉期CT影像中应用卷积神经网络预测胃GIST患者的风险类别⭐⭐⭐
Convolutional neural network applied to preoperative venous-phase CT images predicts risk category in patients with gastric gastrointestinal stromal tumors

【摘要】
目的:胃肠间质瘤(gastric gastrointestinal stromal tumors,GISTs)风险度分层与手术方案,切除范围,和新辅助治疗的必要性密切相关。本研究的目的是基于CT增强扫描静脉其图像构建和验证神经网络模型(Convolutional neural network,CNN)预测胃GISTs风险度。
方法:回顾性收集自2012至2021年多中心425例胃GISTs影像、临床及病理数据分为训练集(极低/低=154,中等=84和高风险=59)和验证集(极低/低=67,中等=35和高风险=26)。获取肿瘤最大层面上和下1,4,7层CT静脉期强化图像,构建3层面(CNN_layer3),9层面(CNN_layer9)和15层面(CNN_layer15)三个CNN模型。受试者曲线下面积和Obuchowski指数比较CNN模型诊断准确性差异。
结果:验证集中,对于低风险胃GISTs,CNN_layer3, CNN_layer9, 和CNN_layer15三个模型AUROCs分别为0.89, 0.90和0.90;中度风险胃GISTs AUROCs 分别0.82, 0.83和0.83;高度风险胃GISTs分别为0.86, 0.86和0.85。三个CNN模型的Obuchowski指数未见统计学意义差异,分别为0.871,0.875和0.873 (P >.05)。
结论:基于GIST术前CT静脉期图像构建CNN模型显示了良好的胃GIST风险度预测能力。
北京大学人民医院放射科
王屹主任医师
【简评】:
NIH基于肿瘤大小,核分裂像,发生部位以及肿瘤破裂构建GIST风险度分层标准。相关研究显示,风险度分层与GIST治疗策略选择,手术方式及患者生存预后密切相关。然而,GIST风险度分层中核分裂像和部分肿瘤破裂状况需病理诊断方可获知。基于人工智能预测GIST风险度分层,为患者和临床医师于术前提供与风险度相关信息,为术前治疗提供依据。既往GIST风险分层预测研究多基于机器学习,但多存在纳入样本量小且为单中心数据等局限性。而且,联合大体影像特征与组学特征所构建的综合模型亦存在研究者间差异性。究其原因,样本量小且分布偏倚是导致结果差异的重要原因。小样本数据难于构建准确性高泛化能力强的深度学习模型。本研究纳入4个中心425例样本,所构建深度学习模型较为准确的预测了胃GISTs风险分层,且在验证集中准确并未显著下降。另外,本研究假设CNN模型准确性与肿瘤体积相关。基于9或15层面肿瘤影像所构建CNN模型于训练集中的准确性显著高于3层面CNN模型,但是与验证集中基于不同数目层面构建模型无显著差异。基于大样本数据,深度学习模型有望基于影像特征进一步探索与GIST肿瘤表型分型相关信息,为患者治疗和临床预后提供准确的无创性生物学标记物。

其他版块

1. 胃肠间质瘤的方方面面:从初诊到个体化治疗的胃肠间质瘤的管理:文献计量学分析 ⭐⭐⭐
The GIST of it all: management of gastrointestinal stromal tumors (GIST) from the frst steps to tailored therapy. A bibliometric analysis

【摘要】:
目的:病人护理的改善与生物医学研究中发表数量的增加有关。然而,如此多的出版物使得医生和科学家筛选和处理他们各自研究领域的文献具有挑战性。在本研究中,我们对胃肠间质瘤(GIST)研究的演变进行了全面的文献计量学分析,分析了该研究的现状,并确定了超越现今的未来研究的关键问题。
方法:利用Web of Science Core Collection,对1984-2022年的5040篇与相关GIST的关键文献计量变量进行鉴定和分析。
结果:2000年以后,与GIST相关的文献出版数量随着时间的推移而大幅增加,并以跨国合作为特征。主要的主题集群包括手术管理、酪氨酸激酶抑制剂(TKI)的开发/治疗、诊断性检查和分子病理生理学。在上述所有的主要主题集群中,多年来的文献都提示取得了重大的进展。这一进展包括从传统的开放手术到包括机器人手术和内镜手术在内的微创切除技术,包括新开发的导致特异性功能基因畸变治疗作用TKIs在临床中被广泛研究,并在GIST治疗指南中实施。然而,在局部晚期、复发和转移性疾病阶段,与手术相关的问题和某些关于(后线)TKI治疗耐药性的特殊问题很少得到解决。
结论:GIST相关出版物数量的增加反映了GIST研究领域的主要主题集群的持续进展。而对于疾病晚期患者,有关手术和TKI治疗敏感性之间相互作用的问题应在未来的研究中加以解决。
浙江大学医学院附属邵逸夫医院
钱浩然主任医师
【简评】:
本月,“胃肠间质瘤月评小组”正式更名为“胃肠间质瘤中国研学社”啦!
这是个信息爆炸的时代,却也是个浮躁的时代。对于如此庞大的信息量,研学社是否已经给全国的专科医生和广大患者提供关于胃肠间质瘤最新的,全面的以及有效的信息呢?这篇文献通过一个新颖的工具——文献计量学分析给出了答案:我们紧跟着全球胃肠间质瘤发展的步伐。根据文中提供的数据,中国学者发表文章的总数量已经位于全球首位,也是参与全球合作较为频繁的国家之一。
当然,我们想要从跟随者跨越成为引领者还需要大量的积累。文中资料显示在胃肠间质瘤领域发表文章最多的10位作者以及引用最多的十篇文献都和中国不相关。我们的研究还需要从做大进一步到做强。
那么胃肠间质瘤研究领域还有哪些薄弱之处呢?文章也告诉我们晚期胃肠间质瘤的远期治疗效果远不如原发性胃肠间质瘤,外科手术介入和有效的靶向药物之间的协作是一个值得关注的方向,而这也是我们研学社今后努力的目标之一。

系统综述

1. 胃肠间质瘤精准治疗 ⭐⭐⭐
Precision Oncology in Soft Tissue Sarcomas and Gastrointestinal Stromal Tumors

【文章简介】:
文章从GIST流行病学、临床特征、组织学病理诊断、免疫组化、分子病理、局限期与转移性GIST的药物治疗,特别是依据基因突变类型对不同分子特征的GIST药物治疗进行了医学证据的综述,并对目前进行的临床研究进行了梳理,同时对分子类型GIST的药物治疗给与了推荐意见。
北京大学肿瘤医院
消化肿瘤内科 李健教授
【简评】:
这是一篇来自瑞士肿瘤内科医生从精准靶向药物治疗的视角完成的综述,由于GIST是个罕见肿瘤,在欧洲国家中关注GIST相对较多医生集中在法国、德国、西班牙、意大利等欧洲国家,以及GIST靶向治疗的起源地芬兰,来自瑞士的医生在既往的学术研究中还真的很少见,或许GIST对于欧洲小国家来说真的是病例太罕见了,不过令人钦佩的是,瑞士医生对GIST精准治疗领域的重要文献检索非常齐全,同时对GIST目前发展遇到的关键问题提出的也非常精准,同时针对不同分子分型GIST给与的药物推荐也非常符合大家对GIST的认知,包括对于原发Kit外显子13与外显子17突变GIST的推荐意见还是很有意思。在本文中,作者同样重点提及了SDH缺陷型GIST,并引用了中山肿瘤邱海波教授团队关于奥雷巴替尼研究的数据。这是一篇挺好的综述,值得对GIST感兴趣的年轻医生进行学习。
GIST文献(2024.3)列表
1. Gastrointest Endosc. 2024 Mar 14:S0016-5107(24)00170-6. doi: 10.1016/j.gie.2024.03.017. Online ahead of print.
The snare-based pre-traction method facilitating endoscopic full-thickness resection of a bidirectional prominent dumbbell-shaped gastrointestinal stromal tumor in gastric fundus
Fu-Qiang Liu, Xiang-Rong Zhou, Wen-Juan Ding, et al.
Department of Gastroenterology, Jianyang People's Hospital, Jianyang, Sichuan Province, China.
2. Dig Dis Sci. 2024 Mar 14. doi: 10.1007/s10620-024-08340-w. Online ahead of print.
Comparative Analysis of Enbloc or Piecemeal Removal After Enbloc Resection of Gastrointestinal Stromal Tumors
Jing-Wen Zhang, Chang-Qing Guo, Shan-Shan Zhu, et al.
Department of Digestive Disease, The First Affiliated Hospital of Zhengzhou University, Zhengzhou, 450052, Henan, China.
3. J Gastrointest Oncol. 2024 Feb 29;15(1):112-124. doi: 10.21037/jgo-24-27. Epub 2024 Feb 28.
Prognostic nomogram in patients with gastrointestinal stromal tumors: a SEER-based study
Pan Xu, Wei Ding, Feifei Zheng, et al.
Oncology Department, The Affiliated Wuxi People's Hospital of Nanjing Medical University, Wuxi People's Hospital, Wuxi Medical Center, Nanjing Medical University, Wuxi, China.
4. J Gastrointest Oncol. 2024 Feb 29;15(1):125-133. doi: 10.21037/jgo-23-963. Epub 2024 Feb 20.
Development and validation of a computed tomography-based radiomics signature to predict "highest-risk" from patients with high-risk gastrointestinal stromal tumor
Jiabin Zheng, Qianchao Liao, Xiaobo Chen , et al.
Department of General Surgery, Guangdong Provincial People's Hospital (Guangdong Academy of Medical Sciences), Southern Medical University, Guangzhou, China.
5. Abdom Radiol (NY). 2024 Mar 12. doi: 10.1007/s00261-024-04224-9. Online ahead of print.
Whole-lesion iodine map histogram analysis in the risk classification of gastrointestinal stromal tumors: comparison with single-slice iodine concentration measurements
Yijing Xie , Shipeng Zhang , Xianwang Liu, et al.
Department of Radiology, The Second Hospital of Lanzhou University, Lanzhou, 730000, China.
6. J Med Ultrason (2001). 2024 Mar 11. doi: 10.1007/s10396-024-01425-z. Online ahead of print.
Reply to comment on predicting the risk stratification of gastrointestinal stromal tumors using machine learning‑based ultrasound radiomics
Minling Zhuo, Yi Tang, Jingjing Guo, et al.
Department of Ultrasound, Fujian Medical University Affiliated Union Hospital, No. 29 Xinquan Road, Fuzhou, 350001, Fujian, China.
7. Eur J Dermatol. 2023 Dec 1;33(6):703-705. doi: 10.1684/ejd.2023.4632.
Panniculitis during avapritinib therapy for gastrointestinal stromal tumour
Changhua Zhu, Ping Wang, Qinqin Long, et al.
Department of Dermatology, Fujian Medical University Union Hospital, Fuzhou, China.
8. Cureus. 2024 Feb 8;16(2):e53851. doi: 10.7759/cureus.53851. eCollection 2024 Feb.
Advanced and Metastatic Gastrointestinal Stromal Tumors Presenting With Surgical Emergencies Managed With Surgical Resection: A Case Series
Divij Jayant, Mrinal Goyal, Vipul Thakur, et al.
General Surgery, Postgraduate Institute of Medical Education and Research, Chandigarh, IND.
9. World J Gastrointest Surg. 2024 Feb 27;16(2):601-608. doi: 10.4240/wjgs.v16.i2.601.
Postoperative encapsulated hemoperitoneum in a patient with gastric stromal tumor treated by exposed endoscopic full-thickness resection: A case report
Hui-Fei Lu, Jing-Jing Li, De-Bin Zhu, et al.
Department of Gastroenterology, the First People's Hospital of Huzhou, Huzhou 313000, Zhejiang Province, China.
10. J Gastrointest Surg. 2024 Feb 20:S1091-255X(24)00333-0. doi: 10.1016/j.gassur.2024.02.025. Online ahead of print.
A nomogram for predicting liver metastasis in patients with gastric gastrointestinal stromal tumor
Jinqiu Ruan, Yinfu He, Qingwan Li, et al.
Department of Radiology, the Third Affiliated Hospital of Kunming Medical University, Yunnan Cancer Hospital, Yunnan Cancer Center, Kunming, China.
11. Comput Struct Biotechnol J. 2024 Feb 22:23:1065-1075. doi: 10.1016/j.csbj.2024.02.017. eCollection 2024 Dec.
Identification and validation of protein biomarkers for predicting gastrointestinal stromal tumor recurrence
Juan Sun, Jie Li, Yixuan He, et al.
Department of General Surgery, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing, China.
12. Int J Surg Case Rep. 2024 Mar 4:117:109456. doi: 10.1016/j.ijscr.2024.109456. Online ahead of print.
A rare case of gastro-intestinal stromal tumor presented with hematemesis and severe anemia from a low and middle-income country
Md Saiful Islam, Abhigan Babu Shrestha, Fahmida Rimti, et al.
Department of Surgery, M Abdur Rahim Medical College hospital, Dinajpur, Bangladesh.
13. J Gastrointest Surg. 2024 Mar;28(3):276-278. doi: 10.1016/j.gassur.2023.12.004. Epub 2024 Jan 19.
Clinical features can distinguish gastrointestinal stromal tumor from other subepithelial gastric tumors
Richard J Straker, Amr K El Jack, Giorgos C Karakousis, et al.
Department of Surgery, Perelman School of Medicine, University of Pennsylvania, Philadelphia, Pennsylvania, United States. Electronic address: Richard.straker@pennmedicine.upenn.edu.
14. Asian J Surg. 2024 Mar 4:S1015-9584(24)00382-8. doi: 10.1016/j.asjsur.2024.02.120. Online ahead of print.
Mechanisms of splenic metastasis in gastrointestinal stromal tumors
Shengjin Wang, Feng Sun, Xinghong Wang
Department of Gastrointestinal Surgery, The Second Affiliated Hospital of Kunming Medical University, Yunnan, China.
15. Endoscopy. 2024 Dec;56(S 01):E207-E208. doi: 10.1055/a-2262-8203. Epub 2024 Mar 1.
No-touch endoscopic full-thickness resection using reopenable-clip over-the-line method for gastric gastrointestinal stromal tumor
Hitoshi Mori, Noriya Uedo, Satoki Shichijo
Department of Gastrointestinal Oncology, Osaka International Cancer Institute, Osaka, Japan.
16. Urol Ann. 2024 Jan-Mar;16(1):94-97. doi: 10.4103/ua.ua_32_23. Epub 2024 Jan 25.
Using machine learning models to predict synchronous genitourinary cancers among gastrointestinal stromal tumor patients
Mohammad Alghafees, Raouf M Seyam, Turki Al-Hussain, et al.
Department of Urology, King Faisal Specialist Hospital and Research Center, Riyadh, Saudi Arabia.
17. Cell Commun Signal. 2024 Feb 27;22(1):153. doi: 10.1186/s12964-023-01411-x.
KIT mutations and expression: current knowledge and new insights for overcoming IM resistance in GIST
Shishan Zhou, Omar Abdihamid, Fengbo Tan, et al.
Division of Oncology, Xiangya Hospital, Central South University, Changsha, Hunan, China, Xiangya road 87.
18. Discov Med. 2024 Feb;36(181):278-285. doi: 10.24976/Discov.Med.202436181.26.
The Value of Computed Tomography in Differentiating Heterotopic Pancreas from Small Gastrointestinal Stromal Tumor
Xiaolin Cui, Xinying Cong, Xuejing Liu
Department of Radiology, Beijing Friendship Hospital, Capital Medical University, 100050 Beijing, China.
19. Diagn Cytopathol. 2024 Feb 23. doi: 10.1002/dc.25285. Online ahead of print.
Gastrointestinal stromal tumors in fine-needle aspiration biopsies
Seyedreza Mousavi, Yuho Ono, Paul A VanderLaan, et al.
Department of Pathology, Beth Israel Deaconess Medical Center and Harvard Medical School, Boston, Massachusetts, USA.
20. SAGE Open Med Case Rep. 2024 Mar 14:12:2050313X241235010. doi: 10.1177/2050313X241235010. eCollection 2024.
Digestive bleeding due to jejunal stromal tumor: A train can hide another-A case report
Kammoun Neirouz, Trabelsi Mohamed Mehdi, Khalfallah Mehdi, et al.
Department B of Surgery, Charles Nicolle Hospital, Tunis, Tunisia.
21. SAGE Open Med Case Rep. 2024 Mar 18:12:2050313X231211124. doi: 10.1177/2050313X231211124. eCollection 2024.
Just the gastrointestinal stromal tumor: A case report of medical modeling of a rectal gastrointestinal stromal tumor
Lucas Keller-Biehl, Diana Otoya, Adam Khader, et al.
School of Medicine, Virginia Commonwealth University, Richmond, VA, USA.
22. World J Surg. 2024 Mar;48(3):598-609. doi: 10.1002/wjs.12073. Epub 2024 Jan 23.
Prognostic factors for liver metastasis in patients with small intestinal stromal tumor: A retrospective analysis of surveillance, epidemiology, and end results
Luojie Liu, Rufa Zhang, Zhenguo Qiao, et al.
Department of Gastroenterology, Changshu Hospital Affiliated to Soochow University, Suzhou, China.
23. Sci Rep. 2024 Mar 19;14(1):6609. doi: 10.1038/s41598-024-56701-2.
The development of a prediction model based on deep learning for prognosis prediction of gastrointestinal stromal tumor: a SEER-based study
Junjie Zeng, Kai Li, Fengyu Cao, et al.
Department of Gastrointestinal Surgery, Renmin Hospital of Wuhan University, Wuhan, 430060, Hubei, China.
24. Front Oncol. 2024 Mar 5:14:1344150. doi: 10.3389/fonc.2024.1344150. eCollection 2024.
Preoperative differentiation of gastric schwannomas and gastrointestinal stromal tumors based on computed tomography: a retrospective multicenter observational study
Luping Zhao, Guanjie Cao, Zhitao Shi, et al.
Department of Medical Imaging, The Affiliated Hospital of Jining Medical University, Jining, Shandong, China.
25. Cureus. 2024 Feb 20;16(2):e54532. doi: 10.7759/cureus.54532. eCollection 2024 Feb.
Uncommon Association Between Gastrointestinal Stromal Tumors (GIST) and Pheochromocytoma With Abdominal Wall Relapse: Case Report and Literature Review
Cesar A Nieves Perez, Miguel C Molina Obana, Regina Uribe Torres, et al.
Internal Medicine, Hospital Angeles Pedregal, Mexico City, MEX.
26. Cureus. 2024 Feb 20;16(2):e54514. doi: 10.7759/cureus.54514. eCollection 2024 Feb.
Pancreatic Extragastrointestinal Stromal Tumor: A Case Report
Tianyu Song, Qiang Hong, Yulian Wu
Department of Surgery, Fourth Affiliated Hospital, Zhejiang University School of Medicine, Yiwu, CHN.























 苏公网安备 32059002004080号
苏公网安备 32059002004080号


