2024年2月29日,ASCENT研究的最终成果荣耀登载《临床肿瘤学杂志》(Journal of Clinical Oncology,IF=45.3)[1]。基于ASCENT研究的卓越成果,戈沙妥珠单抗(Sacituzumab Govitecan,SG)的获批为局晚期或转移性三阴性乳腺癌(mTNBC)治疗带来了革命性进展。本次最新数据的发布,进一步证实了SG在mTNBC治疗中的独特地位。【肿瘤资讯】特邀北京大学肿瘤医院宋国红教授,为我们深入剖析ASCENT研究的数据精髓,共同探索未来mTNBC靶向治疗的方向与策略。
特邀嘉宾:宋国红教授
北京大学肿瘤医院乳腺肿瘤内科 科副主任,内科教研室副主任
主持国家自然科学基金项目及留学人员科技活动择优资助项目
美国国立卫生研究院NIH国家癌症研究所NCI访问学者
北京癌症防治学会乳腺癌精准靶向诊疗专业委员会主任委员
中国临床肿瘤学会CSCO乳腺癌专家委员会委员
中国女医师协会乳腺疾病研究中心常务委员
北京乳腺病防治学会内科专业委员会常务委员
中国医药教育协会乳腺疾病专业委员会委员
北京市住院医师规范化培训专业委员会委员
中国医疗保健国际交流促进会乳腺疾病分会常委
北京中西医慢病防治促进会乳腺癌精准防治全国专家委员会副主任委员中国女医师协会靶向治疗专业委员会常委

创新领航|ASCENT研究亮点概要
SG治疗mTNBC,唯一兼具临床和统计学意义的OS:最新公布的数据令人瞩目,SG治疗组的中位总生存期(OS)显著延长至11.8个月,与医生选择治疗(TPC)组的6.9个月相比,显示出卓越的治疗效果[1]。SG是首个抗体偶联药物(ADC)在mTNBC治疗领域同时取得临床和统计学意义上OS改善的药物。
mTNBC全新靶点Trop-2,且无需靶点检测:SG靶向的Trop-2靶点在mTNBC患者中的普遍表达,使SG的应用无需依赖于复杂的Trop-2表达水平检测[2]。这一特点简化了治疗流程,为mTNBC患者提供了更为便捷的治疗选择。
源起与发展|SG在mTNBC的治疗革新
mTNBC的典型特征是侵袭性临床病程和不良结局,尽管接受了化疗,但疗效不佳。滋养层细胞表面抗原2(Trop-2)是一种上皮抗原,在80%~90%的mTNBC中过表达,与预后不良、肿瘤生长加快和生存率降低有关[3]。因此,Trop-2成为了mTNBC的一个关键生物标志物。
SG是一款 First-in-class 抗 Trop-2 ADC,通过可水解的连接子(称为CL2A),将人源化单克隆抗体hRS7 IgG1κ(sacituzumab)与细胞毒性药物 SN-38偶联[4]。2021年,基于ASCENT研究的积极结果,SG获得美国 FDA 批准上市,成为全球首款获批的靶向 Trop-2的ADC类药物。随后,SG在2022年6月获得了中国国家药品监督管理局(NMPA)的批准,用于既往至少接受过2 种系统治疗(其中至少1种治疗针对转移性疾病)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。随着SG在临床实践中的广泛应用,其在mTNBC治疗中的推荐地位也在不断得到更新和确认。2024年1月,NCCN乳腺癌指南(2024. V1)对SG的使用建议进行了调整,明确指出SG可用于接受过至少1种既往治疗方案的mTNBC患者[5]。这一更新不仅为二线治疗提供了新的选择,也为后续治疗策略的制定提供了指导。
在这一背景下,本次研究的最新数据为我们补充了SG与TPC在意向治疗(ITT)人群中最终预设有效性和安全性次要结局,以及事后生物标志物分析的宝贵信息。这些数据将为医生和研究人员提供关于SG在实际应用中疗效和安全性的重要信息,也为未来mTNBC的个性化治疗提供了科学依据。
疗效突破
OS数据亮眼,为SG靶向mTNBC蓄力添证
研究设计
ASCENT研究是一项国际、多中心、随机、对照Ⅲ期临床试验,旨在比较SG与TPC的疗效。研究纳入了529 例既往接受过至少二线化疗的mTNBC患者,按照1:1随机分组,分别接受SG(10mg/kg,第1天和第8天静脉注射,每21天一周期)或TPC(卡培他滨、艾立布林、长春瑞滨或吉西他滨)直到疾病进展或出现不可耐受的毒性。主要研究终点为独立影像评估(RECIST 1.1标准)的基线无脑转移患者的无进展生存期(PFS)。本次研究数据的更新报告了ITT人群的PFS、OS、客观缓解率 (ORR)、缓解持续时间 (DOR)、安全性,以及根据Trop-2 表达和人表皮生长因子受体 2 (HER2) 状态进行事后亚组分析的结局。
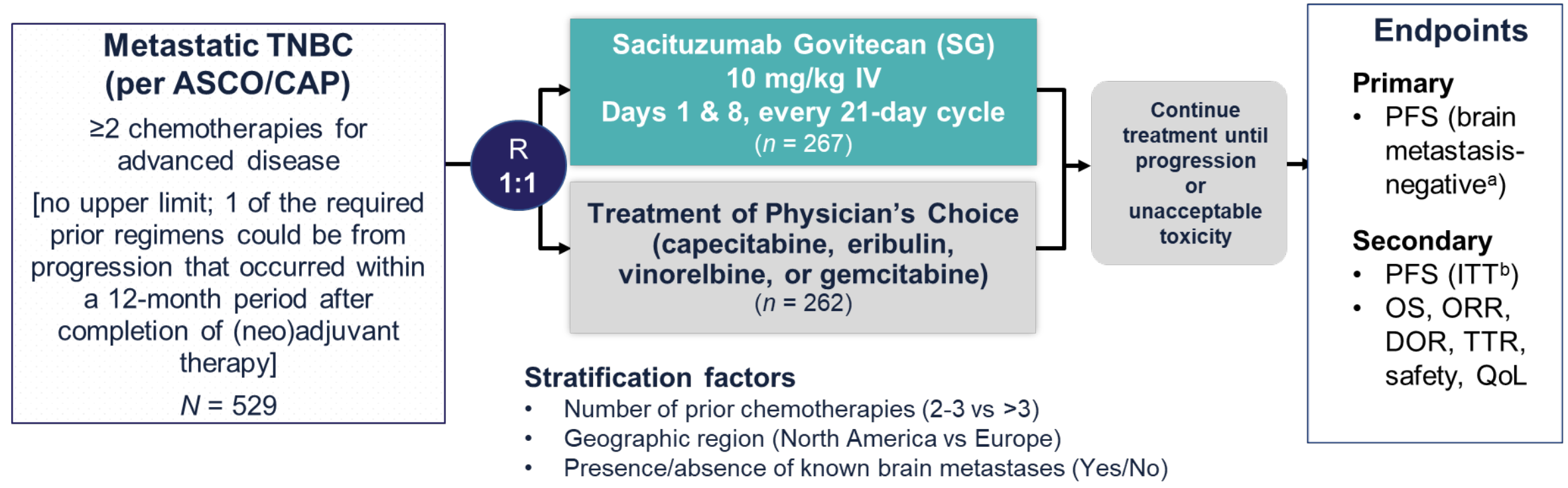
图1 研究设计
临床疗效
SG组(n=267)和TPC组(n=262)患者的中位随访时间分别为11.2个月(范围:0.3~30.8)和6.3个月(范围:0~29.4)。最常见的停药原因为疾病进展 (SG,85%;TPC,70%)。
OS成果卓越:SG在mTNBC治疗中独树一帜
在ITT人群以及无基线脑转移的主要结果人群中,最终疗效分析均一致显示,SG显著提升了患者的OS。SG治疗组的mOS达到11.8个月,而TPC组为6.9个月(HR=0.51;95% CI:0.42~0.63),SG成功降低了49%的疾病进展或死亡风险,为mTNBC患者带来了目前唯一兼具临床和统计学双重意义的OS改善。
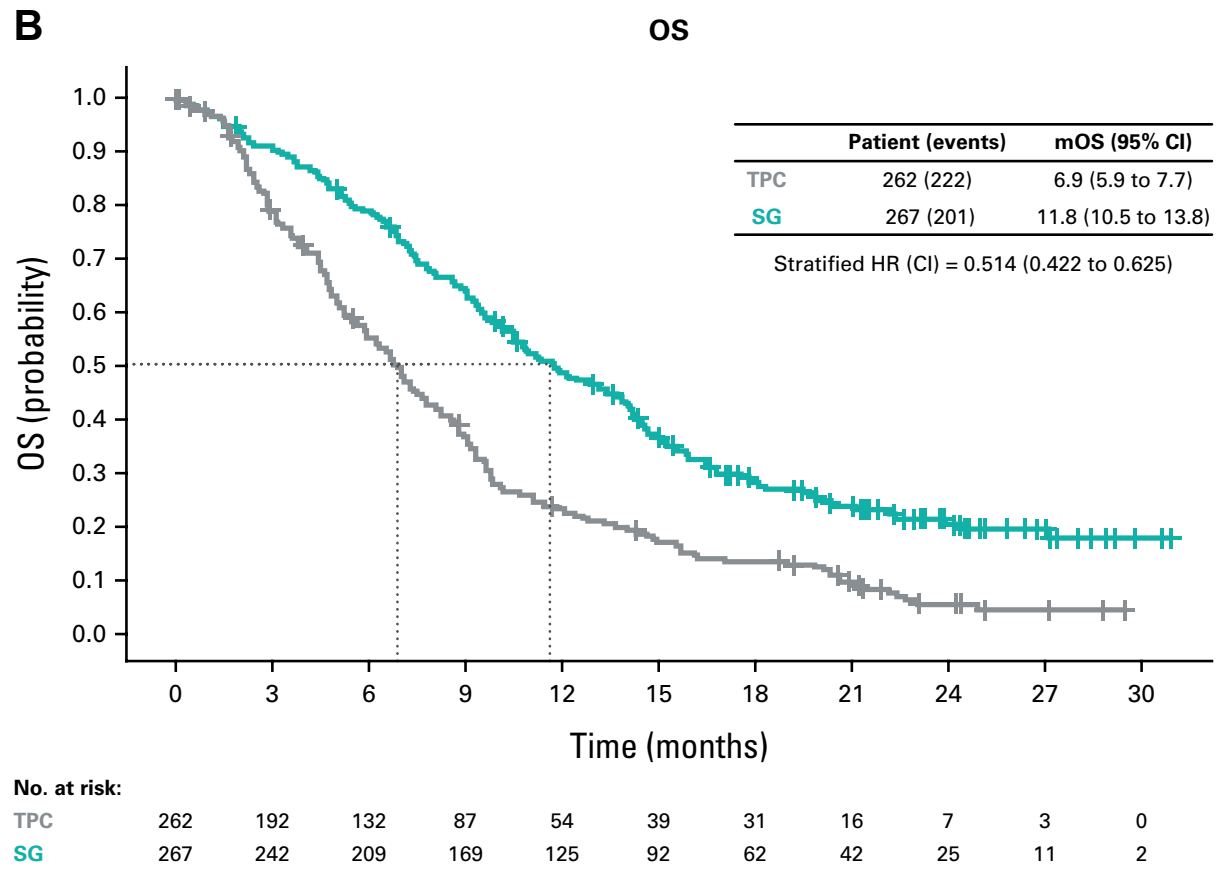
图2 ITT人群的mOS结果(Kaplan-Meier)
mPFS成果显著:SG展现持久疗效
SG在提升患者的mPFS方面取得了显著成效。ITT人群中,SG治疗组的mPFS达到4.8个月,相比之下,TPC组仅为1.7个月(HR=0.41;95% CI:0.33~0.52),彰显了SG在延长患者无病生存时间方面的显著优势。
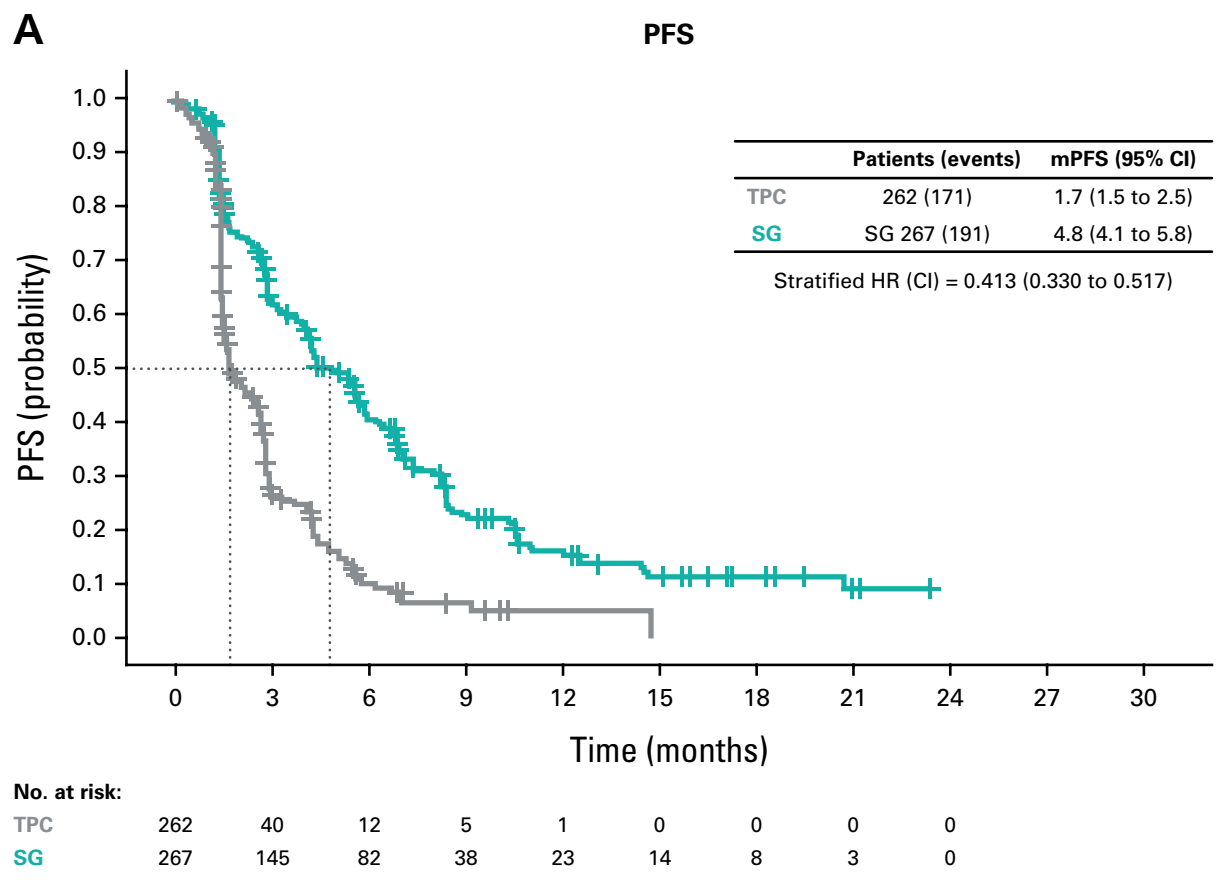
图3 ITT人群的mPFS结果(Kaplan-Meier)
Trop-2可评价人群:与ITT人群结果相当
在ITT人群中,60%的患者Trop-2染色结果可用,其中大部分患者的Trop-2表达水平为中等或高水平(定义为H评分≥130)。在Trop-2可评估的患者群体中,无论是PFS还是OS的结果,均与ITT人群的整体结果保持一致。与TPC相比,SG在所有可评估的Trop-2亚组中均显著提升了患者的mPFS,并在所有亚组中显示出改善mOS的趋势(见图4)。值得注意的是,SG在各个Trop-2表达水平上均优于TPC,且随着Trop-2表达水平的升高,这种改善效果更为显著。
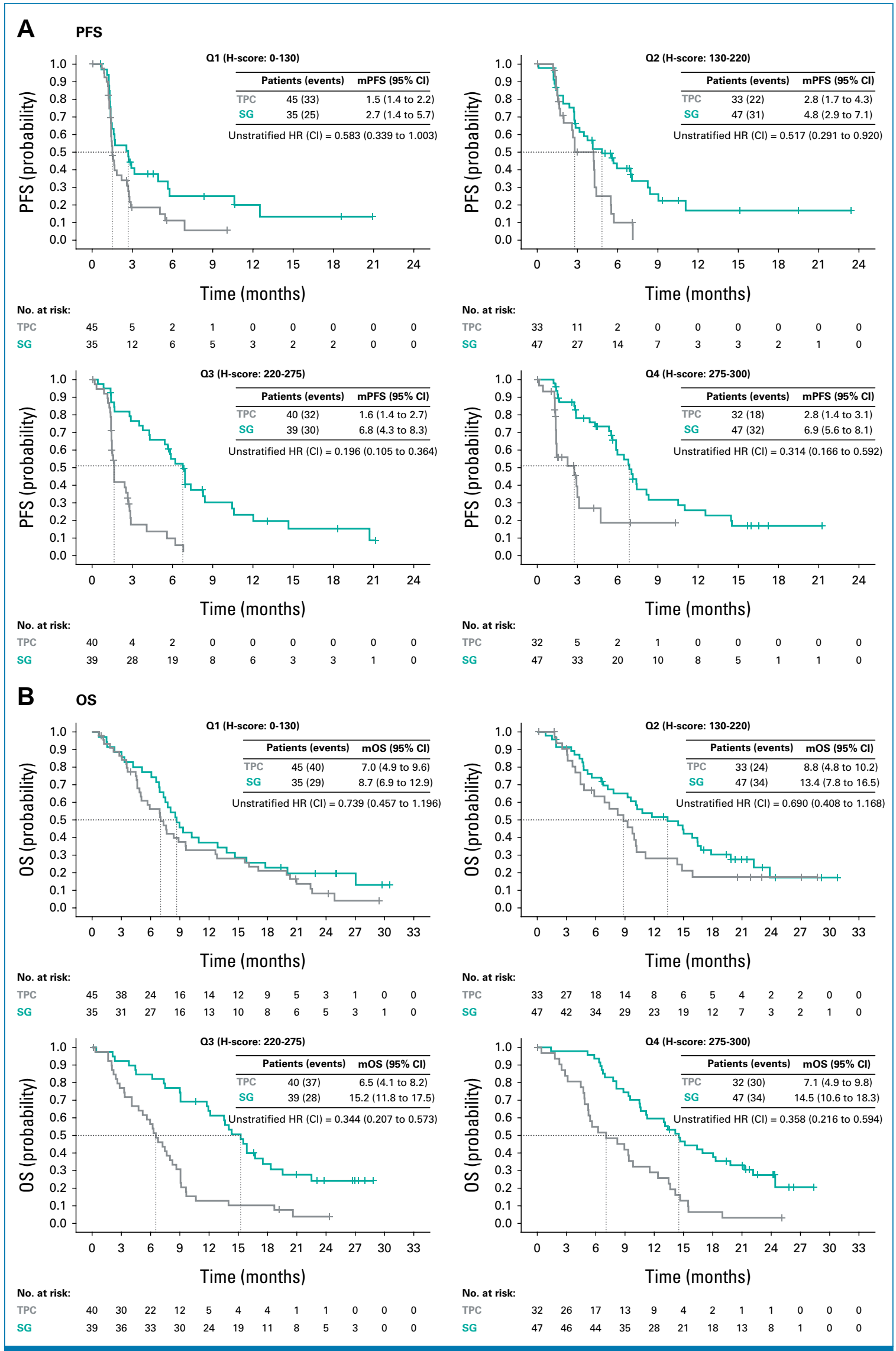
图4 按 H 评分评估的Trop-2表达可评价人群的mPFS和mOS结局
HER2 可评价人群:显示一致获益
在ITT人群中,有78%的患者可以通过IHC进行HER2评估(SG组,n = 211;TPC组,n = 204),其中71%的患者为HER2 IHC0,29%为HER2低表达。HER2可评估人群的PFS和OS与ITT人群的结果相当。SG在两个HER2表达亚组中均改善了PFS和OS。此外,SG的ORR也显著优于TPC。值得注意的是,无论HER2表达状态如何,Trop-2的表达均呈现高水平。
安全性
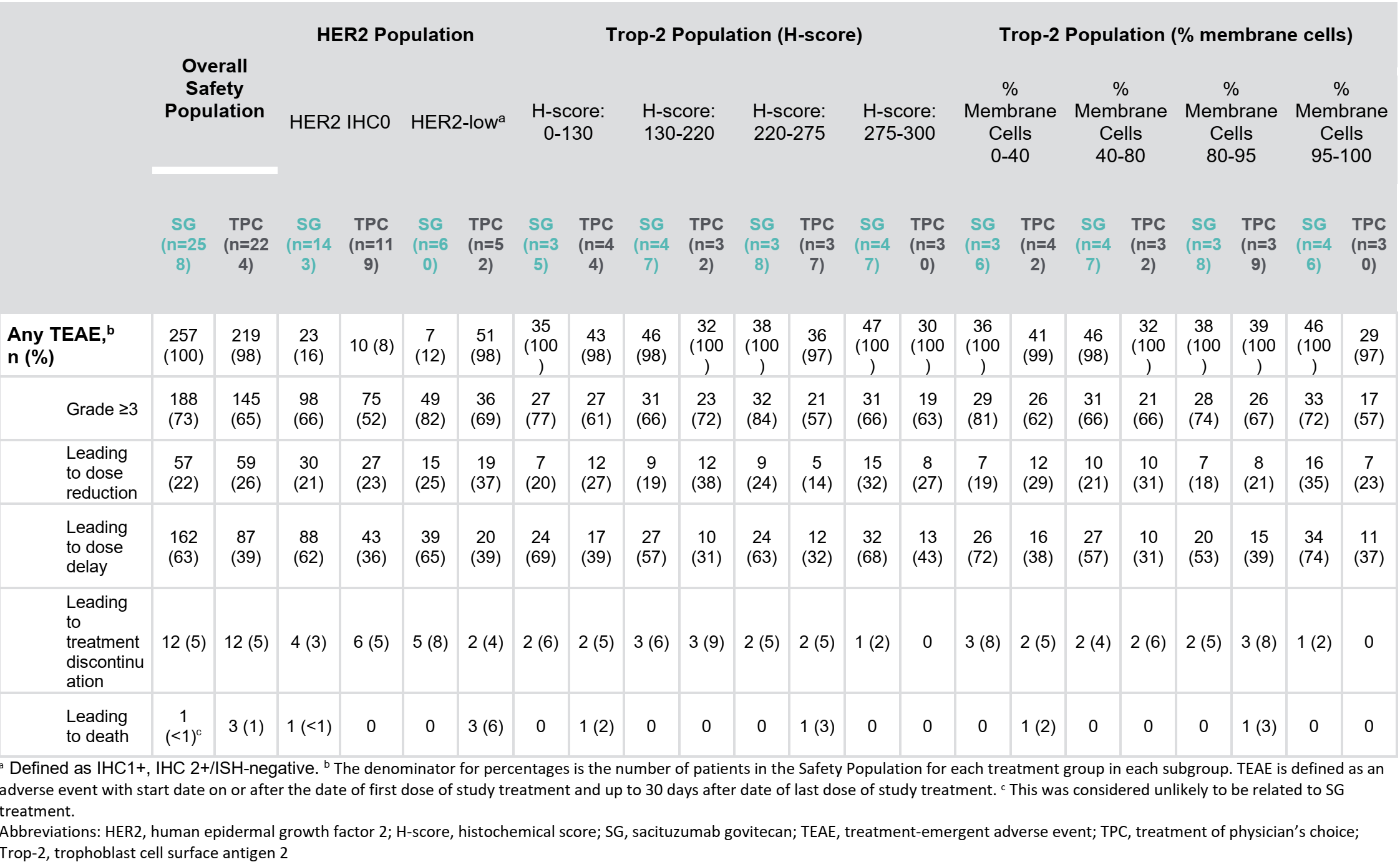
最常见的治疗相关不良事件 (TEAE)(任何级别)与既往分析结果一致(安全性人群,n = 482;SG,n = 258;TPC,n = 224)。两组的停药率 (≤5%) 相似。亚组安全性与总体安全性一致。
表1 安全性结局
专家点评
宋国红教授:mTNBC作为一种高度侵袭性的癌症,由于其独特的生物学特性,即缺乏ER、PR和HER2的表达,使得传统的内分泌治疗和HER2靶向治疗难以发挥作用。ASCENT研究的成果不仅为mTNBC的治疗带来了新的选择,而且确立了SG在这一领域的重要地位。SG在多线化疗后的mTNBC患者中显示出显著的疗效,与TPC相比,在中位PFS、OS和ORR方面均有显著提升。SG的旁观者效应、高结合亲和力和高药物-抗体比率可能是其在低Trop-2水平肿瘤中仍能发挥疗效的关键因素。此外,SG治疗的患者报告了在生活质量方面的显著改善,尽管存在中性粒细胞减少症、腹泻和白细胞减少症等不良事件。
DESTINY-Breast04研究的发现进一步扩展了我们对mTNBC治疗的认识,T-DXd在HER2低表达的mTNBC患者中也显示出显著疗效[6]。这一结果显示了在mTNBC HER2 Low人群治疗中,HER2靶向治疗的潜力。然而,目前尚需更多的研究来确定HER2靶向ADC和Trop-2靶向ADC在mTNBC治疗中的最优使用顺序。在临床实践中,应综合考虑患者的分子分型、药物的毒副反应特征以及患者的耐受性,以制定个体化的治疗策略。
ASCENT研究的更新成果不仅进一步确立了SG在mTNBC治疗中的领先地位,而且为未来的研究方向指明了新路径。SG在TNBC治疗的全方位探索中展现出其潜力,涵盖了从新辅助治疗(如NeoSTAR研究)到辅助强化治疗(如ASCENT-05和SASCIA研究),再到晚期一线治疗(如ASCENT-03和ASCENT-04研究)的各个阶段。此外,SG与免疫治疗(NCT03424005)或PARP抑制剂(NCT04039230)联合治疗TNBC的研究也在进行中。这些研究的进展和成果预期将为TNBC患者带来更为全面和个性化的治疗方案,SG有望成为TNBC全程治疗的关键药物。我们期待这些研究能够为TNBC的治疗提供坚实的循证医学基础,显著提升患者的治疗效果和生活质量。
[1] Aditya Bardia et al., Final Results From the Randomized Phase III ASCENT Clinical Trial in Metastatic Triple-Negative Breast Cancer and Association of Outcomes by Human Epidermal Growth Factor Receptor 2 and Trophoblast Cell Surface Antigen 2 Expression. JCO 0, JCO.23.01409 DOI:10.1200/JCO.23.01409.
[2] Goldenberg DM, Stein R, Sharkey RM. The emergence of trophoblast cell-surface antigen 2 (TROP-2) as a novel cancer target. Oncotarget. 2018 Jun 22;9(48):28989-29006. doi: 10.18632/oncotarget.25615.
[3] 国家卫生建康委合理用药委员会. 新型抗肿瘤药物临床应用指导原则(2023年版). http://www.nhc.gov.cn/yzygj/s7659/202401/48be6030a029446c93b852bfd4a5fdf6.shtml.
[4] 注射用戈沙妥珠单抗说明书.
[5] NCCN Guidelines Version 1.2024: Invasive Breast Cancer.
[6] Shanu Modi, et al. Trastuzumab deruxtecan (T-DXd) versus treatment of physician’s choice(TPC)in patients(pts)with HER2-low unresectable and/or metastatic breast cancer(mBC):Updated survival results of the randomized, phase III DESTINY-Breast04 study.2023 ESMO Abstract#376O.
排版编辑:肿瘤资讯-老猫











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


