人工智能(AI)在乳腺癌影像及病理的诊断,骨转移或淋巴转移病灶的寻找,乳腺实质组织密度的判定中,不仅能提高医生阅片的效率及准确性,还可缓解医生的工作压力,尤其是当图像质量不佳时。AI具有强大的数据分析及模拟再现能力,被广泛运用于乳腺癌的生存期和药物反应预测、临床分期、风险及预后评估等等。AI与临床检查相结合,以无创方式展示出对乳腺癌分子亚型诊断的巨大潜力;深度学习与纳米基因组学相结合,给乳腺癌的精确诊断带来了新的可能。然而,在AI数据库的建立、来源、规模及安全性,临床实践中的验收测试、质量保证、实际操作中,如何实现AI和医疗决策支持工具的泛化特性,如何处理AI造成的错误决策和管理不善,以及如何证明AI模型长期的稳定性和安全性仍是有待解决的问题。
 周油伽,罗文婷,吴溥桢等.人工智能在乳腺癌诊断及预测模型中的应用[J].南昌大学学报(医学版),2024,64(01):81-87.DOI:10.13764/j.cnki.ncdm.2024.01.015.
周油伽,罗文婷,吴溥桢等.人工智能在乳腺癌诊断及预测模型中的应用[J].南昌大学学报(医学版),2024,64(01):81-87.DOI:10.13764/j.cnki.ncdm.2024.01.015.
乳腺癌已取代肺癌,成为世界上发病率最高的癌症[1]。乳腺癌是女性因癌症导致死亡的常见原因之一,在女性癌症病例中约占四分之一,在女性癌症死亡病例中约占六分之一[1]。乳腺癌的治疗通常包括手术切除、药物治疗、放射治疗、免疫治疗等。根据受体类型的不同,乳腺癌主要有三种亚型,而不同亚型的预后及治疗方案也有所差异,如何准确判断乳腺癌亚型等相关临床情况,是实现精准治疗的一道门槛[2]。而在乳腺癌的诊疗中,往往需要运用影像学、显微技术、分子诊断等方法,实现图像的精细分割、微观结构的细致辨别、分子表型的准确判断等,它们的发展为乳腺癌的精准治疗提供了前进动力。人工智能(artificial intelligence,AI)是指计算机学习并模拟人类的分析、决策、判断等智能行为。机器学习 (mental learning,ML)也称为深度学习(deep learning,DL)通过构建特殊算法,进行数据挖掘、学习与分析,进而不断优化改善自身的性能[3]。新型AI技术、海量计算机处理能力、一般数据采集和数据存储的广泛增长促进了科学和健康领域的融合。在癌症领域,AI已被广泛运用于医学图像处理领域,如肿瘤分割、良恶性分化、疾病检测等方面,研究者们也正在不断开发评估用于疾病检测、临床决策的AI系统[4]。AI技术的进步不仅可以提高实际临床工作中乳房成像效率、提高乳腺癌检测准确率,还可以指导乳腺癌筛查和预防策略等[5]。本文系统地阐述近年AI在乳腺癌影像学、病理诊断与治疗决策等方面的应用、潜力及其存在的局限性,并提出对该领域的展望。
AI与乳腺癌影像学
AI在乳腺 X线摄影中的应用
乳腺X线摄影指的是从X线球管发射出的X射线照射在乳腺组织上所形成的图像。在早期乳腺癌的检测、诊断、筛查等方面,乳腺X线摄影是主流的成像方式,发挥着关键作用[6]。在过去几年中,主要由DL和卷积神经网络(convolutional neural network,CNN)驱动的AI革命遍及乳腺 X 线摄影领域[7]。
AI革命为提高影像科医生阅片的效率和准确性带来了新的可能与希望。MCKINNEY等[8]评估了一种用于筛查乳腺 X线摄影的AI系统在临床实际应用中的表现。研究者们评估后发现:来自美国和英国数据集(数据来源Northwestern Medicine)中假阳性率分别减少了5.7%和1.2%,假阴性率分别减少了9.4%和2.7%。
当乳腺X线摄影图像模糊时,名回率会大大增加,癌症检测分类的准确性也会大大降低。如表1所示。ALFIFI等[9]分别使用传统卷积神经网络(traditional convolutionaI neuraI network, TCNN)和支持卷积神经网络(supported convolutionaI neual network,SCNN)的方法,克服乳腺 X线摄影中移位和缩放导致的图像模糊,使乳腺癌诊断准确率分别达到95%和92%。此外,研究者们在此基础上结合翻转旋转的方法(flipped rotation-based approach,FRbA) 考虑不同角度和方向的图像所提供的信息,发现其能够有效提高癌症分类诊断的准确性。
表1 AI在乳腺癌诊断中的应用
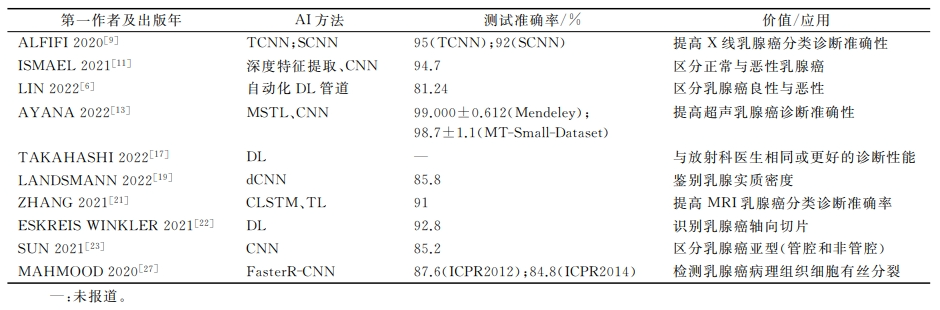
在乳腺X线摄影图像中区分病例的良恶性面临着挑战,然而,AI算法强大的信息分析处理能力,在一定程度上能够提高良、恶性诊断的准确率[10]。IMAEL等[11]利用深度特征提取、预训练CNN微调、已开发CNN模型训练等方法,对正常和恶生乳腺X线图像进行学习分类,发现乳腺癌诊断准确率可达94 7%。LIN等[6]发现一种自动化DL管道一对乳腺X线图像分类的同时标注特定钙化区域,用于乳腺癌微钙化的检测和分类。经训练后结果表明:在区分良、恶性方面,该自动化DL管道的准确率可以达到81.24%。
AI在乳腺超声中的应用
在评估乳房异常方面,乳腺超声和乳腺X线摄影被认为是极其有效的诊断工具。临床实践中大部分未被触及的乳房肿块,以及肿块穿刺过程中针尖的位置,都可以采用乳腺超声的方法检测观察[12]。基于AI的乳腺超声成像在乳腺癌的诊断准确性等方面有着巨大潜力。
2022年,AYANA 等[13]将 多 阶 段 迁 移 学 习(multistage transfer learning,MSTL)算法和CNN模型运用于乳腺超声检查。研究者们纳入20 400张癌细胞图像用于模型的预训练,并采用了200张来自Mendeley数据集和400张来自MT-Small-Dataset数据集的超声图像用于模型的模拟测试,结果显示,Mendeley模拟测试的准确率为(99.000%±0.612,MT-Small-Dataset模拟测试的准确度为(98.7±1.1)%。
2022年,O’CONNELL等[14]评估了一个帮助影像医生诊断乳腺癌的AI程序性能。该项研究纳入了299名患者的乳腺超声图像,这些图像在前期经过10名专业影像医生的审查,确保最终疾病的诊断不受其他因素干扰。将影像医生的诊断结果与AI程序的计算结果相比较后发现:AI程序在诊断乳腺病变的准确性、敏感性、特异性上可与10位专业影像医生相 美。
AI在乳腺CT中的应用
尽管乳腺X线摄影被用作筛查乳腺癌的首选工具,但受其特异性的限制,在某些情况下需要使用进一步的成像工具,计算机断层扫描(computed tomography,CT)、正电子发射断层扫描(positron emission tomography-computed tomography,PET/CT)等分子成像方式在乳腺癌的治疗和复发反应等方面具有较大优势[15]。
骨转移是乳腺癌患者常见的转移进程之一,高达75%的IV期乳腺癌患者会发生骨转移。MOREAU等[16]基于U-Net开发了一种分割乳腺癌PET/CT图像中骨和骨酪转移灶的CNN学习模式。这种模式可以通过骨骼以及骨骼病变程度计算骨骼扫描指数(bone scan index,BSI)下的PET骨骼指数(PET bone index,PBI)。经实验验证后表明:这种CNN学习模式计算的PBI与放射科医生计算结果几乎一致,它不仅提高了乳腺癌骨转移病灶检测诊断的精确度,病灶的分割也更加精细化,并提高了分割病灶的Dice评分。
AI与PET/CT的结合有助于放射科医生未来的诊断工作,减少漏诊误诊的产生。TAKAHASHI等[17]观察到多度PET最大强度投影DL模型有助于提高乳腺癌诊断准确性。经研究者们统计分析后发现:放射科医生的敏感性、DLO度模型敏感性DL4度模型敏感性分别为80%~98%、82%、96%;特异性分别为76%~92%、80%、88%。由此可见,DL4度模型具有与放射科医生相同甚至更好的诊断性能。
乳腺组织密度较高的女性患乳腺癌的风险可能会增加2到6倍,但乳腺组织密度在临床检查中很难确定[18]。有学者[19]将深度卷积神经网络(deep convolutional neural network,dCNN)运用于螺放旋乳房CT中,旨在研究dCNN对乳腺实质密度准确分类的潜力。与放射科医生读数相比,dCNN分类准确性很高(85.8%),表现出非常好的性能(AUC为0.89),并具有不同放射科医生阅片的一致性。
因此,研究者认为将所提出的dCNN实施到临床工作流程中,不仅可以减少不同放射科医生对于阅读同一乳腺组织密度图像的差异性,还可以更准确计算不同患者患乳腺癌的风险。
AI在乳腺MRI中的应用
乳腺X线摄影对乳腺组织致密的女性来说,其敏感性会有所降低。而磁共振成像(magnetic reso nance imaging,MRI)不受乳腺组织密度的影响,且对乳腺癌的检出灵敏度更高,目前已被广泛应用于临床实践[20] 。、
AI在乳腺MRI中表现出高性能的癌症检测以及病变诊断的能力,并有助于放射科医生的诊断。ZHANG等[21]将卷积长短期记忆(convolutional long short-term memory, CLSTM)与迁移学习(transfer learning,TL)相结合,开发了一个用于MRI诊断乳腺癌的AI模型。在数据集的训练模拟中发现,该模型评估的平均准确度为91%,结合TL可将乳腺瘤分类的准确率提高30%以上。ESKRE-IS WINKLER等[22]将DL方法运用于乳腺MRI图像中,研究DL是否可以识别含有肿瘤的轴向切片。验证后结果显示:DL方法通过识别轴向切片检测肿瘤的准确率达到92.8[648/706;95%CI:(89.7%,93.8%)],敏感性为892.5%,特异性为94.3%。
在过去的几年里,ML为进一步探索乳腺癌分子亚型的图像标记提供了一种流行的方法。SUN等[23]开发了一个集成CNN模型,旨在区分乳腺癌亚型(管腔和非管腔)。经测试验证后结果表明:该模型预测管腔与非管腔型乳腺癌的准确度为0.852,精度为0.961,特异性为0.958,AUC为0.867,表现出高度的可靠性和稳定性。研究者认为在乳腺癌亚型的识别方面,该模型显示出良好的应用价值和可扩展性。
AI在乳腺癌影像学方面的应用日新月异。毋庸置疑,在图像分析方面,AI会比影像科医生更有效率,AI可以在短时间内处理数百万张乳腺图像,这是影像医生无法做到的[24]。而AI凭借其强大的数据处理能力及其无限的发展潜力改变着乳腺癌影像学,AI也将成为其不可或缺的一部分,但AI并不能取代影像科医生。从法律角度来看,AI的表现远非完美无缺,AI错误决策和管理不善的处理方法仍有待商椎。同时,AI系统依托于大量临床数据,如何提高数据的安全性、保护患者的隐私也是一个亟需解决的问题。影像科医生本身具有不可替代性,他们不仅能够给患者更多的人文关怀,而且能够在多学科团队会议中花更多时间与临床医生共同商讨,为患者诊疗以及后续的长期护理做出重大贡献。
AI与乳腺癌病理诊断
治疗乳腺癌之前通常需要对患者进行活检。活检是乳腺癌检查的金标准,不同于影像学检查,乳腺组织活检使病理学家能够观察组织的微观结构。然而,分析病理组织学图像是一项耗时且具有挑战性的任务,AI的开发可以增强病理学家对病理图像的分析能力,并帮助他们完成具有挑战性的诊断任务。MERCAN等[25]利用ML方法对240例乳腺活检组织进行分类诊断。与病理学家的诊断结果相比,ML方法的敏感性和特异性不逊色于专业的病理学家,且有望运用于更具有挑战性的乳腺活检样本诊断中。ABDOLAHI等[26]设计了一种可以对浸润性导管癌(invasive ductal carcinoma, IDC)进行分类的CNN基线模型,在乳腺癌全幻灯片图像的训练测试中发现,相较于传统病理诊断的方法,将CNN基线模型运用于组织病理学图像分析中,花相对少的时间即可实现IDC的分类诊断。MAHMOOD等[27]提出一种AI多阶段的模型—— 一利用更快区域CNN(faster region convolutional neural network,FasterR-CNN)和深度CNN对乳腺癌病理组织中处于有丝分裂阶段的细胞进行检测。经数据集模拟验证后结果显示:该方法在ICPR2012的精度为0.876、召回率为0.841、F1-measure为0.858;在ICPR2014的精度为0.848、召回率为0.583 F1-measure为0.691,其准确性和可靠性方面均优于其他方法。
AI在乳腺癌病理学领域的应用正在逐步增加,其表现可以与人类专家相婉美。AI不仅可以减少病理学家的工作量,还可以提高病理学家诊断的准确性,甚至有可能代替一些昂贵的多基因检测工具来预测乳腺癌。但是,目前AI在病理学上的局限性及其面临的巨大挑战也是不容忽视:其一是如何解释和理解AI模型制定临床决策的过程;其二是如何实现AI模型和医疗决策支持工具的泛化特性;其三是如何证明AI模型长期的稳定性和安全性并让病理学家使用它们。
AI与乳腺癌筛查和早期检测
乳腺X线摄影因其图像清晰度高、对比度好、层次丰富等优点成为乳腺癌筛查中最简便的方法之一[28],使用乳腺X线摄影筛查对乳腺癌进行筛查和早期诊断可使乳腺癌患者死亡率降低20%~49%,但主要困境之一在于普及X线筛查乳腺癌的同时,给影像科医生带来了大量的工作量,并且其中绝大多数结果为真阴性。随着AI技术广泛应用于医学,部分技术及诊断问题得以有效解决[29]。
被认为是乳腺癌筛查智能小助手的U-Net分割神经网络AI系统,在确定乳腺癌形态、病灶外钙化和腺内淋巴结的准确性方面并不比放射科医生差[29]。DEMBROWER等[30]观察到,在保证乳腺癌检出准确率、特异性、精确度的同时,使用AI软件检测筛查乳腺癌,有效地减少了放射科医生的工作量。BARI等[31]介绍了一种用于早期乳腺癌检测的UWB系统。经研究者们评估后可见,在该UWB系统检测乳腺癌大小的性能效率约为92.43%;检测乳腺癌位置的性能效率约为91.31%。GUO等[32]采用多层感知器神经网络(multilayer perceptron neural networks,MLP)的同质集成方法对乳腺癌样本进行分类。实验结果表明,与其他先进的乳腺癌样本分类方法相比较,该方法在乳腺癌数据集中的检测率表现更好,约为98.79%。
在AI广泛应用于乳腺癌筛查领域的同时,AI辅助疾病诊断仍存在着一些涉及社会伦理,法律、经济等方面的问题。其中包括AI在实际应用中,社会伦理的关注及内在影响;将癌症筛查与决策委托给AI模型,造成非预期结果的责任归属方;普及AI模型进行乳腺癌筛查带来的经济负担等。这些问题需要在开发乳腺癌筛查AI模型的早期阶段进行探讨,为其远期发展夯实基础[24]。
AI与乳腺癌预测模型
乳腺癌生存预测模型
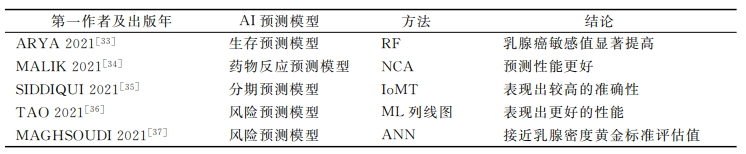
拥有丰富经验的专业医疗人员在预测、治疗IDC等方面面临着挑战———从多个大型丰富的数据源获取所需的相关信息对人类来说是一项复杂的工作。近年来,ML方法在癌症生存分析中的使用频率大幅度增加,这些方法在预测癌症存活率方面优于传统方法。如表2所示。ARYA等[33]利用随机森林(random forest,RF)分类方法构建DL模型,旨在利用多模态数据发现信息特征,提高乳腺癌预测的准确性。在数据集模拟测试中可见,相较其他现有方法,DL模型在乳腺癌患者的生存期估计中,其敏感值显著提高。
表2 乳腺癌AI预测模型
乳腺癌药物反应预测模型
MALIK等[34]采用邻域成分分析(neighborhood component analysis,NCA)神经网络框架,从TCGA和GDSC数据库中检索乳腺癌相关特征基因,用于开发乳腺癌患者的药物反应预测模型。相较于单组学和早期整合方法,研究者的药物反应预测模型性能更好———准确率为94%,均 方 误 差 为1.154,总体回归值为0.92。
乳腺癌分期预测模型
与其他癌症一样,确定分期是治疗乳腺癌的重要步骤,因 此 标 准 化 的 分 期 工 具 显 得 尤 为 重 要。SIDDIQUI等[35]提出 了 一 种 基 于 医 疗 物 联 网 (Internet of medical things IoMT )的乳腺癌分期预测模型。经数据集模拟训练后,该预测模型在验证阶段的准确率为97.81%,对小叶癌、导管癌、乳头状癌、黏 液 癌 检 测 准 确 率 分 别 为99.32%、99.69%、99.32%、98.96%。实验结果表明,IoMT云端预测模型对乳腺癌不同阶段的智能预测表现出较高的准确性。
乳腺癌风险预测模型
风险模型一直支持着风险调整后的筛查和预防,它的持续发展一直是乳腺癌研究的核心支柱。TAO 等[36]通过开发多参数MRIML列线图模型来预测乳腺癌的风险。通过提取图像的高通量特征,经校准 曲 线 和 决 策 曲 线 进 行 验 证 得 出 该 模 型AUC为0.90。MAGHSOUDI等[37]将人工神经网络(artificical neural network,ANN)与放射组学相结合,构建了用于乳腺癌风险评估的Deep-LIBRA模型。研究者们从宾夕法尼亚大学医院及梅奥医学中心获取原始的乳腺FFDM图像数据,用于该模型的测试。为实现对乳房密度的精确评估,Deep-LIBRA模型首先利用2个二元分割U-Net,用于去除图像中的背景及胸肌等干扰因素。进一步,Deep-LIBRA进行图像乳房分割,并对分割后的乳房区域进行乳房密度评估,基于乳房密度进行乳腺癌的风险评估。测试结果显示,二元分割U-Net更好地解决了输入图像中强度变化的问题,并消除了不可预测的伪影。此外,Deep-LIBRA与乳腺组织密度黄金标准评估值一致,相较于传统的人工评估,该模型也具有更好的乳腺癌风险评估性能,AUC为0.612。
对现有数据的分析、识别为开发乳腺癌AI预测模型提供了独特的可能性。但是,在乳腺癌AI预测模型发展过程中仍存在一些问题:其中一个主要的问题是开发的AI预测模型是否可以应用于实际患者群体,不同亚型的乳腺癌可能具有不同的遗传标记,不同人群卒中危险因素的分布也可能会影响AI模型在不同情况下的适用性。同时,数据输入的局限性,极大程度上也会影响AI模型预测结果的准确性。此外,乳腺癌的各种危险因素可能是相互依赖的,如何联系宏观图像与微观分子对乳腺癌风险进行准确评估也是有待考究的一个问题。
AI在乳腺癌其他方面的应用
利用AI实现个性化的乳腺癌放射治疗在节省时间、提高诊疗一致性、辐射剂量分布的自动规划等方面具有较大价值[38]。基于BPNN算法对超声图像分割在乳腺癌腋窝淋巴结转移方面有较好的诊断效果[39]。ML与自动分析纳米基因组学相结合构建的乳腺肿瘤亚型相关模型,给乳腺癌的诊断带来了新的可能[40]。AI工具提供了一种方案来标准化乳腺癌免疫疗法临床实践中的肿瘤浸润免疫细胞评分[41]。将AI算法运用于乳腺癌无病生存的预后评估可行性较好[42]。通过评估Ki-67LI来判断乳腺癌恶性程度及患者预后时,AI有较好的重复性,得出的真实值也更接近“金标准”,是评估Ki-67LI重复性的首选方法[43]。
总结与展望
AI在乳腺癌领域的运用不论是从微观的分子诊断,还是从宏观的X线、CT、超声等诊断,不论是从个性化的乳腺癌治疗方式还是从群体的乳腺癌筛查、预测模型的构建来看,都展现出其广阔前景。AI不存在情绪问题、疲劳、文化和道德信仰。利用人类思维处理大量数据和可用信息的能力是极其有限的,通过AI做出最佳决策是帮助医生快速诊断和探索致癌因素的绝佳工具。与此同时,它存在的局限性和面临的巨大挑战接踵而来。数据库的建立、来源、规模及安全性等;临床实践中的验收测试、质量保证、实施和操作的有效性和安全性等;诊断治疗决策中可能触及有关患者人身生命和健康安全法律等问题都是AI在乳腺癌诊断及治疗决策等未来道路上亟需解决的问题。但这些问题将在相关领域的研究者们对AI应用于临床疾病诊疗的进一步研究中得到更加深入的讨论。
略











 苏公网安备32059002004080号
苏公网安备32059002004080号


