人表皮生长因子2(HER-2)低表达乳腺癌为免疫组化(IHC)评分1+或2+且原位杂交(ISH)阴性的乳腺癌。既往对HER-2患者的二分类法及传统HER-2靶向药物的局限性,使这类人群未受到较多关注。随着Destiny-Breast04(DB-04)研究结果的揭示,抗体偶联药物(ADC)(DS-8201)对晚期HER-2低表达乳腺癌患者的效果得到肯定,为HER-2低表达患者的治疗及预后提供更多可能。现有的评估标准、检测方法对准确识别该类患者存在一定限度。HER-2低表达乳腺癌能否成为独立生物学实体,HER-2评估指标对指导预后及治疗等方面的意义仍存在争议。HER-2低阳性表达的早期乳腺癌患者的预后亦倍受关注,既往回顾性研究结果并不一致,值得进一步探究。本文系统性回顾了HER-2低表达早期乳腺癌的研究进展、临床病理特征、系统治疗反应、预后及未来探索方向。

邢琳,史晋宇,王斐等.HER-2低表达早期乳腺癌研究进展[J].暨南大学学报(自然科学与医学版),2023,44(06):576-585.
ADC药物的深入研发为HER-2低表达乳腺癌患者的生存带来新希望,当前相关研究逐渐增加,但结果未达成一致,HER-2检测的规范化及标准化也待改进,截至2023年5月,本研究以“乳腺癌”“HER-2低表达”“预后” “临床病理学特征”为关键词在PubMed、医知网、知网中检索相关文献,最终22篇研究适合纳入分析(表 1),其中包括2篇荟萃分析,在此基础上对HER-2低表达早期乳腺癌临床病理学特征、研究进展及面临的挑战等方面进行综述。
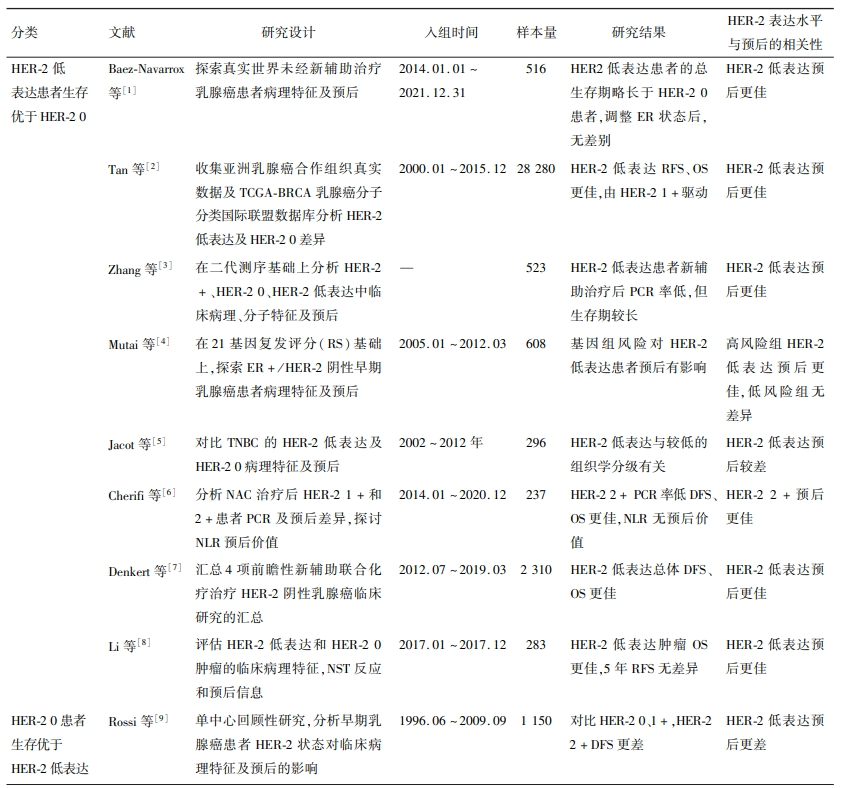
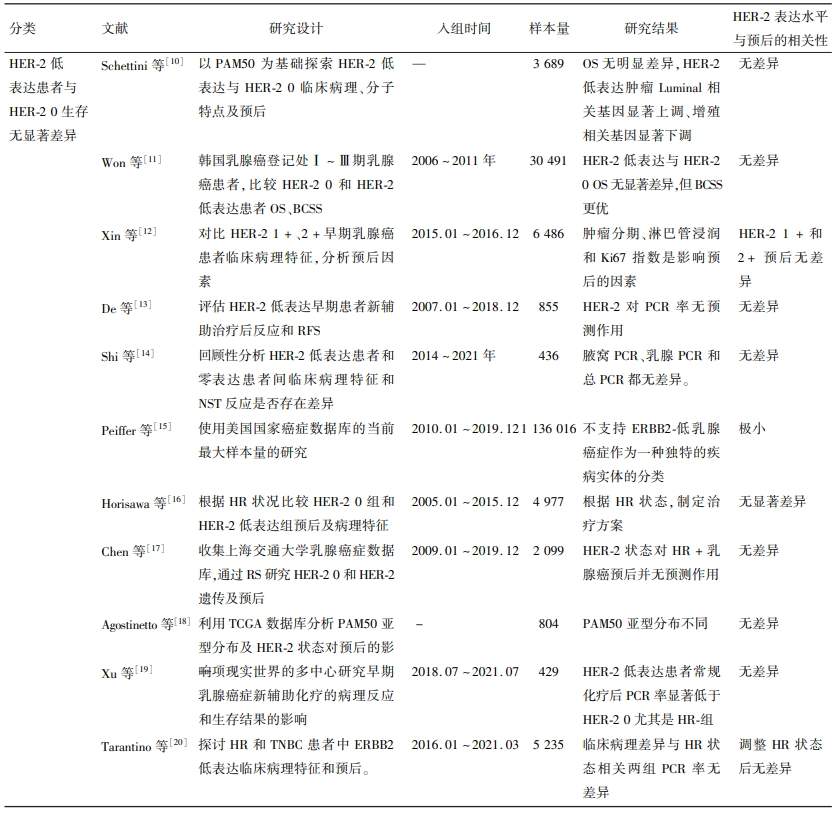
表1 HER-2低表达乳腺癌相关文章汇总
HER-2低表达乳腺癌的定义及类型分布
人表皮生长因子(human epidermal growth factor receptor 2,HER-2)低表达乳腺癌被定义为免疫组化(immunohistochemnical, IHC)评分HER-2 IHC1+或IHC2+且原位杂交(in situ hybridization, ISH)阴性的乳腺癌(图1)[21],这种乳腺癌的新定义挑战了传统HER-2表达二分类法[22] 。分别将HER-2 IHC 0、HER-2 IHC 1+、HER-2 IHC 2+ 、HER-2 IHC 3+简写为HER-2 0、HER-2 1+、HER-2 2+、HER-2 3+。当前通过IHC结合ISH及类型将HER-2表达患者分为阴性和阳性人群(占15%~20%)[23],新定义的HER-2低表达人群占比45%~55%[20],在传统分型中被定义为HER-2阴性。其肿瘤细胞表面有不同程度的HER-2蛋白表达[24],这也为HER-2低表达患者从新型抗体偶联药物(antibody drug conjugate,ADC)类药物(DS-8201)中获益奠定基础。传统抗HER-2靶向药物的出现彻底改变了HER-2阳性患者的生存现状[25],但此类药物对于HER-2低表达患者的疗效并不显著[26]。新兴的以DS-8201为代表的ADC类药物由高度膜可渗透有效载荷连接物与强效拓扑异构酶I抑制剂制成,通过旁杀伤效应在HER-2低表达患者中发挥作用[27] 。 Jerusalem等[28]的研究结果证实了DS-8201对晚期HER-2低表达乳腺癌患者的疗效,也为HER-2低表达早期患者的治疗及生存带来新的希望。HER-2表达状态评估标准是否需要进一步完善,该群体能否成为独立的生物学实体仍存在争议。 当前研究纳入人群及研究方法各异,结果未达成一致。
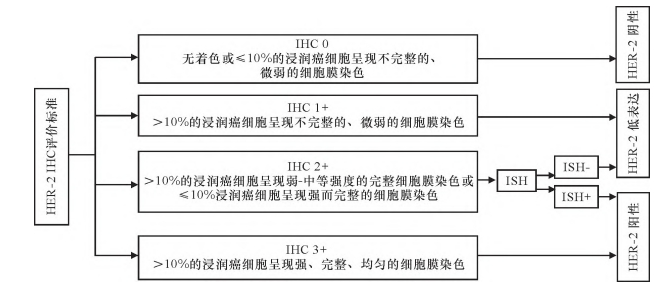
图1 HER-2 IHC 评价标准[21]
HER-2低表达早期乳腺癌病理特征及预后
当前关于HER-2低表达早期乳腺癌研究较少,临床病理特征并不一致。多数研究中HER-2低表达人群占比为45%~55%[20],目前已知最大样本量研究中,HER-2低表达乳腺癌患者占纳入1 136 016名患者的65.5%。激素受体(hormone receptors,HR)表达增高与HER-2低表达发病率增高相关(ER-/PR-发病率为51.5%、ER-/PR+为58.6%、ER+/PR-为66.1%、ER+/PR+为69.1%),HR及其相关基因可能是HR+/HER-2低表达肿瘤的主要驱动因素[15]。3项根据HR状态分组的研究中,HER-2 1+、2+肿瘤在HR+人群中高于HR-人群[2-4]。 一项早期三阴性乳腺癌(triple negative breast cancer,TNBC)患者及Won等[5,11]的研究中,HER-2低表达患者占比低,可能与激素受体状态、HER-2 IHC检测试剂盒不同及ISH检测信息缺失未进行中心病理回顾相关[7-8]。多篇研究中乳腺癌患者临床病理特征因HER-2表达不同而存在差异。两项根据HR状态分组的研究显示:与HR-/HER-2低表达相比,HR+/HER-2低表达乳腺癌患者有更好的T分期、组织学分级[16] 。另有研究指出与HR-/HER-2 0组相比,HR+/HER-2 0组原位癌少、组织学分级高,但无统计学差异[11];在未根据HR状态分组的研究中:原发肿瘤体积、肿瘤分期、组织学分级、Ki-67评分、腋窝淋巴结受累、HR+比例、导管原位癌数量、年龄、肿瘤浸润淋巴细胞(tumor infiltrating Iymphocytes,TILS)水平、种族都作为危险因素出现过,尽管有些影响因素无统计学差异,但可以看出无论HR状态,HER-20表达组较HER-2低表达组有更多不良预后因素,这与Ergun等[29]包含636 535名患者的荟萃分析结果相似。HER-2 0表达肿瘤有更多的危险因素及不良临床病理特征,HR+/HER-2低表达亚组有更特殊的生物学背景,未来需要深入的研究证实。
Schettini等[10]纳入3 689名患者的以PAM50为基础的回顾性研究显示:HR+/HER-2低表达组中最常见的是Luminal型,且表达量与IHC呈正相关,与HER-2 0肿瘤相比,HER-2低表达肿瘤中Luminal相关基因显著上调,Basal-like基因和增殖相关基因显著下调。该研究认为HR+/HER-2低表达肿瘤是一种更为独特的生物学实体,认同HR+/HER-2 2+的生物特殊性。另一项使用PAM50的研究中,最具代表性的亚型也是Luminal A、Luminal B,且相比HR-/HER-2低表达组,HR+/HER-2低表达组与HR+/HER-2 0组更相似。在该研究中酪氨酸激酶受体2(ERBB2)表达与HER-2表达呈正相关,HER2-/HR-肿瘤ERBB2表达最低[18]。
近年使用二代测序的研究发现[3],HER-2低表达患者主要由Luminal B肿瘤(58.9%)和Luminal A肿瘤(28.6%)组成,TP53、PIK3CA是2个最常见的突变基因,HER-2低表达肿瘤在PI3K-Akt信号传导中的突变明显增多,HER-20表达肿瘤在检查点因子(P<0.01)、Fanconi贫血(P<0.05)、p53信号传导和细胞周期途径(P<0.05)方面有更多突变。Denkert等[7]发现,HR+肿瘤患者中HER-2 0表达与HER-2低表达间仅有TP53突变的患病率存在显著差异,而HR-亚组之间均未见显著差异。胚系BRCA1/2基因变异及11个选定的乳腺癌易感基因的胚系变异数据中:无论HR状态,HER-2 0肿瘤的突变率明显高于HER-2低表达肿瘤,这可能代表两者有不同的遗传背景。但Jacout等[5]关于早期TNBC乳腺癌患者的研究中,与HER-2 0肿瘤相比,HER-2低表达肿瘤生物标志物(BRCA1启动子、高甲基化、PIK3CA突变、PTEN缺失、CXCR2水平)间并未发现统计学相关性。在一项TCGABRCA和METABRIC联合队列研究中发现[2]:ERBB2mRNA表达水平越高,HER-2 IHC评分和ERBB2拷贝数变异(copy number variation,CNV)评分越高,HER-2 IHC与CNV评分之间存在微弱的正相关,与HR状态无关,只是HR-组中HER-2 IHC和CNV评分之间没有显著相关性。综合以上研究结果,与HER-2低表达相比,HER-2 0肿瘤增殖基因及Basal-like基因显著上调,且有更多的突变位点及基因变异,这也从基因层面解释HER-2 0表达组更多的危险因素。
Mutai等[13]的单中心回顾性研究以21基因复发评分为基础,聚焦于ER+/HER-2 0表达早期乳腺癌患者,其中HER-2低表达患者在高、低风险组占比相当。在低风险组,浸润性小叶癌在HER-20疾病中的患病率(17%)显著高于HER-2低表达疾病(8%),考虑其与小叶型是仅次于导管癌的最常见亚型相关,此分型约占所有浸润性乳腺癌的10%~15%,典型的小叶癌几乎完全是ER+/HER-2-患者,这一发现也支持HER-2低表达和HER-2 0表达是不同生物学实体的假设[30],其他病理特征及长期预后与HER-2表达无关。另一篇使用21基因复发评分的研究也发现HER-2低表达与ER高表达(>90%)呈正相关,且HER-2表达和ER mRNA水平之间有重要相关性[17]。
多项研究探讨了HER-2低表达人群的预后因素,结果并不一致。大部分研究支持HER-2低表达早期乳腺癌对预后的预测因素,Tan等[2] ABCCG队列中发现,无论HR状态,HER-2低表达是预后的独立因素,且主要由HER-2 1+患者驱动,其总生存期(overall survival,OS)及无复发生存期(relapse free survival,RFS)都优于HER-2 0患者。另一项研究中,HER-2低表达较HER-2 0表达患者OS无显著差异,但HER-2低表达患者具有更好的乳腺癌特异性生存期(breast cancer specific survival, BCSS)。2项荟萃分析也发现,无论HR状态,早期乳腺癌中HER-2低表达肿瘤具有更好的生存结果[29,31] 。Denkert等[7]的前瞻性研究中HER-2低表达肿瘤患者的生存期明显长于HER-2 0肿瘤,特别在HR-患者中差异显著。通过建立复发风险预测模型的研究中:HER-2 1+和2+组间预后无显著差异,肿瘤负荷和侵袭性是HER-2低表达乳腺癌重要预后因素[12]。但另一项研究中,与HER-2 0/1+相比,HER-2 2+肿瘤的RFS似乎更差的结果[6] 。较早期的研究也发现HER-2状态是无病生存期(disease-free survival, DFS)的独立预测因子,与HER-2 0、1+以及接受曲妥珠单抗治疗的HER-2阳性患者相比,HER-2 2+群体有更差的DFS,迟发DFS事件率较高[9] 。Loi等[32]的研究还发现ER和HER-2之间存在双向串扰,内分泌治疗可能会收到干扰,后续有待进一步探讨[33]。Muta等[4]认为HER-2低表达对早期Luminal型乳腺癌的预后因21基因组风险的不同而存在差异,在高基因组风险的女性中虽两组患者临床病理特征相似,但HER-2低表达比HER-2阴性患者有更好的10年0S(89% vs 68%)、DFS(80% vs 59%)和远处无病生存(distant disease free survival,DDFS)(86% vs 59%),无论是否给予辅助化疗。在低基因组风险患者中:HER-2低表达与DFS改善独立相关。但未对HER-2表达程度进行细分,HER-2 2+患者数量也相对有限,无法明确不同强度HER-2表达是否具有预后意义。Chen等[17]的研究中无论是否抑制卵巢功能或化疗,临床病理特征、基因表达、DFS相似(92.3% vs 93.3%,P=0.83)。21基因复发评分和增殖模型仅在预测HER-2 0患者DFS方面显著(P=0.03)。另外Ki-67蛋白表达及其mRNA在预测HER-2低表达肿瘤预后中也未达成一致,Ki-57阅值共识的缺乏会影响其预后可靠性[34-35]。 美国已知最大样本量(831 645)研究中,ERBB-2低表达与生存率虽呈正相关,但差异极小(aHR,0.98;95%CI:0.97~0.99;P<0.001),低表达与HER-2阴性患者治疗反应、长期结果可能相似,不支持将ERBB-2低表达乳腺癌症归为一种独特的生物学实体,该研究虽能反映美国各地大多数癌症情况,但仅分析OS数据[15]。
多项研究中HER-2低表达与HER-2阴性患者临床病理特征不同,但预后无差异。可见病理特征的差异并不影响生存结果,除随访时间短、样本量少、单中心及回顾性研究等因素外,考虑可能与研究的终点事件相关:在3项[1,10,11]只使用OS作为终点事件的研究中,HER-2低表达状态不能指导预后,包含DFS、RFS等其他终点事件时,大多数研究支持HER-2低表达预测作用,这可能与缺乏HER-2低表达状态与癌症特异性预后相关,特别是在HR+队列中,生存率可能滞后于复发多年。当前各研究终点事件不同,HER-2低表达能否指导预后尚未达成一致。
HER-2低表达早期乳腺癌对新辅助治疗的反应
当前HER-2低表达早期乳腺癌对于新辅助治疗反应研究结果不一致,但HER-2低表达肿瘤病理完全缓解(pathologic complete response,pCR)率总体较低[6,8,13-15,19]。
一项855例患者的研究中,使用蒽环类药物行新辅助化疗(neoadjuvant chemotherapy, NAC)后pCR无统计学差异[13](Lumina1/HER-2低表达 vs HER-2阴性为13% vs 9.5%,P =0.27;TNBC/HER-2低表达 vs HER-2阴性为51% vs 47%,P= 0.64),HER-2低表达与RFS无关(HR=0.83,95%CI:0.6~1.11,P=0.21),该研究不认为HER-2低表达可以作为一种独特生物学亚型,对生存结果没有预后价值。另一项接受紫杉烷和葱环类药物行新辅助全身治疗(neoadjuvant systemic therapy,NST)的研究结果相似,无论根据HER-2 IHC状态还是HR状态分组,HER-2低表达与HER-2阴性肿瘤的腋窝PCR、乳L腺pCR和总pCR都无差异且PCR率显著低于先前研究(HER-2阴性 vs HER-2低表达为14.6% vs 9.7%,P= 0.110),主要与大多数患者(约87%)为cN+以及CT2期及以上疾病患者有关,想实现总pCR较困难[14]。
Li等[8]的研究却认为HER-2低表达肿瘤不同于HER-2阴性肿瘤,更难实现pCR(HER-2阴性 vs HER-2低表达为9.2% vs 34.1%,P<0.01),但只在HR-亚组中观察到,HR+无差异。HER-2低表达与HER-2阴性肿瘤的5年RFS无显著差异,但OS显著延长。多变量分析表明,ypN和HER-2低表达是OS的独立预测因子。Cherifi等[6]的研究探索NST治疗后HER-2 1+和2+之间内在差异,PCR率虽无差异(P=0.77),DFS和OS则差异显著,调整变量后,HER-2低表达仍与较好的DFS和OS相关,特别是HER-2 2+组,认为HER-2低表达早期乳腺癌是一个独特的生物实体。HER-2 2+是新辅助治疗后肿瘤复发和生存的独立阳性预测标志物。HR+的高表达解释了低于TNBC或HER-2阳性肿瘤预期的pCR率。Tarantino等[36]的研究中,接受NAC后ERBB2-0肿瘤患者的pCR率较高(26.8% vs 16.6%,P= 0.002)。然而,当根据HR状态进行亚组分析时,两组间pCR 率差异无统计学意义。另一项研究与之结果相似,不同的是,在使用葱环类和紫杉烷为首选的新辅助化疗后,HER-2低表达患者pCR率显著低于HER-2阴性患者(5.2% vs 14.2%,P=0.002),尤其在HR-组中(11.9% vs 25.9%,P=0.045)[19] 。Peiffer等[15]的研究中,虽在总人群、ER+人群、ER-/PR-亚群中,与ERBB-2阴性状态相比,ERBB-2低表达pCR降低(aOR= 0.89;95%C1:0.86~0.92;P<0.001),但多变量分析表明,该差异与ER表达相关。在纳入2 310例患者的前瞻性研究中[7],HR+/HER-2低表达新辅助治疗后pCR率低,HER-2 1+与2+都无任何差异。HR-亚组中HER-2低表达尚未达到pCR,肿瘤的预后优于HER-2 0,但是这种预后仍比病理完全缓解的患者预后差很多。
相关文献的研究中,HER-2低表达患者pCR率低较为一致,这与HER-2低表达人群HR+比例高、有较少的危险因素、更少的基因突变及随访时间等密切相关。HER-2低表达状态可以为PCR的多变量或多组模型提供帮助,但不应影响当前标准的新辅助治疗方案。
存在的问题与未来探索方向
HER-2低表达乳腺癌是当前研究热点,目前的研究仍存在一定局限性。HER-2低表达肿瘤在时间和空间都具有异质性,HER-2表达状态在疾病演进过程中也不稳定。一项547例经组织学检测确认为局部复发或远处转移的乳腺癌患者的研究[37]中,使用IHC方法评估HER-2状态从原发肿瘤到复发转移病灶的演变。复发乳腺癌样本中HER-2低表达肿瘤的比例高于原发肿瘤,HER-2表达不一致率为38.0%,主要体现在HER-2低表达和HER-2阴性的相互转换中,该研究还发现,在HER-2阴性病例中,无论局部复发远处转移,还是不同转移部位,复发时HER-2表达都不受样本获得方式的影响,不同解剖部位之间无明显差异。当评估原发肿瘤HER-2表达时穿刺活检较手术活检标本HER-2低表达比率更高。Tarantino等[38]的研究也发现HER-2表达在乳腺癌的疾病进程中是动态变化的,可能在病程晚期富集。临床前研究也指出,早期给予化疗和放疗可以诱导癌症细胞HER-2蛋白表达上调,增加其表达[39-40]。
目前缺乏HER-2低表达的标准检测方法,主要通过半定量IHC方法识别HER-2低表达肿瘤检测过程对HER-2染色强度有影响,以此评估该类人群近期pCR率或长期的生存结局,不同研究的结果并不一致。若新型抗HER-2药物用于HER-2低表达肿瘤治疗,需要筛选更准确的检测方法增加特异性和敏感性确保复发样本的可靠性,也为原发HER-20表达肿瘤提供新的治疗选择。几种新的定量分析方法正在开发,例如,HER mark技术通过基于接近度的抗体结合荧光标签的释放来测量HER-2表达[41];定量IHC技术将抗体/抗原复合物转化后计数以量化HER-2表达[42];时间分辨荧光能量转移技术能够通过检测由两个非常接近的荧光团发射的荧光来评估HER-2表达[43]。如果得到验证,这些检测可以提高临床识别HER-2低表达患者的能力。
美国临床肿瘤学会(ASCO)/美国病理学家学会(CAP)指南对于IHC的边界值仍在不断调整,当前大多数研究缺乏通过IHC对HER-2状态的集中评估,可能由于不同机构中HER-低表达疾病的比例不同。既往对于HER-2低表达人群的忽视也使HER-2 0与1+人群界限模糊,常将二者合并一起报告。另有部分HER-2 2+的患者并未行ISH检测,HER-2诊断及检测标准的标准化是临床实践中做出正确治疗决策的重要基础,必须要建立检测标准流程。
大型研究中,样本来自不同数据库,有不同的纳入及排除标准,部分早期乳腺癌研究中混杂有转移性疾病患者,且大多数研究时间跨度大,部分随访信息不准确。而单中心研究中,虽在某种程度上避免了各数据库间异质性,但小样本量、种族单一、缺乏长期随访结果等问题同样对实验结果造成影响。且大多数为回顾性队列研究,该类研究通过对既往病例的回顾、总结特点、入组患者的预先干预较少,容易对研究结果造成影响。但在极少数的前瞻性研究中,得到了较为理想的结果。由此可见,即使在前瞻性研究中,无论是临床病例特点还是基因表达方面,都支持HER-2低表达与HER-2 0存在差异。
若新的HER-2评分系统建立,需要开发诸如自动化定量分析技术、HER mark技术等新定量测定方法来提高HER-2评估敏感性,若验证成功可提高识别HER-2低表达肿瘤的能力。随着科技的发展,机器学习进入科研领域,Xin等[12]研究中复发风险预测模型的建立以及森林算法的使用可有效平衡混杂因素,避免多中心、大数据量及数据分布不均匀对实验结果产生的影响,科学的数据分析模型,提高了研究的准确性,对复发风险预测方面有良好的临床参考价值。
综上所述,HER-2低表达乳腺癌患者占比高,须对传统HER-2二分类法进行反思,这类患者有迫切的治疗需求,其预后也值得关注。鉴于当前此类研究较少且多为回顾性研究,临床病理特征并不一致,但无论HR状态,HER-2低表达有更少的不良预后病理特征,与Luminal基因上调、增殖基因下调、更多的突变位点相关,也解释了较低的pCR率。随访时间越长、终点事件与乳腺癌越相关,预后数据往往越好。ER+/HER-2低表达是较为特殊的亚组,这也引发了ER在HER-2低表达人群中作用的探讨,后续有待进一步研究。若新型ADC类药物在HER-2低表达肿瘤中的疗效被证实,亟须更精准的HER-2检测及分类方法来指导治疗。
略











 苏公网安备32059002004080号
苏公网安备32059002004080号


