消化道肿瘤伴肝转移一直是临床治疗的重点和难点之一,尤其对于无法转化的不可切除患者,肝脏的免疫抑制微环境使其难以从免疫治疗中获益,亟需探索新的系统治疗方案。安罗替尼是我国自主研发的一种小分子多靶点的口服抗血管生成药物,可调控肿瘤微环境重编程,展现单药有效、联合化疗/免疫发挥协同增效的作用。2024年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)上报道了两项安罗替尼单药/联合治疗伴肝转移消化道肿瘤的多队列前瞻性、回顾性研究结果,本次特邀主要研究者张俊教授、祝喻甲教授及秦艳茹教授从伴肝转移消化道肿瘤的诊疗现状、安罗替尼单药/联合治疗的研究结果及应用前景、多学科诊疗等多维度进行分享,以期为这部分患者的治疗提供新思路。
上海交通大学医学院附属瑞金医院肿瘤科主任
上海消化外科研究所研究员
上海市医学领军人才
上海市优秀学术带头人
中华医学会肿瘤学分会胃癌学组副组长
中国抗癌协会肿瘤支持专业委员会副主委
中国抗癌协会胃癌专业委员会秘书长
中国临床肿瘤学会血管靶向专业委员会副主任委员
上海市医学会肿瘤靶分子专业委员会主任委员
上海市抗癌协会胃肠肿瘤专业委员会主任委员
上海市医师协会肿瘤分会副会长
2024 ASCO GI张俊教授专访视频
Q1:由您团队开展的ALTER-G-001研究两项摘要以壁报形式在ASCO GI大会公布,探索了安罗替尼联合化疗方案在伴肝转移消化道肿瘤的疗效和安全性。能否请您谈一谈开展这项针对伴肝转移消化道肿瘤的前瞻性研究的初衷?
张俊教授:在今年ASCO GI会议上,ALTER-G-001研究中稿两个Poster,这两个Poster聚焦的核心临床问题是消化道肿瘤肝转移。我们选择消化道肿瘤是因为它具有非常高的发病率和难治性 [1-3];而选择伴肝转移的消化道肿瘤是因为肝脏是很多消化道肿瘤转移的终极器官,甚至是唯一的转移器官 [4]。因此,在基础研究和临床研究领域,针对器官特异性肝转移的分子机制和临床治疗策略的探索在持续进行,这是我们设立该临床研究入组对象的初衷。
ALTER-G-001研究旨在寻找可以控制这类靶器官转移的临床解决方案。首先,我们希望实现良好的空间缩瘤效应和更好的肿瘤应答。其次,希望延长肿瘤的控制时间,以达到更满意的无进展生存(PFS)。第三,尽量减少毒副作用,并提高临床用药的便利度。
因此,在符合相关法规、伦理原则和知情同意的前提下,我们进行了这项前瞻性的研究探索。实际上,这项研究在干预背后的科学思路是对于胃肠道肿瘤肝转移接受一线常规化疗的同时,通过口服抗血管生成药物,以实现更方便的给药方式,提高安全性并初步观察疗效;为后续开展更大样本量的扩展研究奠定基础,积累早期数据。这就是为什么我们要开展ALTER-G-001研究,以消化道肿瘤的肝转移为研究对象,采用化疗联合安罗替尼这样的抗血管生成TKI药物作为治疗策略的科学考虑和初衷。
Q2:请您介绍一下ALTER-G-001研究的主要结果及其临床意义?
张俊教授:ALTER-G-001研究分为3个队列,队列A:伴肝转移结直肠癌,队列B:伴肝转移食管鳞癌,队列C:伴肝转移的其他消化道肿瘤,包括胃癌、胰腺癌和胆道癌等。研究主要终点为客观缓解率(ORR),次要终点包括缓解持续时间(DoR)、疾病控制率(DCR)、PFS、总生存期(OS),以及肝转移灶转化率和安全性等(图1)。
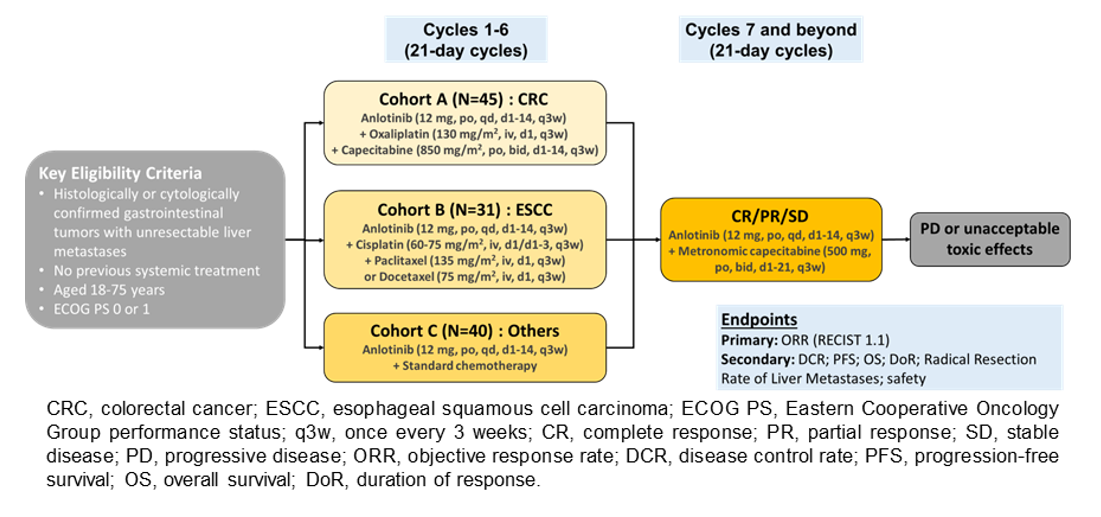
图1. ALTER-G-001 研究设计图
根据研究整体的进展情况,目前已经完成了队列A和C的入组,并且正在积极进行队列B(伴肝转移食管鳞癌)的入组。相关的研究数据,包括初步疗效和安全性数据,已经在去年的ASCO、ESMO和ESMO Asia等大会上公布 [5-8]。今年在ASCO GI会议上,我们以壁报的形式公布了队列A和队列C的最新结果,对应壁报的摘要号分别是112和653,在此向大家介绍这两个队列的更新结果。
截至2023年9月14日,队列A共纳入45例结直肠癌患者,中位年龄67(35-75)岁,仅有肝转移的患者占比为60%。诱导治疗后,8例患者接受手术;23例患者在组(13例患者正在接受诱导治疗,10例正在接受维持治疗),最长DoT为13.7个月(图2)。39例患者疗效可评估,ORR达到48.7%,DCR为97.4%(19例PR,19例SD,其中16例SD患者肿瘤减小)(图2)。中位PFS未达到。所有级别TEAE发生率为80%(36/45),≥3级TEAE发生率为33.3%,主要包括中性粒细胞计数降低(11.1%)、高血压(6.7%)和血小板减少(6.7%)。所有的不良反应都可控,且没有观察到新的不良反应信号。
总体来看,对于伴肝转移结直肠肿瘤具有相对较高的总体应答率。此外,还有一部分病人能够争取到缩瘤降期、切除病灶的机会,且达到比较好的毒性控制。后续会深入分析伴肝转移结直肠癌患者的基因突变状态,左右半结直肠的情况,以及整体的临床病理信息。
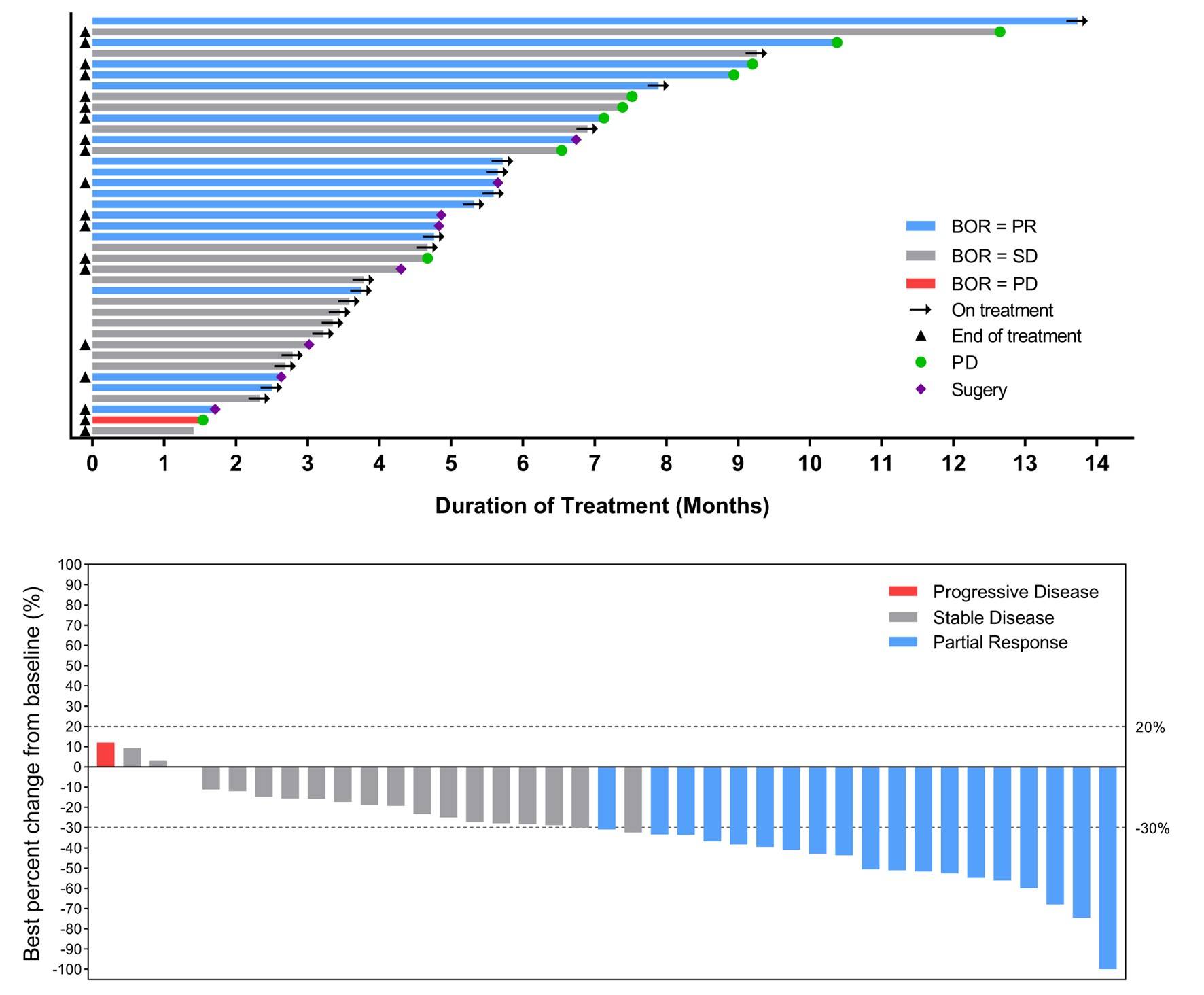
图2. 队列A(n=39)的治疗持续时间和靶病灶最佳缓解瀑布图
队列C纳入41例非结直肠肿瘤和非食管鳞癌的其他消化道肿瘤肝转移患者,包括29例胰腺癌,5例胆道癌,6例胃癌以及1例十二指肠癌。大多数胰腺癌患者接受了安罗替尼联合吉西他滨和白紫化疗作为诱导治疗方案。诱导治疗后,4例患者接受手术(1例胰腺癌,2例胃癌,1例胆道癌)。37例患者疗效可评估,ORR达到45.9%,DCR为86.5%(17例PR,15例SD,其中12例SD患者肿瘤减小)(图3)。25例胰腺癌患者疗效可评估,ORR为48%,DCR为88%;中位DoR为4.2 (95%CI,2.0-6.3)个月,中位PFS为5.5 (95%CI,4.7-6.3)个月(图4-5)。所有级别TEAE发生率 90.2%(37/41),≥3级TEAE发生率51.2%,主要包括中性粒细胞计数降低(19.5%)、白细胞计数降低(12.2%)和血小板减少(9.8%)。
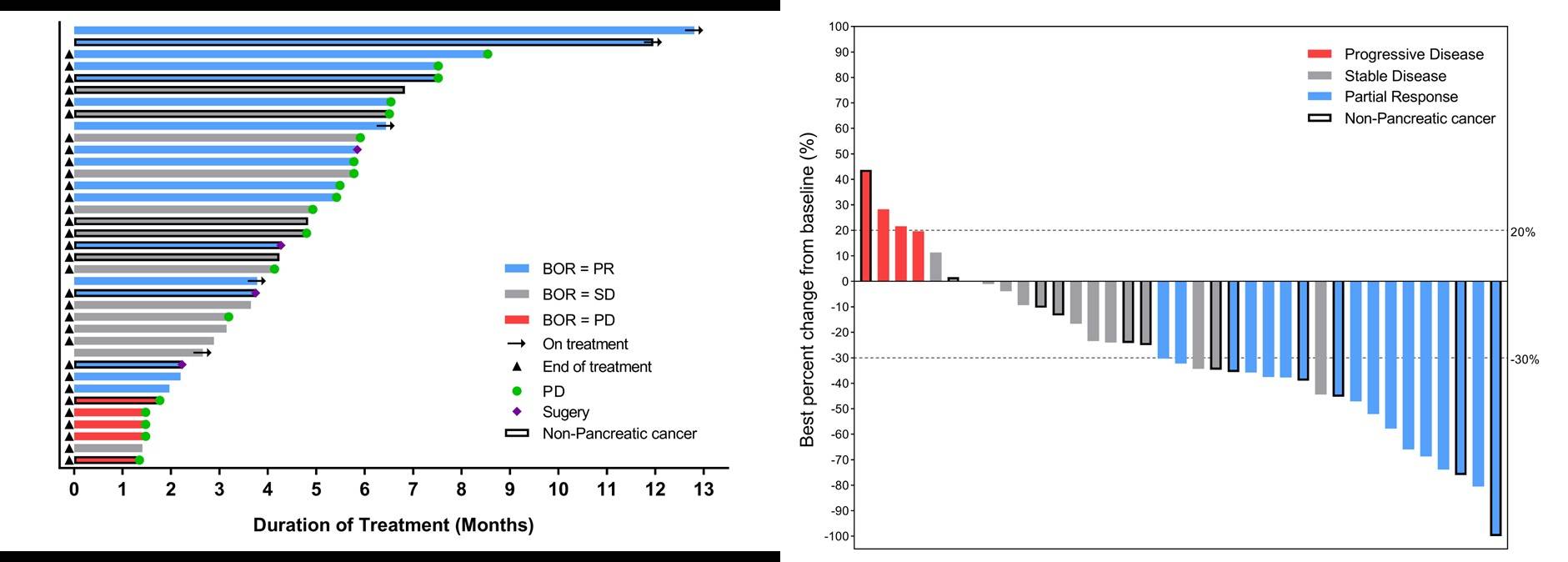
图3. 队列C(n=37)的治疗持续时间和靶病灶最佳缓解瀑布图
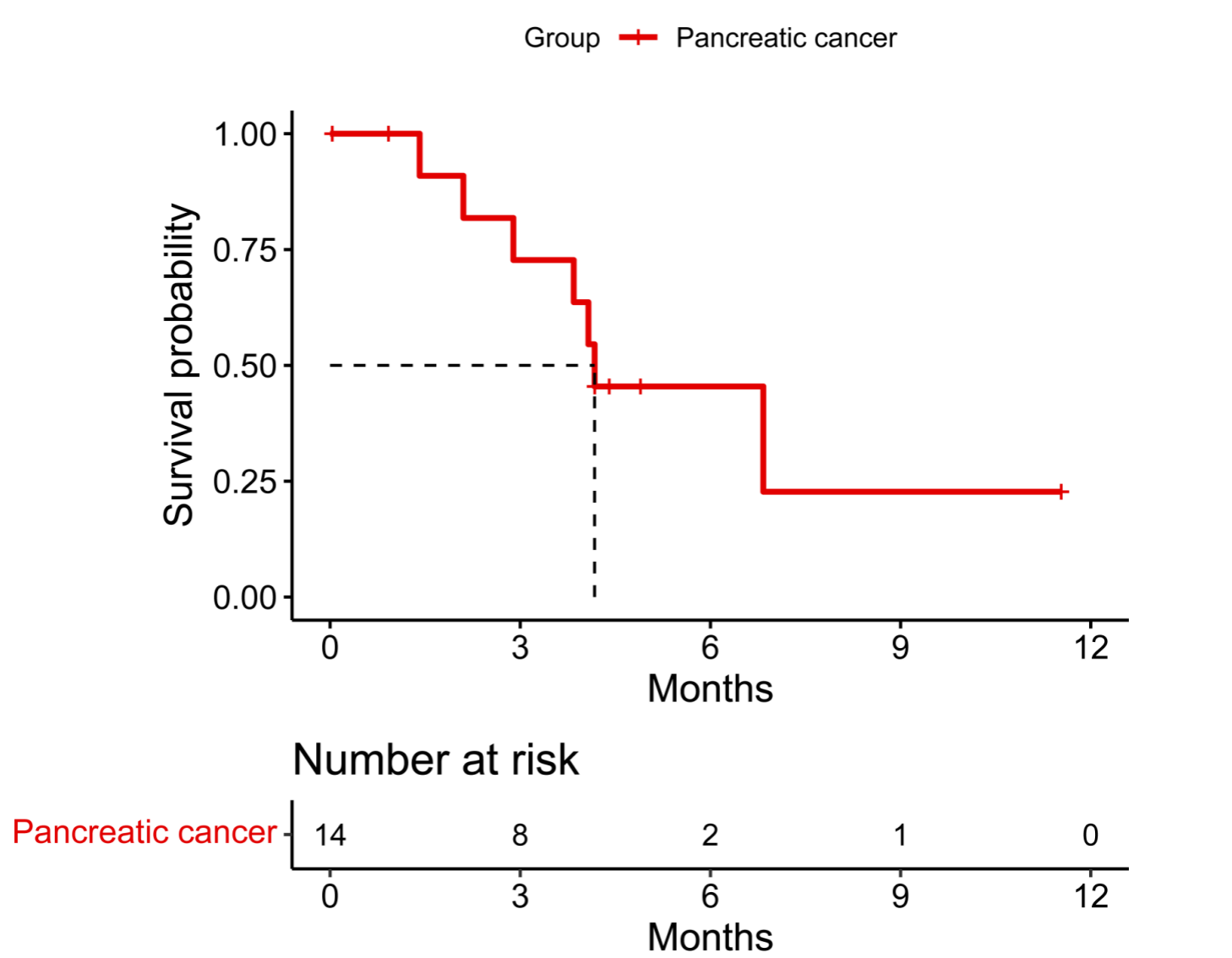
图4. 胰腺癌患者DoR的Kaplan-Meier曲线
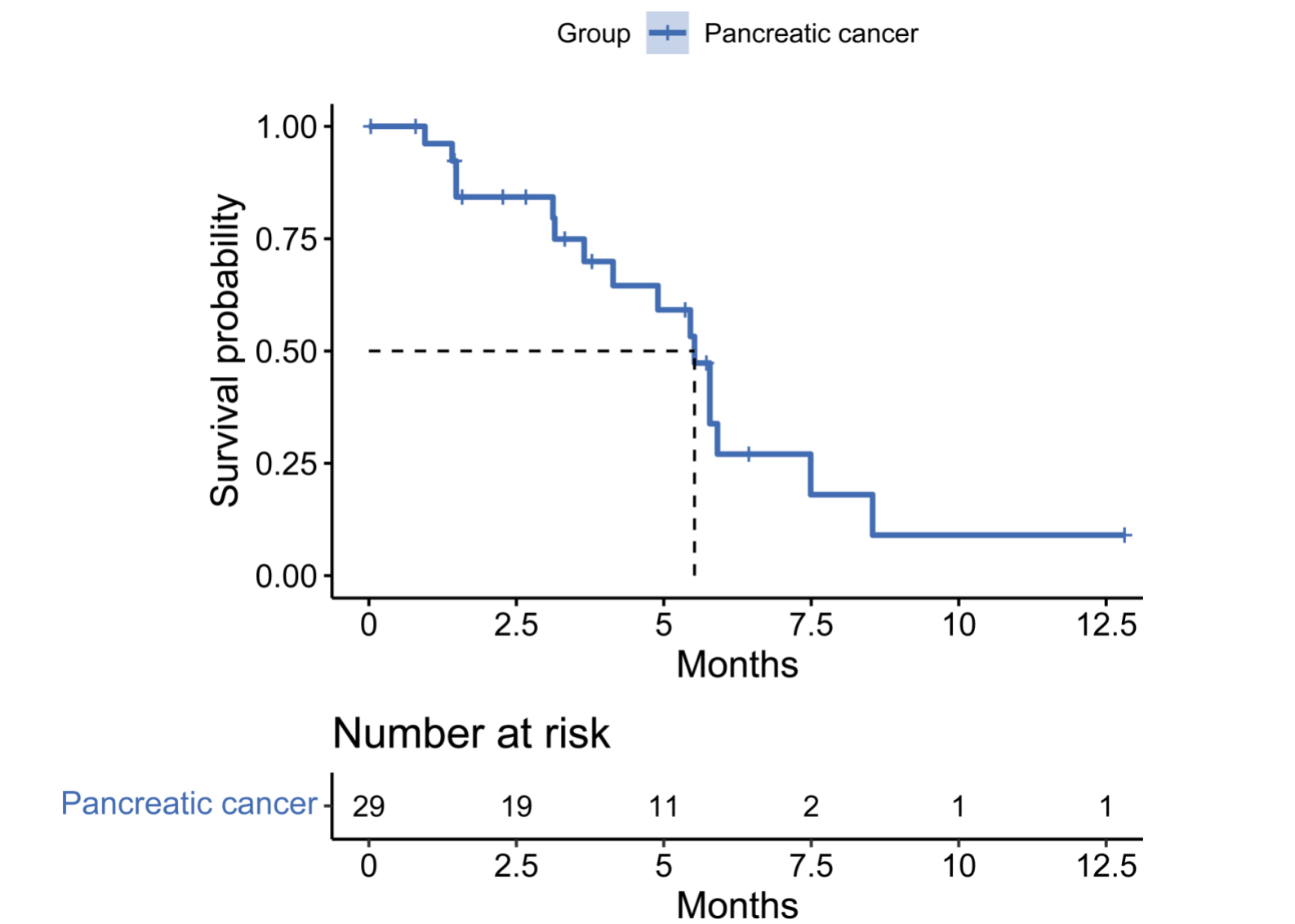
图5. 胰腺癌患者PFS的Kaplan-Meier曲线
因此,从目前队列A和队列C的数据可以观察到一个共同现象,对于伴有肝转移的消化道肿瘤患者,在以化疗为骨架的背景下联合使用安罗替尼,可以实现较好的空间缩瘤比例,并且有相对较高的手术转化机会,而且毒性可控。
在ALTER-G-001研究数据披露过程中,我们积极与国际会议接轨,相继在不同的会议上报告了初步疗效和安全性数据。此外,在本次ASCO GI会议上公布的更新数据也显示出良好的疗效和安全性。未来,希望通过这项研究,首先进一步深入探索相关机制;其次,希望能够以这个小样本的II期研究为基础,为后续扩大样本量的研究奠定初步基础并提供初步数据;第三是增加我们在这类患者中进一步拓展新型的研究策略和联合治疗方案的探索兴趣,最终造福更多的肿瘤病人。
博士研究生,副主任医师,硕士生导师,主诊教授
中山大学肿瘤防治中心放疗科,教学骨干
2016年度中山大学“优秀带教老师”
2017至2018年挂职廉江市人民医院副院长
2021年度“羊城青年好医生”
中国毒理学会特种医学专业委员会委员
广东省抗癌协会食管癌专业委员会委员
广东省临床医学学会肿瘤学专业委员会常委
广东省基层医药协会胸部肿瘤专业委员会常委
广东省临床医学学会食管癌专业委员会委员
以第一作者或通信作者发表SCI论文20余篇,单篇影响因子最高51.1分,主持或参与国家级、省部级科研课题多项
2024 ASCO GI祝喻甲教授专访视频
Q3:消化道肿瘤伴肝转移一直是临床治疗的重点和难点之一,您在临床深耕多年,请您谈谈消化道肿瘤肝转移的诊疗现状如何?
祝喻甲教授:肝脏本身属于消化道器官,也是消化道肿瘤血行转移最容易的靶器官,15%~25%的结直肠癌患者在确诊时即合并肝转移,而另有15%~25%的患者在原发灶根治术后发生肝转移 [9];胃癌肝转移的总体发生率约10%~19%,其中胃癌和肝转移同时发生的患者占73%,胃癌经过一段时间治疗后发生肝转移的患者占27% [10];约47.6%的转移性食管癌患者伴有肝转移 [11];高达80%的转移性胰腺癌患者最终会发生肝转移 [4]。
消化道肿瘤肝转移预后差,未经治疗的结直肠癌肝转移患者中位生存期仅6.9个月,无法切除患者的5年生存率低于5%,肝转移灶能完全切除或可以达到无瘤无疾病状态,即NED状态患者的中位生存期为35个月,5年生存率可达30%~57% [9],但仅部分患者可以通过转化治疗获得肝转移手术机会,更多患者只能继续接受全身药物治疗;胃癌根治术后发生肝脏转移的中位生存时间约11个月,5年存活率不到20% [10];伴肝转移晚期食管癌患者的中位生存时间不足12个月,5年存活率仅约5% [11];伴肝转移胰腺癌患者无论是否接受手术切除或姑息治疗,中位生存期均不超过半年 [4]。
因此,为了预防消化道肿瘤肝转移的发生、提高肝转移灶切除率和5年生存率,通过多学科团队,即MDT,对消化道肿瘤肝转移患者进行全面评估,个性化定制治疗目标并开展相应的综合治疗至关重要。虽然免疫治疗已改变了许多癌症的治疗格局,但转移到肝脏的肿瘤会直接或间接诱导免疫抑制,导致患者无法从免疫治疗中获益,因此仍需探索新的治疗手段,来达到更好的治疗效果。
Q4:您参与的安罗替尼治疗消化道肿瘤伴肝转移的真实世界研究数据于今年ASCO GI大会上公布,您如何看待该研究结果?对患者而言有怎样的意义?
祝喻甲教授: 这项研究数据来源于一项安罗替尼治疗实体瘤伴肝转移的真实世界回顾性研究 [12],收集了2016年1月1日到2023年2月28日期间,包括我们中山大学肿瘤防治中心,及郑州大学第一附属医院、山东省肿瘤医院等5家大型医院就诊的实体瘤伴肝转移且接受安罗替尼治疗的患者,其中有238例的消化道肿瘤患者,包括73例胃癌、71例结直肠癌、46例食管癌、24例胆道癌及24例胰腺癌,75.2%的患者在75岁以下,63.9%的患者BMI正常,87.8%的患者接受安罗替尼三线治疗,90.3%的患者接受安罗替尼单药治疗,从入组人群来看,不仅覆盖了临床常见的消化道肿瘤,且年龄、BMI、用药线数等各方面均贴合临床实际情况。(图6)
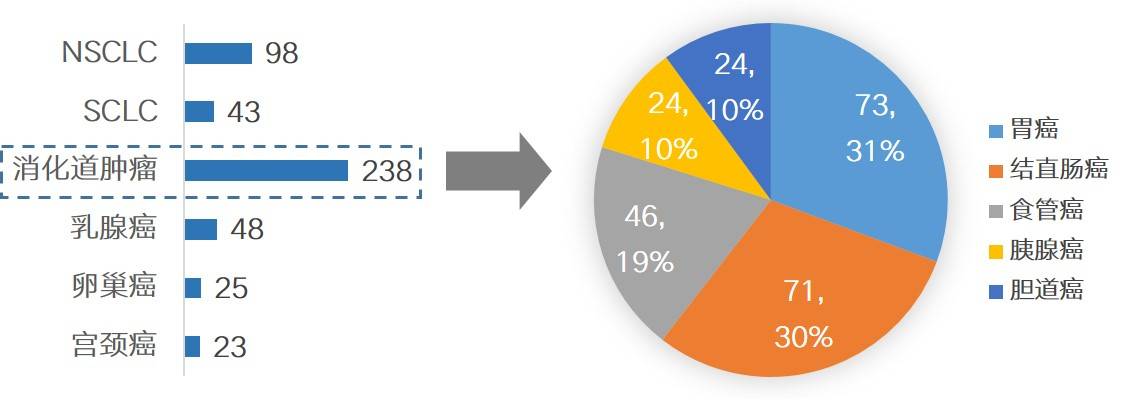
图6. 入组患者分布
结果显示,安罗替尼治疗消化道肿瘤伴肝转移的中位PFS达5.9个月(图7),针对肝转移病灶的中位PFS达6.2个月(图8),中位OS则为9.4个月(图9),且各癌种间的PFS、肝转移病灶PFS和OS均无统计学差异,提示各部位来源的消化道肿瘤一旦发生肝转移,均能从安罗替尼治疗中获益。进一步分析发现,BMI低于18.5,即体重过轻患者的PFS和肝转移病灶PFS均显著降低,在临床中需重点关注这部分患者。安全性方面,仅30例,约12.6%的患者出现不良事件,其中有3例,约1.3%的患者大于或等于3级,最常见的治疗相关不良事件为白细胞减少,发生率仅5.9%。
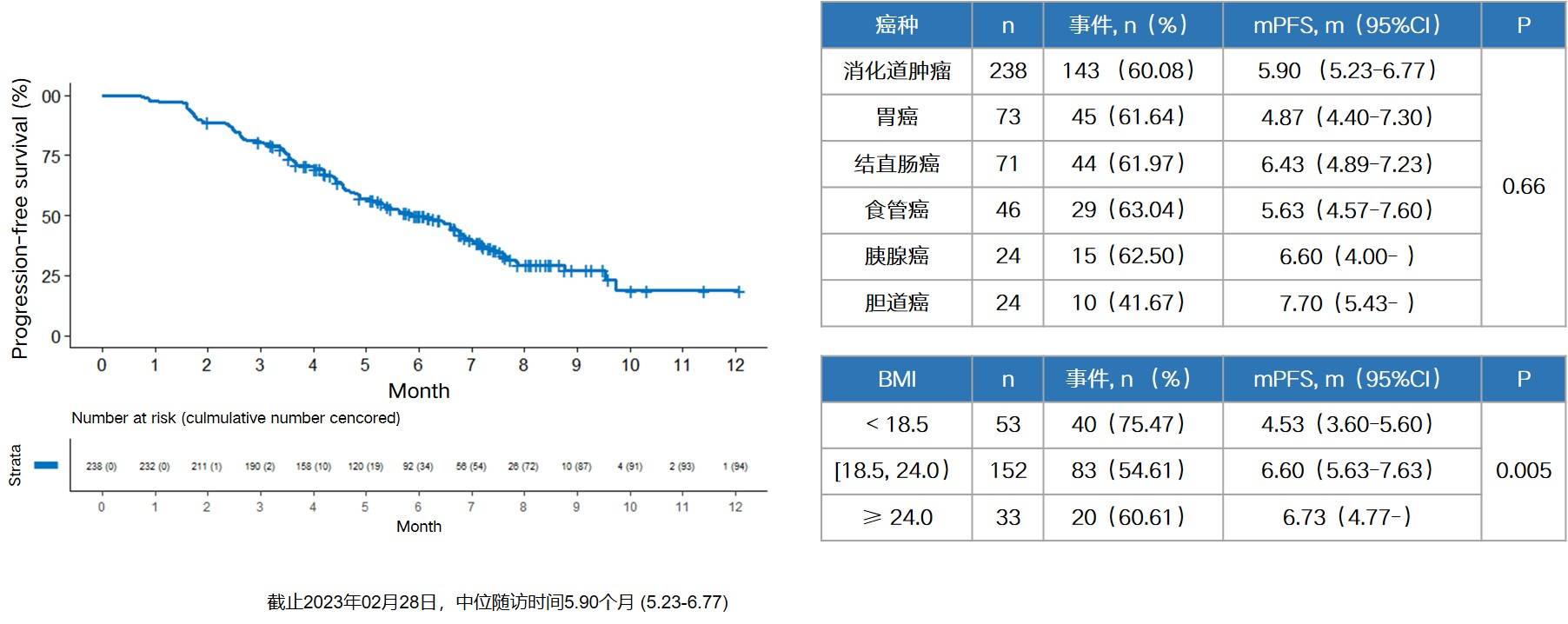
图7. 消化道肿瘤伴肝转移患者的中位无进展生存期
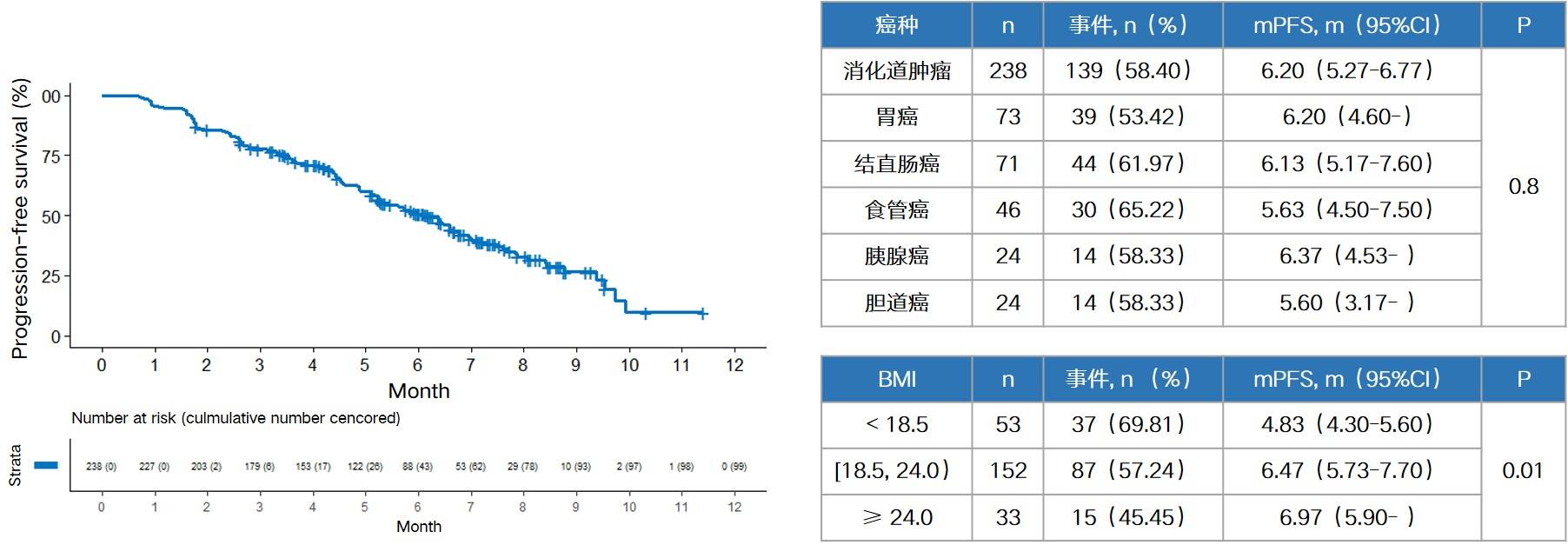
图8. 肝转移病灶的中位无进展生存期
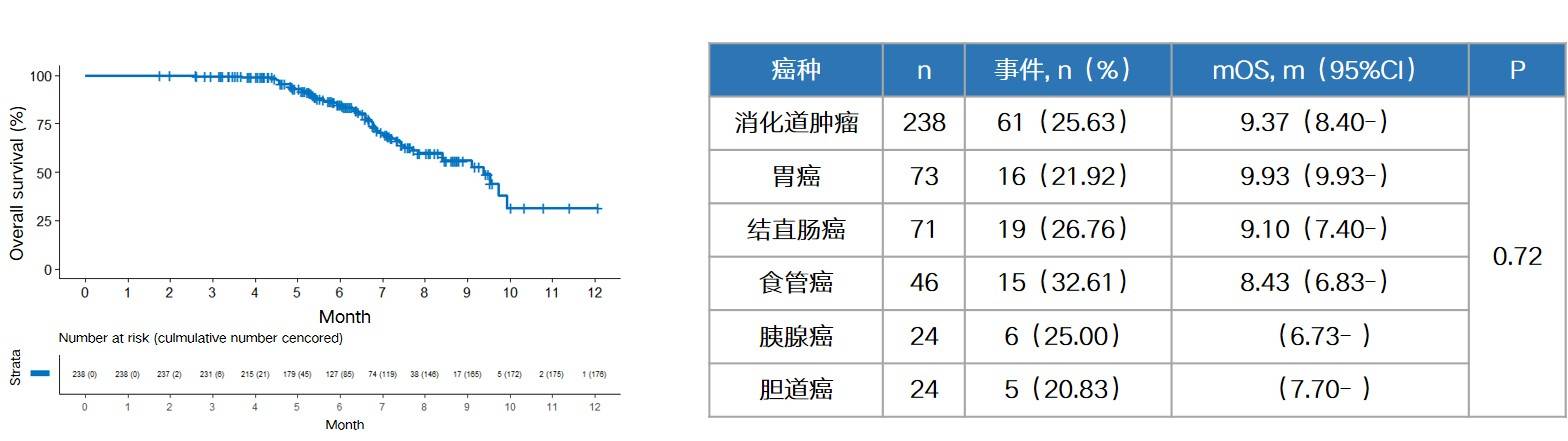
图9. 消化道肿瘤伴肝转移患者的中位生存期
该研究结果从真实世界层面证实了安罗替尼治疗消化道肿瘤伴肝转移的有效性和安全性,为安罗替尼在该部分人群的应用提供进一步的有效证据,安罗替尼是消化道肿瘤肝转移有效的治疗新选择。
主任医师,教授, 博士生导师,香港大学荣誉教授
郑州大学第一附属医院肿瘤科主任
河南省食管癌-胃癌诊疗中心主任
中华医学会肿瘤学分会委员
河南省抗癌协会肿瘤代谢专委会主任委员
河南省医学会肿瘤学分会名誉主委
河南省医学会肿瘤精准治疗分会主任委员
中国抗癌协会肿瘤转化委员会常务委员
中国抗癌协会肿瘤转移专业委员会常务委员
中国抗癌协会胰胆道肿瘤专委会常务委员
中国抗癌协会胃癌专业委员会内科学组委员
中国抗癌协会肿瘤支持治疗骨髓保护专业委员会委员
河南省肿瘤学分会青年委员会主任委员
河南省肿瘤临床化疗专业委员会副主委委员
Q5:您作为安罗替尼治疗实体瘤伴肝转移真实世界研究的主导PI之一,请您谈谈研究设计之初为何会选择安罗替尼作为研究对象?您如何看待安罗替尼在伴肝转移实体瘤患者中的临床应用前景?
秦艳茹教授:安罗替尼是我国自主研发的小分子多靶点TKI,能有效抑制VEGFR、FGFR、PDGFR及c-kit,且具有独特的“肿瘤血管基质重编程”机制,可以通过干扰血管生成信号通路,阻断肿瘤血管的新生,从而抑制肿瘤细胞的生长;还可以干预肿瘤生存发展的微环境,通过调控肿瘤血管、肿瘤细胞和免疫微环境来发挥抗肿瘤作用;安罗替尼还可以联合化疗和免疫抑制剂,协同增效 [13-17](图10)。此外,安罗替尼口服方便、安全性较好,患者接受度高。因此,我们选择了在真实世界背景下回顾性的评估安罗替尼在伴有肝转移的实体肿瘤患者中的疗效和安全性。
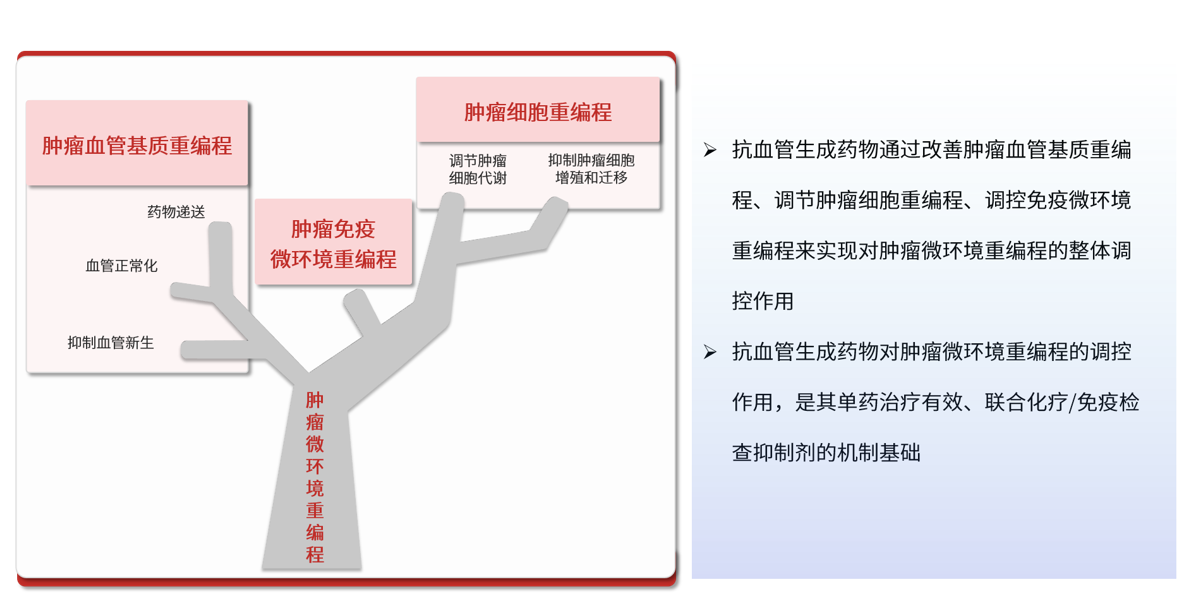
图10. 安罗替尼调控肿瘤微环境重编程
正如前面祝教授分享的,我们本次在ASCO GI上主要公布了238例消化道肿瘤患者的研究数据 [12],结果显示安罗替尼确可为各类型的消化道肿瘤伴肝转移患者带来较好的临床获益,且该获益不逊于无肝转移的患者;这与另一项安罗替尼联合化疗一线治疗伴不可切除肝转移消化道肿瘤的II期前瞻性研究(ALTER-G-001)结果相互印证,为这类患者的临床实践和决策提供了有力的指导。
Q6:对于消化道肿瘤肝转移,多学科团队(MDT)已成为其主要诊疗模式,您认为各科室该如何合作以使患者得到最大的生存获益?
秦艳茹教授:随着诊治手段日趋多元化,传统医学模式已经无法满足临床诊治的需要,MDT模式应该大力倡导。该模式可以减少个体医生做出的不完善决策,避免既往外科偏重手术治疗,内科偏重化疗、靶向治疗等让患者难以抉择的情况出现,给患者带来更个性化的评估体系和治疗、更高的生活质量以及最佳的临床和生存获益。
MDT以病人为中心,成员包括内科、外科、放疗科、介入科、影像科、分子诊断、病理科等核心科室,还涵盖心理、康复、护理等其他学科,通过加强多学科之间的协作和探讨,根据患者的体力状况、年龄、器官功能、合并症和肿瘤的分子病理特征等进行评估,为患者提供多方位、更具针对性和科学性的诊疗方案。
同时,根据患者的机体变化状况、治疗效果等因素,适时调整治疗方案,确保MDT能全程贯穿着病患的诊断、治疗、随访等各个环节。对于安罗替尼的应用,MDT可以就是否使用、单药还是联合治疗、使用时机、使用剂量等方面做出更利于患者的个体化决策,希望本次研究结果的公布也为MDT提供参考。
[1] Wang Y, Zhong X, He X, et al. Liver metastasis from colorectal cancer: pathogenetic development, immune landscape of the tumour microenvironment and therapeutic approaches. J Exp Clin Cancer Res. 2023. 42(1): 177.
[2] Luo Z, Rong Z, Huang C. Surgery Strategies for Gastric Cancer With Liver Metastasis. Front Oncol. 2019. 9: 1353.
[3] Zhang S, Fang W, Zhou S, et al. Single cell transcriptomic analyses implicate an immunosuppressive tumor microenvironment in pancreatic cancer liver metastasis. Nat Commun. 2023. 14(1): 5123.
[4] Tsilimigras DI, Brodt P, Clavien PA, et al. Liver metastases. Nat Rev Dis Primers. 2021. 7(1): 27.
[5] Zhou C, et al. 2023 ASCO: J Clin Oncol 41, 2023 (suppl 16; abstr e16268).
[6] Wu J, et al. 2023 ESMO: Annals of Oncology, Volume 34, S902.
[7] Wu J, et al. 2023 ESMO Asia: Annals of Oncology, Volume 34, S1533.
[8] Wu J, et al. 2023 ESMO Asia: Annals of Oncology, Volume 34, S1510 - S1511.
[9] 中国医师协会外科医师分会, 中华医学会外科分会胃肠外科学组, 中华医学会外科分会结直肠外科学组, 等. 中国结直肠癌肝转移诊断和综合治疗指南(V2023)[J]. 中华胃肠外科杂志, 2023, 26(1): 1-15.
[10] 中国研究型医院学会消化道肿瘤专业委员会,中国医师协会外科医师分会上消化道外科医师委员会,中国抗癌协会胃癌专业委员会,等. 胃癌肝转移诊断与综合治疗中国专家共识(2019版)[J]. 中国实用外科杂志,2019,39(5):405-411.
[11] Dashan Ai, Hanting Zhu, et al. Patterns of distant organ metastases in esophageal cancer: a population-based study. J Thorac Dis. 2017 Sep; 9(9): 3023-3030.
[12] Zhu YJ, et al. 2024 ASCO GI Poster#738.
[13] Xie C, Wan X, Quan H, et al. Preclinical characterization of anlotinib, a highly potent and selective vascular endothelial growth factor receptor-2 inhibitor. Cancer Sci. 2018;109(4):1207-1219.
[14] Su Y, Luo B, Lu Y, et al. Anlotinib Induces a T Cell-Inflamed Tumor Microenvironment by Facilitating Vessel Normalization and Enhances the Efficacy of PD-1 Checkpoint Blockade in Neuroblastoma. Clin Cancer Res. 2022 Feb 15;28(4):793-809.
[15] Huang Y, Kim BY, Chan CK, et al. Improving immune-vascular crosstalk for cancer immunotherapy. Nat Rev Immunol. 2018 Mar;18(3):195-203.
[16] Khan KA, Kerbel RS. Improving immunotherapy outcomes with anti-angiogenic treatments and vice versa. Nat Rev Clin Oncol. 2018 May;15(5):310-324.
[17] Galluzzi L, Humeau J, Buqué A, et al. Immunostimulation with chemotherapy in the era of immune checkpoint inhibitors. Nat Rev Clin Oncol. 2020; Dec;17(12):725-741.
排版编辑:肿瘤资讯-Doris











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


