Nature Reviews Clinical Oncology杂志(影响因子:78)近期发表了由乳腺癌研究和治疗领域的关键人物之一Nicholas C. Turner教授主导的一篇综述,对三种CDK4/6抑制剂进行了全面总结[1]。【肿瘤资讯】对该综述主要内容予以整理,分为上下两篇。在上篇,【肿瘤资讯】总结了III期试验的最新数据,包括总生存期(OS),并讨论了不同药物间研究结果差异的可能原因。本篇(下)主要讨论CDK4/6抑制剂耐药的机制,CDK4/6抑制剂治疗后的治疗方案,使用循环肿瘤DNA(ctDNA)指导治疗,以及未来的方向。

CDK4/6抑制剂耐药的机制
在晚期治疗中,与单用内分泌治疗(ET)相比,在ET的基础上加用CDK4/6抑制剂可改善无进展生存期 (PFS)、总生存期 (OS)、延长化疗时间和生活质量。然而,尽管疗效显著,但最终还是会出现获得性耐药,其耐药机制可能与雌激素受体(ER)途径有关,也可能与细胞周期调控有关,从而导致疾病进展。如何前瞻性地识别那些最有可能从CDK4/6抑制剂中获得最大益处的患者,以及哪些患者可能对治疗具有原发耐药成为关注的热点。
原发性耐药
在激素受体阳性(HR+)乳腺癌患者中,不论是否存在PIK3CA、TP53突变或CCND1扩增,CDK4/6抑制剂均显示出一致的获益。然而,携带RB1或其他信号通路成分基因突变的肿瘤可能对CDK4/6抑制剂具有原发性耐药。临床前模型显示,RB1失活性突变或缺失的同型合子肿瘤对治疗有耐药性(图1)。并且通过ctDNA检测到有这些改变的患者从瑞波西利治疗中与野生型RB1相比获益较少(中位PFS 3.8 vs 18.9个月)。在未经治疗的HR+乳腺癌患者中,RB1突变或缺失较为罕见。单拷贝RB1缺失可能不会导致治疗耐药,但可能增加获得耐药性的风险。携带BRCA2突变的患者可能因为与RB1相邻基因的共同缺失而有更短的PFS。
FAT1是与Hippo信号通路相关的肿瘤抑制基因,在HR+乳腺癌中很少失活。但是,FAT1的失活性突变与对CDK4/6抑制剂较差的反应相关,可能因为FAT1突变导致Hippo信号通路成分编码基因的下调,进而增加CDK6表达。鉴于FAT1突变的罕见性,识别真正的失活性FAT1突变具有挑战性,这限制了将这一证据应用于临床实践。
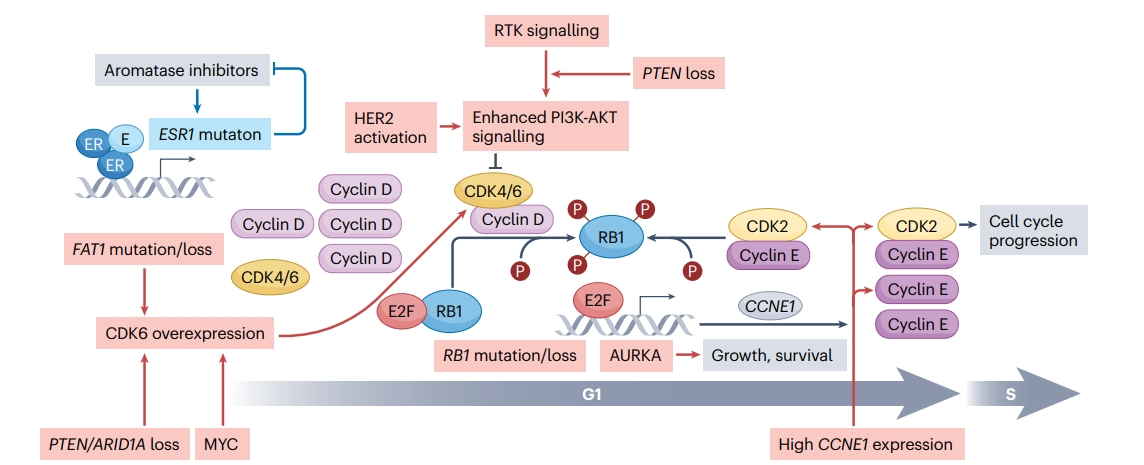
图1 CDK4/6抑制剂耐药机制
已经确定了几种对CDK 4/6信号传导的耐药机制,包括:RB1的失活突变或缺失;AURKA的扩增;导致通过细胞周期蛋白D-CDK4/6对RB1磷酸化抑制的改变,包括编码受体酪氨酸激酶(RTK)的基因的激活突变,如FGFR1和HER2过表达,这些效应可能通过使用特定RTKs来逆转;FAT1、ARID1A或PTEN的突变或缺失,导致CDK6过表达;CCNE1过表达导致高水平的细胞周期蛋白E和绕过CDK2的激活;或ESR1突变。 AURKA,极光激酶A;E,雌激素。
CDK4/6抑制剂的部分耐药性与CCNE1(周期蛋白E1)高表达水平和E2F活化水平高有关。PALOMA-3试验中的分析表明,CCNE1 mRNA高表达与对哌柏西利的反应较差相关。CCNE1的过表达可能通过激活CDK2绕过信号传导途径,导致耐药。临床前研究发现,过度表达CCNE1的细胞对某些抑制剂特别敏感。NeoPalAna和neoMONARCH试验中的生物标记物分析表明,与IFN信号相关的基因表达特征可能与CDK4/6抑制剂的耐药相关。尽管如此,这些发现的临床应用仍不确定,因为在具有这些抗药性特征的患者中仍观察到了CDK4/6抑制剂的一定活性。
在辅助治疗环境中,明确能够从CDK4/6抑制剂治疗中获益的生物标记物依然是一个挑战。目前,尚未有关于MONARCH-E或NATALEE试验中生物标记物分析的报告。然而,PENELOPE-B和PALLAS试验的最新数据提示,一种结合内在亚型、孕激素受体状态和ERBB2(编码HER2)表达的复合生物标记物可能有助于识别那些可能从辅助哌柏西利治疗中获得最大益处的患者亚组。
继发性耐药机制
AURKA(细胞分裂中扮演关键角色的激酶,极光激酶A)已被发现与对CDK4/6抑制剂和内分泌治疗的继发耐药有关,在RB1缺失的临床前模型中显示,对其抑制似乎具有合成致死效应,这一发现正在临床研究中被进一步探索。
在某些对哌柏西利产生耐药性的细胞系中,长期暴露于CDK4/6抑制剂后出现CDK6扩增,从而促进了耐药性。CDK6的高表达可能与TGFβ信号抑制导致的微RNA表达改变有关。实验中发现,CDK6敲除可以恢复对CDK4/6抑制剂的敏感性。此外,在临床前模型中,PTEN和ARID1A的缺失也会增加CDK6表达,这种情况可以通过AKT抑制剂和CDK4/6抑制剂的组合来克服。CAPiTello-291试验的数据证实了AKT抑制剂capivasertib在携带AKT信号通路成分基因突变(包括PTEN)的患者中具有临床活性。
生长因子信号通路的缺陷,即FGFR1过表达是另一种导致对内分泌治疗产生耐药性的已知机制,这种缺陷同样也降低了对CDK4/6抑制剂的敏感性。在MONARCH-3试验中,FGFR1过表达的样本证实了这种耐药性。这种耐药性可能是通过ER和MAPK激活下游信号通路的改变介导的,使用FGFR抑制剂可以逆转这种耐药性。例如,在FGFR1过表达的患者源异种移植模型中,将FGFR酪氨酸激酶抑制剂厄达替尼与氟维司群和哌柏西利三药联合使用,比单独使用哌柏西利和/或内分泌治疗更有效地抑制肿瘤生长。FGFR信号通路下游元素的突变也被识别为潜在的治疗靶点。
肿瘤转录因子c-MYC(MYC)的上调和ESR1突变已被发现与CDK4/6抑制剂的耐药性有关。在MONARCH-3试验中,5%的阿贝西利疾病进展患者和nextMONARCH试验中的9%的患者身上检测到了MYC的获得性突变。PALOMA-3试验样本分析发现,特定的ESR1突变,尤其是ESR1Y537S突变,与耐药性有关。2022年发表的EMERALD试验数据表明,在有无这种突变的情况下,对随后治疗的反应可能有差异。患者在接受CDK4/6抑制剂加内分泌治疗后病情进展,并随机分配到氟维司群加芳香化酶抑制剂对比口服选择性雌激素受体降解剂(SERD)elacestrant治疗。在携带ESR1突变的肿瘤的患者中接受elacestrant治疗的中位PFS显著增加(从2.1个月增加到8.6个月),且在之前接受CDK4/6抑制剂治疗时间更长的患者中这一效应更为显著。基于这些数据,2023年1月FDA批准了elacestrant用于ESR1突变的晚期乳腺癌患者,这些患者在一线及以上内分泌治疗后病情进展。
ERBB2的激活性突变与对内分泌治疗和CDK4/6抑制剂的耐药性相关,且据临床前证据显示,通过添加HER2酪氨酸激酶抑制剂奈拉替尼可克服这种耐药性。II期SUMMIT研究提供了奈拉替尼在此类情况下有效的临床证据。
患者可能积累多种不同的改变,共同导致耐药表型。使用精准的方法识别抗药性机制,如通过ctDNA追踪,以放射学方式可检测的疾病复发,可有助于推迟疾病进展。PADA-1研究中,接受哌柏西利加芳香化酶抑制剂治疗的患者通过ctDNA监测ESR1突变状态,并在检测到ESR1突变时随机分配到继续使用芳香化酶抑制剂或氟维司群联合哌柏西利,显示出在检测到突变时改变治疗策略的益处(中位PFS 5.7个月vs 11.9个月;HR 0.61, 95% CI 0.43–0.86; P = 0.004)。
CDK4/6抑制剂治疗后的治疗选择
CDK4/6抑制剂治疗后的肿瘤细胞进化,包括基因特征的改变和肿瘤表型的变化,与后续治疗决策密切相关。(图2-图7)

图2 CDK4/6抑制剂治疗后的肿瘤进化[2]
单药内分泌治疗,如氟维司群,在CDK4/6抑制剂治疗进展的患者中效果较差(图3)。在CAPitello-291试验中,仅接受氟维司群的患者中位PFS为2.6个月,而之前未接受过CDK4/6抑制剂的患者为7.2个月。在CDK4/6抑制剂治疗进展后,联合内分泌治疗和PI3K-AKT-mTOR通路抑制剂的方案似乎逐渐成为标准治疗(图4)。

图3 单药氟维司群[2]
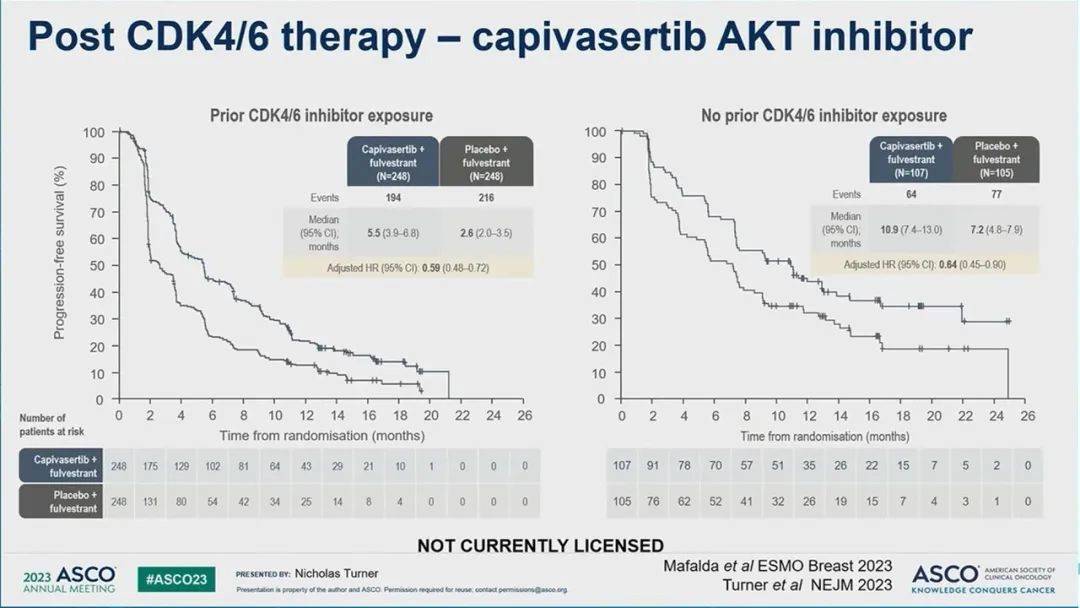
图4 单药氟维司群与AKT抑制剂[2]
对于PIK3CA突变人群,两项研究测试了该人群中PI3K抑制剂alpelisib的疗效:SOLAR-1试验和规模较小的BYLieve试验(图5)。SOLAR-1试验的主要入选标准是对内分泌治疗耐药的患者,纳入的患者仅有6%既往CDK4/6抑制剂经治(该亚组从alpelisib中获得的获益与整个队列相似)。BYLieve试验也显示alpelisib对先前接受过CDK4/6抑制剂的患者具有临床活性。此外,针对这一信号通路的下游元素也是一个有吸引力的研究方向。在CAPitello-291试验中,AKT抑制剂capivasertib在之前接受过CDK4/6抑制剂和未接受过治疗的队列中都展现出了类似的益处。
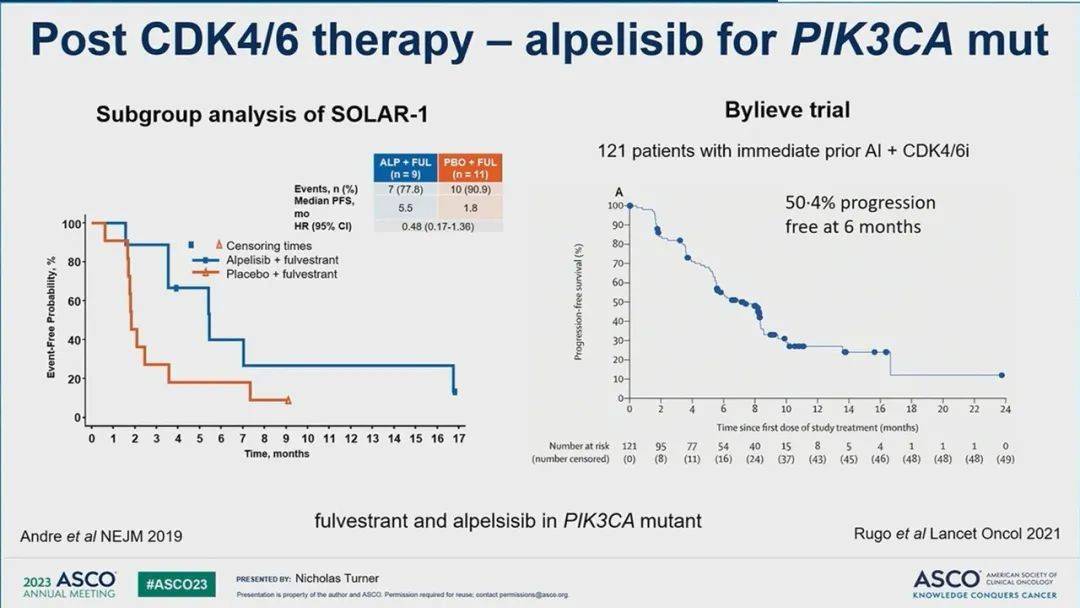
图5 PIK3CA突变人群[2]
前文讨论的elacestrant是另一种与传统内分泌治疗相比,在CDK4/6抑制剂经治人群中具有改善疗效的药物。获得FDA批准后,这种药物可能成为ESR1突变癌症患者在CDK4/6抑制剂治疗进展后的标准治疗。
在过去几年的研究中,同样探索了进展后继续使用CDK4/6抑制剂的潜力(图6)。在II期MAINTAIN试验中,接受内分泌治疗加CDK4/6抑制剂后疾病进展的患者随机接受依西美坦或氟维司群,伴或不伴瑞波西利。大多数患者既往接受过氟维司群(83%)加哌柏西利(84%)。联合瑞波西利组的中位PFS为5.3个月,而单独内分泌治疗为2.8个月(HR 0.56, 95% CI 0.37–0.83; P = 0.004)。同样,在II期PACE试验中,疾病进展的患者被随机分配在进展后接受氟维司群单药,或联合哌柏西利、以及哌柏西利联合氟维司群伴PD-L1 Avelumab单抗(图7)。大多数患者(90.9%)之前接受过哌柏西利,中位PFS没有显著差异(哌柏西利加内分泌治疗为4.6个月,单独内分泌治疗为4.8个月)。MAINTAIN试验队列中大多数患者更换了CDK4/6抑制剂类型,而PACE试验中则继续使用相同的CDK4/6抑制剂,这可能是导致不同结果的原因。
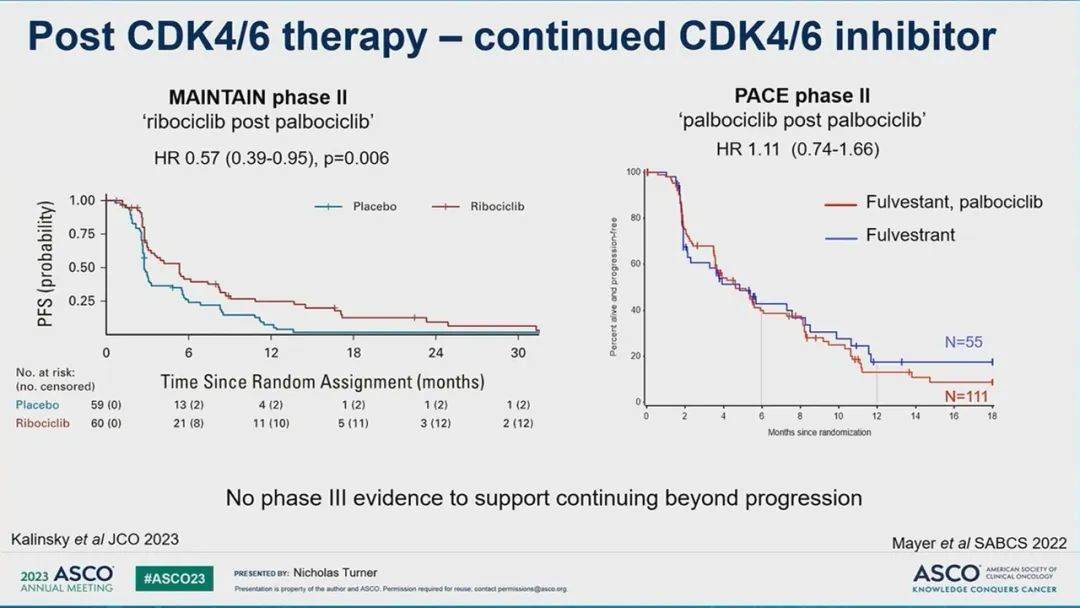
图6 进展后继续使用CDK4/6抑制剂[2]
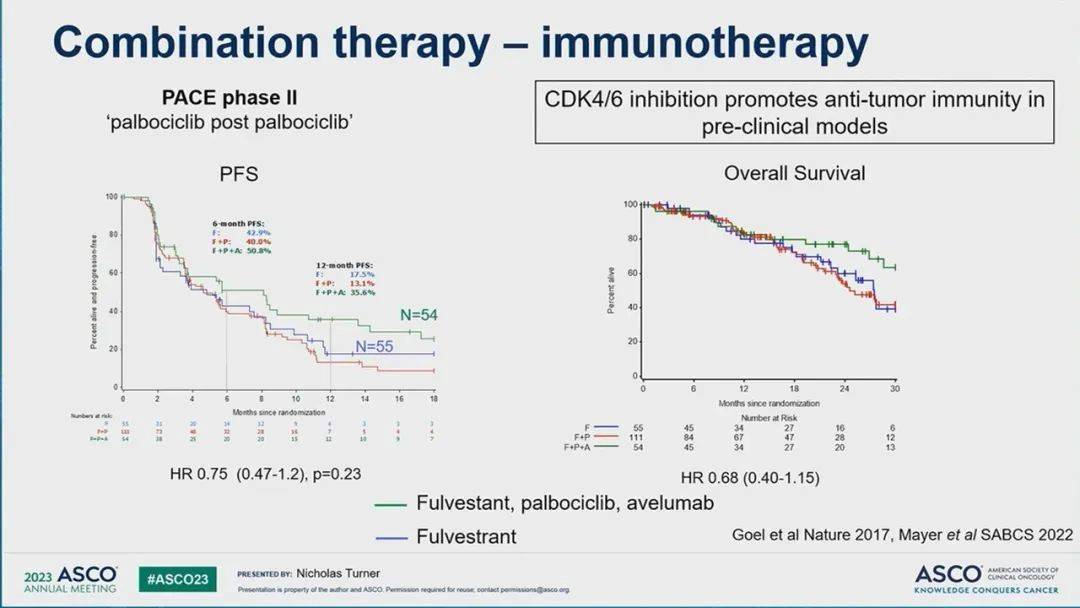 图7 CDK4/6抑制剂与免疫治疗联合[2]
图7 CDK4/6抑制剂与免疫治疗联合[2]
在PALMIRA试验中,尽管患者此前在哌柏西利治疗下疾病进展,试验同样继续使用哌柏西利。患者被随机分配继续使用哌柏西利加第二线内分泌治疗或仅使用第二线内分泌治疗。结果显示中位PFS没有显著差异(4.2个月vs3.6个月; HR 0.8, 95% CI 0.66-1.1; P = 0.206)。
对于阿贝西利,一项小型研究表明,在先前接受过哌柏西利的患者中有一定疗效。III期postMONARCH试验正在研究在第一线内分泌治疗加CDK4/6抑制剂后或辅助治疗后疾病进展的患者使用阿贝西利加氟维司群对比单独氟维司群的效果。这项研究的结果将有助于了解继续使用CDK4/6抑制剂的有效性和治疗顺序的重要性。
利用ctDNA指导治疗
液体活检作为一种非侵入性方法,用于评估特定基因改变的存在或缺失,并可能提供对疾病复发的更敏感监测,优于常规影像学检查。在CDK4/6抑制剂治疗背景下,液体活检未来可能有两个潜在用途:早期监测治疗应答和监测耐药性突变的出现。对治疗有反应的患者通常会出现ctDNA水平的降低,而没有反应的患者与基线相比ctDNA水平不变。这些早期ctDNA水平的动态变化可以用来识别可能需要额外治疗的患者。例如,FAIM II期试验(NCT04920708)正在研究在CDK4/6抑制剂治疗2周后ctDNA水平未显著下降的患者是否从AKT抑制剂ipatasertib治疗中获益(图8)。
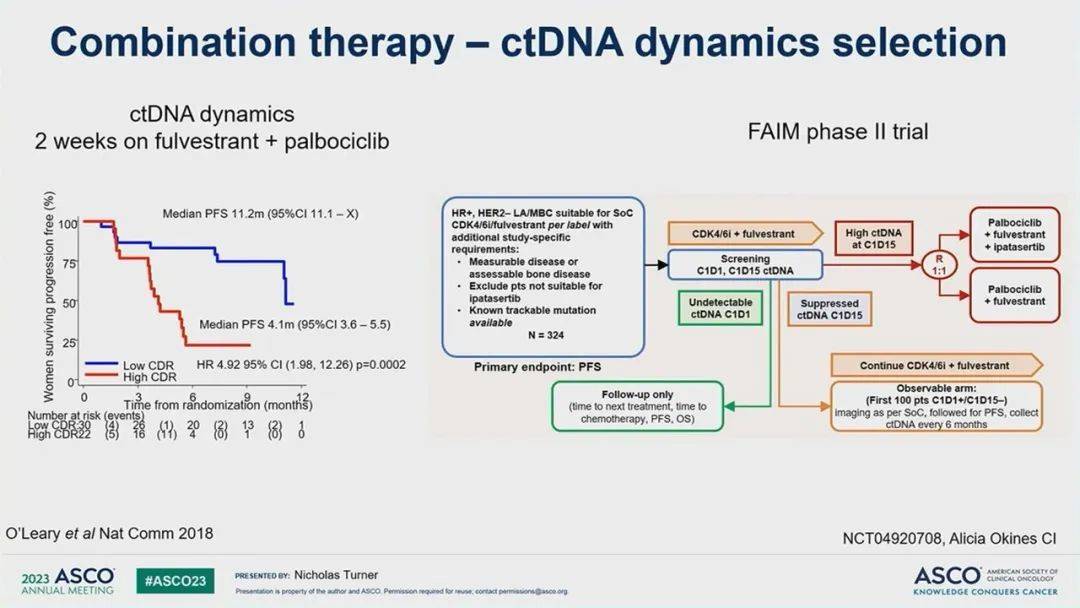
图8 CDK4/6联合方案中,用ctDNA监测疗效,指导在影像学进展之前就进行方案调整的研究[2]
此外,PADA-1试验利用液体活检监测ESR1突变,发现ESR1突变患者转为接受氟维司群联合哌柏西利,对比继续使用芳香化酶抑制剂联合哌柏西利,其结果PFS绝对差异为 6.2 个月(HR=0.63;95%CI [0.45-0.88], p=0.007),显示出在检测到突变时改变治疗策略的益处。正在招募患者的III期SERENA6试验(NCT04964934)将监测在接受CDK4/6抑制剂一线治疗的患者的液体活检中的ESR1突变,患者在疾病进展前检测到ESR1突变后将从芳香化酶抑制剂切换到口服新一代SERD药物camizestrant加上继续CDK4/6抑制剂治疗。这些方法可能会改变CDK4/6抑制剂的临床使用方式,使治疗更加精确和个性化。
未来方向
目前正在探索多种创新方法,以提高CDK4/6抑制剂的治疗效果。对骨髓中CDK6的抑制被认为是可能部分导致治疗相关血液学毒性的原因,但并不能提供额外的治疗效果。当下,具有显著减少CDK6抑制作用的选择性CDK4抑制剂正在进行早期阶段的临床试验,初步结果显示该疗法对HR+乳腺癌患者具有一定的疗效,并且与氟维司群联合使用的安全性数据具有前景。
CDK家族成员在ATP结合位点的相似性为开发高选择性的抑制剂带来了挑战。然而,CDK2作为CDK4/6抑制剂耐药性背后的关键媒介,其通过旁路信号传导引发耐药,因此成为新型抗癌疗法中的一个重要靶点。在临床前模型中,CDK2的抑制被发现可以加强CDK4/6抑制剂的抗肿瘤作用。如果联合抑制CDK2/4/6在安全性和耐受性上可接受,这种组合疗法有可能带来更佳的治疗效果。CDK2/4/6抑制剂PF-3600的初步研究结果表明,对于先前接受过CDK4/6抑制剂治疗的患者,该药物显示出一定的临床活性,主要的不良反应是骨髓抑制。此外,针对特定场景的选择性CDK2抑制剂,如在之前接受过CDK4/6抑制剂治疗的细胞,以及携带CDK2激活改变(例如CCNE1扩增)的临床前模型中,都显示出活性。考虑到其他潜在的CDK可能会补偿CDK2的抑制,针对具有特定依赖于CDK2的癌症患者的精准选择可能是成功临床开发的关键。
联合应用CDK4/6抑制剂和其他靶向疗法,如PI3K抑制剂,呈现出有前景的治疗潜力。虽然临床前数据表明这两种疗法可能具有协同作用,但由于这种组合治疗在所有模型中并非总是有效,因此有必要进一步开展研究,以确定能够预测疗效反应的生物标志物。例如,一项结合使用Alpelisib、瑞波西利和氟维司群的Ib期试验因为明显的毒性反应而被迫终止招募。然而,我们仍期待着与PI3K抑制剂inavolisib联合使用哌柏西利的研究结果(NCT04191499)。此外,预计液体活检技术的更广泛使用将在未来几年里极大地改变患者的监测和治疗方案的调整,包括CDK4/6抑制剂的应用。这种技术的进步有望为医生提供更精准、更灵活的治疗选择,从而提高治疗效果并减少不必要的不良反应。
结论
CDK4/6抑制剂的应用显著改变了HR+乳腺癌患者的治疗模式,在早期和晚期患者中都看到了生存结果的显著改善。随着正在进行的临床试验结果的发布,这些药物在其他乳腺癌亚型以及与其他靶向治疗和免疫治疗结合使用方面的应用可能会进一步扩大。未来的重点将包括优化基于CDK4/6抑制剂的治疗组合和顺序,以及开发能够克服耐药的新方法。
排版编辑:肿瘤资讯-Kelly
[1] Morrison, L., Loibl, S. & Turner, N.C. The CDK4/6 inhibitor revolution — a game-changing era for breast cancer treatment. Nat Rev Clin Oncol (2023). https://doi.org/10.1038/s41571-023-00840-4
[2] 图2-8来源:https://conferences.asco.org/











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


