ASTRUM-004研究结果在2023年世界肺癌大会(WCLC)和欧洲肿瘤内科学会亚洲年会(ESMO ASIA 2023)上广受关注,随之全文于2024年1月5日发表在国际知名学术期刊Cancer Cell(IF=50.3),展现了其在国际权威学术舞台的地位。作为我国自主研发的PD-1单抗,斯鲁利单抗将有望成为晚期肺鳞癌临床治疗中的有力选择。【肿瘤资讯】特邀山西医科大学第一医院贾军梅教授剖析ASTRUM-004研究数据,探讨免疫治疗未来的临床探索方向。
山西医科大学第一医院呼吸肿瘤科主任
主任医师 硕导
中国抗癌协会支持治疗专业委员会委员
山西省心理卫生协会第六届理事会常务理事
山西省抗癌协会第六届理事会常务理事
山西抗癌协会肿瘤支持治疗专业委员会主任委员
山西省老年医学学会肿瘤热疗专委会主任委员
山西省心理卫生协会临终关怀专委会主任委员
山西医师协会肿瘤精准治疗专委会副主任委员
山西医学会肿瘤学专委会副主任委员
山西抗癌协会肿瘤转移防治委员会副主任委员
山西抗癌协会神经内分泌肿瘤委员会副主任委员
山西省卫生和计划生育委员会百千万人才培养工程骨干精英人才
肺鳞癌患者治疗手段有限,临床亟待更有效治疗方案
贾军梅教授:根据国家癌症中心的最新统计报告,肺癌是我国发病率最高的恶性肿瘤,每年新发肺癌约82万例[1]。其中,肺鳞癌的发病约占肺癌总体的30%~40%[2]。肺鳞癌患者呼吸短促、咳嗽、咯血等症状较腺癌更明显,患者常年龄较大,伴有其他疾病(高血压、冠状动脉性疾病或慢性阻塞性肺疾病),为治疗带来更多困难,而由于一部分患者初诊时已经处于晚期,治疗选择更为有限。
鳞癌与非鳞癌(nsqSNCLC)的免疫微环境存在差异,从免疫微环境来看,sqNSCLC和nsqNSCLC可能是不同类型的疾病[3]。肺鳞癌与吸烟关系更为密切,肺鳞癌中很少发生驱动基因突变,即便是少数存在EGFR和ALK突变患者,靶向治疗的疗效也较差,导致肺鳞癌治疗选择少。sqNSCLC传统一线治疗为含铂化疗,最常用的方案包括卡铂+紫杉醇、卡铂+白蛋白结合型紫杉醇以及顺铂+吉西他滨,但一线化疗患者获益较为有限,难以满足临床需求,晚期sqNSCLC患者迫切需要有效的治疗选择[4]。
与腺癌相比,鳞癌基因组不稳定性更高,鳞癌的肿瘤突变负荷(TMB)也高于腺癌。理论上讲,晚期肺鳞癌更能从免疫联合治疗中获益。临床研究结果显示,晚期肺鳞癌的患者一线采用化免联合,显著提高了患者生存。如何通过生物标记物指导优势人群的筛选,以及探索可为患者带来更多生存获益的免疫联合方案是肺鳞癌治疗中的重要探索方向[5]。另外,一线标准化免疫治疗进展之后,患者随时间推移仍可能出现疾病进展,后线治疗如何进行也是临床医师必须面对的困境。因此在肺鳞癌的治疗中,仍然存在不少的挑战和困境,需要我们进一步探索更为高效的治疗手段。
免疫治疗特殊机制较化疗具有更好安全性,“长拖尾”效应有望助患者长期获益
贾军梅教授:免疫治疗是近几年来在临床中兴起的一种新型的治疗药物选择。目前,PD-1/PD-L1单抗乃至CTLA-4单抗都是临床研究中的热点,这些药物也在肺鳞癌的临床治疗中取得了突破性进展。
PD-1是一种位于免疫细胞表面的受体,而PD-L1是其配体,表达于肿瘤细胞和肿瘤浸润免疫细胞的表面。当PD-1与PD-L1结合时,可以产生负性刺激信号抑制T淋巴细胞的活化,导致T细胞无法杀伤肿瘤细胞,肿瘤细胞逃避了免疫系统的监控,即免疫逃逸,最终导致肿瘤的发生。如今,通过PD-1/PD-L1抑制剂阻断这种相互作用,使免疫细胞能够有效地识别并消灭肿瘤细胞,达到治疗肿瘤的作用。
免疫治疗与传统化疗的作用机制不同,化疗药物选择性不足,不仅攻击癌细胞,也可能对正常细胞造成损伤,导致患者可能出现较严重的不良反应,影响生活质量,免疫疗法通常比经典的细胞毒性化疗药物具有更好的耐受性。此外,化疗药物起效后维持的时间较短。免疫治疗具有长效的免疫记忆,一旦起效,疗效一般会持续较长时间,被称为长拖尾效应。这使得患者在接受免疫治疗停药后,肿瘤仍然会继续反应[6]。因此,对于患者而言,免疫治疗可以具有更长的作用时长,在疗效和疗效持续时间方面具有优势。
ASTRUM-004研究公布中国亚组数据,为中国患者提供更优治疗策略
贾军梅教授:2022年11月,斯鲁利单抗联合化疗正式获得中国国家药品监督管理局(NMPA)批准用于一线治疗鳞状非小细胞肺癌(sqNSCLC),并被 2023 年《CSCO 非小细胞肺癌诊疗指南》推荐作为晚期 sqNSCLC一线治疗Ⅰ级推荐,为该患者群体带来更多生存获益。不久前的ESMO ASIA大会中,周彩存教授团队披露了ASTRUM-004 研究中国患者群体研究数据[7],为斯鲁利单抗联合化疗一线治疗晚期或转移性sqNSCLC中国人群新增了高级别的医学证据。
ASTRUM-004研究是一项随机、双盲、多中心的国际III期研究,共纳入537例患者,其中359例为中国患者。该研究评估了斯鲁利单抗加卡铂/白蛋白紫杉醇与安慰剂加卡铂/白蛋白紫杉醇在一线治疗晚期或转移性sqNSCLC患者的疗效和安全性。主要终点为独立放射学审查委员会(IRRC)根据RECIST v1.1评估的无进展生存期(PFS)。
研究结果显示,中位随访时间为32.9个月时,在359例中国患者中,斯鲁利单抗联合化疗组相比于单纯化疗组显示出更优PFS,中位PFS分别为9.9个月对比5.8个月(图1)。斯鲁利单抗联合化疗降低了患者疾病进展或死亡的风险达57%(HR=0.43),PFS延长绝对值达到了4.1个月。斯鲁利单抗在中国肺鳞癌人群中的中位PFS达到9.9个月,是目前晚期肺鳞癌化免联合治疗研究中的历史最佳纪录。
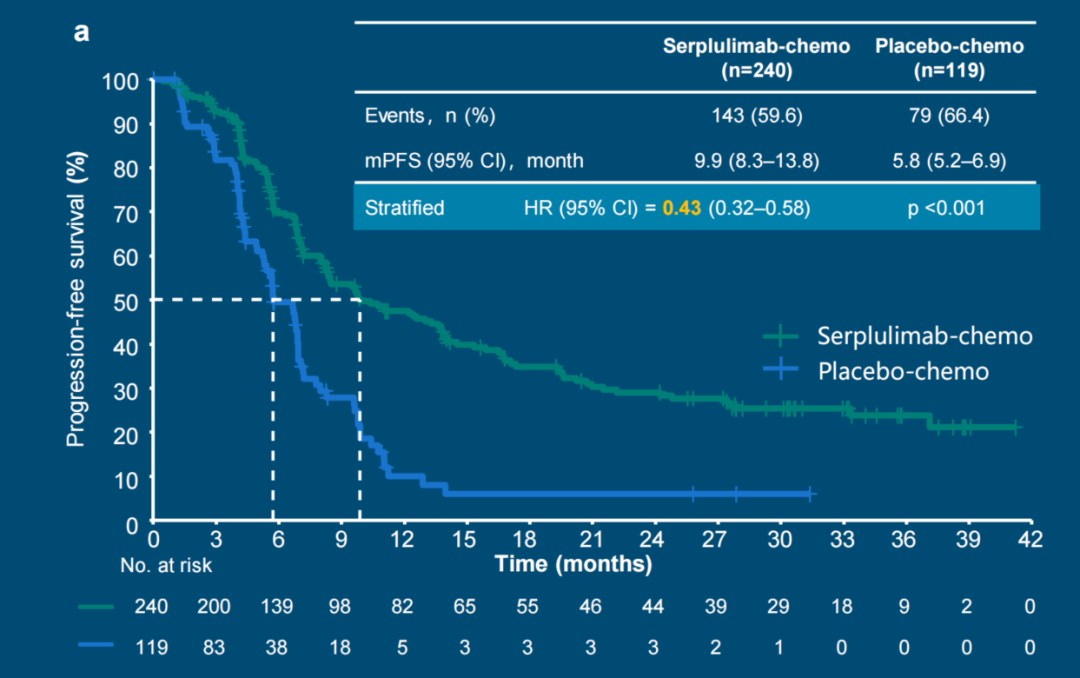
图1. 斯鲁利单抗组显著降低了57%的疾病进展或死亡风险
斯鲁利单抗联合化疗组在总生存期(OS)方面也展现出显著的优势,中位OS达到27.4个月,相比于单纯化疗组的18.4个月(HR=0.62)。斯鲁利单抗联合化疗延长了OS达9个月,降低了38%死亡风险,具有显著生存获益(图2)。
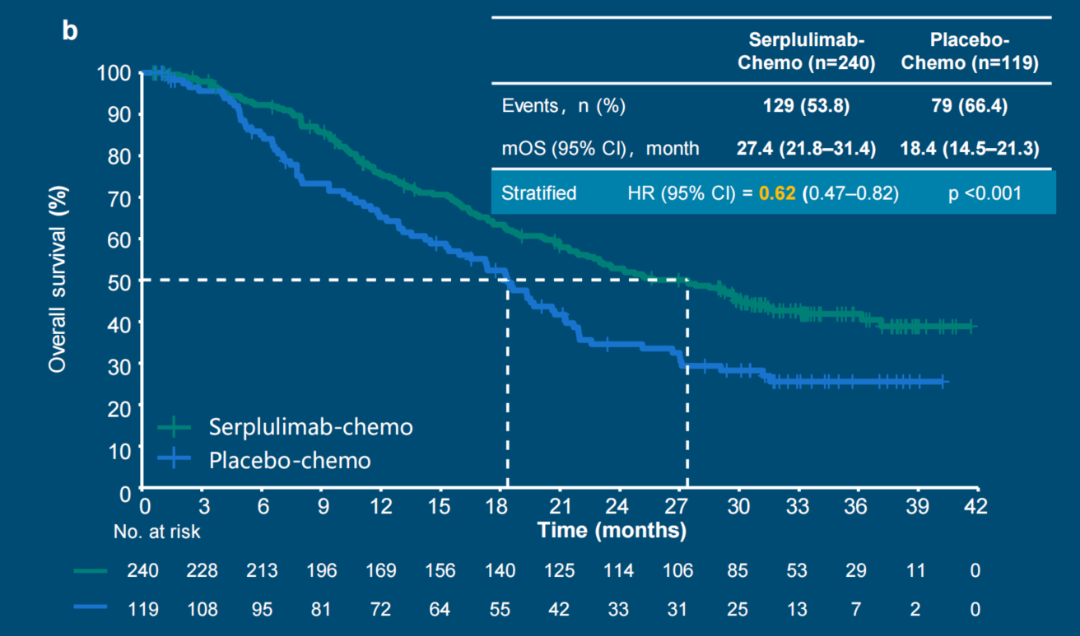
图2. 斯鲁利单抗组显著降低了38%的死亡风险
值得关注的一点是,ASTRUM-004研究设计之初允许患者进行交叉,即对照组患者在疾病进展之后,可以给予斯鲁利单抗的后线治疗。研究中有74例患者在疾病进展后交叉至斯鲁利单抗组,OS结果仍表现出显著的获益,这体现了斯鲁利单抗的卓越疗效。在经模型校正排除交叉治疗的影响后,斯鲁利单抗联合化疗组的中位OS达到了27.4个月(vs 10.7个月,HR=0.37),OS 延长了16.7个月,对比化疗组死亡风险降低了63%。无论患者是否有脑转移,斯鲁利单抗均显示出显著的临床获益。治疗能显著降低脑转移亚组疾病进展或死亡风险达69%(HR=0.31)。
ASTRUM-004研究对于临床实践具有比较大的指导意义,为中国sqNSCLC患者提供了针对性的治疗方案。安全性分析中,斯鲁利单抗联合化疗在中国人群中有着良好的安全性,斯鲁利单抗组和对照组治疗期间不良事件(TEAE)和治疗相关不良事件(TRAE)的发生率类似,大多数免疫相关不良反应(irAEs)为1~2级。这些结果直接为临床应用斯鲁利单抗提供了循证医学依据,为晚期肺鳞癌患者带来了新的治疗选择。
免疫治疗策略仍有待优化,生物标志物筛选助力最佳个体化方案制定
贾军梅教授:免疫治疗在临床中应用的越来越广泛,在为患者带来了疗效获益的同时,也带来了很多思考。我们如何能够将这一种新型的治疗药物发挥更好的效果,优化治疗策略,是我们需要思考的问题。
首先,我们需要筛选出最有可能从免疫治疗中获益的患者群体。治疗前应对主要生物标志物PD-L1的表达水平进行评估。此外,深入研究肺鳞癌的分子生物学和遗传学特征,例如突变、基因表达模式和信号传导途径,识别与筛选肺鳞癌发生和发展相关的新生物标志物,以进一步筛选治疗获益人群。
另外,还需要进一步优化对该类患者的预后情况的预测。此前有研究表明,cCD8+ TILs的浸润程度是sqNSCLC组独立的正向预后指标(P =0. 003);单变量分析中,CD8+ TILs在间质中、CD4+ TILs在癌巢和间质中、以及FOXP3+ TILs在癌间质中浓度也与不同的预后相关。这些标志物在未来预测sqNSCLC的预后中会扮演重要角色[3]。因此,我们需要进一步对肿瘤微环境中的免疫细胞和因子进行深入的探索,找到提示肿瘤免疫微环境的相关细胞因子,以助于肺鳞癌患者预后的预测。
除了筛选优势人群以及进行患者预后预测之外,目前研究新的免疫治疗联合方案也是非常重要的方向。例如哪一种化疗方案和免疫联合能够得到更好的疗效?或者免疫联合抗血管有没有可能带来新的突破?怎样组合不同的治疗药物能够给患者带来疗效上的获益?这都是我们要思考的一些临床问题。这些问题也提醒我们,免疫治疗的研究仍需努力,在将来应开展更多临床研究,以解决当下临床实践中的挑战,最终为患者探索出更精准的个体化治疗方案。
1. Zheng RS, Zhang SW, et al. Cancer incidence and mortality in China, 2016. Journal of the National Cancer Center. 2022 Mar.
2. 国家卫生健康委办公厅.原发性肺癌诊疗指南(2022年版)[J].协和医学杂志,2022,13(04):549-570.
3. Meng Xj, Gao YS, et al. Immune Microenvironment Differences Between Squamous and Non-squamous Non-small-cell Lung Cancer and Their Influence on the Prognosis. Comparative Study Clin Lung Cancer. 2019 Jan;20(1):48-58.
4. Meshulami N, Tavolacci S, de Miguel-Perez D, Rolfo C, Mack PC, Hirsch FR. Predictive Capability of PD-L1 Protein Expression for Patients With Advanced NSCLC: Any Differences Based on Histology? Clin Lung Cancer. 2023 Jul;24(5):401-406. doi: 10.1016/j.cllc.2023.03.014. Epub 2023 Apr 25. PMID: 37208221.
5. Sally CM, YW Pan, et al. Squamous cell lung cancer: Current landscape and future therapeutic options. Cancer Cell. 2022 Nov 14;40(11):1279-1293. doi: 10.1016/j.ccell.2022.09.018.
6.Gauci ML, Lanoy E, Champiat S, Caramella C, Ammari S, Aspeslagh S, Varga A, Baldini C, Bahleda R, Gazzah A, Michot JM, Postel-Vinay S, Angevin E, Ribrag V, Hollebecque A, Soria JC, Robert C, Massard C, Marabelle A. Long-Term Survival in Patients Responding to Anti-PD-1/PD-L1 Therapy and Disease Outcome upon Treatment Discontinuation. Clin Cancer Res. 2019 Feb 1;25(3):946-956. doi:10.1158/1078-0432.CCR-18-0793.
7. Abstract 540P: Phase 3 study of serplulimab plus chemotherapy as first-line therapy for advanced squamous non-small-cell lung cancer: ASTRUM-004 Asian subgroup. 2023 ESMO ASIA.
排版编辑:肿瘤资讯-CYY











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


