为进一步规范新型抗肿瘤药物临床应用,我委组织国家卫生健康委合理用药专家委员会牵头对《新型抗肿瘤药物临床应用指导原则(2022年版)》进行修改完善,制定了《新型抗肿瘤药物临床应用指导原则(2023年版)》。本文对乳腺癌用药指导原则进行整理,以飨读者。
乳腺癌常用的小分子靶向药物和大分子单克隆抗体类药物
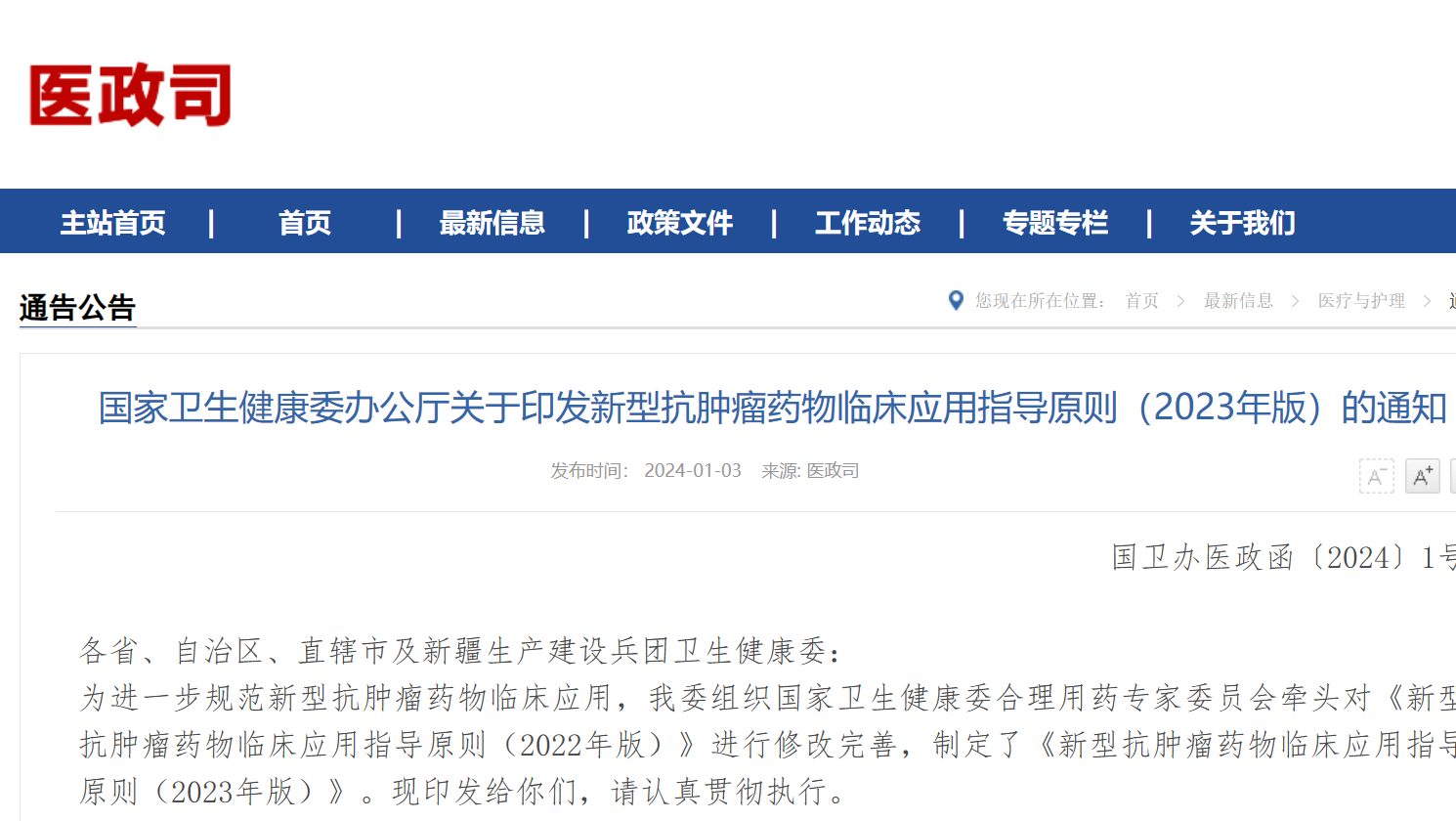
现代抗肿瘤药物的一个显著特征,是出现一批针对分子异常特征的药物——即分子靶向药物。目前,根据是否需要做分子靶点检测,可以将常用的小分子靶向药物和大分子单克隆抗体类药物分为需要检测和无需检测分子靶点两大类(表1)。
表1 乳腺癌常用的小分子靶向药物和大分子单克隆抗体类药物(2022版与2023版对比)
乳腺癌的药物临床应用指导原则(2023年版)
本文整理了2023版中新增的德曲妥珠单抗、瑞波西利、帕博利珠单抗,以及有部分内容更新的达尔西利、吡咯替尼的临床应用指导原则。其他药物的应用原则请参见“乳腺癌|新型抗肿瘤药物临床应用指导原则(2022年版)”。
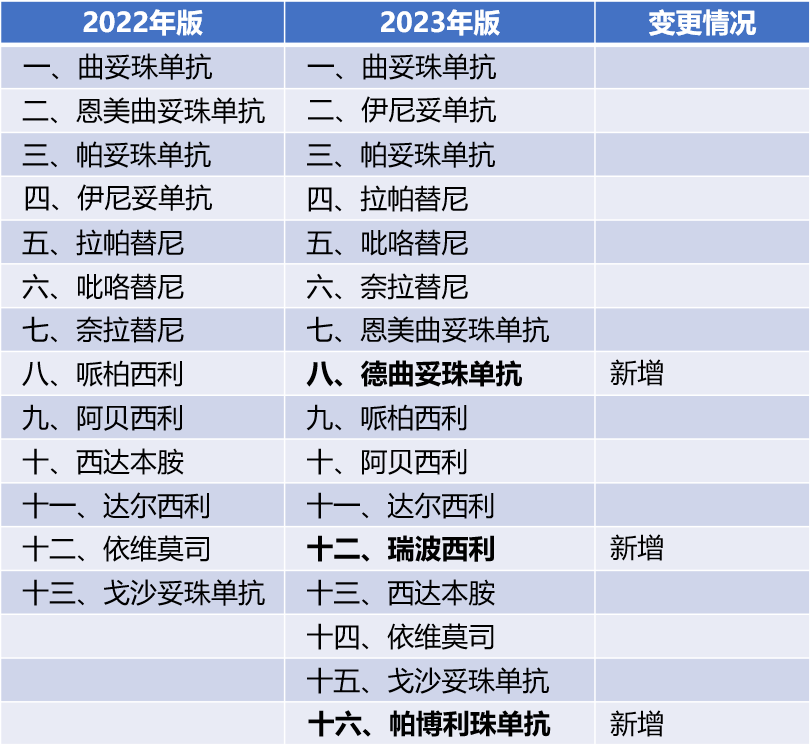
表2 乳腺癌用药(2022版与2023版对比;药物顺序有所调整)
五、吡咯替尼 Pyrotinib
【制剂与规格】
片剂: 80mg、 160mg
【适应证】
1. 复发或转移性乳腺癌:吡咯替尼联合卡培他滨,适用于治疗 HER2阳性、既往未接受或接受过曲妥珠单抗的复发或转移性乳腺癌患者。使用吡咯替尼前患者应接受过蒽环类或紫杉类化疗。与曲妥珠单抗和多西他赛联合,用于 HER2阳性、晚期阶段未接受过抗 HER2治疗的复发或转移性乳腺癌。
2. 乳腺癌新辅助治疗(附加条件批准):与曲妥珠单抗和多西他赛联合,用于 HER2阳性早期或局部晚期乳腺癌患者的新辅助治疗。
3. 本品与曲妥珠单抗和多西他赛联合,适用于治疗 HER2阳性、晚期阶段未接受过抗 HER2治疗的复发或转移性乳腺癌患者。
【合理用药要点】
1. 在使用吡咯替尼治疗前,应使用经充分验证的检测方法进行 HER2状态的检测。吡咯替尼仅可用于 HER2阳性的乳腺癌患者。
2. 晚期治疗期间只要观察到临床获益,应继续吡咯替尼治疗,直至疾病进展或出现不可耐受的毒性。
3. 吡咯替尼推荐剂量为 400mg/次,每天一次,餐后 30分钟内口服,每天同一时间服药。连续服用,每 21天为一个周期。如果患者漏服某一天的吡咯替尼,无需补服,下一次按计划服药即可。
4. 治疗过程中如患者出现不良反应,可通过暂停给药、降低剂量或停止给药进行管理。对于腹泻、皮肤不良反应可首先进行对症治疗并密切观察。一些持续存在的 2级不良反应也可能需要多次暂停用药和/或降低剂量。如暂停给药后受试者仍有临床不可控制(即临床治疗或观察≤14天后仍存在,出现≥两次)的不良事件,则在暂停后恢复用药时应减少一个水平的剂量,吡咯替尼允许下调最低剂量为 240mg。
5. 如联合使用 CYP3A4强效诱导剂或抑制剂,应密切监测,结合临床观察考虑是否调整剂量。
6. 吡咯替尼主要经肝脏代谢,中重度肝功能损伤的患者不推荐使用。肾功能损伤对吡咯替尼暴露影响非常有限,肾功能损伤患者仍应在医师指导下谨慎使用吡咯替尼。
7. 腹泻是临床试验中观察到的最常见的不良反应。治疗期间患者应关注排便性状和频率的变化,发现大便不成形后,尽早开始抗腹泻治疗,可选用洛哌丁胺或蒙脱石散。如出现持续的 3级腹泻、或 1~2级腹泻伴并发症(≥2级的恶心、呕吐、发热、便血或脱水等)时,患者应立即联系医师并接受治疗上的指导,尽早开始对症治疗。发生腹泻后可根据剂量调整指导原则进行处理。对于治疗期间频繁发生腹泻的患者,应警惕发生严重腹泻的可能。
8. 尚未确定吡咯替尼在 18岁以下儿童和青少年患者的安全性和有效性。
9. Ⅲ期临床试验(PHOEBE)数据显示,吡咯替尼联合卡培他滨治疗既往接受过曲妥珠单抗治疗失败,同时接受过蒽环类或紫杉类化疗的 HER2阳性转移性乳腺癌患者,对比拉帕替尼联合卡培他滨可显著延长中位无进展生存期(12.5个月 vs 6.8个月, HR=0.39,p<0.0001)。
10. 吡咯替尼Ⅲ期临床试验(PHEDRA)数据显示,吡咯替尼联合曲妥珠单抗和多西他赛,较安慰剂联合曲妥珠单抗和多西他赛,显著提高早期患者的病理完全缓解率(41% vs 22%,p<0.0001)。
八、德曲妥珠单抗
Trastuzumab Deruxtecan
【制剂与规格】
注射用冻干粉针剂: 100mg/瓶
【适应证】
1. 单药用于治疗既往接受过一种或一种以上抗 HER2 药物治疗的不可切除或转移性 HER2 阳性乳腺癌成人患者。
2. 单药用于治疗既往在转移性疾病阶段接受过至少一种系统治疗的, 或在辅助化疗期间或完成辅助化疗之后 6 个月内复发的, 不可切除或转移性 HER2 低表达( IHC1+或IHC2+/ISH-) 乳腺癌成人患者。
【合理用药要点】
1. 德曲妥珠单抗与曲妥珠单抗和恩美曲妥珠单抗为不同药物, 使用前应检查标签, 防止用药错误。
2. 在接受德曲妥珠单抗治疗前, 应有经记录的 HER2 阳性或者 HER2 低表达肿瘤状态。 HER2 检测必须在专业实验室进行, 以确保结果的可靠性。
3. 德曲妥珠单抗的推荐剂量为5.4mg/kg, 每3周一次(每周期 21 天) , 静脉输注, 直至疾病进展或出现不可耐受的毒性。 初始给药应为 90 分钟静脉输注, 若耐受性良好后续可采用 30 分钟输注给药。 不得通过静脉推注或快速静脉注射给药。如果患者出现输注相关反应, 应减慢德曲妥珠单抗的输注速率或中断给药。 出现严重输注相关反应时, 应永久停用。
4. 德曲妥珠单抗稀释于 100ml 的 5%葡萄糖溶液, 不得使用氯化钠溶液,不得振摇。包裹输注袋以避光。 仅可使用0.20或0.22μm的管内聚醚砜或聚砜滤器静脉输注。如果未立即使用,输注液在室温下最长放置 4 小时或在 2~8℃的冰箱中最长放置 24 小时。储存期间需避光,切勿冷冻。
5. 在每次使用德曲妥珠单抗前,应预先使用两种或三种药物组合(如地塞米松和 5-HT3受体拮抗剂和/或 NK1受体拮抗剂,以及其他适用的药物) ,用于预防化疗引起的恶心和呕吐。
6. 使用德曲妥珠单抗治疗期间,应监测患者是否出现间质性肺炎的体征和症状。怀疑发生间质性肺炎的患者应行放射影像学检查,应考虑请呼吸科或肺科医师会诊, 并参照说明书调整剂量。德曲妥珠单抗每次开始给药前以及有临床指征时,应监测全血细胞计数, 根据中性粒细胞减少症的严重程度,可能需要参照说明书中断或减少剂量;开始治疗前以及治疗期间定期( 按临床指征)评估 LVEF, LVEF 降低应通过中断治疗进行管理,如果 LEVF<40%或相对基数降低大于20%,以及发生有症状的充血性心力衰竭的患者, 应永久停药。
7. 对于不良反应的管理可能需要暂时中断给药、降低剂量或终止治疗。降低剂量后,不应再增加德曲妥珠单抗剂量。
表3 德曲妥珠单抗剂量降低方案 
8. 尚未确定德曲妥珠单抗在 18 岁以下儿童和青少年患者的安全性和有效性。中重度肝功能损伤患者应慎用本品。
※9. 基于Ⅱ 期临床研究 DESTINY-01 和 DESTINY-02 的结果,美国 FDA 已经批准德曲妥珠单抗治疗既往接受过系统性治疗的 HER2 突变不可切除或转移性 NSCLC 患者,目前国内尚未获批此适应证,可在与患者充分沟通的情况下按照 FDA批准的方法使用。
十一、达尔西利 Dalpiciclib
【制剂与规格】
片剂:50mg、125mg、150mg
【适应证】
本品适用于激素受体 HR 阳性、 HER2 阴性的局部晚期或转移性乳腺癌患者:与芳香化酶抑制剂联合使用作为初始内分泌治疗;与氟维司群联合用于既往曾接受内分泌治疗后出现疾病进展的患者。
【合理用药要点】
1. 在接受达尔西利治疗前,应在有资质的病理实验室进行检测证实 HR阳性、 HER2阴性患者方可使用。
2. 达尔西利联合内分泌治疗的推荐起始剂量为 150mg/次,每天一次,口服。每天大约同一时间服药,服药前、后 1小时禁食。连续服用 21天之后停药 7天, 28天为一个治疗周期。如果患者漏服一次,当天无需补服,下一次按计划服药即可。
3. 在达尔西利治疗开始前、每个周期开始时、前两个治疗周期的第 15天以及出现临床指征时监测全血细胞计数。对于白细胞/中性粒细胞减少症等血液学不良反应可首先进行对症治疗并密切观察。对症治疗后仍未缓解的不良反应,可对达尔西利进行暂停用药和/或降低剂量。原则:血液学毒性 1级或 2级无需调整剂量。3级血液学毒性需暂停服用达尔西利,直至恢复至≤2级。当首次出现的 3级不良反应在恢复至≤2级时,以相同剂量开始下一治疗周期。当 3级不良反应多次发生时,恢复后可考虑下调一个剂量重新开始治疗。 4级或3级及以上发热性中性粒细胞减少症需暂停服用达尔西利,直至恢复至≤2级。当首次出现 4级不良反应或 3级及以上发热性中性粒细胞减少症时,恢复后可考虑相同剂量或下调一个剂量重新开始治疗。非血液学毒性 1或 2级无需调整剂量。 3级及以上非血液学不良反应需暂停服用达尔西利,直至恢复至≤2级。以同样剂量或下调一个剂量重新开始治疗。
4. 达尔西利治疗期间应避免联合使用 CYP3A4强效抑制剂。如必须使用,应考虑暂停达尔西利;在停止使用 CYP3A4强效抑制剂且至该药物清除 3~5个半衰期后,可恢复达尔西利用药至联合使用 CYP3A4强效抑制剂前的给药剂量与频率。
5. 尚未开展达尔西利在儿童、青少年、肝肾功能损伤的药代动力学研究。但有研究提示在肝肾功能轻度异常的患者中,达尔西利的吸收、代谢和清除不受影响。
6. Ⅲ期临床试验( DAWNA-1)数据显示,达尔西利联合氟维司群较安慰剂联合氟维司群,在既往接受过内分泌治疗后进展的 HR阳性、HER2阴性患者中,显著提高无进展生存期(15.7个月 vs 7.2个月, p<0.0001)。
十二、 瑞波西利 Ribociclib
【制剂与规格】
片剂: 200mg
【适应证】
1. 与芳香化酶抑制剂联合,作为初始内分泌治疗,用于HR 阳性、HER2 阴性局部晚期或转移性乳腺癌成人患者。使用内分泌疗法治疗绝经前或围绝经期女性患者时应联用黄体生成素释放激素激动剂。
2. 与氟维司群联用作为初始内分泌治疗或用于初始内分泌治疗失败疾病进展的 HR 阳性、HER2 阴性晚期或转移性乳腺癌绝经后女性患者或男性患者。
【合理用药要点】
1. 在接受瑞波西利治疗前,应在有资质的病理实验室进行检测证实 HR阳性、HER2阴性患者方可使用。
2. 瑞波西利与内分泌治疗联用时推荐剂量为 600mg/次,每天一次,口服,连续服药 21天,之后停药 7天, 28天为一个完整治疗周期。只要患者从治疗中获得临床获益或直至发生不可接受的毒性前,应继续进行治疗。
3. 瑞波西利可与食物同服或不同服。应鼓励患者在每日大致相同的时间服用药物,最好在早晨服用。如果患者在服药后呕吐或错过服药,则不应在当日额外服药。应按照常规时间服用下一剂处方药物。瑞波西利不应随葡萄柚或葡萄柚汁同服。
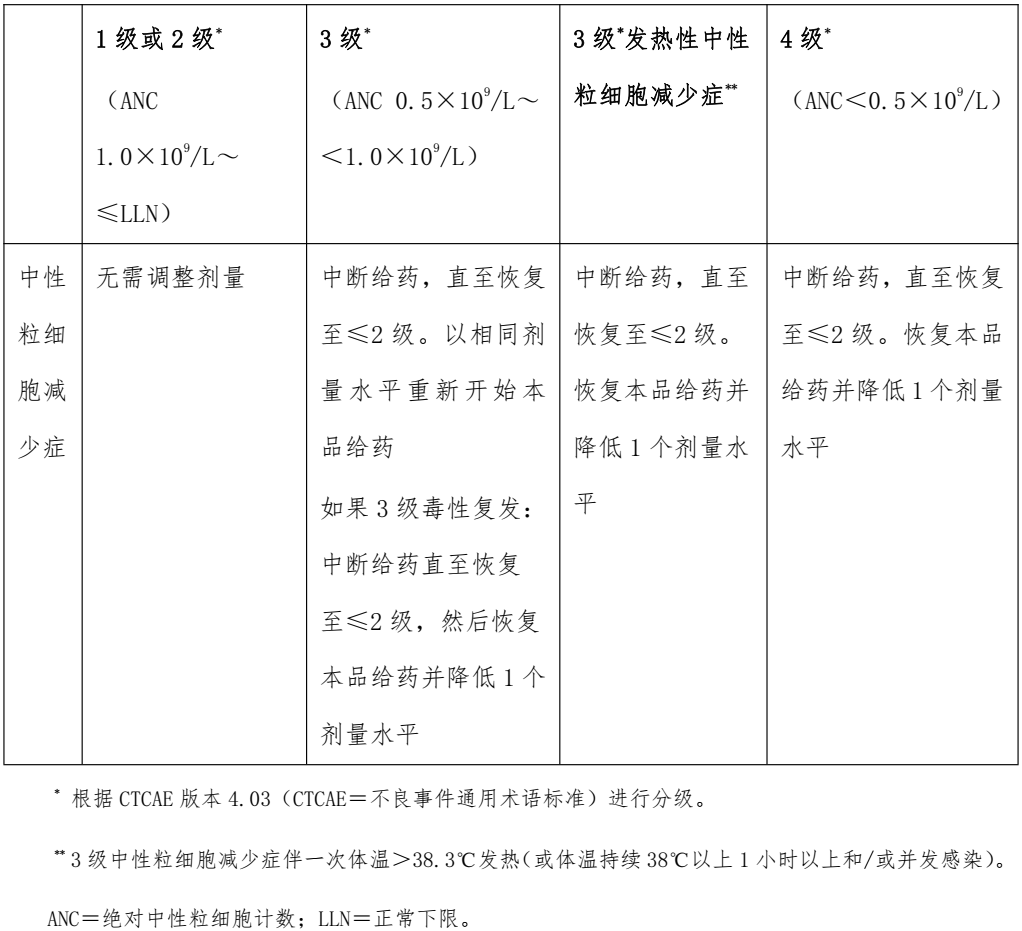
4. 在开始治疗之前应进行全血细胞计数。开始治疗后,在前 2个周期内每 2周监测全血细胞计数,随后 4个周期内在每一个周期开始时监测全血细胞计数,之后则根据临床指征监测全血细胞计数。 中性粒细胞减少症的处理措施可参见表4。
表4 瑞波西利致中性粒细胞减少症的处理措施
5. 在开始治疗前应检查心电图检测。治疗开始后, 在第1 个周期的大约第 14 天、第 2 个周期开始时重复进行心电图评估,之后则根据临床指征检查心电图。 如果在治疗期间出现了 QTc 间期延长,建议增加心电图监测频率。在 QTc 间期延长>480ms 的患者中,无论联用哪种药物,其发作中位时间为 15 天,这些变化通过中断治疗和/或剂量调整后均可逆。QTc 延长的处理措施可参见表5。
表5 瑞波西利致 QTc 延长的处理措施

6. 应避免与 CYP3A强效抑制剂联用,并考虑使用 CYP3A抑制作用较弱的替代联用药物。如果患者需要必须联用 CYP3A强效抑制剂,则应将瑞波西利剂量降至 400mg/次,每天一次。
7. Ⅲ期临床研究 MONALEESA-2、MONALEESA-3以及 MONALEESA-7研究均证实瑞波西利联合内分泌相比内分泌单药可以显著延长晚期 HR阳性、HER2阴性乳腺癌患者的无进展生存期和总生存。RIGHT Choice研究证实瑞波西利在疾病进展迅速的 HR阳性、HER2阴性乳腺癌患者中相比联合化疗可以显著延长无进展生存期( 24个月 vs 12.3个月,p= 0.0007)。
8. NATALEE研究结果显示,在更广泛的Ⅱ/Ⅲ期 HR阳性、HER2阴性早期乳腺癌患者接受 3年瑞波西利强化治疗后,相比内分泌单药,能够显著提升 3年无侵袭性疾病生存率( 90.4% vs 87.1%),肿瘤复发风险降低 25%( HR= 0.748, p=0.0014)。
十六、 帕博利珠单抗 Pembrolizumab
【制剂与规格】
注射剂: 100mg(4ml) /瓶
【适应证】
帕博利珠单抗联合化疗新辅助治疗并在手术后继续帕博利珠单抗单药辅助治疗, 用于经充分验证的检测评估肿瘤表达PD-L1综合阳性评分≥20的早期高危三阴性乳腺癌患者的治疗。
【合理用药要点】
1. 帕博利珠单抗经国家药品监督管理局批准的乳腺癌适应证,是基于全球Ⅲ期临床研究 KEYNOTE-522研究结果。对于早期Ⅱ~Ⅲ期患者,术前给予帕博利珠单抗+紫杉醇+卡铂 4周期,序贯帕博利珠单抗+多柔比星/表柔比星+环磷酰胺新辅助治疗,手术后辅助帕博利珠单抗一年,相比化疗对照组显著提高病理学完全缓解(64.8% vs 51.2%)及无事件生存( 84.5% vs 76.8%)。该方案 2021年获得美国 FDA批准, 2022年获得 NMPA批准用于早期高危三阴性 PD-L1综合阳性评分≥20)患者。
2. 对于三阴性乳腺癌的新辅助治疗和辅助治疗,患者应接受帕博利珠单抗联合化疗新辅助治疗,帕博利珠单抗按200mg每 3周一次给药共计 8次,或 400mg每 6周一次给药,共计 4次,或直至妨碍根治性手术的疾病进展或出现不可接受的毒性。术后接受帕博利珠单抗单药辅助治疗,给予 200mg每 3m周一次给药共计 9次,或 400mg每 6周一次给药,共计 5次,或直至疾病复发或出现不可接受的毒性。患者在联合化疗新辅助阶段出现妨碍根治性手术的疾病进展,或出现帕博利珠单抗相关的不可耐受毒性,则不应继续接受帕博利珠单抗单药辅助治疗。
3. 在使用本品之前应避免使用全身性糖皮质激素或其他免疫抑制剂,因为这些药物可能会影响本品的药效学活性及疗效。但在本品开始给药后,可使用全身性糖皮质激素或其他免疫抑制剂治疗免疫介导性不良反应。当帕博利珠单抗与化疗联合使用时,糖皮质激素也可以作为治疗前用药来预防呕吐和/或缓解化疗相关不良反应。
4. 根据个体患者的安全性和耐受性,可能需要暂停给药或永久停用,不建议增加或减少剂量。
5. 发生 4级或复发性 3级的免疫相关性不良反应,应永久停用帕博利珠单抗。
6. 老年患者(≥65岁)无需调整剂量。
7. 轻中度肾功能损伤患者无需调整剂量,尚未在重度肾功能损伤患者中进行本品的相关研究。
8. 轻中度肝功能损伤患者无需调整剂量,尚未在重度肝功能损伤患者中进行本品的相关研究。
9. 对于疑似免疫相关性不良反应,应进行充分的评估以确认病因或排除其他病因。根据不良反应的严重程度,应暂时停用帕博利珠单抗,并使用糖皮质激素治疗。当免疫相关性不良反应改善至≤1级时,需至少一个月的时间逐步减少糖皮质激素的用量直至停药。基于有限的临床研究数据,发生糖皮质激素无法控制的免疫相关性不良反应时可以考虑使用其他全身性免疫抑制剂。如果不良反应改善到≤1级,且糖皮质激素剂量已降至≤10mg/d强的松或等效剂量,则可在最后一次帕博利珠单抗给药后 12周内重新开始帕博利珠单抗治疗。
10. 帕博利珠单抗尚未进行正式药代动力学药物相互作用研究。由于帕博利珠单抗通过分解代谢从血液循环中清除,预计不会发生代谢性药物-药物相互作用。
※11. 美国 FDA、欧盟 EMA和日本 PMDA批准帕博利珠单抗的适应证还包括:用于治疗早期高危三阴性乳腺癌患者(无需检测 PD-L1表达),联合化疗作为新辅助治疗,然后继续单药作为术后辅助治疗。美国 FDA还批准与化疗联合使用,用于治疗PD-L1综合阳性评分≥10局部复发不可切除或转移的三阴性乳腺癌患者一线治疗。目前国内尚未获批这些适应证,可在与患者充分沟通的情况下,按照 FDA批准的用法正确使用。
点击保存☞ 新型抗肿瘤药物临床应用指导原则(2023年版)
http://www.nhc.gov.cn/yzygj/s7659/202401/48be6030a029446c93b852bfd4a5fdf6.shtml.
排版编辑:肿瘤资讯-Paine











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


