2023年12月13日,备受瞩目的《肿瘤学年鉴》(Annals of Oncology,影响因子:50.5)期刊在线发布了2023版ESMO早期乳腺癌临床实践指南——“Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up”。本期(中篇)【肿瘤资讯】整理了不同亚型EBC(新)辅助全身治疗的要点及推荐意见,供读者参阅。
点击查看指南(上篇):
2023版ESMO临床实践指南(上篇)——筛查、诊断及局部区域治疗的要点及推荐意见
EBC管理
(新)辅助全身治疗
全身治疗的基本原则和考量因素
关于全身治疗的决定应基于病理反应指导的术后全身治疗的机会、使用该治疗的益处,以及个体复发风险和对治疗类型的预测敏感性。最终决定还应考虑短期和长期毒性、患者的生物学年龄、一般健康状况、合并症和偏好。新辅助治疗应在诊断和分期完成后尽快开始(理想情况下在2-4周内)。辅助治疗应尽快开始(理想情况下在4-6周内),因为数据显示,如果在手术后超过12周才进行,其疗效会降低。当有全身辅助 ChT 指征时,也可考虑新辅助使用相同的方案。除非有禁忌症,否则所有 HR 阳性乳腺癌患者均应使用ET。
HR 阳性、HER2阴性 EBC
图4、图5提供了治疗方案,补充表S5可在《肿瘤学年鉴》在线获取,为HR阳性、HER2阴性的EBC患者提供了辅助治疗的概述。
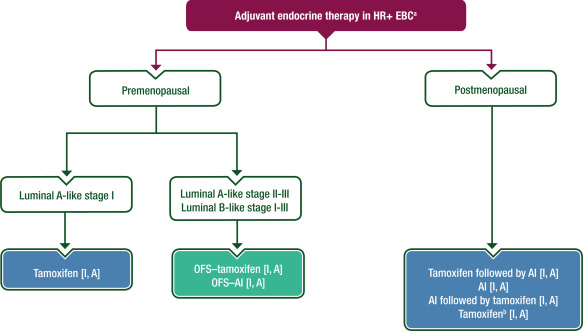
图4 在HR阳性EBC中辅助ET的作用
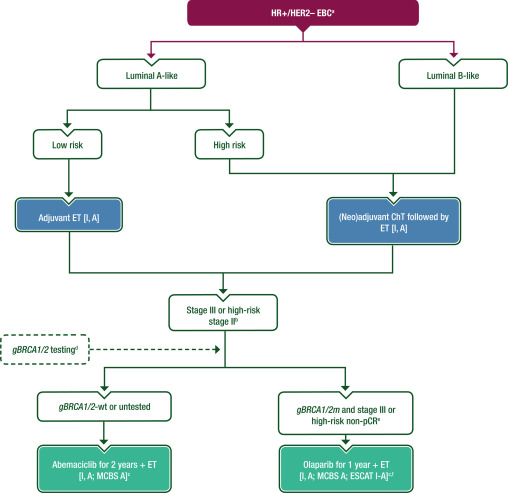
图5 HR 阳性、HER2阴性乳腺癌的全身治疗
HR 阳性、HER2阴性肿瘤是最常见的 EBC 类型,占全球所有病例的 > 70%。HR阳性癌症复发的风险因素已得到确认(见本指南的“筛选、诊断、病理学和分子生物学”章节)。
治疗根据肿瘤分期和生物学特征[亚型(补充材料第4节,可在《肿瘤学年鉴》在线获取,提供亚型分类的详细信息)]、绝经状态和几类治疗干预(包括ET、ChT和靶向治疗)进行个体化治疗。尽管 ChT 和 ET 在不同亚组中的相对获益可能相同,但绝对获益取决于个体复发风险。在与患者进行知情决策的过程中,应结合每种治疗的副作用考虑绝对获益。
解剖风险变量(肿瘤大小、淋巴结状态)不影响治疗敏感性或辅助治疗的相对获益;然而,通过指导治疗选择,它们可对绝对风险降低产生重大影响。高风险 HR 阳性肿瘤通常需要基于芳香化酶抑制剂 (AI) 的治疗,考虑ChT、靶向治疗、延长辅助ET,对于绝经前女性,还需要卵巢功能抑制 (OFS) 和ChT。
对于大多数HR阳性、HER2阴性、筛查发现的乳腺癌,手术是初始治疗方式。对于肿瘤较大或临床淋巴结受累的女性,可首选新辅助全身治疗。新辅助 ChT 可有效用于 HR 阳性、HER2阴性癌症的手术降期;然而,pCR并不常见,但其更常见于年轻患者和/或高级别肿瘤患者。对于选择适当的新辅助治疗方案,与辅助治疗的考虑相似。
无论何种乳腺癌亚型,辅助 ChT 均可降低女性的相对复发风险并使生存率提高25%-30%。越来越依赖于基于基因组特征以及其他生物学因素(即ER、PR、HER2和Ki-67)对肿瘤进行分类,以定义最适合ChT的队列。低级别和/或低 Ki-67 水平与 ER/PR强表达和对短期术前 ET 的内分泌反应的组合可作为充分有利生物学的替代指标。在LN阴性或有1-3个阳性LN和低风险基因组标记评分/低风险生物学的绝经后妇女中,与单独 ET 相比,辅助 ChT 没有进一步降低复发率。在LN阴性或1-3个阳性LN和低风险基因标签评分的绝经前女性中,与单独 ET 相比,辅助 ChT 确实降低了复发率。其中一些益处可能是由于 ChT 诱导的闭经,尽管目前尚不清楚有多少差异是由ChT对微转移癌的直接细胞毒性与继发性内分泌效应引起的。术前4周 ET 方案后使用 Ki-67 反应 (Ki67≤10%) 进行内分泌反应评估,可用于估计0-3个受累 LN 患者辅助 ChT 的获益,尤其是绝经后女性。对于需要ChT的HR阳性、HER2阴性乳腺癌女性,蒽环类、紫杉类和烷化剂基础的ChT方案是标准方案,但对于Ⅰ和Ⅱ期癌症且LN受累有限的情况,非蒽环类方案可能是更适用。
辅助 ET 几乎适用于任何分期和 HER2 状态的 HR 阳性浸润性乳腺癌患者,可降低局部复发、远处转移复发和对侧乳腺癌的风险,同时改善OS。
在 HR 阳性癌症风险较高的绝经前女性中,与他莫昔芬单药治疗相比,OFS联合 AI 或他莫昔芬可降低复发可能性并改善OS。与他莫昔芬+OFS 相比,AI+OFS可减少复发。在绝经后女性中,与他莫昔芬单药相比,AIs在他莫昔芬治疗2-3年后预先或序贯使用,复发风险较低,尤其是在高分期的癌症中。标准治疗持续时间为5年,但延长至7或10年可以进一步降低复发风险并提高生存率,尤其是在高分期癌症中。
在绝经后 EBC 女性以及接受 OFS 的绝经前女性中使用辅助双膦酸盐治疗可降低肿瘤复发风险,并减轻与AI相关的骨量减少/骨质疏松的副作用。早期乳腺癌试验协作组(EBCTCG)发表的荟萃分析表明,无论 HR 状态和双膦酸盐类型或治疗方案如何,均有获益。地舒单抗辅助治疗的大型随机试验在对乳腺癌结局的影响方面结果不一,因此不推荐使用。
在EBC中,除了ET之外,使用细胞周期依赖性激酶4/6(CDK4/6)抑制剂的靶向治疗已经广泛研究。在≥4枚阳性LN或1-3枚阳性LN且伴有其他高危因素(符合以下情况之一:肿瘤大小≥5cm、组织学分级3级、Ki-67≥20%)的HR阳性、HER2阴性EBC中,加用阿贝西利治疗2年将4年绝对复发风险降低了6.4%(HR=0.664,95%CI:0.578-0.762,P < 0.0001)。NATALEE 试验评估了在美国癌症联合委员会(第八版)Ⅱ期(N0伴2-3级和/或Ki67≥20%或N1)或Ⅲ期 HR 阳性、HER2阴性乳腺癌女性中,在辅助 ET 基础上加用瑞波西利400 mg/天(每个28天周期的第1-21天)治疗3年。该研究达到其主要终点,3年iDFS改善3.3%(HR=0.748,95%CI: 0.618-0.906,P = 0.0014)。该药在等待FDA或EMA批准,这可能成为中高风险EBC患者的另一个选择。
在 gBRCA1/2m 和高危 HER2 阴性肿瘤患者中,无论 HR 状态如何,1年奥拉帕利辅助治疗可改善DFS(HR=0.63,95%CI:0.5-0.78)和OS(HR=0.68,95%CI:0.47-0.97,P = 0.009)。4年iDFS和远端 DFS 的绝对差异分别为7.3%(95%CI: 3.0%-11.5%) 和7.4%(95%CI:3.6%-11.3%)。HR 阳性肿瘤患者在诊断时必须有≥4个受累LN,或临床和病理分期及 ER 和核分级 (CPS + EG) 评分≥3,才有资格入选试验。
虽然支持性干预可以减少许多治疗相关副作用,但考虑到 ER 阳性乳腺癌的许多常见治疗可适度降低复发或改善OS,尤其是在低风险肿瘤中,患者偏好是决定辅助治疗推荐的重要部分。
所有luminal型乳腺癌均应接受 ET 治疗 [Ⅰ,A]。
大多数luminal A型肿瘤不需要ChT,除非肿瘤负担高[Ⅰ, A]。
在辅助 ChT 适应症不确定的情况下(考虑所有临床和病理因素后),可使用基因表达测定或内分泌反应评估来指导辅助 ChT 的决策 [Ⅰ,A]。
luminal B型HR 阳性、HER2阴性肿瘤应接受 ChT后接受ET治疗。在高临床风险(例如,多LNs阳性、绝经前LN阳性、局部晚期)和0-3个具有高风险特征(如高风险基因表达检测结果)的LNs受累的情况下,应考虑ChT[Ⅰ,A]。
绝经前患者应接受他莫昔芬单药治疗(luminal A型,I期)[Ⅰ,A],或在复发风险较高的情况下,使用OFS–他莫昔芬 [Ⅰ,A] 或OFS–AI[Ⅰ,A] 进行卵巢抑制。
绝经后患者应接受AI,或他莫昔芬后接受AI治疗[Ⅰ,A]。
对于低风险肿瘤或不能耐受AI的患者,可给予他莫昔芬[Ⅰ, A]。
对于无卵巢功能的女性(绝经后或接受卵巢功能抑制),特别是复发风险高[Ⅰ, A]或治疗相关骨丢失[Ⅰ, A],建议使用双磷酸盐(最多5年)。
对于完成局部区域治疗后的III期或高风险II期EBC患者,应考虑在ET治疗后额外使用阿贝西利2年[I, A;ESMO-临床获益量表(ESMO-MCBS)v1.1评分:A]。
在高风险 EBC 中应考虑将 ET 延长至5年以上 [Ⅰ,A];对于大多数高风险患者,7-8年的治疗持续时间似乎足够 [Ⅰ,A]。
在完成(新)辅助和局部区域治疗后,对于gBRCA1/2m和HER2阴性,HR阳性EBC患者,在初次手术后多个阳性LNs或新辅助ChT后残留高风险EBC,建议接受1年的辅助奥拉帕利[Ⅰ, A;ESMO-MCBS v1.1评分:A;ESCAT:Ⅰ-A]。
在 gBRCA1/2m 携带者中,ET应与奥拉帕利辅助治疗同时给药 [Ⅰ,A]。
由于毒性重叠,不应同时使用奥拉帕利和阿贝西利,但可以在奥拉帕利之后序贯使用阿贝西利[Ⅴ, A]。
HER2阳性EBC
在 ChT 中加入曲妥珠单抗可使 OS 改善约三分之一。随访10年后,HR阳性EBC患者的相对生存获益与HR阴性EBC相同;然而,后者的复发时间更早。图6提供了一个针对HER2阳性EBC患者的治疗方案。
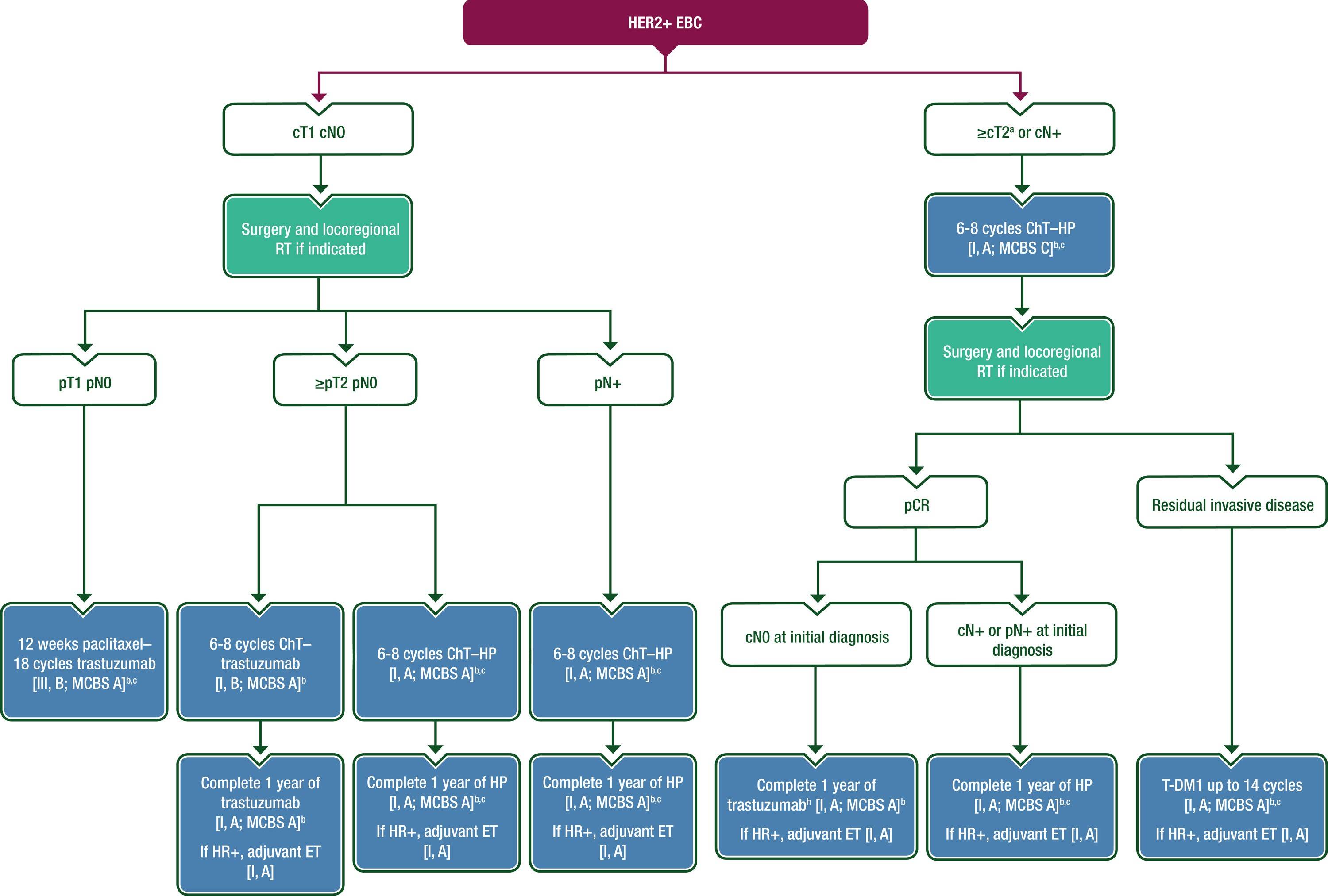
图6 HER2阳性EBC的管理
基于pCR的新辅助和新辅助后全身治疗
临床Ⅱ~Ⅲ期患者,首选方案为术前初始全身治疗后局部治疗,目的是通过病理反应评估治疗疗效,指导风险分层,缩小手术范围和确定辅助治疗方案。新辅助治疗后达到 pCR 的患者疾病复发风险显著降低。然而,初始肿瘤负荷高的患者即使达到pCR,复发风险仍较高。乳腺或LN中存在残留浸润性肿瘤表明预后较差。以蒽环类药物-紫杉烷为基础的 HER2 靶向药物联合治疗一直是 HER2 阳性疾病患者(新)辅助 ChT 的基础,但与极低但潜在严重的心脏毒性和继发性急性髓系白血病相关(每400-500例患者中增加1例治疗诱导的白血病)。在 Ⅱ期 (PREDIX HER2、TRAIN2、TRYPHAENA) 和Ⅲ期 (BCIRG-006) 临床试验中,对由卡铂和紫杉烷类组成的无蒽环类药物治疗方案进行了试验,报告了与含蒽环类药物治疗方案相似的结局,并改善了心脏安全性。新辅助 ChT 联合双重 HER2 阻断 [曲妥珠单抗-帕妥珠单抗 (HP)] 的 pCR 率高于曲妥珠单抗单药治疗,尤其是在 LN 阳性癌症患者中。在低至中风险 HER2 阳性、HR阴性疾病中,紫杉醇联合HP(术后未使用蒽环类药物)治疗12周在单臂Ⅱ期研究中显示 pCR 率 > 90%,5年 iDFS 约为98%。该方案目前正在其他优化试验中进行评价。
标准新辅助全身治疗后 pCR 的患者应继续抗 HER2 治疗,总治疗期为1年。Ⅲ期 KATHERINE 试验报告,在残留浸润性癌的患者中,恩美曲妥珠单抗 (T-DM1) 治疗显著改善了患者结局,T-DM1与曲妥珠单抗治疗的3年无浸润性疾病的患者比例分别为88.3%和77.0%。T-DM1 显著降低了浸润性乳腺癌复发或死亡的风险(HR=0.50,95%CI: 0.39-0.64,P < 0.001)。无论非 pCR 标本中的 HER2 状态如何,T-DM1均有效。辅助 RT 和 ET 可安全地与 T-DM1 同时进行,但对于广泛淋巴结照射(包括内乳LN)的患者,数据有限。对于初次诊断时临床LN阴性的 pCR 患者,在术后辅助治疗中,不应常规考虑在曲妥珠单抗基础上加用帕妥珠单抗。对于疑似基线LN阳性的患者(约30%的患者)可能有益。
HER2 阳性乳腺癌的辅助治疗
初次手术治疗的 HER2 阳性乳腺癌患者,如果 HR 阳性,应接受 HER2靶向治疗加 ChT 和 ET 的辅助治疗。ESCAT评分仅适用于 FISH/CISH 检测 HER2 基因扩增的情况。
对于病理分期pT1 pN0疾病的患者,可以考虑减轻辅助治疗的强度,使用每周一次的紫杉醇,最多12剂,同时给予12个月的曲妥珠单抗。在一项前瞻性单臂Ⅱ 期试验中,这种减轻强度的方案提供了较低的复发率,报告的10年iDFS、乳腺癌特异性生存率和 OS 率分别为91.3%、98.8%和94.3%。
APHINITY试验比较了辅助HP与曲妥珠单抗-安慰剂,两者均与基于蒽环类(78%)或基于非蒽环类的ChT联合使用。初步报告显示,HP显著改善了3年iDFS(HR=0.81,95% CI:0.66-1.00,P = 0.045)。随着随访时间的延长,LN阳性亚组维持了明显有利于 HP 的 iDFS 获益,8年 iDFS 为86% vs 81%(HR=0.72,95%CI: 0.60-0.87),OS未显著改善;在LN阴性亚组中未观察到获益。HR 阳性队列与 HR 阴性队列的获益相似。
辅助抗HER2靶向治疗的持续时间
辅助治疗中使用曲妥珠单抗的时间长度是基于关键试验的结果确定的。HERA 试验报告治疗2年无额外获益。临床研究调查了曲妥珠单抗治疗持续时间较短(6个月 vs 12个月)的非劣效性。PERSEPHONE 试验表明曲妥珠单抗治疗6个月与12个月相比具有非劣效性,而其他试验不能排除非劣效性。虽然这些结果被认为是不确定的,但在资源有限且提供12个月治疗的能力有限的情况下,可能需要平衡12个月与6个月曲妥珠单抗治疗的获益与基线复发风险。目前尚不清楚对新辅助 ChT 加 HER2 靶向治疗达到完全缓解的患者是否需要完成12个月的曲妥珠单抗治疗。
TKI作为辅助治疗
已在HER2阳性EBC的临床试验中评价了辅助酪氨酸激酶抑制剂 (TKI)。评价拉帕替尼治疗EBC的试验均未显著改善结局。Ⅲ期 ExteNET 试验在完成1年的曲妥珠单抗辅助治疗后评价了奈拉替尼1年的扩展治疗。该试验表明,奈拉替尼总体上显著改善了iDFS(HR=0.73,95%CI: 0.57-0.92,P = 0.0083),但主要在HR阳性肿瘤亚组中(HR=0.60,95%CI 0.43-0.83,P = 0.063)。该研究是在基于帕妥珠单抗或 T-DM1 的治疗出现之前进行的,目前是标准治疗。奈拉替尼与中度至重度腹泻的高发生率相关;然而,实施剂量递增方案和优化预防性干预可降低3级腹泻发生率、改善治疗依从性和降低停药率。
HER2 靶向治疗(初始同步ChT)应给药12个月,涵盖新辅助和/或辅助治疗阶段 [Ⅰ,A;ESCAT评分Ⅰ,A]。
如有指征,可与 RT 和 ET 联合使用 [Ⅰ,A]。在选定的低风险情况下,6个月的抗 HER2 治疗可能具有非劣效性。
建议定期进行心脏评估(治疗前、治疗中和治疗后),并选择在任何 ChT 治疗开始前进行额外评估 [Ⅱ,B]。
对于临床Ⅱ-Ⅲ期 HER2 阳性乳腺癌患者(例如T > 2 cm或LN阳性),抗 HER2 治疗(包括曲妥珠单抗-帕妥珠单抗)的新辅助全身 ChT 是首选 [Ⅰ,A;ESCAT评分Ⅰ,A]。
对于 ChT为基础的方案,无论新辅助或辅助治疗,蒽环类-紫杉烷或紫杉烷-卡铂方案都有证据支持 [Ⅰ,A]。
HP 双重阻断(与曲妥珠单抗单药相比)联合 ChT 可获得更高的 pCR 率,推荐用于新辅助治疗 [Ⅰ,A;ESMO-MCBS v1.1评分:C;ESCAT评分Ⅰ,A]。
有残留浸润性疾病的患者(新辅助 ChT 和抗 HER2 治疗后非pCR)应接受 T-DM1 辅助治疗,最长14个周期 [Ⅰ,A;ESMO-MCBS v1.1评分:A;ESCAT评分Ⅰ,A]。
对于Ⅰ期 (T1a-b N0)HER2 阳性 EBC 患者,可进行手术 [Ⅲ,B],随后根据病理学确认的临床分期,给予12周紫杉醇加上1年曲妥珠单抗的辅助治疗 [Ⅲ,B;ESMO-MCBS v1.1评分:A;ESCAT评分Ⅰ,A]。
对于初始手术治疗的病理分期Ⅱ期或Ⅲ 期癌症患者,应给予辅助 ChT 联合1年抗 HER2 治疗 [Ⅰ,A;曲妥珠单抗ESMO-MCBS v1.1评分:A;HP ESMO-MCBS v1.1评分:A;ESCAT评分Ⅰ,A]。
在LN阳性患者中,无论 HR 状态如何,在辅助治疗背景下均应强烈考虑在曲妥珠单抗基础上加用帕妥珠单抗 [Ⅰ,A;ESMO-MCBS v1.1评分:A;ESCAT评分Ⅰ,A]。
高风险 HR 阳性肿瘤患者可考虑在完成1年曲妥珠单抗或基于曲妥珠单抗的治疗后接受1年奈拉替尼延长治疗(与 ET 同时进行) [Ⅰ,B;ESMO-MCBS v1.1评分:无可评价获益;ESCAT评分Ⅰ,A]。
Loibl S, André F, Bachelot T, Barrios CH, Bergh J, Burstein HJ, Cardoso LMJ, Carey LA, Dawood S, Del Mastro L, Denkert C, Fallenberg EM, Francis PA, Gamal-Eldin H, Gelmon K, Geyer CE, Gnant M, Guarneri V, Gupta S, Kim SB, Krug D, Martin M, Meattini I, Morrow M, Janni W, Paluch-Shimon S, Partridge A, Poortmans P, Pusztai L, Regan MM, Sparano J, Spanic T, Swain S, Tjulandin S, Toi M, Trapani D, Tutt A, Xu B, Curigliano G, Harbeck N; ESMO Guidelines Committee. Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up†. Ann Oncol. 2023 Dec 8:S0923-7534(23)05104-9. doi: 10.1016/j.annonc.2023.11.016.
排版编辑:肿瘤资讯-Paine











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


