运动和健康饮食是否可以改善接受化疗的乳腺癌女性患者的化疗完成率和病理完全缓解 (pCR)?2023年12月1日,Journal of Clinical Oncology期刊(影响因子为45.3)在线发表了一篇名为“Randomized Trial of Exercise and Nutrition on Chemotherapy Completion and Pathologic Complete Response in Women With Breast Cancer: The Lifestyle, Exercise, and Nutrition Early After Diagnosis Study”的文章[1]。这篇文章为我们进行了解答。下面,跟着小编一起进行深度探究吧。

研究背景
化疗对降低早期乳腺癌女性死亡率至关重要[2],其中相对剂量强度(RDI)是关键指标[3],低于85%的RDI常导致治疗效果和预后恶化[4]。研究表明,高水平体力活动和良好饮食与降低乳腺癌死亡率相关,这可能是通过改善代谢和炎症生物标志物完成的。然而,许多患者在确诊时体力活动低,饮食不理想,化疗副作用进一步加剧了这些问题[5]。
锻炼和良好营养可能提高RDI,肌肉减少症和营养影响症状与较低RDI和高死亡率相关。ASCO指南推荐癌症治疗期间进行锻炼,但关于运动对RDI影响的数据有限。目前,饮食干预对RDI的影响也未明确[6]。
本研究探索了家庭运动和营养干预对乳腺癌女性化疗期间RDI的影响,以及其对接受新辅助化疗患者病理完全缓解(pCR)的潜在影响。
研究方法
LEANer研究是一项双臂随机试验,比较化疗后营养和运动干预与常规护理 (UC) 对RDI(主要目标)和新辅助化疗患者pCR(次要目标)的影响。
资格标准
纳入标准:
新诊断的I-III期乳腺癌女性。
接受化疗。
愿意随机分配。
能够行走。
每周进行少于150分钟的中度至高强度体力活动。
每天摄入少于7个水果或蔬菜。
能够理解英文说明。
排除标准:
已接受第二个化疗周期的女性。
怀孕或计划怀孕。
过去一年内经历过中风或心肌梗塞。
患有痴呆症。
患有严重精神疾病。
正在参加减肥计划。
患者招募
2018年2月至2021年7月,通过耶鲁-纽黑文医院的Smilow癌症医院网络和丹娜-法伯癌症研究所招募。使用电子病历评估初步资格,化疗处方确认和肿瘤科医生批准后进行筛选。完成基线调查问卷后,参与者随机分配至干预组或UC组,分层化疗周期和人表皮生长因子受体2 (HER2)、激素受体 (HR) 状态,使用具有可变块大小的排列方法生成随机化列表。
每日摄入量与评估
数据从EMR和治疗团队提取,包括药物剂量、给药日期及任何剂量调整或延迟原因。RDI计算为实际化疗剂量强度除以规定剂量强度的百分比,后者基于体表面积(BSA)和计划治疗周期。每种药物的RDI单独计算后求平均,包括RDI <85% 或 ≥85%、剂量调整和延迟情况。
聚合酶链反应
新辅助化疗患者的病理报告在手术后获得。如果标本(ypT0N0或ypTisN0)中无残留侵袭性疾病,则记录为pCR。
问卷调查
参与者在基线时和最后一次化疗后完成了人口统计和病史的自我报告调查问卷,包括疾病分期、手术和化疗信息、体重和身高。PA问卷评估过去3个月的活动类型、频率和持续时间,食物频率调查问卷评估膳食摄入量。完成化疗后,参与者填写了过去4周的9 种症状患者报告结果 - 不良事件通用术语标准(PRO-CTCAE)调查问卷。
干预措施
目标是让参与者遵守饮食和PA指南,包括每周至少150分钟的中等至高强度PA和两次阻力训练。营养咨询强调以植物为基础的饮食,运动计划包括渐进式力量训练和快走。干预措施根据参与者偏好和COVID-19限制,通过不同方式提供,包括第一个月每周四次会议,第二个月和第三个月每两周一次,以及此后每月一次。
UC组措施
UC 组可以在整个治疗过程中按照常规临床护理随时访问 RD 和生存诊所,并由主治肿瘤科医生酌情转诊。研究结束时,UC参与者与研究RD一起接受个性化的咨询会议,并收到 研究材料的副本。
统计考虑因素
样本量计算使用PASS 12软件,旨在检测两组间RDI的至少5%差异。统计分析总结各组特征,使用T检验和卡方检验比较结果,分析包括患者基线特征和预后因素对RDI的影响。
研究结果
通过电话对425名女性进行了筛查;173 名女性入组并被随机分配至干预组(n=87)或UC 组(n=86;图1)。登记的女性与筛查但未登记的女性的年龄、种族、民族和肿瘤类型没有差异。
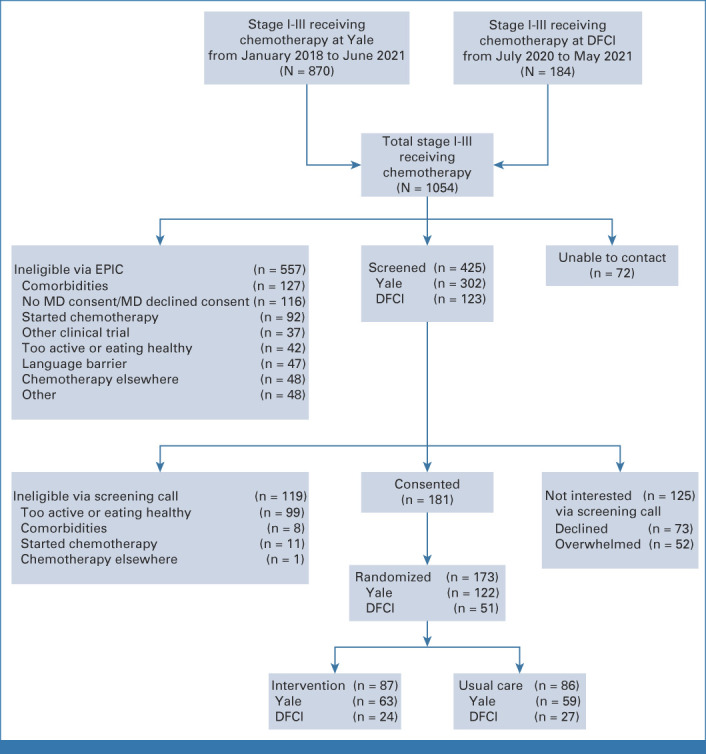
图1
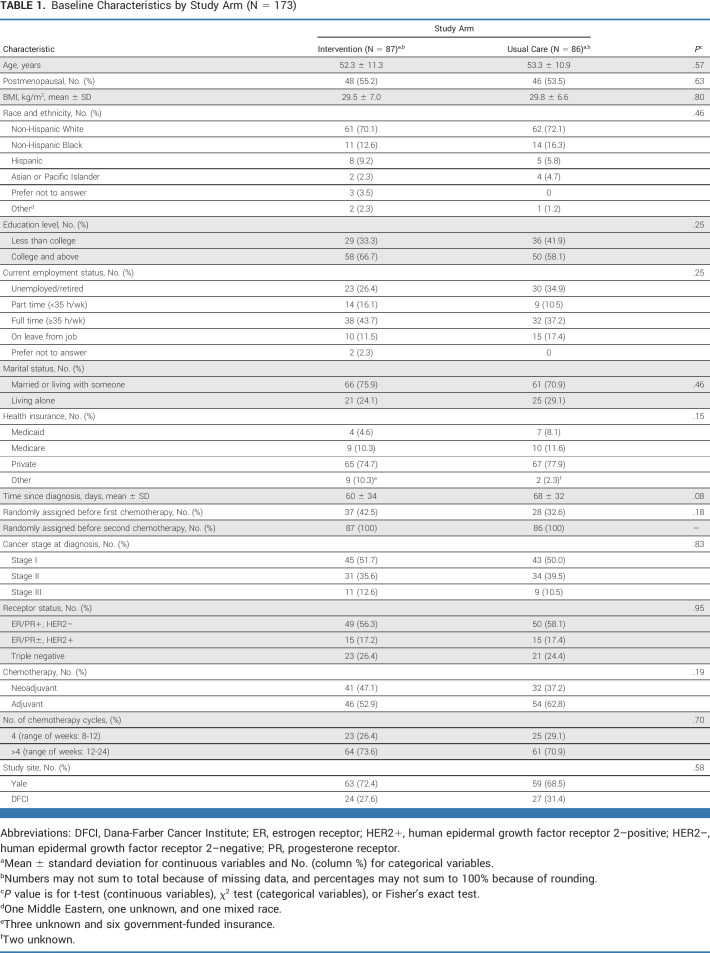
基线特征
研究显示,各组间在基线特征上表现出显著的一致性(见表1)。参与女性的平均年龄为53岁(标准差±11岁),平均体质指数(BMI)为29.7 kg/m²(标准差±6.7 kg/m²)。在种族背景方面,71%为非西班牙裔白人,14%为黑人,8%为西班牙裔。这些女性在确诊后平均64天(标准差±33天)被随机分配至相应组别。主要诊断为I期乳腺癌的女性占51%,其中42%接受了新辅助化疗,58%接受了辅助化疗。
在采用的化疗方案中,三种最常见的方案分别占到了全部治疗方案的25%。这些方案包括:每3周一次,连续4个周期的多西紫杉醇和环磷酰胺(TC × 4);剂量密集型阿霉素和环磷酰胺(ddAC),接着是每2周一次,共4个周期的剂量密集型紫杉醇(ddAC × 4,随后ddT × 4);以及剂量密集型阿霉素和环磷酰胺后,每周一次紫杉醇,持续12周(ddAC后每周T × 12)。
表1
运动和饮食的改变
在本次研究中,化疗治疗的平均持续时间为3.3个月(标准差±1.2个月)。在被随机分配至干预组的女性中,她们平均参加了8次(标准差±3次)的研究咨询课程,其中出席率高达91%。
至化疗结束时,干预组女性的运动量显著增加,平均每周增加143.4分钟(标准差±119.5分钟),相比之下,常规护理(UC)组的平均增加量仅为47.7分钟(标准差±99.6分钟;P < .001)。值得注意的是,在接受干预的女性中,有70%的人报告在化疗期间进行了力量训练,而在UC组,这一比例仅为7%(P < .0001) 。
此外,接受干预的女性在化疗期间还增加了水果、蔬菜和膳食纤维的摄入量,与UC组相比,这是一个显著的积极变化(P < .01;参见表2)。在化疗期间,两组患者的体重平均减少了大约1公斤(P = .76)。
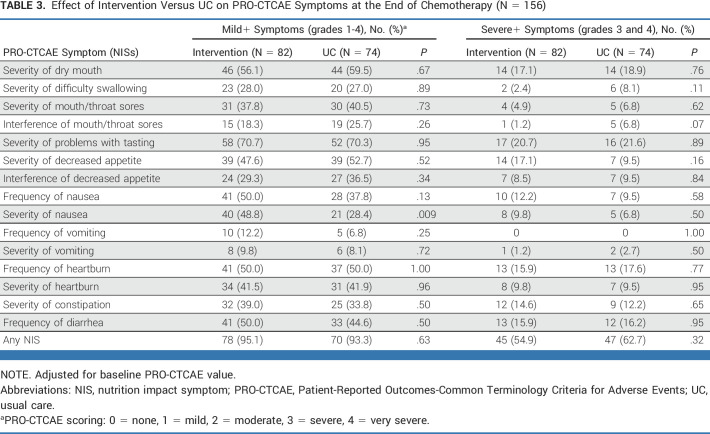
NIS(营养影响症状)
大多数女性经历过至少一次 PRO-CTCAE NIS,其中分别有 55% 和 63% 的女性被随机分配到干预组和 UC 组,经历至少一次严重 NIS(P = .32;表2)。
表2
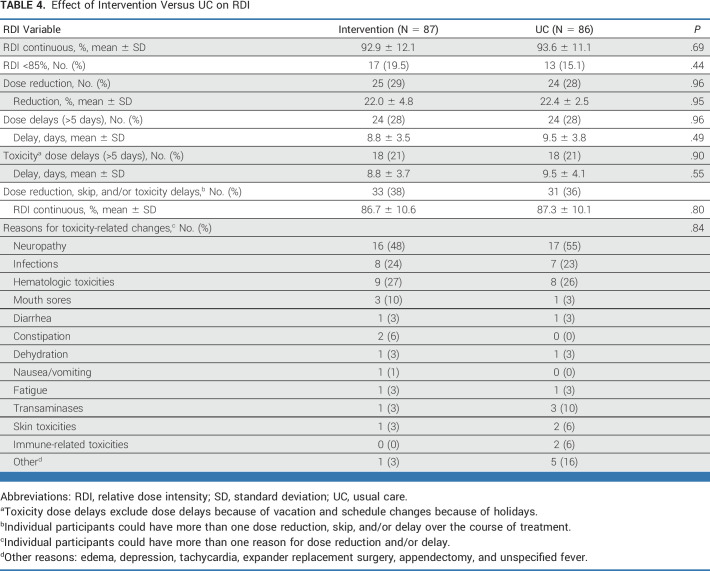
每日摄入量(RDI)
干预组和常规护理(UC)组接受的处方化疗的相对剂量强度(RDI)分别为92.9%(标准差±12.1%)和93.6%(标准差±11.1%),两组之间的差异不显著(P = .69,参见表3)。在药物特异性RDI上,以及达到或超过85% RDI的患者比例方面,干预组(81%)与对照组(85%)也没有显著差异(P = .44)。略超过三分之一的女性在治疗过程中经历了化疗剂量的减少和/或延迟(干预组38%对比UC组36%,P = .80)。导致剂量减少和/或延迟的最常见原因包括神经病变、感染和血液毒性。
此外,肿瘤分期、治疗方案、诊断时的绝经状态、激素受体(HR)状态、年龄(小于65岁对比65岁及以上)、体质指数(BMI)(小于30 kg/m²对比30 kg/m²及以上)、种族和民族、居住状况(与他人同住或独居)以及教育水平均未对干预对RDI的影响产生显著变化。"
表3
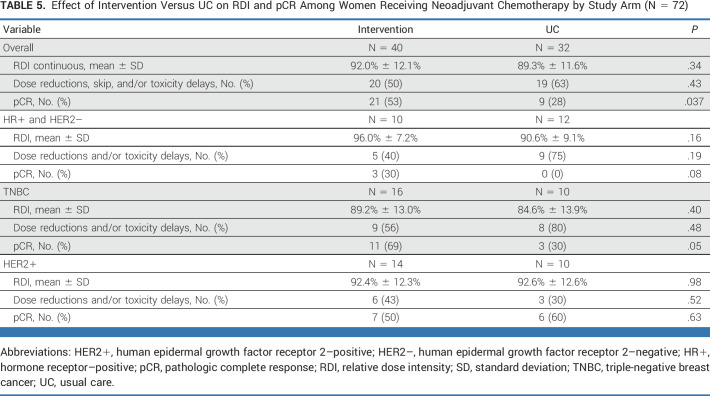
聚合酶链反应(pCR)
在接受新辅助化疗的72名女性中,干预组获得pCR的比例显著高于UC组(53% vs 28%); P = .037。结果仅限于HR+/HER2-或三阴性乳腺癌亚型女性。在该子集中,乳腺癌亚型和 RDI 在干预和 UC 方面相似(表4)。
表4
研究结论
LEANer试验显示,接受化疗的乳腺癌女性在化疗期间通过运动和营养干预显著提高了运动量(平均每周增加143分钟)和饮食质量。虽然94%的参与者至少经历一次NIS,但干预组相比UC组在化疗期间饮食质量有所改善。
[1] Sanft T, Harrigan M, McGowan C, et,al. Randomized Trial of Exercise and Nutrition on Chemotherapy Completion and Pathologic Complete Response in Women With Breast Cancer: The Lifestyle, Exercise, and Nutrition Early After Diagnosis Study. J Clin Oncol. 2023 Dec 1;41(34):5285-5295.
[2] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020 Jan;70(1):7-30.
[3] Longo DL, Duffey PL, DeVita VT Jr, et,al. The calculation of actual or received dose intensity: a comparison of published methods. J Clin Oncol. 1991 Nov;9(11):2042-51.
[4] Bonadonna G, Valagussa P, Moliterni A, et,al. Adjuvant cyclophosphamide, methotrexate, and fluorouracil in node-positive breast cancer: the results of 20 years of follow-up. N Engl J Med. 1995 Apr 6;332(14):901-6.
[5] Weycker D, Barron R, Edelsberg J, et,al. Incidence of reduced chemotherapy relative dose intensity among women with early stage breast cancer in US clinical practice. Breast Cancer Res Treat. 2012 May;133(1):301-10.
[6] Ligibel JA, Bohlke K, May AM, et,al. Exercise, Diet, and Weight Management During Cancer Treatment: ASCO Guideline. J Clin Oncol. 2022 Aug 1;40(22):2491-2507.
排版编辑:肿瘤资讯-Awa












 苏公网安备 32059002004080号
苏公网安备 32059002004080号


