近年来,免疫检查点抑制剂(ICI)已改变不可切除局部晚期或转移性非小细胞肺癌(NSCLC)的治疗格局,并不断向早期肺癌的治疗领域探索迈进。凭借IMpower010阳性研究结果,阿替利珠单抗成为首个获批早期肺癌辅助治疗适应症的ICI。美国食品药品监督管理局(FDA)和中国国家药品监督管理局(NMPA)均批准其用于:PD-L1阳性(TC≥1%)、经手术切除、以铂类为基础化疗之后的II-IIIA期NSCLC患者辅助治疗。2022世界肺癌大会(WCLC)上,业界始终高度关注的IMpower010研究5年OS数据令人振奋。无独有偶,在今年刚刚召开的WCLC上,阿替利珠单抗公布了肺癌围术期研究包括生物标志物在内等其他相关因素的探索性分析。
开山立派,IMpower010研究率先开启NSCLC辅助免疫治疗格局
IMpower010是全球首个显示辅助化疗后序贯使用辅助免疫治疗显著改善早期可切除NSCLC患者DFS的随机III期研究(图1)[1]。研究数据显示,在PD-L1 TC≥1% II-IIIA期患者中,阿替利珠单抗辅助治疗对比BSC的DFS分别为尚未达到(NR)和35.3个月(DFS HR=0.66;95% CI:0.50~0.88;p=0.0039),2年和3年DFS率均高于BSC对照组(74.8%vs61.0%、60.0%vs48.2%)。经历长达约4年的随访后,现有数据表明,阿替利珠单抗辅助治疗方案为早期NSCLC患者带来了长期生存获益。第一次预设的OS期中分析显示[2],在PD-L1 TC≥1%的II-IIIA期患者中观察到了阿替利珠单抗组对比BSC组有OS获益趋势(OS HR=0.71 ;95% CI:0.49~1.03) ,阿替利珠单抗组5年OS率达76.8%。尤其是在不包含EGFR/ALK阳性的PD-L1 TC≥50% II-IIIA期患者中获益趋势更明显(OS HR=0.42;95% CI:0.23~0.78),阿替利珠单抗组5年OS率更是高达84.8%。
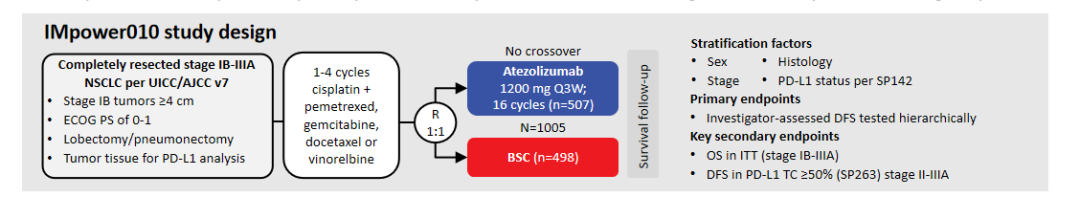
图1、IMpower010研究设计
基于此,阿替利珠单抗已在包括FDA和NMPA在内的全球多个国家获批相关适应症。在2023年《CSCO非小细胞肺癌诊疗指南》中,阿替利珠单抗更是唯一一个获得I级推荐的免疫辅助治疗ICI[3],用于PD-L1 TC≥1%、经手术切除、以铂类为基础化疗之后的II-IIIA期和IIIB(T3N2M0)期NSCLC患者的辅助治疗[4],改变了早期NSCLC治疗格局。
稳扎稳打,IMpower010研究WCLC数据更新带来全新启示
自从2021 ASCO首次公布IMpower010研究结果以来,阿替利珠单抗辅助免疫治疗的进展就频频入选国际大会,持续发表更长随访时间的数据以及重点亚组数据。诸多因素都会影响PD-1/L1抑制剂的治疗结局,包括PD-L1表达水平、ctDNA、肿瘤浸润淋巴细胞(TILs)、TMB、驱动基因突变等等。为了进一步明确阿替利珠单抗辅助治疗的获益人群,在2023WCLC上,IMpower010研究对549例TMB可评估的II-IIIA期NSCLC患者进行了TMB状态、PD-L1表达水平与DFS相关性的探索性分析报告[5]。
结果1:在阿替利珠单抗治疗组与BSC组中,TMB-H人群(n=273)的DFS较TMB-L人群(n=276)的DFS改善(图2),提示TMB状态可能与早期NSCLC患者预后相关。
结果2:无论是在TMB-H亚组还是TMB-L人群中,阿替利珠单抗对比BSC的DFS改善程度均相似(图2),提示TMB状态可能不是阿替利珠单抗辅助治疗的疗效预测指标。
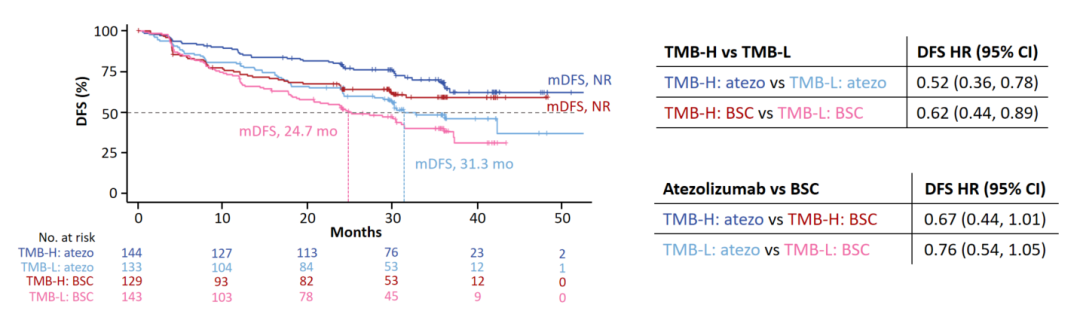
图2、基于TMB状态分层的DFS率
结果3:无论是在TMB-H亚组还是TMB-L亚组中,与PD-L1 TC<1%患者相比,在PD-L1 TC≥1%患者中都观察到了阿替利珠单抗相对BSC的DFS改善(图3),提示PD-L1表达水平可能是阿替利珠单抗辅助治疗的疗效预测指标,且不受TMB状态影响。
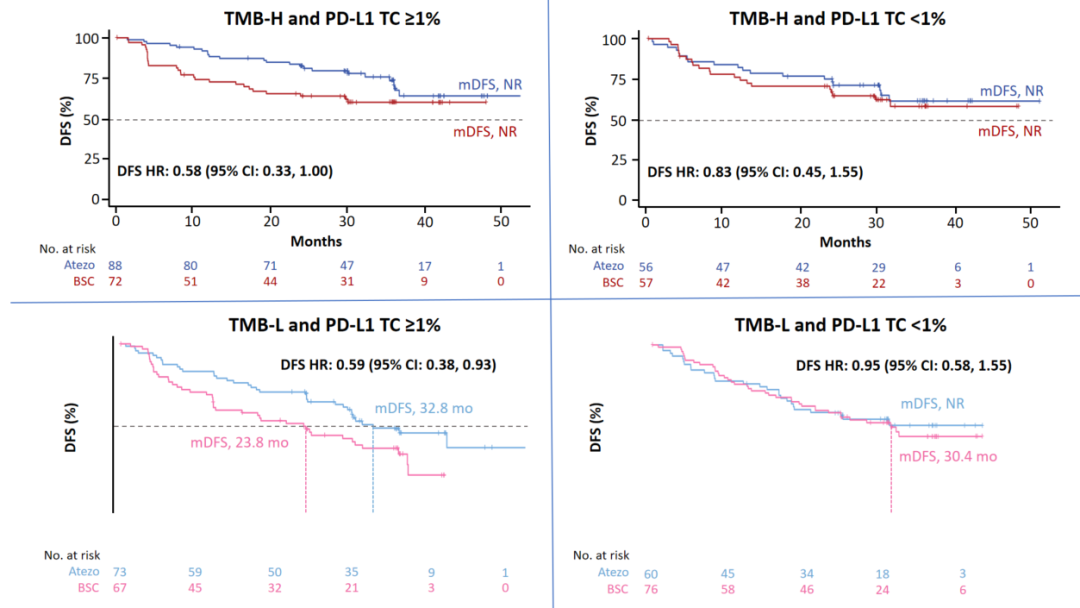
图3、以TMB状态和PD-L1表达水平分层的II-IIIA期患者DFS率
在精准诊疗背景下,获益人群的筛选、疗效预测指标和预后指标的探索始终是临床专家学者们需要不断回答的问题。既往IMpower010研究已经探索了ctDNA、PD-L1表达水平、KRAS基因突变等生物标志物在疗效及预后方面的价值[6]。此次更新的数据提示,TMB表达状态在早期NSCLC辅助免疫治疗中具有预后作用,但是其在阿替利珠单抗疗效预测方面的价值仍需探索。期待未来IMpower010研究引领更多精准分层方面的探索,更大程度地发挥免疫治疗的优势,造福更多患者。
百尺竿头,阿替利珠单抗探索NSCLC围术期免疫“夹心饼”模式
从晚期NSCLC到早期NSCLC,阿替利珠单抗已经顺利完成了“跨界”。从辅助到新辅助,阿替利珠单抗凭借LCMC3研究一举实现新辅助免疫以及“夹心饼”模式的双重探索。LCMC3研究是目前NSCLC新辅助免疫探索的最大样本量的单臂Ⅱ期临床研究(n=181),旨在探索可切除IB-IIIA及部分经选择的IIIB期NSCLC患者使用阿替利珠单抗单药新辅助免疫治疗2个周期后选择性使用阿替利珠单抗辅助治疗的疗效及安全性(图4)[7]。主要研究终点为MPR(定义为手术切除标本中存活肿瘤细胞≤10%);次要终点包括根据PD-L1表达进行分层的病理学缓解和根据PD-L1、TMB、新抗原和基因表达谱(GEP)进行分层的影像学缓解;探索性终点为DFS和OS等。
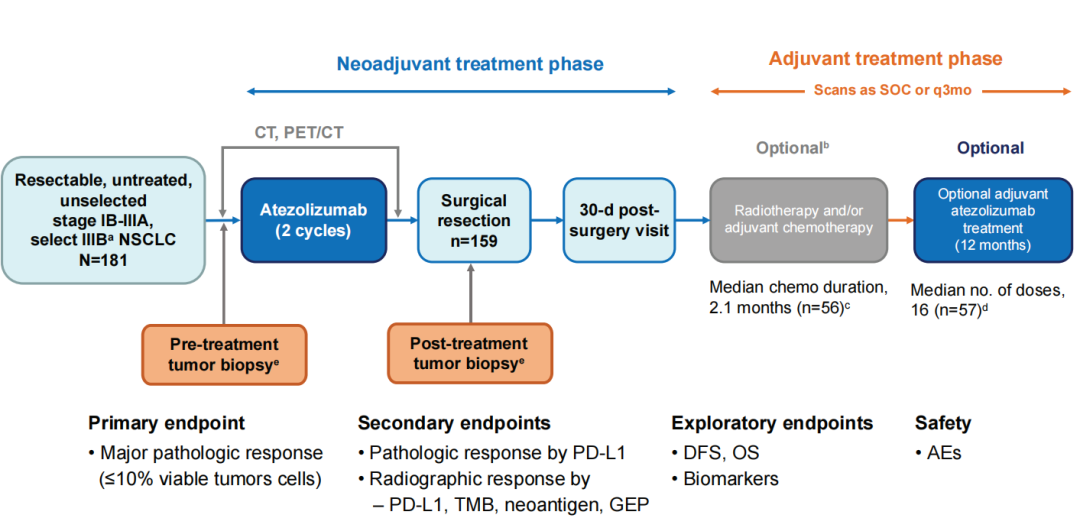
图4、LCMC3研究设计
根据LCMC3研究在2023欧洲肺癌大会(ELCC)中公布的最新结果[8],可评估MPR人群(n=137)中,接受阿替利珠单抗新辅助治疗患者的3年DFS率和3年OS率分别为72%和82%,这是非常令人鼓舞的数据。根据患者是否接受阿替利珠单抗辅助治疗进行生存分析,接受阿替利珠单抗辅助治疗(“夹心饼”模式)的患者(n=53)和未接受阿替利珠单抗辅助治疗的患者(n=84),3年DFS率分别为83%和64%(HR 0.44,95% CI:0.21~0.91),DFS有效延长;3年OS率也显示出获益趋势,分别为89%和77%(HR 0.48,95% CI:0.19~1.21)。其中采用“夹心饼”模式的患者3年OS率接近90%,实现了较为长期的生存。同时还观察到辅助治疗后未达到MPR的患者(n=108)也可从“夹心饼”模式中获益,对比未接受阿替利珠单抗辅助治疗的患者,3年DFS率分别为80%和62%(HR=0.48,95% CI:0.21~1.13),3年OS率分别为87%和75%(HR=0.50,95% CI:0.17~1.46)。提示我们针对新辅助免疫治疗缓解程度欠佳的未达MPR的患者,术后继续辅助免疫治疗的临床意义。
针对老年肺癌患者的临床诊疗,尤其是免疫治疗在老年患者中的疗效与安全性始终备受关注。在本次WCLC大会中,LCMC3研究也将患者年龄(≥65岁或者<65岁)与新辅助治疗疗效、安全性以及T细胞克隆数之间的相关性进行了探索性分析[9]。
结果1:相较于≥65岁亚组,<65岁亚组进行手术的患者比例略高,两组分别为86%和90%(P=0.49),中位住院时间分别为10(2~40)天和6(2~68)天。
结果2:在初始疗效分析中(n=143),≥65岁或者<65岁亚组的MPR率均为20%,不同年龄组间的MPR率没有差异。MPR的患者中,不同年龄组的3年DFS率或3年OS率没有显著差异
结果3:不同年龄组间的3年DFS率和3年OS率提示<65岁年龄组显示出一定的获益优势,分别为78%对比66%,87%对比77%(图5)。
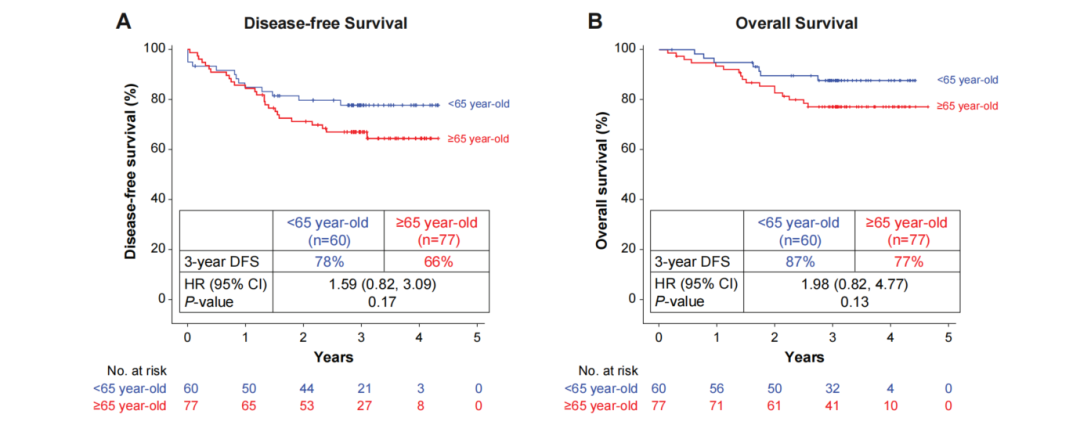
图5、基于年龄分层的3年DFS率和3年OS率
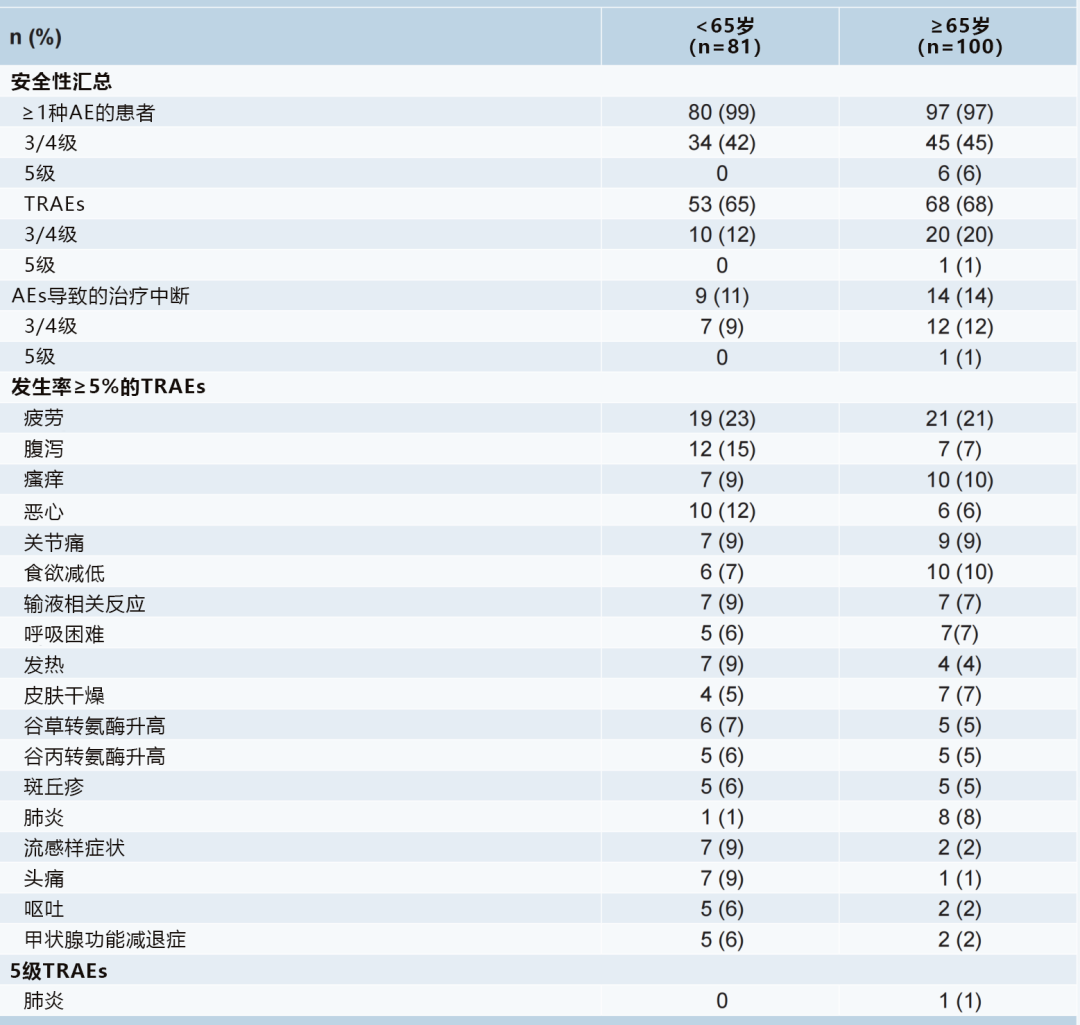
结果4:在可评估安全性人群中(n=181),≥65岁或者<65岁两个年龄组对阿替利珠单抗新辅助治疗的耐受性相似,未出现新的安全信号(表1)。
表1、两个年龄组阿替利珠单抗新辅助治疗阶段安全性数据汇总
结果5:阿替利珠单抗新辅助治疗前,在非鳞NSCLC患者的肿瘤组织标本中,<65岁亚组的中位T细胞克隆数显著低于≥65岁亚组。而在鳞状NSCLC患者的肿瘤组织标本中,<65岁亚组(n=34)的中位T细胞克隆数显著高于≥65岁亚组。在阿替利珠单抗新辅助治疗后,两个年龄亚组之间的中位T细胞克隆数差异消失(图6)。出现这种差异的原因仍需要进一步探索。
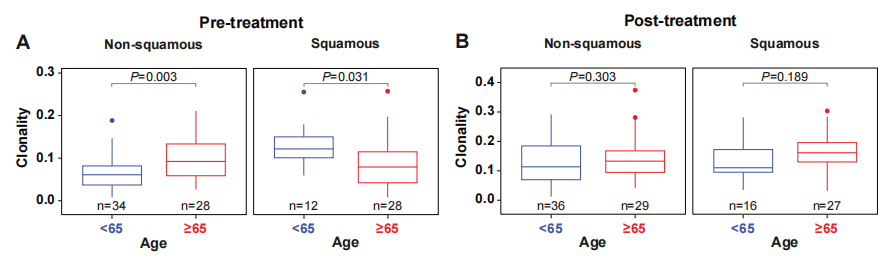
图6、基于年龄和病理学类型分层阿替利珠单抗治疗前后的中位T细胞克隆数差异
LCMC3研究中,阿替利珠单抗新辅助治疗的3年DFS率和3年OS率非常亮眼,而以阿替利珠单抗为基础的“夹心饼”模式为早期NSCLC患者带来的获益更大,3年DFS率和3年OS率分别达到了83%和89%。此次在年龄相关性探索中,阿替利珠单抗新辅助治疗的疗效和安全性在≥65岁的老年群体中亦得到了初步验证,为临床应用解决了更多的后顾之忧,提供了潜在的新的治疗选择。期待未来更长随访时间、更多适用人群的探索性分析结果。
结语
随着越来越多的ICI用于NSCLC围手术期治疗的临床研究结果的公布,肺癌围术期免疫治疗呈现全新的格局,亦为早期NSCLC患者带来更为持久的生存获益。何建行院长指出,当前还有诸多的临床问题需要进一步探索和验证,例如如何选择肺癌围术期最佳治疗模式,新辅助免疫治疗,辅助免疫治疗亦或是新辅助+辅助免疫“夹心饼”治疗模式,不同治疗模式下该如何筛选获益人群,如何选择最佳生物标志物。结合当前的循证医学证据以及临床实践经验,考虑II期NSCLC患者可能更适宜采用直接手术+术后辅助免疫治疗的模式;而III期NSCLC患者则应依据患者具体情况,考虑可采用新辅助免疫治疗,或者直接手术后再进行辅助免疫治疗或“夹心饼”模式治疗。
每一次国际学术盛宴都集聚了众多医学领域专家的智慧以及患者的共同努力,相信随着更长时间的随访和更多新的研究数据结果公布,我们能够观察到更为确切治疗模式及适合人群的选择,从而进一步改善早期NSCLC患者的预后。
1、Felip E, Altorki N, Zhou C, et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial[J]. Lancet, 2021, 398(10308): 1344-1357.
2、王洁等.IMpower010: 在IB-IIIA期可切除NSCLC患者辅助化疗后对比阿替利珠单抗与最佳支持治疗的3期全球研究的主要结果、复发部位和后续治疗分析。2022 CSCO年会。
3、《中国临床肿瘤学会非小细胞肺癌诊疗指南2022》
4、《中国临床肿瘤学会非小细胞肺癌诊疗指南2023》
5、Enriqueta F,et al.Mpower010: exploratory analysis of tumour mutational burden and disease-free survival with adjuvant atezolizumab in NSCLC,2023 WCLC.
6、Zhou C, Thaku MD, Srivastava MK, et al. IMpower010: biomarkers of disease-free survival (DFS) in a Phase 3 study of atezolizumab (atezo) vs best supportive care (BSC) after adjuvant chemotherapy in stage IB-IIIA NSCLC. Annals of Oncology (2021) 32 (suppl_7): S1373-S1391. 10.1016/annonc/annonc784.
7、Chaft, Jamie E et al. “Neoadjuvant atezolizumab for resectable non-small cell lung cancer: an open-label, single-arm phase II trial.”Nature medicine vol. 28,10 (2022): 2155-2161.
8、Carbone DP, Waqar SN, Chaft JE, et al. Updated survival, efficacy and safety of adjuvant atezolizumab after neoadjuvant atezolizumab in the phase 2 LCMC3 study. Presented at:2023 European Lung Cancer Congress;March 29-April 1, 2023;Copenhagen, Denmark. Abstract 145MO.
9、Carolyn J, Dwight H,et al. Outcomes by Age With Neoadjuvant Atezolizumab Treatment for Resectable Non-small Cell Lung Cancer in the Phase 2 LCMC3 Study,2023WCLC.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


