这几天北京雾霾严重,大家的心情或许也和雾霾一样灰暗,在过去的几天里,一些人相继离开了我们!缅怀离去的人们,感谢他们在世时所给与每个人的帮助与关怀,也珍惜身边的亲朋,去努力帮助身边每一个人,去努力过好自己的每一天!
本期GIST月评检索了来自Pubmed 2023.09.26-2023.10.25的GIST相关文献,排除仅发表英文摘要与非英文的论文,共28篇,中国学者发表论文13篇,其中包括月评小组成员北大人民医院叶颖江/高志冬老师团队、四川大学华西医院张波教授团队、福建协和医院周永建教授团队的精彩论文,表示祝贺!本期选取7篇论文进行解读,21篇进行列表。同时分享刚刚结束的ESMO年会中GIST报告 内容,有大家关注的AZD3229研究与TAS116研究的最新结果。
本期文献月评检索与文字排版得到了范雯霏女士的大力帮助,同时感谢再鼎医学GI团队协助进行论文标题首页的排版与编辑,以及ESMO GIST研究内容的检索与整理,最后感谢刘丹博士的校审!

ESMO GIST报告速递

北京大学肿瘤医院
消化肿瘤内科 李健教授
2023年欧洲肿瘤内科学年会于2023.10.20–2023.10.24在西班牙马德里举行,非常遗憾因为一些原因未能前往马德里亲自聆听并学习肿瘤最新进展,作为小的瘤种,本次ESMO年会中仍然有多篇GIST研究值得我们关注,包括大家关注的NB003(AZD3229)研究获得了口头报告的机会,同时还有在国内已经正式开始入组的热休克蛋白抑制剂TAS-116联合伊马替尼二线治疗的研究、瑞戈非尼联合免疫三线治疗GIST队列数据以及野生型GIST治疗分析。感谢再鼎医学GI团队协助我们整理ESMO GIST报告内容,现挑选部分重要研究和大家分享。其中NB003研究与TAS-116研究正在我国同步开展,靶免联合与野生型GIST治疗均是大家关注的GIST研究领域热点话题。
1. 1916MO:NB003(一种强效、选择性KIT/PDGFRα抑制剂)治疗晚期胃肠间质瘤(GIST)患者的首次人体1期试验
NB003是新一代小分子抑制剂,可选择性靶向GIST中广泛的原发和继发KIT/PDGFRα耐药突变,但对VEGFR2的作用较小。本项I期研究评估NB003治疗伊马替尼与其他标准治疗失败或不能耐受的转移性GIST的安全性,;研究分为剂量递增阶段与剂量扩展阶段,本次会议报告的是剂量递增阶段数据,本阶段研究在中国与美国同步开始。研究起始剂量为3mg/天,最高爬坡剂量为40mg/天,最终入组患者78%为四线及以上治疗患者。3例患者发生DLT,分别为水肿、疲乏、粒缺+斑丘疹;纳入的23例患者中有19例可进行缓解评价,5例PR,第16周的疾病控制率为79%。本项研究目前在国际多中心开展剂量扩展阶段研究。
2. 1917MO:CHAPTER-GIST-101:pimitespib联合伊马替尼治疗伊马替尼难治性胃肠间质瘤的1期研究
在伊马替尼耐药异种移植模型中,热休克蛋白抑制剂Pimitespib可有效抑制肿瘤生长,联合伊马替尼可进一步增强抗肿瘤活性。本项I期研究入组伊马替尼治疗失败的转移性GIST,研究采用3+3的剂量递增设计,主要研究终点是DLT与MTD,次要终点包括PFS与RR。研究中任一剂量组未发生DLT,最终确定MTD为第二个剂量水平PIMI 120mg/天;ORR 8.3%,58.3%患者PFS超过6个月;扩展阶段研究采用与舒尼替尼对比的RCT二线研究。
3. 1920MO:Regomune:瑞戈非尼 + 阿维鲁单抗治疗实体瘤的II期研究——晚期或转移性胃肠间质瘤(mGIST)队列的结果
研究评估瑞戈非尼联合阿维鲁单抗治疗既往接受过≥1线TKI治疗的转移性胃肠间质瘤的疗效与安全性,主要研究终点为6个月无进展率;最终纳入50例患者,6个月无进展率为17%,中位PFS为5.5月;确认的RR6.5%,胃原发GIST获益更高。
4. 1975P:系统性治疗KIT/PDGFRA野生型GIST患者回顾性分析
法国单中心研究回顾性分析野生型GIST接受TKI治疗疗效情况。31例转移性GIST中,NF-1型GIST占42%,SDHB型占23%,NTRK3融合1例,TSC1突变1例,未检测到驱动基因9例。31例患者均未对伊马替尼有应答,但仑伐替尼组(均为SDH缺陷型)、培唑帕尼组、舒尼替尼组和瑞戈非尼组中分别有3/3(100%)、1/3(33%)、2/20(10%)和2/10(20%)例患者达到部分缓解;培唑帕尼组PFS最长(在SDH缺陷型GIST患者中达到111个月)。
大家还可以通过以下链接下载2023ESMO GIST核心幻灯资源:
https://pan.baidu.com/s/15j6bFUpVW1d4zGBvwvBj6g 提取码: 1234

流行病学版块

1. 胃肠间质瘤发展历程的标志性事件和展望:一项文献计量学分析★★★
Hallmarks and novel insights for gastrointestinal stromal tumors: A bibliometric analysis

【摘要】:
背景:随着对胃肠间质瘤(GIST) 认识的逐步提高,许多新发现、新观点、新理念在基础与临床研究中逐渐被提出,这些重要的发现正在引领和重塑 GIST 领域的研究。本文旨在通过文献计量学的方法,将 GIST 领域的研究现状可视化,并提出未来GIST 领域潜在的发展趋势。
方法:文章检索了 Web of Science 核心合集中 GIST 领域相关研究,通过 Citespace 和 VOSviewer 软件完成文献计量学分析。
结果:研究总计包含 13,766 条检索记录,根据纳排标准,总计纳入 5,911 篇文献。通过文献计量学分析,文章描述了文献的分布特征,并总结了 4 个潜在的未来发展趋势:1. 不同地区、人群的精确发病率与临床病理学特征;2. 新的治疗、诊断、监测方法,例如新的靶向药物、用药方案、ctDNA 检测;3. “黏膜外科”与“浆膜外科”之争:术式选择、功能保护和生物学外科;4. 少见的病理类型的研究,例如 NF-1 相关型、Carney 综合征、SDH 缺陷型等。
结论:文章总结潜在研究热点可能在以上四个领域,期待文献计量学结果可以为 GIST 领域的研究者提供概览与引导。
北京大学人民医院胃肠外科
高志冬主任医师 李晨博士
【简评】::
文章采用了文献情报学中经典的文献计量的方法,主要对当前 GIST 领域三个方面进行了描述分析。
第一部分是基本的文献发表和分布特征。GIST 领域文献总体是呈现迅速上升趋势,机构聚类分析可以看到,发文量大的国家主要为美国、日本、中国、德国和意大利,国家地区间的合作网络主要有三组:分别是英-美、日-法-荷兰-比利时、中-韩-新加坡。发文量较大的机构主要集中在美国的哈佛大学及附属医院、纪念斯隆凯德林癌症中心、丹娜-法伯癌症研究所。我国发文量较大的机构包括复旦大学、上海交通大学、中山大学、浙江大学及华中科技大学等。在研究者聚类分析中,对Heinrich MC、von Mehren M、Demetri GD、 Miettinen M,Fletcher JA、Blay JY等诸多 GIST 领域的资深学者主要研究方向与合作网络进行了详细描述。
第二部分是发表文献关键词聚类分析和时序分析。文章总计提取了 9043 个关键词,仅对出现次数>20 次的进行分析,总计可构成 15 个聚类。其中,出现频率较高的包括内镜下切除、电镜特征、危险因素等聚类,包含 FNA、c-kit、CD117、TKI 药物、生存率等关键词。在时序分析中,电镜特征、Carney 综合征、恶性危险因素等关键词聚类是最早出现的,而当前的研究的聚类则多聚焦于内镜下切除/完整切除、系统治疗以及分子标志物等。
第三部分是文章根据文献计量学总结的潜在研究热点。在流行病学研究中,不同地区和人种的发病率、发病部位、病理特征差异以及基因学特征是潜在热点。在药物研究中,针对耐药性和新药的基础研究是持续的研究热点;临床药物治疗中,联合用药、放疗、ctDNA 等是潜在的热点话题。在手术治疗方面,小 GIST手术与否、2-5cm GIST内镜与外科手术的选择是热点话题。此外,作为靶向治疗的标杆瘤种,基因指导的生物学外科的理念也是未来 GIST 研究领域中的潜在热点。最后,罕见GIST 亚型的发病原因、病理特征、治疗方案、预后等,是未来的重要的研究方向之一。
2. 基于SEER数据库的胃肠道外间质瘤生存率分析:一项基于人群的研究★★★
Survival analysis of extragastrointestinal stromal tumors based on the SEER database: a population‑based study

【摘要】:
背景:胃肠道外间质瘤(EGIST)是一种罕见的间叶源性肿瘤,起源于胃肠道以外的部位。然而,人们对EGIST的人群生存分析仍然缺乏了解。因此,我们旨在利用监测、流行病学和最终结果(SEER)数据库分析EGIST患者的生存情况。
方法:利用SEER数据库确定了2000年至2019年期间诊断为GIST和EGIST的所有患者。采用多重估算法处理缺失数据。采用Kaplan-Meier分析和COX比例风险模型评估人口统计学和临床特征对总生存率(OS)和癌症特异性生存率(CSS)的影响。
结果:共有13,330名患者被纳入研究,其中12,627人确诊为GIST,703人确诊为EGIST。 与GIST患者相比,EGIST患者的OS[风险比(HR)1.732,95%置信区间(CI)1.522-1.970,P<0.001]和CSS(HR 2.167,95% CI 1.821-2.577,P<0.001)明显较差。EGIST患者的1年、3年、5年和10年平均OS率分别为78.3%、61.9%、50.5%和32.5%,相应的平均CSS率分别为84.3%、70.8%、61.3%和46.5%。多因素COX回归分析发现,年龄、种族、性别、分级、大小和手术类型是影响EGIST患者OS的独立危险因素,而年龄、性别、诊断年份、分级、手术类型和放疗则是影响CSS的独立危险因素。接受手术治疗的EGIST患者的5年OS率(49.0% vs. 39.9%,P=0.035)和CSS率(63.9% vs. 53.0%,P=0.028)明显高于未接受手术治疗的患者。
结论:与GIST患者相比,EGIST患者的预后较差;不过,手术治疗已被证明可改善预后。
福建协和医院胃肠外科
周永建教授
【简评】:
Miettinen等人于1999年首次将起源于胃肠道以外、临床病理特征和分子特征与GIST相似的软组织肿瘤定义为EGIST,EGIST可出现在网膜、腹膜后、肝脏、前列腺等胃肠道外部位。传统GIST的临床病理和生物学特征及预后已广为人知,但EGIST的临床病理和生物学特征及预后,因其病例数稀少(发病率约占所有GIST的10%或更少)而尚未得到深入研究。该研究通过分析SEER数据库中的EGIST相关数据,发现了EGIST患者的OS和CSS显著差于GIST患者,同时揭示了EGIST患者生存的危险因素与保护因素。
该研究存在一定的局限性,包括使用SEER数据库数据进行回顾性研究而产生的偏移,以及SEER数据库中未记录相关数据而影响生存分析评估等。但瑕不掩瑜,该研究是首次基于大样本量并利用具有代表性的SEER数据库对EGIST存活率进行的分析研究,加深了我们对EGIST预后的了解,也期待后续有更多关于EGIST患者的潜在发病机制、对应治疗方法的相关研究报道。
3. 过去十年胃肠道间质瘤患者的预后★★★
Patients with Gastrointestinal Stromal Tumors in the Past Decade

【摘要】:
背景:胃肠道间质瘤(GIST)是一种罕见的胃肠道间质肿瘤,约占原发性胃肠道癌症的1%至2%。由于其罕见性,人们对其总体流行病学及其病理预后因素知之甚少。本研究旨在评估过去十年中被诊断为胃肠道间质瘤的患者死亡率的独立决定因素。
研究方法:从2000-2017的来自SEER数据库中的2374名GIST患者,分析GISTs的基线特征、总死亡率(OM)以及癌症特异性死亡率(CSM)。
结果:多变量cox回归分析显示,非西班牙裔黑人患者(HR = 1.516, 95% CI 1.172-1.961, p = 0.002),80岁以上患者 (HR = 9.783, 95% CI 4.185-22.868, p = 0)、其次是 60-79 岁的患者(HR = 3.408, 95% CI 1.488-7.807, p = 0.004);男性患者(HR = 1.795, 95% CI 1.461-2.206, p < 0.001);有远处转移的晚期患者(HR = 3.865, 95%CI 2.977-5.019, p<0.001),其次是通过直接侵犯和淋巴结受累的局部转移患者(HR = 3.853,95% CI 1.551-9.57, p = 0.004);以及丧偶患者(HR = 1.975, 95% CI 1.551-9.57, p = 0.004)、其次是单身患者(HR=1.53, 95% CI 1.154-2.028,p = 0.003) 的总死亡率更高。除丧偶患者和 60-79岁患者外,其他群体的 CSM 均最高。化疗患者的 CSM 也最高(HR = 1.687, p = 0.003)。
结论:在这项关于 GIST 患者预后的最新研究中,我们发现非西班牙裔黑人患者、男性患者和 60 岁以上患者的 GIST 死亡率较高。此外,接受过化疗的患者的 GIST 特定死亡率较高,而已婚患者的死亡率较低。然而,我们还不知道这些独立的预后因素在多大程度上会影响死亡率。本研究为今后探讨这些相互作用的研究铺平了道路。这项研究的结果可能有助于临床医生识别预后不良的患者群体,因为这些患者可能需要更密切的随访和更深入的治疗。已婚患者的生存率较高,我们希望鼓励临床医生在病程早期就让患者家属参与进来,因为社会支持可能会影响预后。
中国科学院大学附属肿瘤医院结直肠外科
朱玉萍教授
【述评】:
胃肠道间质瘤(GIST)是一种罕见的胃肠道间质肿瘤,约占原发性胃肠道癌症的1%至2%。由于其罕见性,人们对其总体流行病学及其病理预后因素知之甚少。本研究旨在评估过去十年中被诊断为胃肠道间质瘤的患者死亡率的独立决定因素。该研究从SEER数据库中搜索到2000-2017的2374名GIST患者,分析GISTs的基线特征、总死亡率(OM)以及癌症特异性死亡率(CSM)。结果发现非西班牙裔黑人患者、男性患者和 60 岁以上患者的 GIST 死亡率较高。此外,接受过化疗的患者的 GIST 特定死亡率较高,而已婚患者的死亡率较低。然而,我们还不知道这些独立的预后因素在多大程度上会影响死亡率。本研究为今后探讨这些相互作用的研究铺平了道路。这项研究的结果可能有助于临床医生识别预后不良的患者群体,因为这些患者可能需要更密切的随访和更深入的治疗。已婚患者的生存率较高,我们希望鼓励临床医生在病程早期就让患者家属参与进来,因为社会支持可能会影响预后。

病理版块

1. 双光子成像揭示新辅助治疗诱发的胃肿瘤微环境组织病理学变化★★★
Two-photon imaging reveals histopathological changes in the gastric tumor microenvironment induced by neoadjuvant treatment
【摘要】:
胃癌患者在接受新辅助治疗后,肿瘤反应与生存期之间存在密切联系。准确、快速地评估治疗效果有助于后续治疗和个体预后。目前,病理检查是评估治疗反应的金标准,但它需要额外的染色,过程繁琐,耗费大量人力和时间。在这里,我们引入了一种无标记成像技术--双光子成像,用于评估术前治疗引起的组织病理学变化,重点是评估肿瘤消退和基质反应。成像数据显示,双光子成像可以无标记、快速地观察肿瘤微环境病理改变的各个方面,如坏死反应、炎症细胞浸润、粘液反应、孤立残留肿瘤细胞等。此外,还开发了一种半自动图像处理方法来提取胶原蛋白形态特征,统计结果表明,治疗和未治疗的胃癌组织在胶原蛋白面积、长度、宽度、交联空间等方面存在显著差异。随着便携式微型双光子成像设备的出现,我们有足够的理由相信,这项技术将成为评估新辅助治疗反应的重要辅助诊断工具,从而为患者量身定制最合适的治疗策略。
福建协和医院胃肠外科
周永建教授
【简评】:
新辅助治疗作为局部晚期胃癌的标准治疗方法,对晚期胃癌患者生存率的提高已得到临床试验证实。不同胃癌患者接受新辅助治疗的获益程度不同,术后评估胃癌对新辅助治疗的反应,可提供预后信息、帮助指导后续治疗决策。术后组织病理学检查是评估胃癌患者新辅助治疗效果的金标准,但需要额外的染色,存在繁琐、费力、耗时的局限性。双光子成像技术是近期研究的热门之一,能对新鲜组织切片进行亚细胞水平高对比度、无标记成像,相较于传统光学相干断层扫描、光声显微镜技术,能提供更高分辨率的生物组织光学图像,精确监测组织病理学变化而在评估新辅助治疗后的肿瘤反应中具有潜力。
该研究对来自福建协和的45例手术切除胃标本进行双光子成像,结果显示双光子显微镜能够无标记检测出新辅助治疗导致的病理变化(包括肿瘤消退、坏死、炎性细胞浸润等),同时观察到了在肿瘤发生发展过程中肿瘤微环境内胶原形态发生的变化。作者通过一系列的图像分析,对治疗和未治疗的癌症组织的胶原形态差异进行定量评估,也发现一些有趣的现象和机理,为我们后续的研究提供了重要思路。虽然该研究存在样本量较少、未实现自动定量分析等局限性,但瑕不掩瑜,随着双光子成像技术的不断进步,可以预见该技术在新辅助治疗的肿瘤反应评估和临床决策指定中的应用潜力,也期待后续进一步的研究结果报道。

影像版块

1. 个体化影像组学标签筛选KIT-11突变胃肠间质瘤患者:一项多中心回顾性研究★★★
Personalized radiomics signature to screen for KIT-11 mutation genotypes among patients with gastrointestinal stromal tumors: a retrospective multicenter study

【摘要】:
目标:携带不同KIT-11基因突变的GIST有不同的预后,对伊马替尼的治疗反应也存在差异。本文探索CT影像组学是否可以对KIT-11突变基因型进行准确分层,以辅助伊马替尼治疗选择和监测。
方法:来自3个独立中心的1143名GIST患者被分为训练队列(TC)及验证队列(VC)。根据KIT-11突变类型分为4类:无KIT-11突变(K11-NM)、点突变或重复突变(K11-PM / D)、KIT-11 557/558缺失突变(K11-557/558D)和无557/558的KIT-11缺失突变(K11-D)。随后,基于增强CT动脉期图像生成影像组学标签(RS),提取1408个定量图像特征,通过LASSO降维构建KIT-11突变预测模型,并评估其预测能力。
结果:在训练组中,判断K11-NM, K11-PM/D, K11-557/558D和 K11-D 的AUC值分别为 0.848 (95% CI 0.812–0.884),0.759 (95% CI 0.722–0.797), 0.956 (95% CI 0.938–0.974)和0.876 (95% CI 0.844–0.908), 在验证组则分别为0.723 (95% CI 0.660–0.786), 0.688 (95% CI 0.643–0.732), 0.870 (95% CI 0.824–0.918)和 0.830 (95% CI 0.780–0.878). 宏观加权AUC范围在训练队列中为0.838(95%CI 0.820-0.855),在验证队列中为0.758(95%CI 0.758-0.784)。训练队列中基于RS的KIT-11突变分型预测的总体准确度为0.694(95%CI 0.660–0.729),而验证队列的准确度为0.637(95%CI 0.595–0.679)。
结论:CT影像组学特征在区分不同KIT-11基因突变分型方面表现出良好的预测效能,特别是对K11-557/558D基因型的预测。基于 RS 的 K11-NM、K11-557/558D 和 K11-D 患者分类可能作为伊马替尼治疗选择的指征。
北京大学肿瘤医院
医学影像科 唐磊教授
【简评】:
上期刚刚解读一篇基于临床-影像组学的KIT 外显子11缺失突变胃肠间质瘤的治疗决策支持模型研究,本篇文献同样针对KIT-11,探索方向有异曲同工之妙。亮点是超过千例患者入组,应该是近年来同类研究中最大的样本量了,在此大样本的加持下,研究团队也得以在传统二分类研究(基因表达阴性/阳性)的基础上,进一步探索影像组学(更确切说是影像基因组学,radiogenomics)在区分四种KIT-11基因突变亚型中的效能,得到了比较满意的结果。影像组学方面,研究并未探索过于高深的算法技术,只是基于PyRadiomics提取了诸如GLCM等常规一二阶纹理特征(如作者在局限性中所说,希望该模型能够得到广泛的应用验证,所以越普遍越常规的技术,更有利于推广),所构建模型还是获得了较高的诊断效能,训练组和验证组AUC值均达到0.75以上,准确率不足0.7还有待进一步提高。尽管已是大样本研究,在讨论的局限性部分作者还是做了详细的阐述,也对未来的大样本研究提出了建议,比如一些少见的突变类型,样本量仍不足所以未做进一步分析,如KIT-9, KIT-12 和PDGFRA突变的判断,但这些对治疗选择又是很重要的,未来需要更大样本分析;以及病灶分割测量方面,二维vs.三维,人工vs.自动等方面的改进,为未来研究指出方向。但不管如何,三家医院一千例的大样本,本身对GIST影像学研究领域就是一个很大的鼓励,如果能够扩大到十家或者更多的中心,大家齐心协力做几项更大样本的研究,相信能够为GIST精准诊疗提供更多有意义的信息。

药物版块

1. 拉罗替尼在成人原肌球蛋白受体激酶(TRK)融合肉瘤患者中的疗效和安全性★★★★
Larotrectinib efficacy and safety in adult patients with tropomyosin receptor kinase fusion sarcomas

正文主要内容:
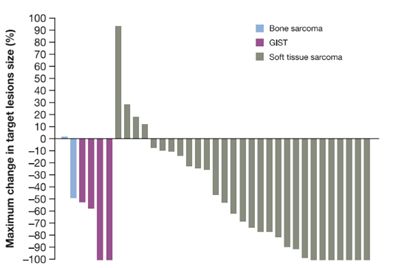
拉罗替尼是一种高选择性、“first-in-class”原肌球蛋白受体激酶(TRK)抑制剂,已被证明对成人和儿童各种携带NTRK基因融合的实体瘤患者有效。该研究主要考察拉罗替尼在成人TRK融合肉瘤患者扩展队列亚组中的有效性和安全性。从三项临床试验中确定了携带NTRK基因融合的肉瘤患者(≥18岁),接受拉罗替尼100mg口服,每日两次。研究者根据RECIST v1.1对疗效进行评估,数据截止日期为2021年7月20日。共纳入36例患者:2例(6%)为骨肉瘤,4例(11%)为胃肠道间质瘤,30例(83%)患者为软组织肉瘤。所有患者均可评估疗效,ORR为58%,中位PFS 28.3个月,36个月OS率为77%[其中4例GIST患者(1CR,3PR,如下图)中位DoR为 26.3个月,随访时间50.4 个月];AE多为1/ 2级,15例(42%)患者发生了3级治疗突发事件(TEAE),没有4级,2例5级TEAE,均与药物不相关,4例(11%)患者因TEAE永久停药。由此得出结论,在成人TRK融合肉瘤患者中拉罗替尼表现出稳健和持久的疗效,延长了生存期,并具有良好的安全性,随访时间更长,NTRK基因融合检测应纳入各种类型肉瘤成人患者的临床管理。
东部战区总医院肿瘤中心
刘秀峰教授
【述评】:
1、NTRK(神经营养酪氨酸受体激酶基因) 1/2/3对应编码TRK A/B/C,拉罗替尼作为一种口服TRK A/B/C的抑制剂,在NTRK融合突变的17瘤种“篮子”试验中表现惊艳(N Engl J Med, 2018;378:731-739.),同道们可以溯源。
2、该研究本身就是扩展队列的subset,笔者必须在此基础上开根号。GIST“离家出走”20年了,拉罗替尼牵线,本次回归软组织肿瘤大家庭。说是拉罗替尼牵线,其实有沈琳老师、刘天舒老师的功劳。本文发表之日,想必“天朗气清,惠风和畅”,而这样的团队合作也定是“群贤毕至,少长咸集”。
3、 成人软组织肉瘤NTRK融合突变率不足5%,本队列36例患者分析结果发表弥足珍贵。作者建议将NTRK基因融合检测纳入各类肉瘤成人患者的临床管理,当然也包括GIST。如果C-KIT和PDGFRA野生,同道们记得检测!如果耐药呢?本队列70%以上既往都接受系统治疗,但不足以说明拉罗替尼克服了耐药,也许只是当时不认识NTRK。如果此刻您的门诊遇到了NTRK融合的GIST患者,CSCO指南2023版有推荐(p49),但可能明年需要更新文献了。

外科版块

1. 直肠胃肠道间质瘤的局部切除术和根治性切除术:荟萃分析方案★★★
Local excision and radical excision for rectal gastrointestinal stromal tumors: a meta-analysis protocol

【摘要】:
背景:迄今为止,已有多项研究比较了直肠胃肠道间质瘤(GIST)的局部切除术(LE)和根治性切除术(RE)的手术和肿瘤学结果,但其中一些研究是小样本,病例数有限。本方案概述了系统综述和荟萃分析的计划范围和方法,将比较LE和RE对直肠GIST患者的外科和肿瘤学效果。
方法:本研究方案是根据PRISMA-P指南制定的。将对 PubMed、Embase、Web of Science、Cochrane Library和万方数据库进行系统检索。此外,所有纳入文章的参考文献将进行人工筛选,以添加其他符合条件的研究。我们将纳入随机对照试验(RCT)和非随机研究(NRS)。评估的主要结果是R0切除率和无病生存率,次要结果包括总生存率、住院时间、肿瘤破裂率和并发症。两名审稿人将独立筛选研究,从纳入的研究中提取数据,并评估纳入研究的偏倚风险。本方案中详细介绍了预先计划的亚组分析和敏感性分析。证据的强度将采用 GRADE证据分级。
讨论:本综述和荟萃分析将对直肠GIST患者应用LE和RE的现有证据进行全面评估。本综述的研究结果将为今后的研究奠定基础,并强调对临床实践的影响。
四川大学华西医院胃肠外科 张波教授
【简评】:
GIST可发生在从食道到肛门的任何部位,但主要发生在胃(60-70%),其次是小肠(20-30%),约5%发生在直肠。虽然直肠GIST的发病率较低,但其恶性程度高,预后较差。手术切除是原发局部GIST的唯一治愈方法。直肠GIST的手术方法有两种:局部切除术和根治性切除术。局部切除术具有创伤小、恢复快的优点,但存在切除不彻底和肿瘤破裂的风险,有可能增加局部复发的几率。根治性切除术可实现完整的切除,但会增加各种术后并发症以及降低术后的生活质量。由于手术涉及到复杂的解剖区域、肛门保留和术后的泌尿生殖神经功能,直肠GIST的最佳手术方式仍然存在争议。目前,手术方式的选择主要取决于医生的偏好和经验。
既往比较直肠GIST的两种手术方式效果的研究纳入的临床病例数少,对手术决策提供的证据力度较弱。因此,有必要对新的研究结果及现有证据进行重新评估。期待该荟萃分析的结果会对手术方式的选择提供更加可靠的证据。
GIST文献(2023.10)列表
1. Sci Rep. 2023 Oct 16;13(1):17568.
doi: 10.1038/s41598-023-43902-4.
Computed tomographic imaging features to differentiate gastric schwannomas from gastrointestinal stromal tumours: a matched case-control study
Lijia Wang, Qi Wang, Li Yang, et al.
Department of Radiology, The Fourth Hospital of Hebei Medical University and Hebei Provincial Tumor Hospital, 12 Jiangkang Road, Shijiazhuang, 050011, Hebei Province, China.
2. BMC Med Inform Decis Mak. 2023 Oct 13;23(1):214.
doi: 10.1186/s12911-023-02324-y.
Intelligent identification system of gastric stromal tumors based on blood biopsy indicators
Shangjun Han, Meijuan Song, Jiarui Wang, et al.
Department of the First Clinical Medical College, Gansu University of Traditional Chinese Medicine, Lanzhou, People's Republic of China.
3. Curr Med Sci. 2023 Oct;43(5):935-946.
doi: 10.1007/s11596-023-2715-8. Epub 2023 Oct 13.
MicroRNA-409-5p Inhibits GIST Tumorigenesis and Improves Imatinib Resistance by Targeting KDM4D Expression
Cheng Qiu, Yong-Dong Feng, Xi Yang
GI Cancer Research Institute, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan, 430030, China.
4. Cureus. 2023 Sep 8;15(9):e44926.
doi: 10.7759/cureus.44926. eCollection 2023 Sep.
A Rare Case of Gastrointestinal Stromal Tumor of the Abdominal Cavity: A Case Report
Carlos Ignacio Rafael-Perez, Alexis Jared Paz-López, Paola Saskia Castañeda-Anaya
Digestive and Endocrine Surgery Department, Unidad Médica de Alta Especialidad No. 25, Monterrey, MEX.
5. Ann Surg Oncol. 2023 Oct 9.
doi: 10.1245/s10434-023-14346-x. Online ahead of print.
Neoadjuvant Imatinib in Locally Advanced Gastrointestinal Stromal Tumors (GISTs) is Effective and Safe: Results from a Prospective Single-Center Study with 108 Patients
Stijn J C van der Burg, Deborah van de Wal, Evelyne Roets, et al.
Department of Surgery, Netherlands Cancer Institute, Antoni van Leeuwenhoek Hospital (NCI-AVL), Amsterdam, The Netherlands.
6. J Adv Pract Oncol. 2023 Sep;14(6):541-547.
doi: 10.6004/jadpro.2023.14.6.7. Epub 2023 Sep 1.
Surgical Management of Gastrointestinal Stromal Tumors
Heather Townsend
From Atrium Health Carolinas Medical Center, Charlotte, North Carolina.
7. J Med Ultrason (2001). 2023 Oct 5.
doi: 10.1007/s10396-023-01373-0. Online ahead of print.
Predicting the risk stratification of gastrointestinal stromal tumors using machine learning-based ultrasound radiomics
Minling Zhuo, Yi Tang, Jingjing Guo, et al.
Department of Ultrasound, Fujian Medical University Affiliated Union Hospital, No. 29 Xinquan Road, Fuzhou, 350001, Fujian, China.
8. Ann Ital Chir. 2023:94:358-366.
Synchronous and metachronous neoplasms of different histogenesis with gastrointestinal stromal tumor (GIST): 10 years experience of a single institution
Zafer Teke, Ahmet Rencuzogullari, Orcun Yalav, Osman Erdogan, Serdar Gumus, Figen Doran
9. Onco Targets Ther. 2023 Sep 27:16:785-799.
doi: 10.2147/OTT.S404648. eCollection 2023.
c-Kit Receptors as a Therapeutic Target in Cancer: Current Insights
Mona S Abdellateif, Ahmed K Bayoumi, Mohammed Aly Mohammed
Medical Biochemistry and Molecular Biology, Cancer Biology Department, National Cancer Institute, Cairo University, Cairo, 11796, Egypt.
10. Neoplasma. 2023 Aug;70(4):526-533.
doi: 10.4149/neo_2023_230523N272.
LncRNA HIF1A-AS2 mediates imatinib resistance by regulating autophagy in gastrointestinal stromal tumor cells
Jingyi Yan, Xiaolei Chen, Ji Lin, et al.
Department of Gastroenterology and General Surgery, The Quzhou Affiliated Hospital of Wenzhou Medical University, Quzhou People's Hospital, Quzhou, Zhejiang, China.
11. Diagn Pathol. 2023 Oct 3;18(1):110.
doi: 10.1186/s13000-023-01398-6.
Jejunal gastrointestinal stromal tumor that developed in a patient with neurofibromatosis type 1: a case report
Hideki Nagano, Shigekazu Ohyama, Atsushi Sato, et al.
Department of Surgery, Marunouchi Hospital, 1-7-45, Nagisa Matsumoto, Nagano, 390-0841, Japan. naganohideki06s@gmail.com.
12. Front Oncol. 2023 Sep 14:13:1233561.
doi: 10.3389/fonc.2023.1233561. eCollection 2023.
De novo dedifferentiated SDH-deficient gastrointestinal stromal tumor with MDM2 amplification: case report and literature review
Qi-Xing Gong, Ying Ding, Wei-Ming Zhang, et al.
Department of Pathology, The First Affiliated Hospital of Nanjing Medical University, Nanjing, China.
13. Eur J Gastroenterol Hepatol. 2023 Nov 1;35(11):1306-1307.
doi: 10.1097/MEG.0000000000002634. Epub 2023 Sep 27.
Characteristics and outcomes with or without gastrointestinal bleeding in patients with gastrointestinal stromal tumors
Lovekirat S Dhaliwal, Udhayvir S Grewal, Apoorva K Chandar, et al.
Department of Internal Medicine, Louisiana State University Health Sciences Center, Shreveport, Louisiana.
14. Eur Radiol. 2023 Sep 29.
doi: 10.1007/s00330-023-10249-3. Online ahead of print.
Prediction of high Ki-67 proliferation index of gastrointestinal stromal tumors based on CT at non-contrast-enhanced and different contrast-enhanced phases
Zhenhui Xie, Shiteng Suo, Wang Zhang, et al.
Department of Radiology, Renji Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai, China.
15. Med Sci (Basel). 2023 Sep 10;11(3):57.
doi: 10.3390/medsci11030057.
Concurrence of Adenomyoepithelioma of the Breast and Gastrointestinal Stromal Tumor of the Stomach: A Case Report and Review of the Literature
Fatma Althoubaity, Lamar A Wazira, Hanin M Y Ahmad, et al.
Department of Surgery, King Abdulaziz University Hospital, Jeddah 21589, Saudi Arabia.
16. Surg Case Rep. 2023 Oct 23;9(1):183.
doi: 10.1186/s40792-023-01766-w.
Surgery for multiple gastric gastrointestinal stromal tumors and large esophageal diverticulum related to germline mutation of the KIT gene: a case report
Asami Arita, Tsuyoshi Takahashi, Kiyokazu Nakajima, et al.
Department of Gastroenterological Surgery, Graduate School of Medicine, Osaka University, 2-2 Yamadaoka, Suita City, Osaka, 565-0871, Japan.
17. Radiol Case Rep. 2023 Oct 17;18(12):4533-4536.
doi: 10.1016/j.radcr.2023.08.108. eCollection 2023 Dec.
A case of primary gastrointestinal stromal tumor of the liver
An Nguyen Thi My Xuan, Van Le Thi Bich, Dung Le Van, et al.
Department of Radiology, Cho Ray Hospital, Ho Chi Minh, Viet Nam.
18. Radiol Case Rep. 2023 Oct 11;18(12):4465-4473.
doi: 10.1016/j.radcr.2023.09.048. eCollection 2023 Dec.
Gastric schwannoma: Two case reports and review of the literature
Rodrigo Cordeiro, Margarida Morgado, Vera Oliveira, et al.
Department of Radiology, Hospital do Divino Espírito Santo de Ponta Delgada, Av. D. Manuel I, 9500-370 Ponta Delgada, Azores, Portugal.
19. JCO Glob Oncol. 2023 Sep:9:e2300070.
doi: 10.1200/GO.23.00070.
Cost Evaluation Analysis of Genetic Testing and Tailored Adjuvant Imatinib in Patients With Resected High-Risk GI Stromal Tumors: The Brazilian Perspective
Bruna Bianca Lopes David, Pedro Nazareth Aguiar Junior, Matheus Costa E Silva, et al.
Grupo Oncoclinicas, São Paulo, Brazil.
20. Int J Colorectal Dis. 2023 Oct 19;38(1):253.
doi: 10.1007/s00384-023-04548-w.
Survival outcome of local versus radical resection for jejunoileal gastrointestinal stromal tumors: a propensity score-matched population-based analysis
Shangcheng Yan, Wei Peng, Ming Cheng, et al.
Department of Gastrointestinal Surgery, Second Affiliated Hospital of Soochow University, Suzhou, China.
21. Scand J Gastroenterol. 2023 Oct 22:1-7.
doi: 10.1080/00365521.2023.2270758. Online ahead of print.
Gastric gastrointestinal stromal tumors: therapeutic strategies and long-term prognosis
Chunhui Shou, Zhou Chen, Zhijian Li, et al.
Department of Gastrointestinal Surgery, The First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou, China.
排版编辑:肿瘤资讯-胡一帆



















 苏公网安备 32059002004080号
苏公网安备 32059002004080号


