【肿瘤资讯】特邀UCSF海伦迪勒家庭综合癌症中心Hope S. Rugo教授在西班牙ESMO会场接受专访,解读高风险HR+/HER2-早期乳腺癌(EBC)的重磅研究进展和未来发展方向。
本次ESMO大会上,monarchE研究5年随访数据披露并入选LBA摘要,作为monarchE试验的研究者和指导委员会成员,您如何解读该研究?
Hope S. Rugo教授:本次ESMO大会上,monarchE研究更新了5年数据,该研究旨在探索2年阿贝西利(abemaciclib)联合内分泌辅助治疗HR+,HER2-, 淋巴结阳性,高危EBC患者的疗效和安全性。入组的高风险患者定义为≥4枚阳性淋巴结,或1-3枚阳性淋巴结伴有组织学分级3级和/或肿瘤直径≥5cm(队列1,5120例);其余517例患者(队列2)为1-3枚阳性腋窝淋巴结,Ki67≥20%。所有患者在随机化后至少接受5年内分泌治疗,联合或不联合2年阿贝西利治疗。
在ITT人群中,中位随访期为54个月,阿贝西利治疗组持续获益,无浸润性疾病生存期(IDFS)的风险比(HR)为0.680 (95% CI: 0.599, 0.772),无远处复发生存期(DRFS)的HR为0.675(95% CI: 0.588, 0.774)。阿贝西利的持续获益转化为Kaplan-Meier生存曲线的持续分离。
与4年IDFS/DRFS率(6.0%/5.3%)和3年IDFS/DRFS率(4.8%/4.1%)相比,5年IDFS、DRFS的绝对获益分别达到7.6%和6.7%。
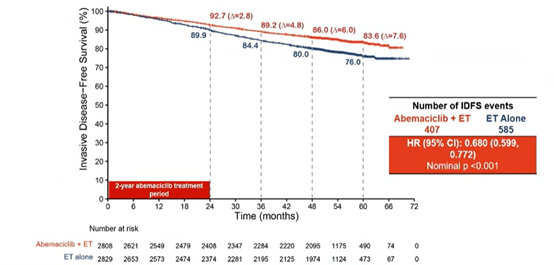
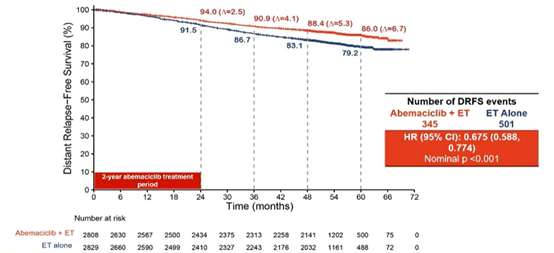 ITT人群IDFS、DRFS获益持续
ITT人群IDFS、DRFS获益持续
与单纯内分泌治疗组相比,阿贝西利联合内分泌治疗组的死亡人数更少(208 vs 234;HR 0.903;P=0.284)1。由于阿贝西利辅助治疗仅需用药2年,所以截至随访截止日期,所有患者均已完成阿贝西利的疗程,因此没有观察到新的安全信号。
 ITT人群中阿贝西利组死亡事件更少
ITT人群中阿贝西利组死亡事件更少
2年的阿贝西利辅助治疗带来了长达5年的持续获益,monarchE研究的更新数据可谓非常鼓舞人心。尽管总生存期(OS)结局尚未报告显著的统计学差异,但阿贝西利治疗组中发生转移的患者比例更低1,有望在后续随访中进一步更改善HR+,HER2-, 淋巴结阳性,高危EBC患者的生存预后。
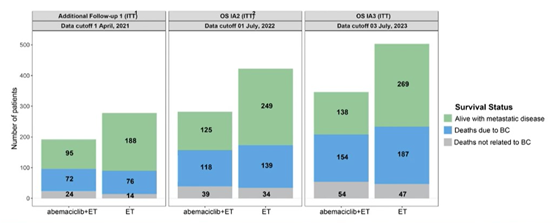 阿贝西利组发生疾病转移的患者更少
阿贝西利组发生疾病转移的患者更少
基于CDK4/6抑制剂在早期乳腺癌中的进展,您对HR+早期乳腺癌的治疗前景有何看法?
Hope S. Rugo教授:另一项Ⅲ期临床研究NATALEE也取得了阳性结果2。NATALEE研究的初步数据表明,低剂量瑞波西利(400mg/d)联合内分泌治疗相较于单纯内分泌治疗能够有效改善IDFS。同时,NATALEE研究的最新数据也进一步支持了monarchE研究中阿贝西利辅助治疗的临床获益。但在为期3年的随访期间,仅有20%的患者完成了3年的瑞波西利治疗3。因此,未来可能需要进一步探索长期使用低剂量瑞波西利治疗的获益情况。
monarchE研究中使用阿贝西利的患者均已完成治疗,且超过80%的患者在完成阿贝西利治疗后已经至少随访了2年。本次公布的数据有助于我们更好的理解阿贝西利降低疾病复发风险的情况。同时,换用其他CDK4/6抑制剂治疗的“postMONARCH”临床研究,目前患者已招募完毕,明年或许将由数据公布,其不仅可为晚期阶段CDK4/6抑制剂耐药后换用其他CDK4/6抑制剂带来新的循证数据,也可为CDK4/6抑制剂辅助治疗后,晚期阶段使用其他CDK4/6抑制剂带来启发。
在免疫治疗方面,多种免疫检查抑制剂也显示了其在HR+早期乳腺癌中的应用潜力,但仍需重视免疫检查点抑制剂可能会诱导严重的不良反应,例如,KEYNOTE-756研究中就报告了几例免疫治疗相关不良事件的死亡。后续需要开展研究探索潜在的生物标志物,以筛选出能够从免疫治疗中获益的患者群体。
此外,我们期待能够将“内分泌+靶向治疗”应用到乳腺癌患者发生转移之前的早期阶段。目前,已有多种新的内分泌治疗——口服SERDs药物和新的靶向治疗药物出现,因此未来期望通过在早期阶段使用口服SERDs药物和CDK4/6抑制剂等有效的联合治疗,以更好地控制乳腺癌的发展,并延长患者的生存期。这种早期阶段的治疗策略有望为乳腺癌患者提供更好的治疗效果,同时减少转移的风险。
本次ESMO年会在ER+/HER2-乳腺癌免疫治疗领域有哪些进展?您认为免疫治疗能否推动ER+乳腺癌新辅助治疗模式的变革?
Hope S. Rugo教授:ER+,HER2-乳腺癌一直以来被认为对免疫治疗反应不佳,本次ESMO年会早期乳腺癌专场公布了2项免疫检查点抑制剂联合化疗治疗ER+,HER2-,高危EBC的疗效,为我们带来了新的视角。
KEYNOTE-756研究旨在评估帕博利珠单抗/安慰剂+化疗新辅助治疗,序贯帕博利珠单抗/安慰剂+内分泌治疗辅助方案用于ER+,HER2-,高危EBC的疗效。研究者认为对化疗有反应的高风险患者可能对免疫治疗的反应更好。因此,研究选择了淋巴结阳性、病灶较大及组织学分级3级的患者[分期为T1c-2(≥2 cm)cN1-2或T3-4 cN0-2;ER+/HER2-、乳腺浸润性导管癌3级]。
本次公布的结果显示,免疫治疗方案取得了病理完全缓解率(pCR:24.3% vs 15.6%)的显著获益。该研究深化了学界对乳腺癌亚型及免疫治疗获益人群的理解,支持在化疗中加入帕博利珠单抗以提高ER+/HER2-,高危EBC患者的pCR率4。高危患者通常肿瘤微环境中免疫相关细胞更为丰富,可能对免疫治疗更加敏感,因此,Luminal B型乳腺癌和基底样型乳腺癌在接受帕博利珠单抗治疗后可能达到更高的pCR。
CheckMate 7FL研究则评估了纳武利尤单抗对比安慰剂分别联合新辅助化疗和辅助内分泌治疗在高风险HR+/HER2-、原发性乳腺癌患者中的应用。研究共入组521例患者,与单纯化疗组相比,免疫治疗+化疗组的pCR显著改善(13.8% vs 24.5%)。在进一步的亚组分析中,与KEYNOTE-756研究采用CPS≥1判断肿瘤PD-L1表达状态不同,CheckMate 7FL研究将SP142≥1%定义为PD-L1阳性,并发现PD-L1阳性的患者接受免疫治疗获益更显著(pCR:44.3% vs 20.2%)5。这一结果非常令人兴奋,未来有望通过细化患者分层进一步改善HR+,HER2- EBC患者的预后。
但要想将免疫治疗引入HR+,HER2- EBC的新辅助治疗的临床实践,还需要观察更长期的无事件生存数据。此外,Luminal B型乳腺癌、基底样型乳腺癌等亚型在上述研究中的例数较少,未来可能需要针对在这些亚型扩大样本量,更进一步探索免疫治疗在特定人群中的获益。
采访最后,Hope S. Rugo教授总结道,CDK4/6抑制剂阿贝西利治疗HR+, HER2-, 淋巴结阳性、早期乳腺癌高危患者已经在monarchE研究中展现出卓越的获益。随着新型靶向药物的不断涌现,还需开展研究尝试新的治疗组合。此外,仍待深入探索循环肿瘤DNA(ctDNA)等生物标志物对治疗结局的预测和预后价值。
美国加州大学旧金山分校(UCSF)海伦迪勒家庭综合癌症中心血液和肿瘤内科教授
UCSF海伦迪勒家庭综合癌症中心乳腺肿瘤学和临床试验教育主任
美国临床肿瘤学会(ASCO) 委员
乳腺癌转化研究联盟 (TBCRC)成员
联盟(前CALGB)乳腺委员会成员
随机Ⅱ期I-SPY2药物实验安全委员会主席
乳腺癌研究基金会(BCRF)资助的多中心免疫治疗临床研究首席研究员
[1] N. Harbeck, et al. Adjuvant abemaciclib plus endocrine therapy for HR+, HER2-, high-risk early breast cancer: Results from a preplanned monarchE overall survival interim analysis, including 5-year efficacy outcomes. LBA17. Presented on ESMO 2023.
[2] Aditya Bardia, et al. Invasive disease–free survival (iDFS) across key subgroups from the Phase III NATALEE study of ribociclib (RIB) + a nonsteroidal aromatase inhibitor (NSAI) in patients (pts) with HR+/HER2− early breast cancer (EBC). LBA23. Presented on ESMO 2023.
[3] Dennis J. Slamon, et al. Ribociclib and endocrine therapy as adjuvant treatment in patients with HR+/HER2- early breast cancer: Primary results from the phase III NATALEE trial. LBA500. Presented on ASCO 2023
[4] F. Cardoso, et al. KEYNOTE-756: Phase III study of neoadjuvant pembrolizumab (pembro) or placebo (pbo) + chemotherapy (chemo), followed by adjuvant pembro or pbo + endocrine therapy (ET) for early-stage high-risk ER+/HER2e breast cancer. LBA21. Presented on ESMO 2023.
[5] Sherene Loi, et al. A randomized, double-blind trial of nivolumab (NIVO) vs placebo (PBO) with neoadjuvant chemotherapy (NACT) followed by adjuvant endocrine therapy (ET) ± NIVO in patients (pts) with high-risk, ER+ HER2L primary breast cancer (BC). LBA20. Presented on ESMO 2023.
排版编辑:yyan











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


