1. Targeting m6A reader YTHDF1 augments antitumour immunity and boosts anti-PD-1 efficacy in colorectal cancer
2. Phase Ib open-label, multicenter study of pixatimod, an activator of TLR9, in combination with nivolumab in subjects with microsatellite-stable metastatic colorectal cancer, metastatic pancreatic ductal adenocarcinoma and other solid tumors.
3. Effective combination of liposome-targeted chemotherapy and PD-L1 blockade of murine colon cancer
4. Blockade of interleukin 10 potentiates antitumour immune function in human colorectal cancer liver metastases
5. Phase I/II study of PexaVec in combination with immune checkpoint inhibition in refractory metastatic colorectal cancer
1. Impact of cytotoxic T lymphocytes immunotherapy on prognosis of colorectal cancer patients
2. Genomic and transcriptomic analysis of MSI-H colorectal cancer patients with targetable alterations identifies clinical implications for immunotherapy
3. Association of immune-related adverse events with the outcomes of immune checkpoint inhibitors in patients with dMMR/MSI-H metastatic colorectal cancer
4. Prevalence and Associations of Beta2-Microglobulin Mutations in MSI-H/dMMR Cancers
5. Characterization of the immune cell landscape in CRC: Clinical implications of tumour-infiltrating leukocytes in early- and late-stage CRC
治疗
1. Targeting m6A reader YTHDF1 augments antitumour immunity and boosts anti-PD-1 efficacy in colorectal cancer
靶向m6A阅读器YTHDF1可增强结直肠癌的抗肿瘤免疫和抗PD-1疗效https://pubmed.ncbi.nlm.nih.gov/36717220/
Bao Y, et al. Gut. 2023 Jan 30;gutjnl-2022-328845.
PMID:36717220
IF:31.793
目的:N6-甲基腺苷(m6A)在肿瘤免疫微环境(TIME)中的作用仍未得到充分研究。本研究旨在阐明YTHN6-甲基腺苷RNA结合蛋白1(YTHDF1)在结直肠癌(CRC)TIME中的功能和机制。
研究设计:在组织微阵列(N=408)和TCGA(N=526)队列中评估YTHDF1的临床意义。在同源肿瘤、肠道特异性YTHDF1基因敲入小鼠和人源化小鼠中测定YTHDF1功能。采用单细胞RNA-seq(scRNA-seq)分析TIME。采用甲基化RNA免疫沉淀测序(MeRIP-seq)、RNA测序(RNA-seq)和核糖体测序(Ribo-seq)识别YTHDF1直接靶标。囊泡样纳米颗粒(VNPs)包裹的YTHDF1-siRNA用于体内YTHDF1沉默。
结果:YTHDF1在TCGA-CRC中的表达与干扰素-γ基因信号呈负相关。相同的,在独立的组织芯片队列中,YTHDF1蛋白与CD8+T细胞浸润呈负相关,提示其在肿瘤免疫微环境中的作用。在CT26(MSS-CRC)和MC38(MSI-H-CRC)同源肿瘤中,YTHDF1基因耗竭增强抗肿瘤免疫,而在氧化偶氮甲烷-葡聚糖硫酸钠或ApcMin/+模型中,YTHDF1基因敲入促进CRC的免疫抑制时间。scRNA-seq检测发现,在Ythdf1敲除肿瘤中,髓源性抑制细胞(MDSCs)减少,细胞毒性T细胞增加。整合MeRIP-seq、RNA-seq和Ribo-seq发现p65/Rela为YTHDF1靶标。YTHDF1促进p65翻译上调CXCL1,CXCL1通过CXCL1-CXCR2轴增加MDSC迁移。增加的MSDC反过来在TIME中拮抗功能性CD8+T细胞。重要的是,通过CRISPR(成簇的、有规律间隔的短回文重复序列)或VNPs-siYTHDF1靶向YTHDF1增强了MSI-H CRC的抗PD1疗效,并克服了MSS CRC的抗PD1耐药性。
结论:YTHDF1通过m6A-p65-CXCL1/CXCR2轴损害抗肿瘤免疫促进CRC的发展,可以作为免疫检查点阻断治疗的靶点。
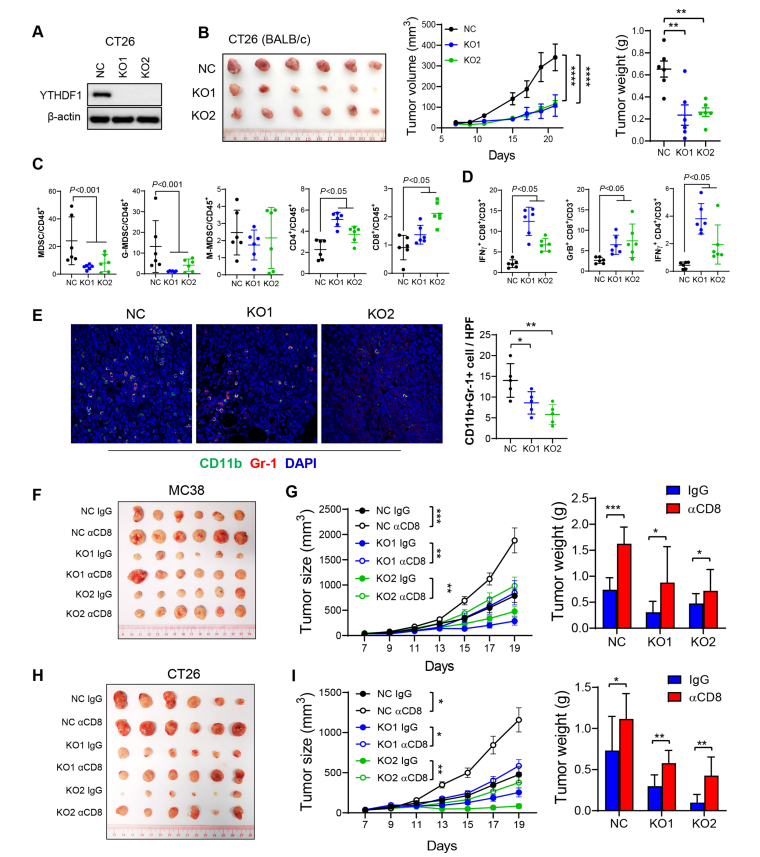
图. YTH N6-甲基腺苷RNA结合蛋白1(Ythdf1)敲除通过减少髓源性抑制细胞(MDSC)和增加同源肿瘤中的功能性T 细胞诱导抗肿瘤免疫,这种作用可被CD8 + T细胞耗竭逆转
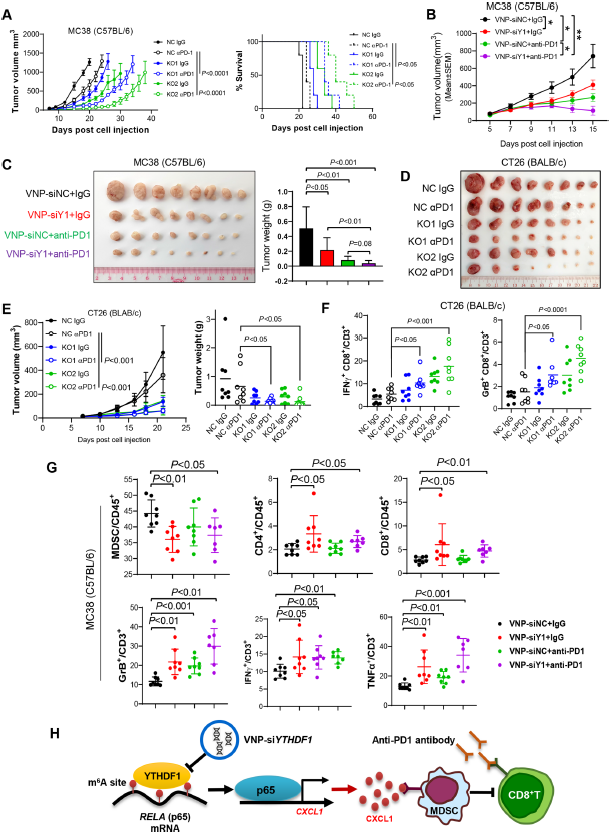
图. 靶向YTHDF1可增强MSI-H CRC的抗PD1阻断治疗疗效
2. Phase Ib open-label, multicenter study of pixatimod, an activator of TLR9, in combination with nivolumab in subjects with microsatellite-stable metastatic colorectal cancer, metastatic pancreatic ductal adenocarcinoma and other solid tumors.
一项评价pixatimod(一种TLR9激动剂)联合纳武利尤单抗治疗微卫星稳定的转移性结直肠癌、转移性胰腺导管腺癌和其他实体瘤受试者的Ib期、开放标签、多中心研究
https://pubmed.ncbi.nlm.nih.gov/36634920/
Lemech C, et al. J Immunother Cancer. 2023 Jan;11(1):e006136.
PMID: 36634920
IF:12.469
背景:Pixatimod是Toll样受体9信号通路的特异性激动剂。这项I期试验评估了pixatimod联合PD-1抑制剂纳武利尤单抗在免疫冷肿瘤中的安全性、疗效和药效学。
方法:在微卫星稳定型转移性结直肠癌(MSS mCRC)和转移性胰腺导管腺癌(mPDAC)中进行3+3剂量递增扩展队列研究。受试者接受pixatimod(每周一次,静脉输注1小时)联合纳武利尤单抗(每2周一次)治疗。研究目的包括评估该方案的安全性、抗肿瘤活性、药效学和药代动力学特征。
结果:58例受试者接受治疗,pixatimod的最大耐受剂量为25mg与240mg 纳武利尤单抗联合,这一联合给药剂量用于研究的扩展阶段。12例受试者报告了21起3-5级治疗相关不良事件(AE) (21%);1例接受50mg pixatimod/纳武利尤单抗治疗的受试者发生治疗相关5级AE。MSS mCRC队列(n=33)的3/4级AE发生率为12%。mPDAC队列中无缓解者(n=18)。在MSS mCRC队列中,25例受试者可被评估(初始基线后评估扫描>6周);其中,3例受试者确认达到部分缓解(PR),8例受试者达到疾病稳定(SD)至少9周。临床获益(PR+SD)与泛免疫炎症值和血浆IL-6降低相关,与IP-10和IP-10/IL-8比值升高相关。在1例最佳缓解为PR的MSS mCRC受试者中,治疗后5周后,T细胞、树突状细胞和NK细胞浸润明显增加。
结论:Pixatimod 25mg联合纳武利尤单抗耐受性良好。MSS mCRC的疗效信号和药效学变化需要进一步研究。
表. 治疗相关重度AE、导致停药的 AE 和严重 AE
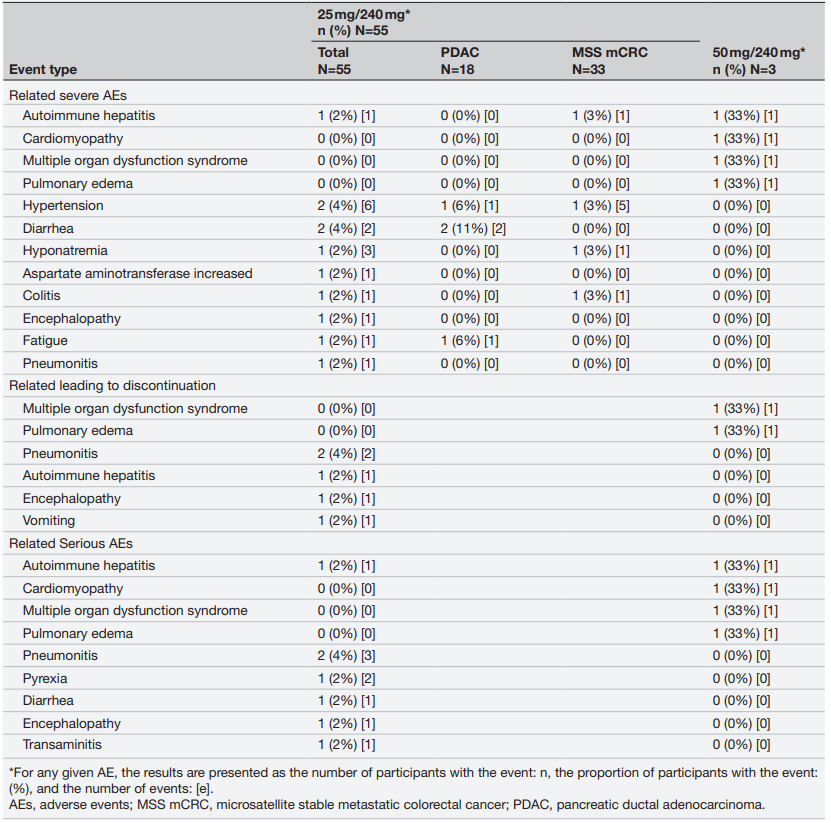
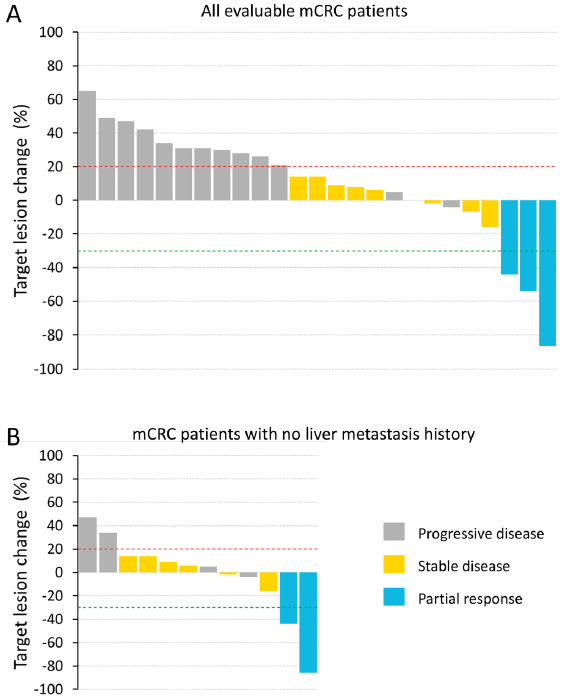 图. 所有可评估的转移性结直肠癌(mCRC)受试者(a)和仅无肝转移史的mCRC受试者(b)的最佳肿瘤缩小瀑布图(根据RECIST评估)
图. 所有可评估的转移性结直肠癌(mCRC)受试者(a)和仅无肝转移史的mCRC受试者(b)的最佳肿瘤缩小瀑布图(根据RECIST评估)
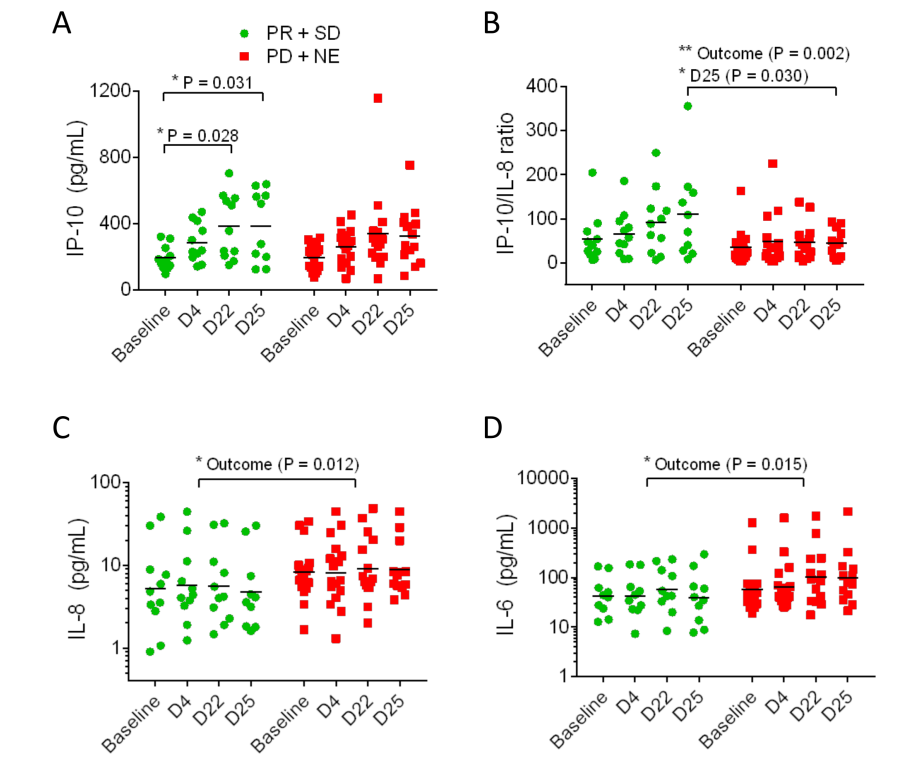 图. 在有临床获益的转移性结直肠癌(mCRC)受试者(PR + SD)和无临床获益的mCRC受试者(PD+NE)之间,血浆蛋白生物标志物IP-10、IP-10/IL-8比值、IL8和 IL-6存在差异
图. 在有临床获益的转移性结直肠癌(mCRC)受试者(PR + SD)和无临床获益的mCRC受试者(PD+NE)之间,血浆蛋白生物标志物IP-10、IP-10/IL-8比值、IL8和 IL-6存在差异
注:Pixatimod联合纳武利尤单抗目前在中国大陆尚未获批结直肠癌适应症
3. Effective combination of liposome-targeted chemotherapy and PD-L1 blockade of murine colon cancer
脂质体靶向化学治疗和PD-L1 阻断剂有效联合治疗鼠结肠癌https://pubmed.ncbi.nlm.nih.gov/36460179/
Gu Z, et al. J Control Release. 2023 Jan;353:490-506.
PMID: 36460179
IF: 11.467
背景:肿瘤治疗药物疗效可能受限于肿瘤穿透力不足、清除迅速、全身毒性和(获得性)耐药性。使用脂质体制剂可以改善因药物渗透率低、药物清除过快和毒性导致的治疗指数差。与多西他赛联合用药可降低培美曲塞的耐药性。本研究开发了一种特殊的脂质体制剂,可以同时给药多西他赛和培美曲塞,以改善疗效和安全性。
方法:采用薄膜水化法高效地将疏水性的多西他赛和亲水性的培美曲塞共包封到 pH 敏感脂质体中。体外试验检测脂质体的理化性质、毒性和免疫学作用。使用两种小鼠结肠癌模型进行体内试验,评估脂质体化疗与 PD-L1 免疫检查点抑制剂联用时的生物分布、抗肿瘤疗效和全身免疫应答。
结果:在细胞实验中,脂质体表现出较强的细胞毒性并诱导免疫原性细胞死亡。在体内试验中,基于脂质体的药物联合治疗可抑制肿瘤发展并刺激免疫应答。与游离药物给药相比,脂质体包封显著降低了全身毒性。在携带同源MC38或CT26结肠肿瘤的免疫功能正常小鼠中,联合抗PD-L1免疫治疗可显著增强肿瘤控制。
结论:本研究表明,多西他赛+培美曲塞的化疗脂质体制剂联合抗PD-L1免疫治疗是一种有前景的结肠癌治疗策略。
4. Blockade of interleukin 10 potentiates antitumour immune function in human colorectal cancer liver metastases
阻断白细胞介素10增强结直肠癌肝转移的抗肿瘤免疫功能
https://pubmed.ncbi.nlm.nih.gov/35705369/
Sullivan KM, et al. Gut. 2023 Feb;72(2):325-337.
PMID:35705369
IF:31.793
目的: 免疫检查点抑制剂和过继细胞疗法在微卫星稳定性结直肠癌肝转移(CRLM)患者中取得的成功有限。本研究评估白细胞介素10 (IL-10)阻断对CRLM 切片培养物中内源性T细胞和嵌合抗原受体T(CAR-T)细胞抗肿瘤功能的影响。
研究设计:根据人类CRLM(n=38 例患者的肿瘤)制备器官型切片培养物,并检测了靶向 IL-10(αIL-10)的中和抗体单独治疗以及与外源性给予的癌胚抗原(CEA)特异性CAR-T细胞联合治疗的抗肿瘤作用。使用单一和多重免疫组织化学、原位杂交、单细胞RNA测序、反相蛋白质阵列和延时荧光显微镜评估切片培养物。
结果: αIL-10使人CRLM切片培养物中T细胞介导的癌细胞死亡增加了1.8倍。αIL-10 显著增加CD8+ T细胞比例,无耗竭转录改变,增加巨噬细胞人白细胞抗原-DR同型(HLA-DR)的表达。αIL-10 抗肿瘤作用被主要组织相容性复合体I类或II类(MHC-I或MHC-II) 的阻断逆转,证实了抗原呈递细胞的重要作用。阻断IL-10信号传导也能从骨髓细胞介导的免疫抑制中挽救小鼠CAR-T细胞增殖和细胞毒性。在人CRLM切片中,αIL-10增加了CEA 特异性CAR-T细胞的活化和CAR-T细胞介导的细胞毒性,在多种人类肿瘤中近70%的癌细胞凋亡。用IL-10受体阻断抗体预处理也增强了CAR-T功能。
结论:因此,中和IL-10在人CRLM中具有独立治疗和增强过继转移CAR-T细胞功能的治疗潜力。
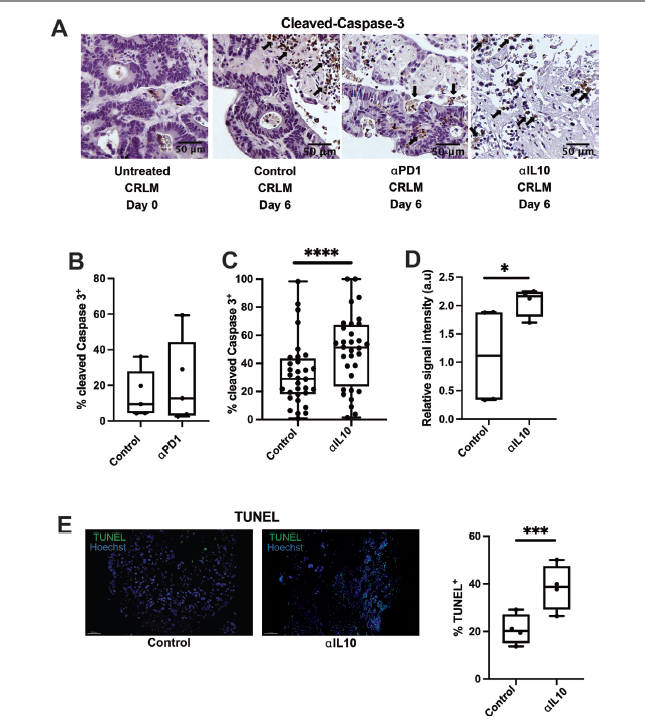
图. 白细胞介素10(IL-10)的阻断促进肿瘤细胞凋亡显著增加
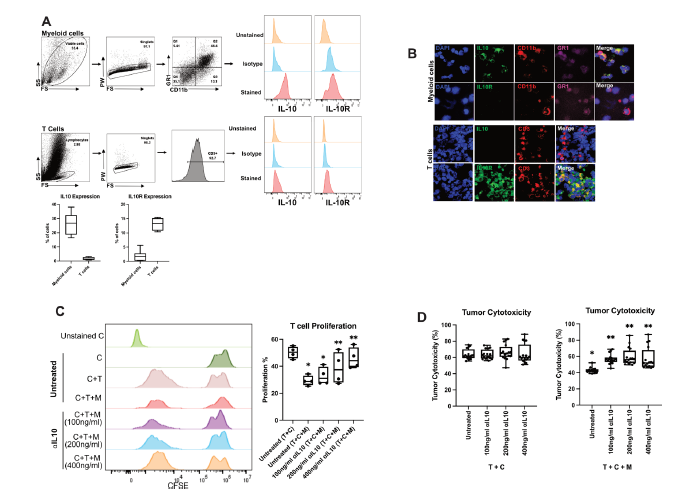
图. 用白细胞介素10 (IL-10)抗体治疗可逆转小鼠髓系细胞对嵌合抗原受体T(CAR-T)细胞的抑制活性
5. Phase I/II study of PexaVec in combination with immune checkpoint inhibition in refractory metastatic colorectal cancer
PexaVec联合免疫检查点抑制治疗难治转移性结直肠癌的I/II期研究https://pubmed.ncbi.nlm.nih.gov/36754451/
Monge C, et al. J Immunother Cancer. 2023;11(2):e005640.
PMID:36754451
IF:12.469
背景:溶瘤免疫疗法为肿瘤的治疗提供了独特的治疗平台。本研究是一项I/II期试验,旨在评估pexastimogene devacirepvec (PexaVec) +度伐利尤单抗(PD-L1)联合或不联合曲美木单抗(CTLA-4)治疗标准化疗难治性错配修复功能完整(pMMR)的转移性结直肠癌(mCRC)患者的安全性和疗效。
方法:4个队列纳入组织学确诊的晚期pMMR mCRC成人患者,这些患者在既往接受至少两线系统化疗且发生疾病进展。患者接受4剂PexaVec IV,剂量为3×108菌斑形成单位(pfu)(剂量水平1)或1×109 pfu(剂量水平2),每2周一次。在首次PexaVec给药后12天,患者接受1,500 mg 度伐利尤单抗单药,每28日1次,或者在第1天接受了额外的300 mg 曲美木单抗单次给药。每8周通过CT或MRI评估疗效。记录不良事件。主要终点是安全性和可行性。次要终点包括无进展生存期(PFS)和总生存期。对收集配对的肿瘤样本和外周血进行免疫监测。
结果:本研究纳入34例mCRC患者: PexaVec/度伐利尤单抗队列16例和PexaVec/度伐利尤单抗/曲美木单抗队列18例。总体而言,PexaVec联合免疫检查点抑制剂未导致任何非预期毒性。观察到的最常见毒性是输注PexaVec后发热和寒战。2例3级结肠炎、1例2级肌炎和1例3级低血压导致免疫检查点抑制剂和PexaVec治疗停药。PexaVec/度伐利尤单抗/曲美木单抗队列的中位PFS为2.3个月(95% CI: 2.2 ~ 3.2个月) vs PexaVec/curvalumab队列的2.1个月(95% CI: 1.7 ~ 2.8个月;P=0.57)。外周血单核细胞的流式细胞术分析显示,治疗后Ki67+CD8+ T细胞增加。
结论:PexaVec联合度伐利尤单抗和曲美木单抗是安全、可耐受的,未观察到非预期毒性。PexaVec/度伐利尤单抗/曲美木单抗联合治疗在pMMR mCRC患者中显示出潜在的临床活性,但需要进一步研究来确定预测性生物标志物。
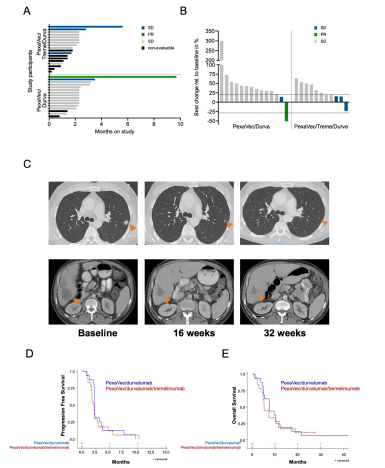
图. 临床结局
注:PexaVec联合度伐利尤单抗目前尚未在中国大陆获批肠癌适应症
预后和疗效预测
1. Impact of cytotoxic T lymphocytes immunotherapy on prognosis of colorectal cancer patients
细胞毒性T淋巴细胞免疫治疗对结直肠癌患者预后的影响
https://pubmed.ncbi.nlm.nih.gov/36726382/
Zhu Y, et al. Front Oncol. 2023 Jan 16;13:1122669..
PMID:36726382.
IF:5.738
背景:细胞毒性T淋巴细胞(CTLs)体外扩增和活化是一种很有前景的免疫治疗策略,重组腺相关病毒(rAAV)载体转化的肿瘤相关抗原(TAAs)转染树突状细胞(DC)可启动CTLs。本研究旨在探索rAAV-DC诱导的CTLs对CRC预后的影响,并探讨影响预后的相关因素。
方法:本项前瞻性观察性研究纳入了2016年至2019年期间在昆明医科大学附属延安医院接受手术的CRC患者。主要终点是无进展生存期(PFS),次要终点是总生存期(OS)和不良事件。共纳入49例患者,其中29例接受rAAV转染DC诱导的CTLs,20例接受化疗。
结果:随访37-69个月(中位随访54个月),两组的OS(P=0.0596)和PFS(P=0.0788) 差异均无统计学意义。2例(6.9%)给予CTLs输注的患者出现轻度发热。化疗组均出现轻中度不良反应,包括血管炎(n=20,100%)、呕吐(n=5,25%)、恶心(n=17,85%)和乏力(n=17,85%)。
结论:在CTLs治疗组中,淋巴结转移(HR=4.498,95%CI:1.290-15.676;P=0.018)和HLA-I表达较低(HR=0.294,95%CI:0.089-0.965;P=0.044)与较差的OS相关。rAAV-DCs诱导CTLs治疗CRC患者的疗效与化疗相当,肿瘤相关HLA-I高表达和无淋巴结转移的患者更有可能从CTLs治疗中获益。
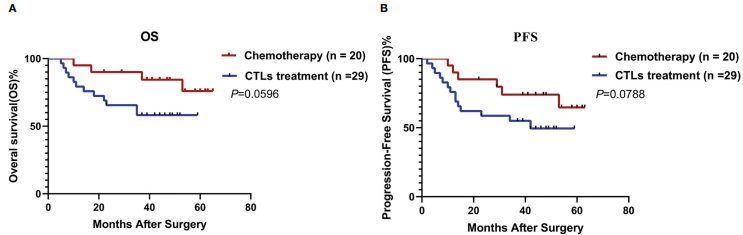
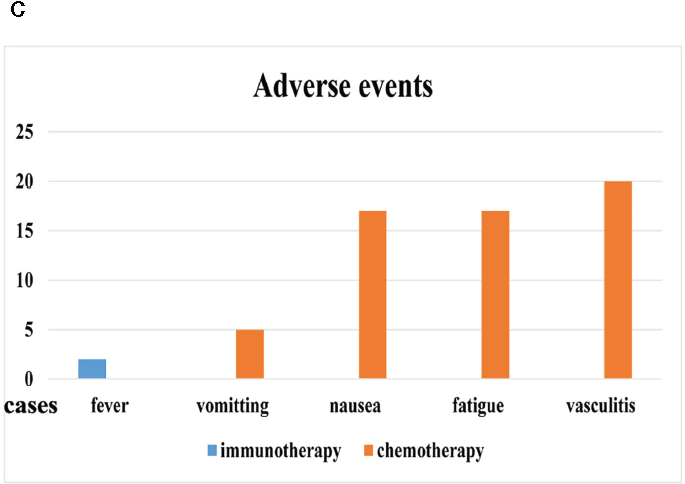
图. rAAVs诱导细胞毒性T淋巴细胞治疗具有良好的疗效和耐受性
通过Kaplan-Meier法估计的(A)总生存期(OS)和(B)无进展生存期(PFS)。(C)两组的不良事件。
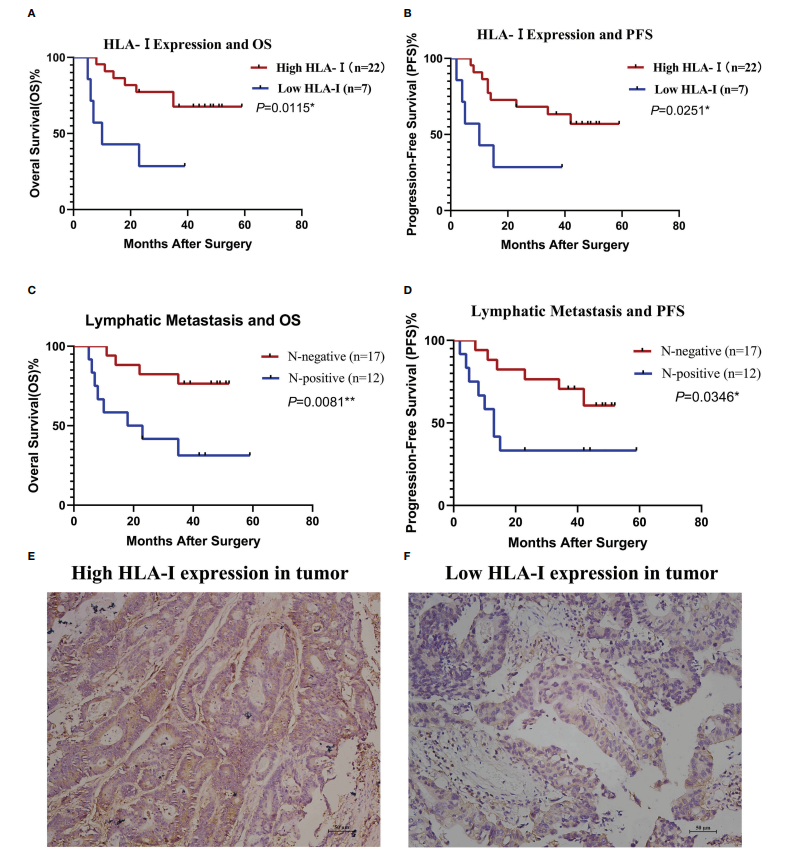
图2. HLA-I表达和淋巴结转移与细胞毒性T淋巴细胞(CTL)输注治疗的临床疗效有关
根据HLA-I表达对总生存期(OS,A)和无进展生存期(PFS,B)进行分层分析。根据淋巴转移状态对OS(C)和PFS(D)进行分层分析。通过Kaplan-Meier方法估计OS和PFS。*P<0.05,**P<0.01.(E)用抗HLA-I抗体对结肠癌组织进行免疫染色的免疫组织化学显示HLA-I高表达。(F)用抗HLA-I抗体进行结肠癌组织免疫染色的免疫组织化学显示HLA-I低表达。
2. Genomic and transcriptomic analysis of MSI-H colorectal cancer patients with targetable alterations identifies clinical implications for immunotherapy
具有靶向突变的MSI-H结直肠癌患者的基因组和转录组学分析确定免疫治疗的临床意义
https://pubmed.ncbi.nlm.nih.gov/36700211/
Hua H, et al. Front Immunol. 2023 Jan 9;13:974793.
PMID: 36700211
IF: 8.786
引言:BRAFV600E突变和NTRK融合等靶向突变在高度微卫星不稳定性(MSI-H)结直肠癌(CRC)中常见。具有靶向突变的MSI-H(MSI-H突变)可能为靶向治疗和免疫治疗提供独特的机会。本研究系统地评估了MSI-H突变和无MSI-H靶向突变(MSI-H wt)的CRC患者的分子特征和免疫相关特征。
方法:在1938例连续入组的CRC患者中,本回顾性研究纳入126例MSI-H患者(6.50%)。分别通过二代测序(NGS)和基因表达谱(GEP)研究基因组和转录组学数据。
结果:BRAFV600E、NTRK1和FGFR2突变是MSI-H CRC患者中最常见的靶向突变。MSI-H突变表型与年龄较大(p<0.001)、右结肠肿瘤(p=0.024)和女性(p=0.036)显著相关。在MSI-H突变组中未发现林奇综合征(LS)患者。MSI-H突变组和MSI-H 野生组的肿瘤突变负荷(TMB)和肿瘤新抗原负荷(TNB)差异无统计学意义(p<0.05)。随后,转录组学研究分析进一步表明,MSI-H突变的CRC患者与免疫活性肿瘤微环境相关,具有较高水平的Teff IFN-γ、CYT和MERCK18标记,以及较低水平的IPRES基因标记、EMT和TGFβ标记。此外,该病例研究支持携带靶向突变的MSI-H CRC患者也可能从免疫治疗中收获长期无病生存期。
讨论:本研究初步显示,MSI-H突变作为MSI-H CRC患者的一种新亚型,具有独特的分子特征和免疫活性肿瘤微环境。考虑到免疫检查点抑制剂(ICIs)治疗的可及性,本研究结果可能为具有靶向突变的MSI-HCRC患者的免疫治疗提供临床证据。
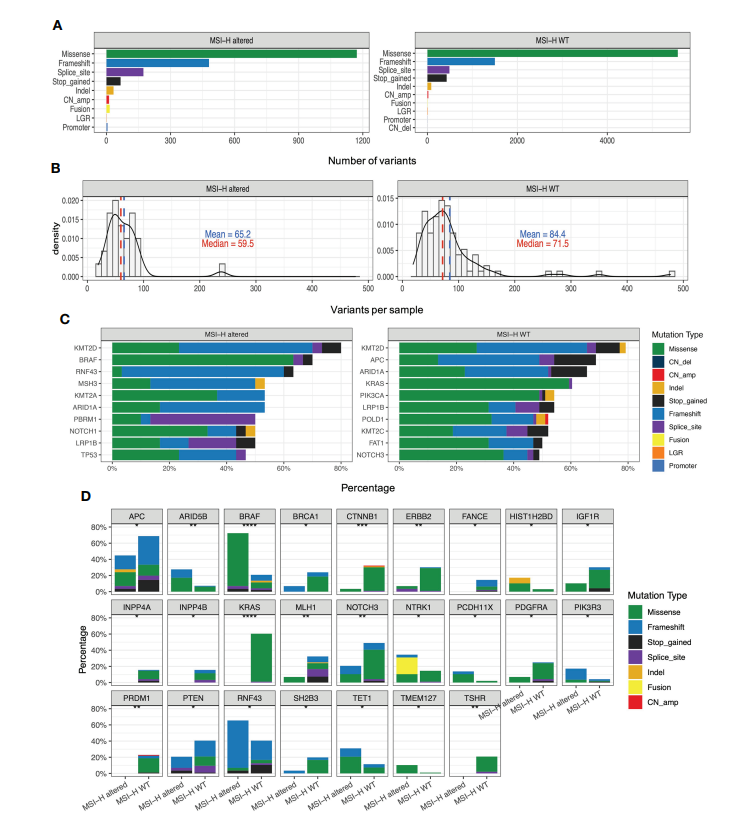
图. MSI-H 突变组和MSI-H wt组的基因组分析
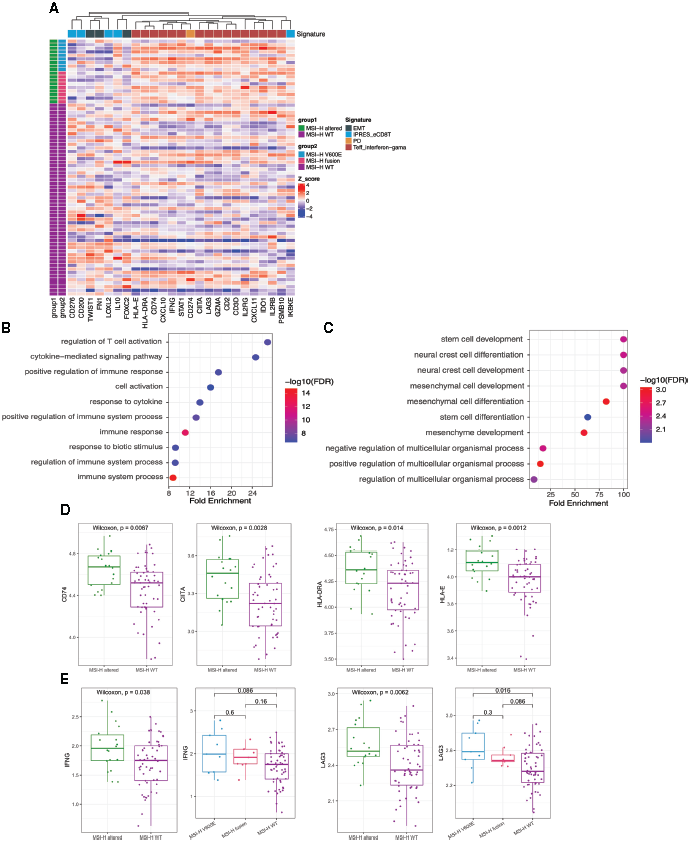
图. MSI-H 突变组和MSI-H wt组的转录组学分析
3. Association of immune-related adverse events with the outcomes of immune checkpoint inhibitors in patients with dMMR/MSI-H metastatic colorectal cancer
免疫相关不良事件与免疫检查点抑制剂治疗dMMR/MSI-H转移性结直肠癌患者结局的相关性
https://pubmed.ncbi.nlm.nih.gov/36593068/
Nasca V, et al. J Immunother Cancer. 2023 Jan;11(1):e005493.
PMID: 36593068
IF: 12.469
背景:免疫检查点抑制剂(ICI)在微卫星高度不稳定(MSI-H)转移性结直肠癌(mCRC)中显示出巨大的抗肿瘤活性,但仍有一部分患者对其无效。需要预后或预测性标志物。尽管之前在其他肿瘤类型中已经进行了研究,但在接受ICI治疗的MSI-H癌症患者中尚未充分评价免疫相关不良事件(irAE)。
方法:在国际性三级肿瘤中心进行了一项队列研究,收集了331例接受ICI治疗的MSI-H mCRC患者的临床病理学特征。使用“负荷评分”总结irAE,通过累积许多低级别irAE或少数高级别irAE获得相同的评分值构建“负荷评分”;因此,负荷评分越低越好。显然,irAE负荷不是基线信息,因此在单变量和多变量Cox模型中作为时间依赖性变量建模。
结果:331例患者中,144例(43.5%)患者报告了irAE。在中位随访29.7个月后,皮肤、内分泌和肌肉骨骼irAE负荷较高的患者(在多变量分析中证实了后两者的效应)的总生存期(OS)较长,而胃肠道、非感染性肺炎、神经系统、肝脏、肾脏和其他irAE显示出有害效应。无进展生存期(PFS)观察到相似结果。根据器官特异性irAE的结果,制定“综合”负荷评分,以区分对OS和PFS有预后影响的“保护性”(内分泌和肌肉骨骼)和“有害性”(胃肠道、肺炎、神经系统、肝脏)irAE。
结论:本研究结果表明,并非所有irAE都对肿瘤预后有保护性作用。一个简单易用的ICI毒性模型(保护性和有害性irAE的负荷评分)可用作疗效的替代标志物。
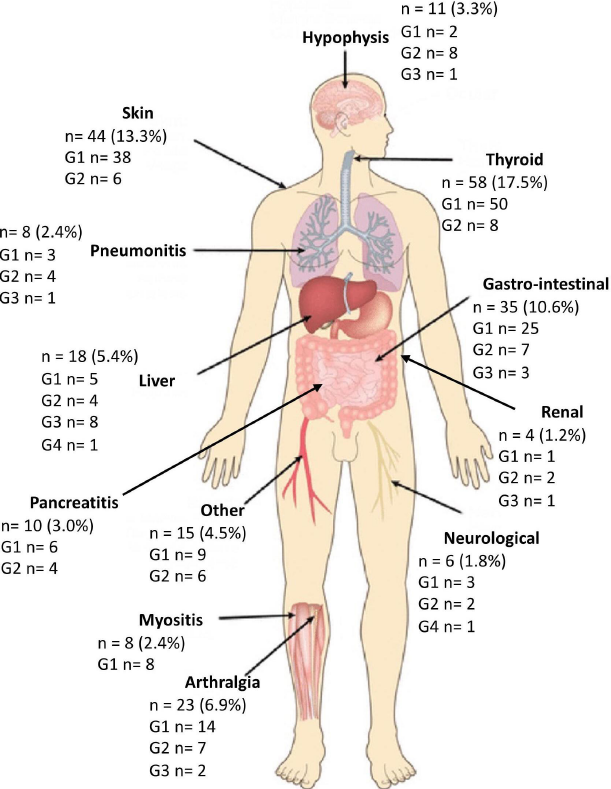
图. 研究人群中记录的免疫相关不良事件的发生率和严重程度总结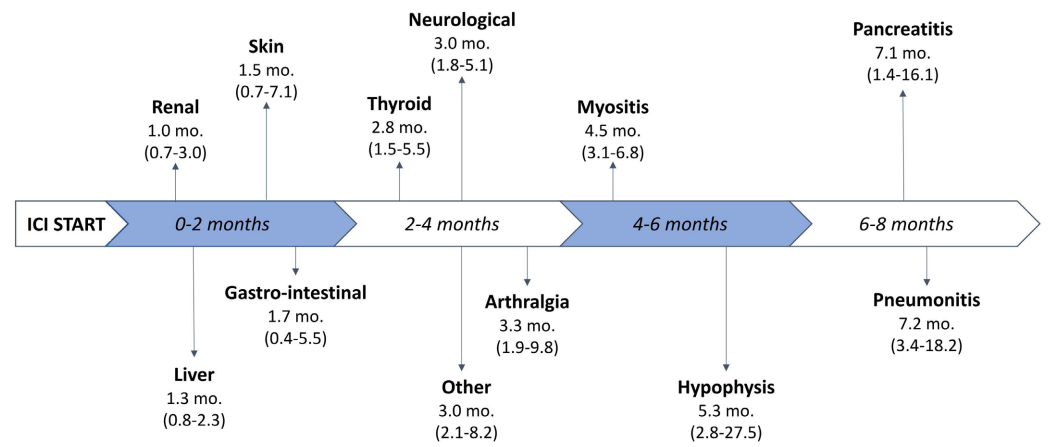
图. 不同器官特异性irAE的中位发生时间的时间线 (四分位数)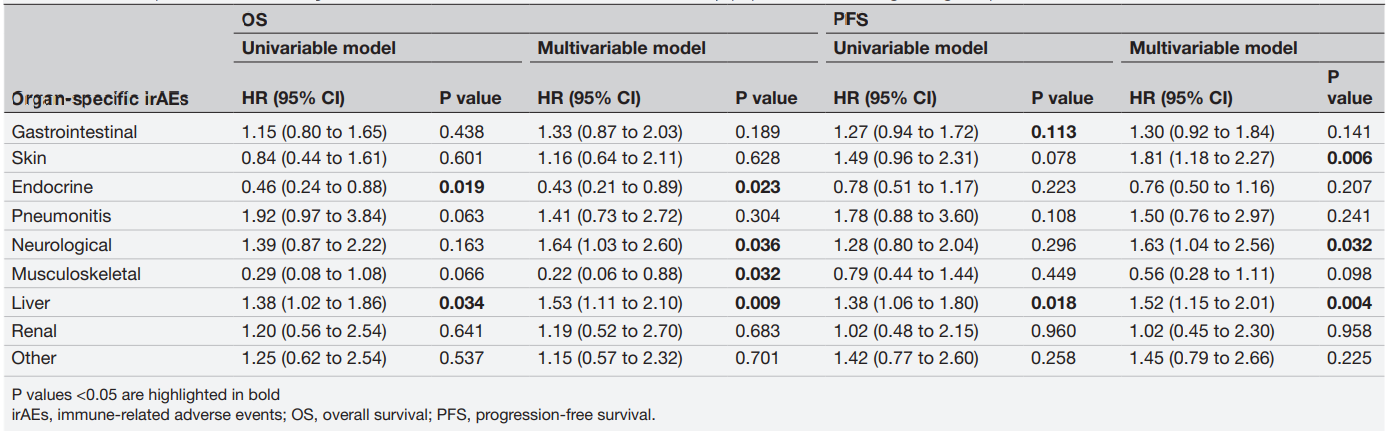
图. 不同器官特异性irAE,整个研究人群中OS和PFS的Cox比例风险回归模型
4. Prevalence and Associations of Beta2-Microglobulin Mutations in MSI-H/dMMR Cancers
MSI-H/dMMR肿瘤中β2-微球蛋白突变的发生率和相关性https://pubmed.ncbi.nlm.nih.gov/36724040/
Liu F, et al. Oncologist. 2023 Feb 1;oyac268. doi: 10.1093/oncolo/oyac268
PMID:36724040
IF:5.837
摘要:微卫星不稳定性(MSI)已成为免疫治疗策略敏感性的重要预测因素。β-2-微球蛋白(B2M)在编码区内含有微卫星,在MSI/错配修复缺陷(MSI/dMMR)肿瘤中容易发生体细胞改变。为了描述MSI-H/dMMR肿瘤中B2M突变的发生率和相关性,研究者探索了微卫星高度不稳定(MSI-H)/dMMR发生率高的胃癌(GC)、结直肠癌(CRC)和子宫内膜癌(EC)中B2M的突变特征以及临床和病理特征。从108例MSI/dMMR GC、CRC和EC患者中收集福尔马林固定石蜡包埋(FFPE)肿瘤组织和匹配的正常组织。通过二代测序(NGS)分析组织和血液样本的基因组特征。使用免疫组织化学(IHC)检测是否存在B2M蛋白。在B2M的外显子微卫星区域中观察到不同但频率较高的突变(CRC为57.5%,GC为23.9%,EC为13.6%)和不同形式。NGS检测显示,MSI-H队列中参与染色质调节、PI3K通路、WNT通路和错配修复的基因发生了广泛改变。Signature 6和26是与DNA错配修复缺陷相关的4个突变signatures中的2个,在所有3种类型的肿瘤中其特征是以大量的小插入/缺失(InDel)为主。在B2M的外显子微卫星区域中观察到不同但高频率(在CRC中为57.5%,在GC中为23.9%,在EC中为13.6%)的变化,呈现出不同形式。MSI-H/dMMR肿瘤的B2M突变患者的肿瘤突变负荷(TMB)显著高于野生型B2M患者(P=0.026),发生在外显子微卫星位置的移码突变导致B2M基因功能丧失。此外,还报道了一例携带B2M基因indels的CRC患者对ICI治疗产生耐药。总之,携带B2M突变的MSI-H/dMMR肿瘤的患者表现出显著更高的TMB。这些患者使用ICIs需要进行仔细评估。
5. Characterization of the immune cell landscape in CRC: Clinical implications of tumour-infiltrating leukocytes in early- and late-stage CRC
结直肠癌免疫细胞图谱的特征:早期和晚期结直肠癌肿瘤浸润白细胞的临床意义https://pubmed.ncbi.nlm.nih.gov/36846019/
Bazzi ZA, et al. Front Immunol. 2023 Feb 8;13:978862.
PMID:36846019
IF:8.786
背景:结直肠癌(CRC)是全球第三大癌症相关死亡原因。肿瘤浸润白细胞在包括CRC在内的肿瘤中起着重要作用。因此,本研究旨在描述肿瘤浸润白细胞对CRC预后的影响。
方法:为了确定CRC组织中的免疫细胞特征是否会影响预后,研究者采用三种计算方法(CIBERSORT、xCell和MCPcounter),根据基因表达预测免疫细胞类型的丰度。这是通过两个患者队列,TCGA和BC癌症个体化肿瘤基因组学(POG)完成。
结果:观察到CRC和正常邻近结肠组织之间的免疫细胞组成存在显著差异,还存在基于分析方法的差异。基于免疫细胞类型的生存评估显示,树突状细胞是一种有效的预后标志物,不同方法结果均一致。肥大细胞也是一个阳性预后标志物,但呈分期依赖性。非监督聚类分析表明,与晚期CRC相比,免疫细胞组成的显著差异对早期CRC的预后影响更明显。该分析揭示了一组不同的早期CRC患者,这些患者具有免疫浸润特征,意味着生存率更高。
结论:总之,CRC中免疫情况的表征为评估预后提供了有力的工具。研究者预计,免疫图谱的进一步表征将有助于免疫疗法在CRC中的应用。
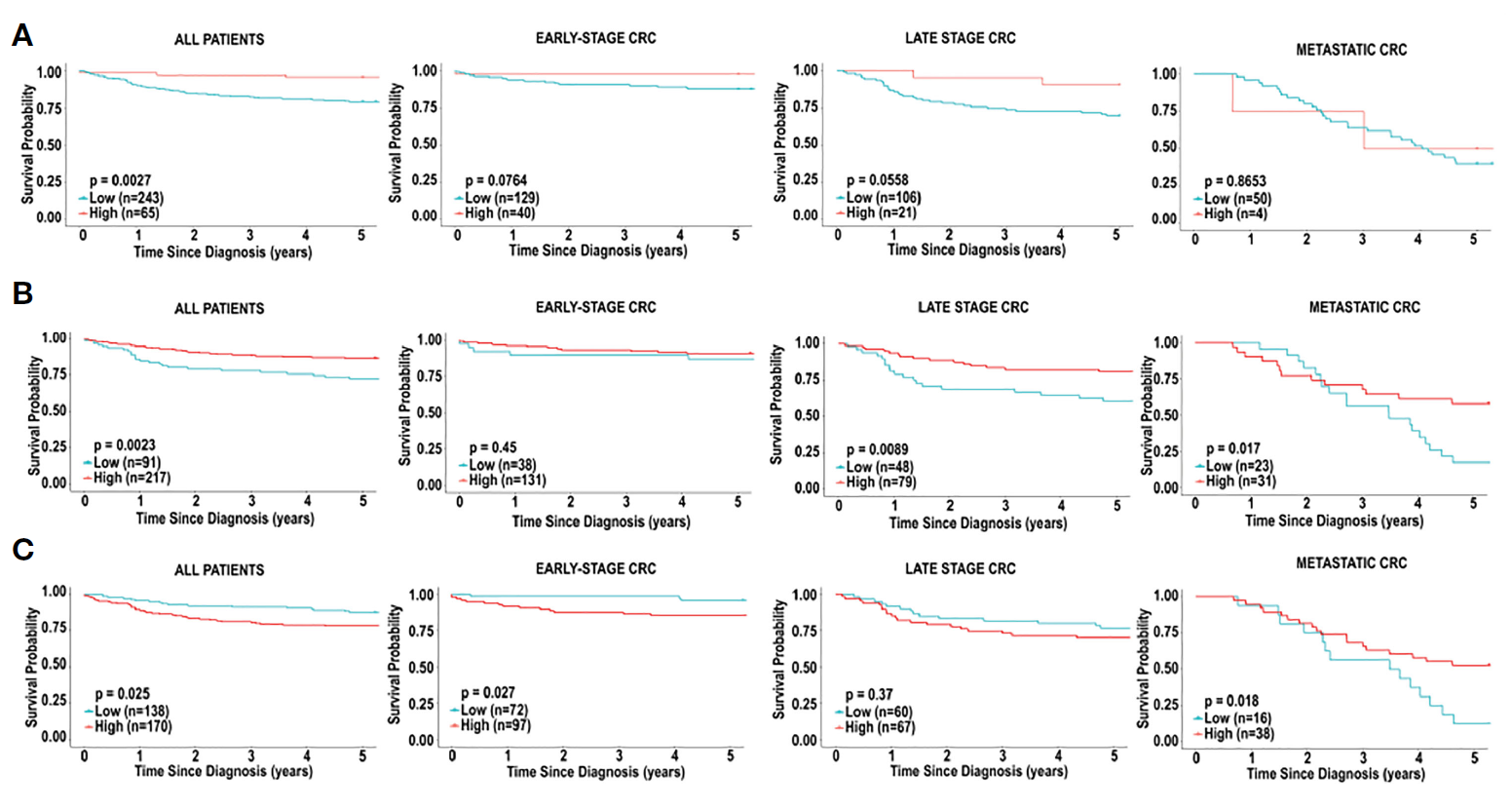
图. 基于活化树突状细胞的CRC免疫细胞浸润和生存分析
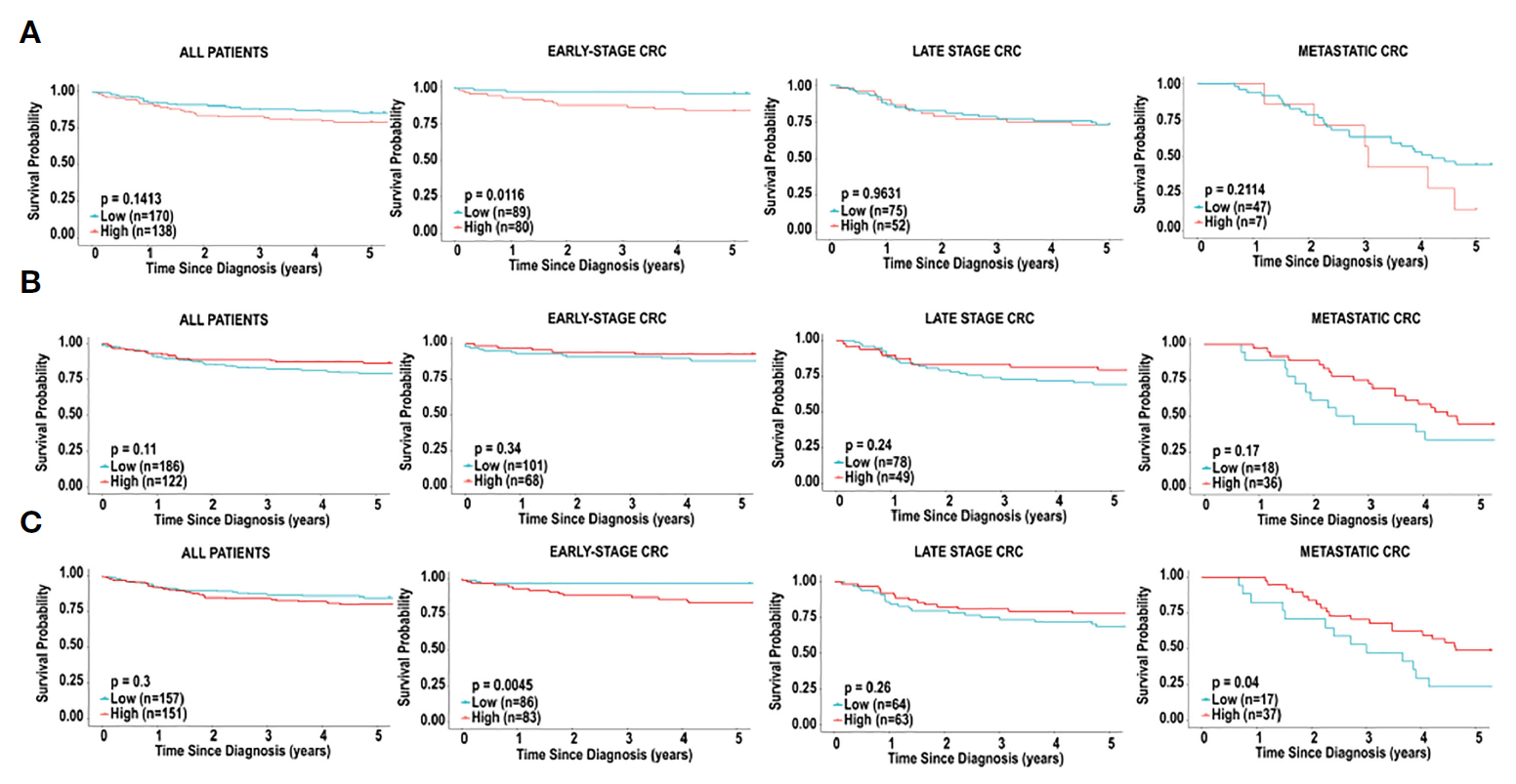
图. 基于CD8+T细胞的CRC免疫细胞浸润和生存分析
审批编号:MI-PD1-4993-CN
过期日期:5/31/2024
本资讯由默沙东医学团队编辑提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
排版编辑:肿瘤资讯-Phoebe











 苏公网安备 32059002004080号
苏公网安备 32059002004080号


