
西南医院肿瘤科
肿瘤科主任助理
博士、副主任医师、副教授
重庆市中青年医学高端人才
中国临床肿瘤学会(CSCO)胆道肿瘤专家委员会秘书长
重庆市医学会肿瘤学分会委员
重庆医院管理学会肿瘤管理专委会青年委员会副主任委员
第四期BTC双月评如约而至,恰逢2023年ESMO大会完满落下帷幕,我们在常规精选了五篇文献进行点评之余,还特别准备了一篇ESMO会议胆系肿瘤精华研究串评以飨读者。本期邀请到的六位点评专家均长期耕耘于肝胆肿瘤领域,对胆系肿瘤的基础研究和临床诊疗有着深刻的认知和独到的见解,细心的读者可能会发现部分专家已经“梅开二度”,在往期的点评中业已贡献了自己的真知灼见。本期双月评内容方面既有最新靶向药物的临床应用,又有常见靶点靶向药物的文献综述,不仅有对BTC发病机制的探索,更有对化免联合以及靶免结合局部治疗在胆系肿瘤真实世界疗效的观察。接下来,让我们跟随点评专家的视角,一起来领略BTC基础与临床独特的风景。
本期检索了2023年8月1日至10月31日期间发表的最新文献以及最新的ESMO大会内容。
本期文献检索和内容编辑得到了基石医学团队的大力帮助。
ESMO进展及点评
浙江大学医学院附属第一医院
肿瘤内科主任、博导
LBA34-Trastuzumab deruxtecan (T-DXd) for pretreated patients (pts) with HER2-expressing solid tumors: Primary analysis from the DESTINY-PanTumor02 (DP-02) study
背景:本项LBA研究(NCT04482309)是T-DXd治疗HER2表达的经治实体瘤患者(DP-02)的初步分析,评估了HER2表达(通过局部或中心检测免疫组织化学[IHC]3+/2+)、1次全身治疗(Tx)后局部晚期/转移性疾病或无替代Tx选择的患者的T-DXd(5.4mg/kg Q3W)。主要终点为研究者评估的ORR。次要终点包括安全性、DOR、PFS和OS。
有效性结果:截止数据(2023年6月),267名胆道(BTC)、膀胱(URO)、宫颈(CC)、子宫内膜(EC)、卵巢(OC)、胰腺(PC)或其他肿瘤患者接受了Tx治疗。在所有患者中,研究者评估的ORR为37.1%,mPFS为6.9个月,mOS为13.4个月;值得注意的是,在IHC3+表达的患者中,ORR为61.3%,mPFS为11.9个月,mOS为21.1个月,高表达病人疗效有明显提高。其中,BTC 41pts(IHC 3+ 16pts),ORR 22%(IHC3+为56.3%),mPFS 4.6(IHC3+为7.4),mOS 7.0(IHC3+为12.4),也显示了同样的改善趋势。
副反应结果:0.8%的患者发生了3级Tx相关不良事件;8.6%的患者因Tx相关AE而停止Tx。10.5%的患者经调整因素分析考虑有与Tx相关的间质性肺病/肺炎,其中有3例死亡。
点评:确实是高表达高疗效,可以作为泛瘤种标志物,但仍需警惕ILD。
654O-Efficacy and safety of trastuzumab deruxtecan (T-DXd) in patients (pts) with solid tumors harboring specific HER2-activating mutations (HER2m): Primary results from the international phase II DESTINY-PanTumor01 (DPT-01) study
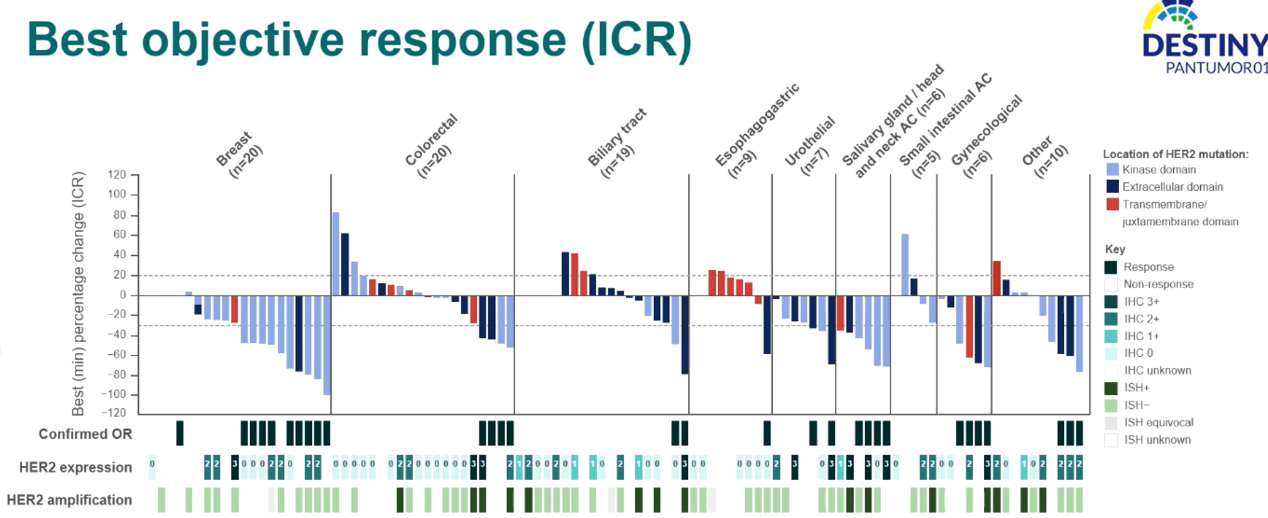
直接点评:为上一个研究的前驱研究,样本数略少,为102例,有效和安全性数据一致,但如下图可以看到,在瘤种方面,乳腺癌有优势,BTC表现一般,各瘤种均有非3+或ISH非阳性的病例获得确认PR表现,且HER2在激酶域,胞外域等不同突变位点与表达及扩增状态的内在关系尚不明朗。
94MO-Advanced extrahepatic cholangiocarcinoma: Post-hoc analysis of the ABC-01, -02 and -03 clinical trials
研究结果:在ABC-01、-02和-03研究中招募的534名患者中,179名(33.5%)患有eCCA(107名远端即dCCA,72名肝门即hCCA)。在接受CisGem化疗的117名eCCA患者中,客观缓解率为23.9%,其中19例dCCA的有效率为27.9%,高于9例hCCA的18.4%。dCCA和hCCA的PFS分别为8.3和8.4个月;OS分别为14.3和12.2个月。OS的多变量生存分析证实,PS=2分和高CA125是eCCA预后的负性指标。
点评:这项由来自英国UCL癌症中心约翰“桥水”(John Bridgewater,不是桥水基金)团队做的ABC系列研究事后分析,解答了eCCA的发病以及治疗现状,该亚型在BTC的高占比(56.29%)以及易于肝转移和腹腔转移的特性,提示该领域的研究仍然是未被满足的巨大临床及转化研究需求。
95MO-Tinengotinib in patients with advanced, fibroblast growth factor receptor (FGFR) inhibitor refractory/relapsed cholangiocarcinoma
直接点评:这项纳入73例经治BTC患者的研究中,主要探讨了可逆转目前可及的FGFR靶向药物耐药的新药Tinengotinib的作用,如下图可以看到,结合位点的不同以及高结合力,都是该药的优势。尤其是对于激酶结构域(KD)突变的病例,可达到44%的有效率和6.9个月的PFS,这些数据是建立在有47.2%的患者已接受过一线以上FGFR抑制剂治疗的情况下,不过因入组患者80.9%是白人,故在亚洲人群的有效性数据尚需等待。

文献点评
Ivosidenib: A Review in Advanced Cholangiocarcinoma
艾伏尼布在晚期胆管癌中的研究进展

文献引用:Frampton JE. Target Oncol. 2023;10.1007/s11523-023-01002-3. [PMID: 37855990. doi: 10.1007/s11523-023-01002-3]
期刊:Targeted Oncology(IF= 5.4)
文献类型:艾伏尼布、晚期胆管癌、IDH1突变
胆管癌是最具致命性的恶性肿瘤之一,疾病进展后可用的治疗方案有限,迫切需要新的治疗方法。研究表明,针对胆管癌细胞中异柠檬酸脱氢酶突变基因的药物研发,为其靶向治疗策略提供了机会。
本文中艾伏尼布直接抑制mIDH1导致血浆2-HG水平降低并恢复正常的细胞分化,被认为是在mIDH1 CCA中临床获益的基础。艾伏尼布口服吸收迅速,每天给药一次即可在14天内达到稳定的血浆水平。
在全球III期研究中,与安慰剂相比,艾伏尼布单药治疗显著延长了IDH1突变晚期胆管无进展生存期(PFS),疾病控制率几乎增加了一倍。此外,它对总生存期(OS)有有利的影响,在校正了安慰剂组(试验方案允许)的高交叉率后,总生存期也显著延长。艾伏尼布保留了与身体功能、疼痛和食欲下降/饮食相关的健康相关生活质量,且通常耐受性良好。
因此,艾伏尼布是一种新的、有价值的靶向治疗方法。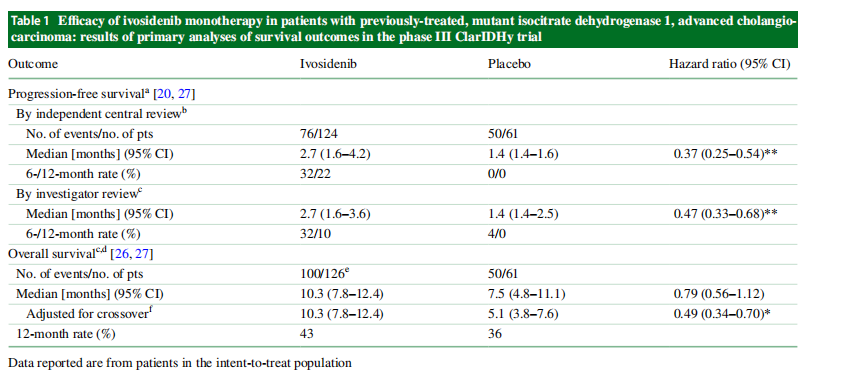
专家点评

胆管癌(CCA)通常诊断时已是晚期,由于治疗选择有限,预后很差。近年经研究发现,有40%的胆管癌患者可以找到关键的突变靶点,可以针对性选择治疗。其中IDH1就是其中很重要的一个基因,它在肝内胆管癌中的突变频率在14%左右。下面我们就把这篇关于IDH1抑制剂的综述进行点评和总结。
一、IDH1在三羧酸循环中的作用和致癌的机制
IDH1负责癌代谢物的积累,诱导参与各种信号通路的表观遗传变化。正常情况下,IDH1可以使异柠檬酸盐氧化脱羧形成α-KG,人体细胞产生的低浓度D-2HG和L-2HG也可以通过2-羟基戊二酸脱氢酶及时转化为α-KG以免积累。然而,突变的IDH1具有新形态活性,可以促进α-KG向癌代谢物2-HG的转化,导致2-HG在细胞中高水平积累,阻碍α-KG依赖性酶参与表观遗传调控,从而导致基因表达改变和分化阻断。
二、艾伏尼布的药理学特征及其在既往接受过治疗的IDH1突变胆管癌患者中的有效性和安全性。
艾伏尼布(Ivosidenib)是一种首创的口服强效靶向突变型IDH1小分子抑制剂,在实体瘤患者的研究中显示出作为单一药物的临床活性,已成为欧盟和美国批准的首批mIDH1抑制剂。研究显示,Ivosidenib对IDH1突变体具有高度选择性,体外Ivosidenib对某些IDH1 R132突变体的抑制浓度远低于野生型IDH1,并且不抑制IDH2的野生型或突变型亚型。在临床前模型中,Ivosidenib迅速降低了D-2HG水平并诱导了细胞分化。
I期研究中Ivosidenib患者的血浆2-HG水平较基线降低显著,并能对血浆D-2HG长期保持抑制,恢复正常的细胞分化。Ivosidenib口服吸收迅速,主要通过肝脏代谢,经粪便途径消除。
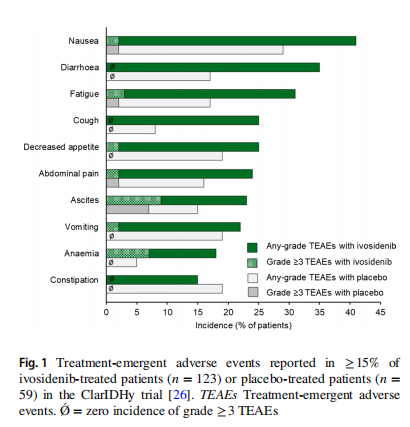
在核心研究中,Ivosidenib显示了对于晚期CCA患者良好的有效性和安全性。试验组124例患者的中位OS为10.3个月,而对照组为7.5个月,在纠正安慰剂组的高交叉率后,总生存期(OS)也显著延长。试验组中位PFS为2.7个月,对照组为1.4个月,达到了近翻倍的PFS。Ivosidenib的最长治疗持续时间为34.4个月。Ivosidenib的耐受性普遍良好,最常见的是1-2级的不良反应。虽然有34%接受Ivosidenib治疗的患者出现严重的不良事件,但仅有3例(2%)被认为与治疗相关。
总体来讲,Ivosidenib单药治疗已经显著改善了晚期CCA的PFS和OS,该结果为晚期胆管癌的治疗提供了一个极具价值的治疗方法。基于其强有力研究证据,目前已获得国内外等权威胆管癌指南的一致推荐。
目前Ivosidenib联合诱导化疗治疗白血病的研究已经开展,初始结果令人鼓舞。Ivosidenib单药治疗IDH1突变型胆管癌的基础上联合其他治疗,能否取得更显著的成效还需要我们不断地关注和探索。
IDH1突变的CCA为免疫抑制性冷肿瘤,对免疫治疗反应较差。然而近年来报道的基础研究显示,艾伏尼布可通过抑制2-HG诱导肿瘤免疫相互作用和干扰素途径激活,进而使IDH1突变CCA从冷肿瘤转为热肿瘤,并且艾伏尼布联合抗CTLA-4单抗可明显诱导肿瘤细胞死亡,并能持续引起肿瘤的特异性T细胞反应。以上结果提示,艾伏尼布联合免疫检查点抑制剂可能具有协同作用,值得进一步探讨探索。目前,一项艾伏尼布联合纳武利尤单抗联合治疗IDH1突变实体瘤的二期研究正在进行,期待研究的结果公布,能够帮助IDH1突变患者取得更优的临床获益。
RLY-4008, the First Highly Selective FGFR2 Inhibitor with Activity across FGFR2 Alterations and Resistance Mutations
RLY-4008——首个具有跨FGFR2改变和耐药性突变活性的高选择性FGFR2抑制剂

文献引用:Vivek Subbiah, et al.Cancer Discov 2023;13:2012-31. doi: 10.1158/2159-8290.CD-23-0475.
期刊:Cancer Discovery(IF=28.2)
文献类型:靶向治疗、二线治疗
FGFR2基因所编码的蛋白质是属于成纤维细胞生长因子受体(FGFR)家族成员之一,其作用机制可驱动多个瘤种,是具有探索潜力的治疗靶点。而在FGFR2融合阳性肝内胆管癌(iCCA)中,尽管泛FGFR抑制剂(pan-FGFRi)的临床疗效验证了FGFR2驱动因素的作用,但其获益受限于FRFR1和FGFR4介导的毒性(分别为高磷血症和腹泻)以及FGFR2耐药突变的出现。
RLY-4008是首个高选择性、不可逆的FGFR2抑制剂,对其进行的探索旨在克服这些局限。在体外,RLY-4008的选择性分别是FGFR1和FGFR4的250倍和5000倍以上,并可靶向原发变异和耐药突变。在体内,RLY-4008可诱导多种异种移植瘤模型(包括FGFR2耐药突变模型,该模型驱动pan-FGFRi的临床研究进展)消退,同时保留FGFR1和FGFR4。在早期临床试验中,RLY-4008的疗效并不伴随临床意义的非异构体FGFR毒性,证实了选择性靶向FGFR2的广泛治疗潜能(如下图病例介绍)。
由此结论:鉴于多种FGFR1-4介导的毒性和获得性FGFR2耐药突变,FGFR2驱动的癌症患者从pan-FGFRi中获益有限。RLY-4008是一种高选择性FGFR2抑制剂,可靶向原发变异和耐药突变,诱导肿瘤消退,同时保留其他FGFR,表明其可能具有进一步探索的价值。
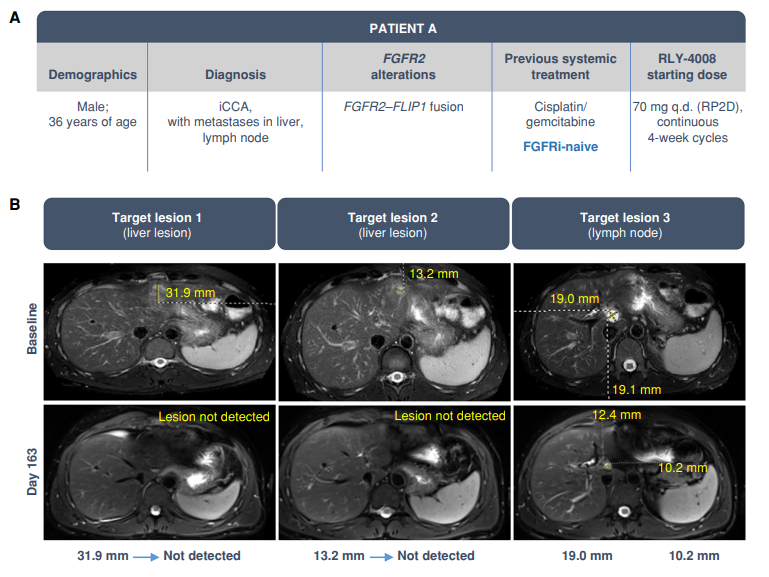
图1:未接受过FGFRi治疗的伴肝和淋巴结转移iCCA患者应用RLY-4008-70mg每日一次的临床应答
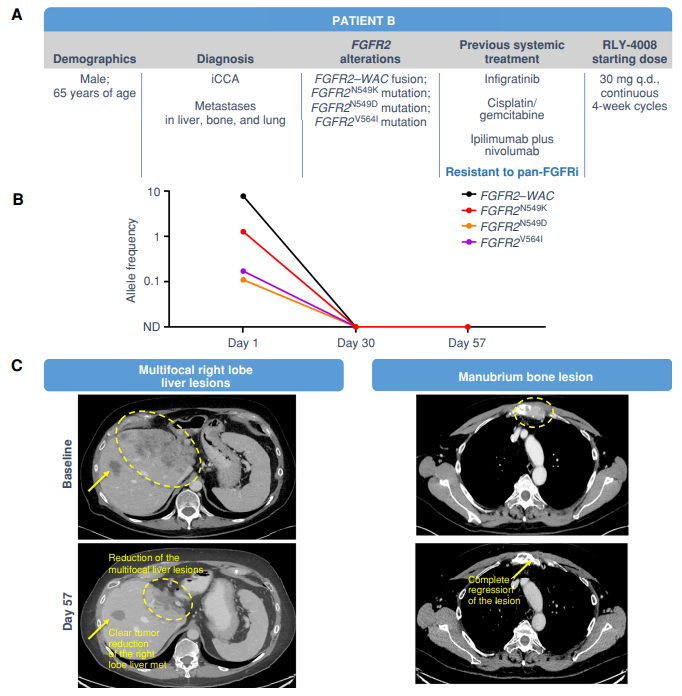
图2:伴肝、骨和肺转移的泛FGFRi耐药iCCA患者应用RLY-4008-起始30mg每日一次的临床应答
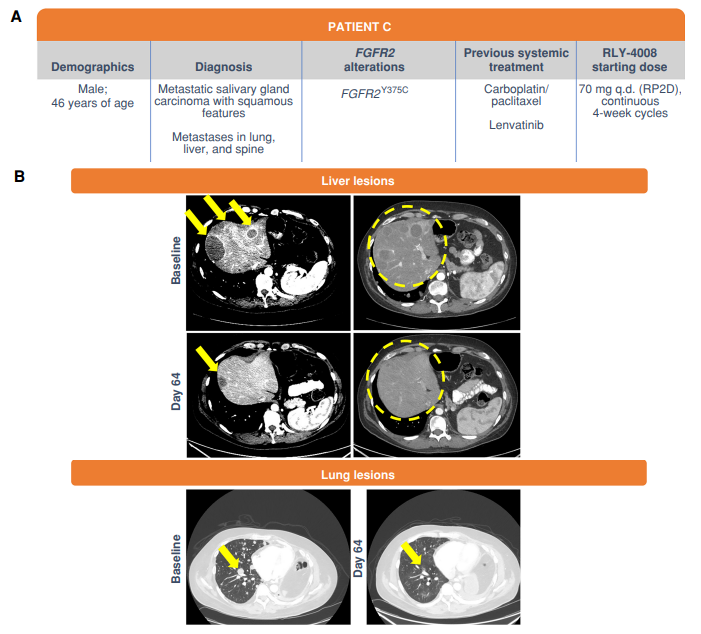
图3:伴肺、肝和脊柱鳞状转移特征的转移性唾液腺癌患者应用RLY-4008-70mg每日一次的临床应答
专家点评

1. FGFR抑制剂分为四类(详见崔玖洁教授的BTC月评1),具体药名在此不再罗列。需要重点关注的是2022年 ESMO大会报告的ReFocus研究(Antoine Hollebecque et al. LBA12.),这是一项全球,开放标签、I/II期研究,主要考察RLY-4008在伴FGFR融合/重排、未经FGFR抑制剂治疗的胆管癌患者中的疗效和安全性。结果显示,RP2D为70mg QD时,ORR为88%(15/ 17,15例患者持续应答),所有剂量水平的ORR为63%(24/ 38,19,19例患者持续应答);最常见的治疗相关的不良反应(TRAEs)包括轻度的口腔炎(48%)、手足综合征(46%)以及口干(31%);PK/PD和差异化安全性数据表明RLY-4008对FGFR2具有高效的靶点抑制,无显著的临床脱靶毒性。
2. 本研究来自MD Anderson Cancer Center,是“from bench to bedside”的典范,笔者垂涎三尺,试图采用倒序的方法解读或者领略文中的风景,首先请同道们在上述三个病例处驻足。天天见面的ICC,此刻似乎变得陌生!试问,您在门诊遇到病例A或B或C,是直接给TKI还是1L化疗?是三联四药还是PD-1抑制剂为主的二联?抑或肝脏局部治疗(LRT)序贯PD-1抑制剂?肝胆领域的系统治疗进步太快,没有ICIs,似乎没有话语权!笔者顾虑的是,我们在不断做加法的时候,是否抽离了病人的“nature history”?有好事者直接比较FGFR变异和野生的预后(无任何治疗干预),结果发现变异者本身预后就好(EJC 2022,166:165-175),恰巧今年梅奥给出了相同的结论(ESMO 2023:108P)。
3. ReFocus正在进行中(NCT04526106),III期注册临床即将开展,期待RLY-4008给患者点燃希望,同时也照亮领域内个体化、精准化道路。“肝胆相照,一路同行”,从思想政治的角度必须“相照”,但就临床研究的范式,BTC还是另辟蹊径为宜。“一路同行”NCCN可能不同意,FGFR、HER-2、NTRK等一众兄弟可能都不答应。
Effect of different PD-1 inhibitor combination therapies for unresectable intrahepatic cholangiocarcinoma
不同PD-1抑制剂联合治疗不可切除肝内胆管癌的疗效

文献引用:Lei Z, et al. Aliment Pharmacol Ther. 2023. Sep;58(6):611-622. [PMID: 37349908 doi: 10.1111/apt.17623.]
期刊:Aliment Pharmacology Therapeutics(IF=7.6)
文献类型:化疗联合治疗;免疫检查点抑制剂;免疫疗法;肝内胆管癌
免疫检查点抑制剂(ICI)联合治疗为治疗不可切除的肝内胆管癌(uICC)提供了一种新的选择。本研究的目的是比较不同抗PD-1联合疗法作为uICC一线治疗的临床获益。
研究纳入了来自中国22个中心的318名患者,他们接受了单独化疗(Chemo)、抗PD-1联合化疗(ICI化疗)、抗PD-1联合靶向治疗(ICI靶向)或抗PD-1联合靶向治疗和化疗(ICI-靶向化疗)作为uICC的一线治疗。主要终点是无进展生存期(PFS)。次要终点包括总生存率(OS)、客观有效率(ORR)和安全性。
结果显示,ICI化疗患者(中位PFS[mPFS],6.3个月;HR:0.61,95%CI:0.42-0.88;p=0.008;中位OS[mOS],10.7个月;HR:0.61,95%CI:0.39-0.94;p=0.026),ICI靶向(mPSF为7.2个月;HR:0.54,95%CI:0.36-0.80;p=0.002;mOS为15.8个月;HR:0.54,95%CI:0.35-0.84;p=0.006)或ICI靶向化疗(mPFS为6.9个月;HR:0.65,95%CI:0.47-0.90;p=0.009;mOS为14.4个月;HR:0.47,95%CI:0.31-0.70;p<0.001)取得了比化疗更好的临床结果(mPFS为3.8个月;mOS为9.3个月)。ICI靶向化疗在生存结果方面与ICI化疗(PFS的HR:0.88,95%CI:0.55-1.42;p=0.614;OS的HR:0.89,95%CI:0.51-1.55;p=0.680)和ICI靶向(PFS的HR:1.20,95%CI:0.77-1.88;p=0.413;OS的HR:0.86,95%CI:0.51-1.47;p=0.583)相似,但导致了更多的不良事件(p<0.001;p=0.010)。多变量和倾向评分分析支持这些发现。
因此,研究者认为,在uICC患者中,ICI化疗或ICI靶向比化疗提供了更多的生存益处,同时实现了与ICI靶向化疗相当的预后和更少的不良事件。
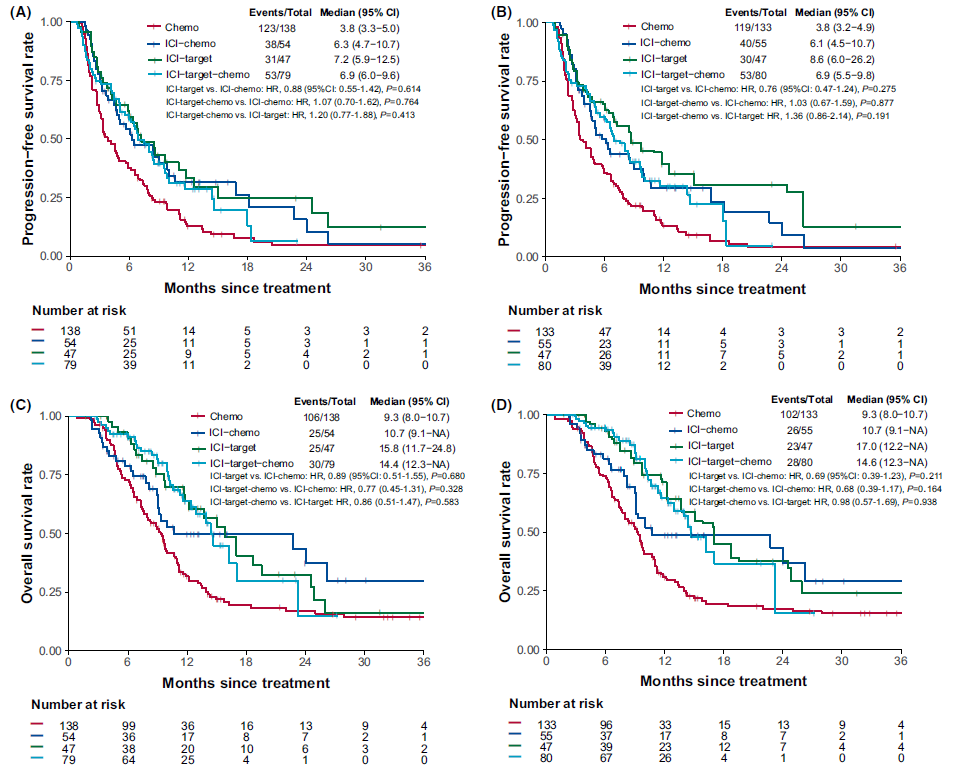
图:不同治疗组K-M生存曲线。(A)未校正PFS。(B)IPTW校正PFS曲线。(C)未校正OS曲线。(D)IPTW校正OS曲线
专家述评

该研究是国内首个多中心,包含回顾性队列及前瞻性队列,通过对真实世界中晚期肝内胆管癌(ICC)一线治疗常用的4种方案,如化疗、免疫检查点抑制剂(ICI)联合化疗、ICI联合靶向治疗和ICI联合靶向加化疗等方案进行两两比较,评估各自疗效与不良反应。
研究共纳入来自全国22个中心共318例患者,其中回顾性队列118例,前瞻性队列200例,主要终点为无进展性生存期(PFS),次要终点包括总生存率(OS)、客观反应率(ORR)和安全性。研究结果提示:单纯化疗组mPFS 3.8个月,mOS为9.3个月;ICI联合化疗组mPFS 6.3个月,mOS为10.7个月;ICI联合靶向治疗组mPFS 7.2个月,mOS为15.8个月,ICI联合靶向加化疗组mPFS 6.9个月,mOS为14.4个月。在晚期ICC患者中,ICI联合化疗或ICI联合靶向治疗比单纯化疗能提供更多的生存获益,与ICI联合靶向加化疗获益类似,不过不良事件更少。
肝内胆管癌的独立队列研究不多见,大多数ICC研究数据都是覆盖在胆管癌(BTC)队列研究中。BTC目前一线标准治疗仍然推荐GP或GEMOX,近年来TOPAZ-1研究和KEYNOTE 966,分别用PD-L1/PD-1与GP(GC)联合的方案,均取得不错的疗效,不过低应答率和延长不明显的OS也是我们目前治疗的痛点。国内有学者提出三联四药的方案,ORR有显著提升,不过暂缺大样本数据验证。免疫联合靶向治疗的部分小样本队列也显示出较好耐受性及可观的生存期。因此,临床中对于晚期ICC,可选择的方案就很多,哪种方案更合适,目前没有定论。这个研究的最大意义,是从真实世界中描述了uICC的4种常见治疗方案的各自疗效,从比较结果上看,这4种方案疗效都是不错的。免疫联合靶向方案和免疫联合化疗似乎较好的兼顾了近期、远期疗效和不良反应的控制。值得一提的是,对于部分拒绝化疗的病人,免疫联合靶向治疗应该也是个值得选择的方法。当然,该研究也存在一些问题,还需要前瞻性、统一方案的对照性队列的验证,才能避免数据偏差。
Hepatic arterial infusion chemotherapy plus lenvatinib with or without programmed cell death protein-1 inhibitors for advanced cholangiocarcinoma
肝动脉灌注化疗联合仑伐替尼联合或不联合程序性细胞死亡蛋白-1抑制剂治疗晚期胆管癌
文献引用: Front Immunol. 2023 Aug 30:14:1235724. doi: 10.3389/fimmu.2023.1235724. eCollection 2023.
期刊:Front Immunol(IF= 7.3)
文献类型:回顾性对照,化疗/靶向±免疫
由于目前一线化疗方案的疗效有限,晚期胆管癌(CCA)患者需要新的治疗策略来改善疾病预后。尽管肝动脉灌注化疗(HAIC)、仑伐替尼和程序性细胞死亡蛋白-1(PD-1)抑制剂联合治疗晚期肝细胞癌已得到广泛评价,但它们在晚期CCA中的作用仍知之甚少。本研究的目的是比较HAIC联合仑伐替尼与PD-1抑制剂联合或不联合治疗晚期CCA患者的疗效和安全性。
在2019年3月至2022年6月期间,55名晚期CCA患者纳入研究,分别入组HAIC仑伐替尼(LEN)PD-1抑制剂(PD-1i)组(n=35)和HAIC LEN组(n=20)。中位随访时间为14.0(5-42)个月。HAIC LEN PD-1i组患者的PFS(HR=0.390;95%CI 0.189-0.806;p=0.001)和OS(HR=0.461;95%CI 0.2290.927;p=0.01)明显优于HAIC LEN组患者(见图1)。HAIC LEN PD-1i和HAIC LEN组的中位OS分别为16个月和11个月(p=0.138),而两组的中位数PFS分别为6.5个月和3.5个月(p=0.020),HAIC LEN PD-1i组的6个月、1年和2年PFS发生率显著高于HAIC LEN组(分别为p=0.004、p=0.007、p=0.001和p=0.004)(表2)。
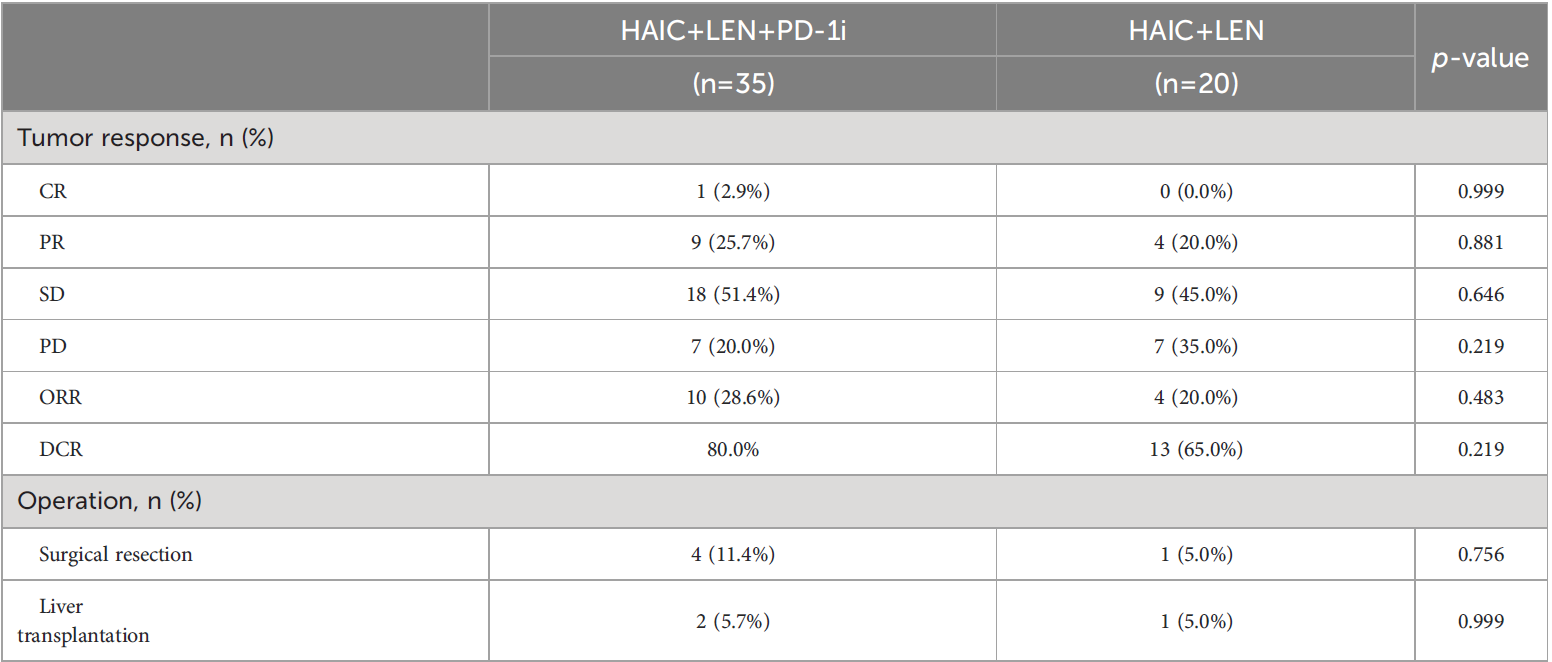
治疗后3个月的影像学评估表明,HAIC LEN PD-1i组有7名(20.0%)PD,18名(51.4%)患者SD,9名(25.7%)患者PR,1名(2.9%)患者CR,ORR为28.6%,DCR为80.0%。在HAIC LEN组中,7名(35.0%)患者PD,9名(45.0%)患者SD,4名(20.0%)患者PR,ORR为20.0%,DCR为65.0%。HAIC LEN PD-1i组的ORR和DCR高于HAIC LEN组,但没有发现显著差异(表3)。HAIC LEN PD-1i组显示出比HAIC LEN组更高的客观缓解率和疾病控制率,但没有显著差异。与HAIC LEN组相比,HAIC LEN PD-1i组的1-2级和3-4级AE的发生率没有显著升高,HAIC LER PD-1i小组中有两例患者(5.7%)经历了5级免疫介导的肺炎。
HAIC+仑伐替尼联合PD-1抑制剂是安全、耐受性良好的,有可能延长晚期CCA患者的生存期。PD-1抑制剂的加入可能会增强HAIC+仑伐替尼的疗效。因此,联合治疗有可能成为晚期CCA的治疗选择。
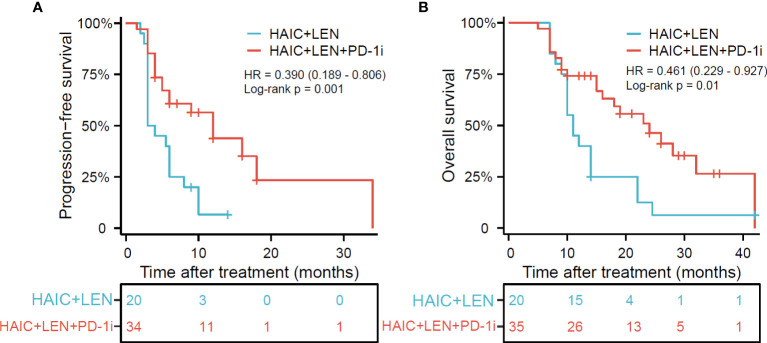
HAIC,肝动脉灌注化疗;LEN,乐伐替尼;PD-1i,PD-1抑制剂;OS,总体生存率;PFS,无进展生存期。
*HAIC LEN PD-1i组的一名患者无法准确评估疾病进展的时间,因此只有34名患者被纳入无进展生存期的评估。
图1:基于HAIC LEN PD-1i组的无进展生存期(A)和总生存期(B)的Kaplan-Meier图与HAIC LEN组相比
表1:两组患者的总生存率和无进展生存率
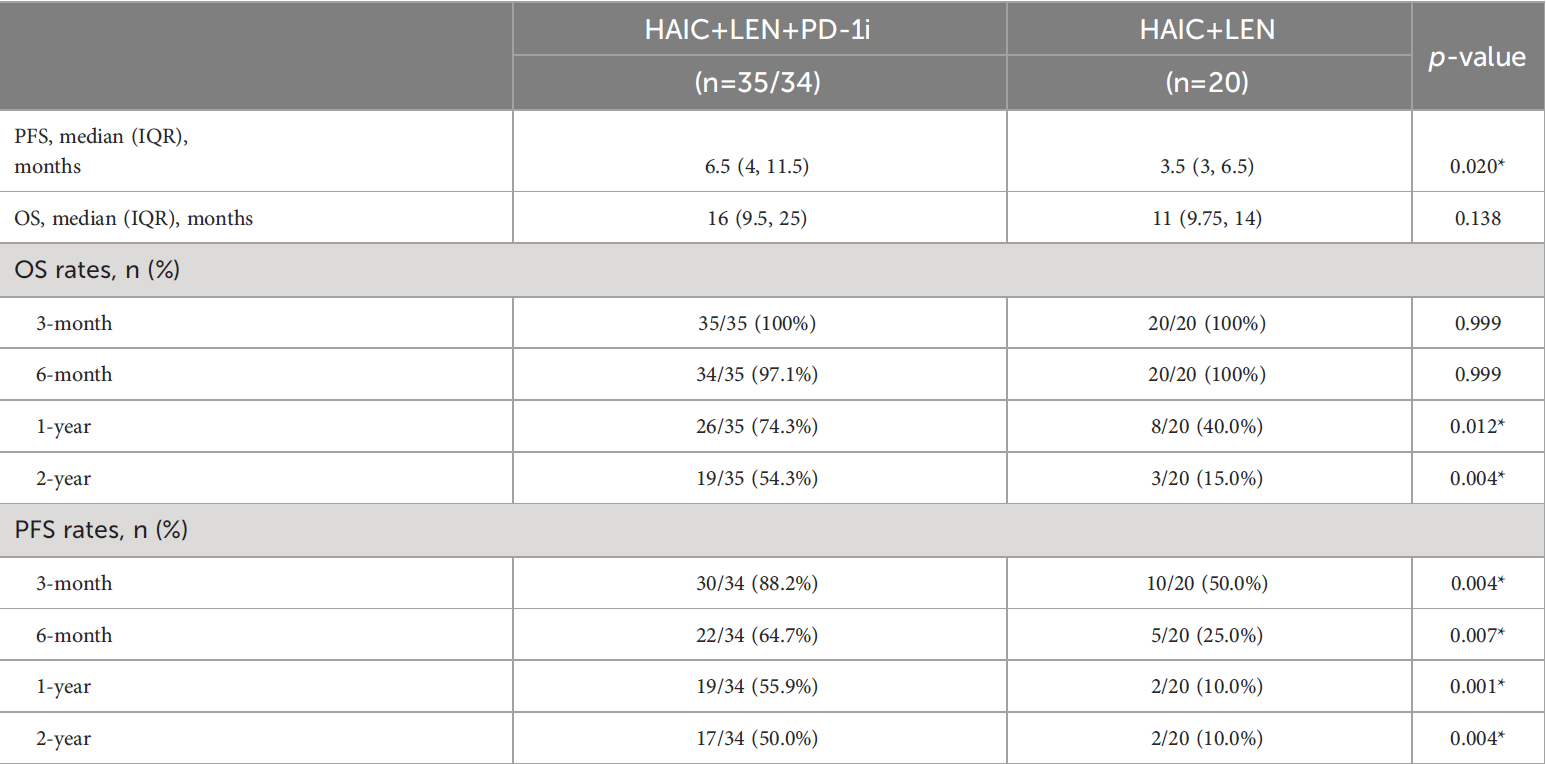
表2:两组的肿瘤反应率和手术率
专家点评
 该研究回顾性分析了55例胆管癌(CCA)患者,比较FOLFOX-HAIC+仑伐替尼联合或不联合PD-1抑制剂(PD-1i)(35例 vs. 20例)的疗效和安全性,研究结果显示在FOLFOX-HAIC+仑伐替尼的基础上加用PD-1i可以显著的延长PFS(6.5m vs 3.5m,p=0.02)和OS(16m vs 11m,p=0.138),3月、6月、1年、2年的PFS率和1年、2年的OS率均有显著的增加,肿瘤反应的相关指标ORR、DCR也有增加的趋势,且不良反应安全可控。
该研究回顾性分析了55例胆管癌(CCA)患者,比较FOLFOX-HAIC+仑伐替尼联合或不联合PD-1抑制剂(PD-1i)(35例 vs. 20例)的疗效和安全性,研究结果显示在FOLFOX-HAIC+仑伐替尼的基础上加用PD-1i可以显著的延长PFS(6.5m vs 3.5m,p=0.02)和OS(16m vs 11m,p=0.138),3月、6月、1年、2年的PFS率和1年、2年的OS率均有显著的增加,肿瘤反应的相关指标ORR、DCR也有增加的趋势,且不良反应安全可控。
目前晚期CCA的标准治疗为全身系统治疗,即化疗联合抗PD-1/PD-L1抗体,但根据TOPAZ-1和KEYNOTE966的研究结果来看中位OS在1年左右,疗效有限。多靶点的小分子酪氨酸激酶抑制剂,如仑伐替尼、安罗替尼与免疫治疗联合从机制上可以改善肿瘤的免疫微环境,两者具有协同增效的作用,且有研究已经显示靶免联合模式在一部分胆道恶性肿瘤的后线治疗中获得了成功。现有多个研究在胆道恶性肿瘤中探索靶免化治疗模式的可行性,其中复旦大学附属中山医院周俭教授牵头的GEMOX+特瑞普利单抗+仑伐替尼一线治疗晚期胆道肿瘤的Ⅱ期研究和我们中心的SAGC研究均显示了靶免化模式在胆道恶性肿瘤中的疗效,特别是肝内胆管癌。但是也看到多种药物的组合带来较高的不良反应。
HAIC治疗模式属于肝脏肿瘤的局部治疗手段,现阶段主要用于肝细胞性肝癌的局部治疗。该研究则将HAIC治疗模式移植到了CCA中,与射频消融、放疗等其他局部治疗手段相比,其对弥漫性和多发性病变存在明显的优势。但是该研究中FOLFOX方案药物的剂量较标准方案低,治疗周期为2-5周,长于标准的2周方案。虽然不良反应较标准全身治疗有所改善,但剂量的减少、治疗间期的延长及给药模式的改变对静脉中血药浓度的影响会不会影响方案的疗效及耐药性的产生是我们所担心的问题。而且该研究回顾性的设计,没有设立标准治疗组的对照,使得研究结果的解读有一定的局限性,我们只能得出FOLFOX-HAIC+仑伐替尼的基础上加用PD-1i可以延长晚期CCA患者生存,但与标准化疗联合免疫或是单纯靶向联合免疫比较孰优孰劣仍需进一步的研究去验证。
总之,该研究比较FOLFOX-HAIC+仑伐替尼联合或不联合PD-1抑制剂治疗晚期CCA的疗效和安全性的临床研究,初步证实是安全且耐受性良好的,并且有可能延长晚期CCA患者的生存期。PD-1抑制剂的加入可增强HAIC和仑伐替尼的疗效。
基础研究
An inflammatory checkpoint generated by IL1RN splicing offers therapeutic opportunity for KRAS mutant intrahepatic cholangiocarcinoma
由IL1RN剪接产生的炎症检查点为KRAS突变型肝内胆管癌提供了治疗机会

文献引用:Zhang Mao, et al. Cancer Discov.2023 Oct 5;13(10):2248-2269. [PMID: 37486241. DOI: 10.1158/2159-8290.CD-23-0282]
期刊:Cancer Discovery (IF: 29.497)
文献类型:基础研究、KRAS基因
这项试验由复旦大学附属中山医院、复旦大学附属金山医院以及上海临港实验室共同完成。描述了一种由IL1RN选择性剪接变异体介导的新型炎症检查点,可能为开发KRAS突变的iCCA和其他癌症的治疗方案提供有希望的理论基础。
过去几十年里,肝内胆管癌(intrahepatic cholangiocarcinoma,iCCA)已成为一个主要的全球癌症问题,诊断率和死亡率居高不下。尽管免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)+化疗在不可切除的iCCA患者中获得了一定的生存益处,但总体生存仍不令人满意。因此,迫切需要更深入地了解iCCA的发病机制,以指导发现新的治疗策略。
高通量测序分析扩展了目前对iCCA的分子特征的认识。利用多组学数据,各种研究表明:KRAS突变是iCCA的主要驱动因素,其在炎症亚型中显著富集;而炎症可加速肿瘤进展,严重损害免疫疗法的疗效。与之相反,白细胞介素-1受体拮抗剂(IL1RN, interleukin 1 receptor antagonist)是一种内源性拮抗剂,可阻断白细胞介素-1(IL-1)通路,抑制炎症级联反应。
本研究基于大量的组学数据发现:KRAS突变与肝内胆管癌(iCCA)中的选择性mRNA剪接(AS, alternative mRNA splicing)的特定景观相关。并发现了一个可能的负反馈机制:白细胞介素1受体拮抗剂(IL1RN)-201/203由于选择性剪接(AS)而上调,从而在KRAS突变体iCCA中发挥了重要的抗炎作用。
在KRAS突变的iCCA小鼠模型中,研究者观察到了前述临床样本中存在的负反馈现象。另外还发现:无论IL1RN-201/203表达上调,还是anakinra(一种白细胞介素-1受体拮抗剂)治疗,均可以引起细胞毒性T细胞(如GZMB+ CD8+ T细胞)的富集,并伴随免疫抑制性中性粒细胞亚群(如CXCR4+ 中性粒细胞)的减少和重编程。
在临床上,本研究发现KRAS突变iCCA患者中较高的IL1RN-201/203水平与抗pd-1免疫治疗的应答效果显著相关。
本研究发现了一个由IL1RN的mRNA剪接产生的新的炎症检查点,它可以通过调节中性粒细胞的募集和极化来抑制KRAS突变介导的炎症信号级联、肿瘤的进展和ICIs耐药性。这些发现为开发及制定针对KRAS突变型iCCA乃至其他瘤种的有效干预措施提供了坚实的理论基础。
专家点评


肝内胆管癌(intrahepatic cholangiocarcinoma,iCCA)是一种高度异质性的恶性肿瘤,由于肿瘤侵袭性早、复发率高且有远处转移倾向,治疗具有极大的挑战性。虽然针对FGFR2融合/重排、IDH1突变的靶向药物,以及TOPZA-1和KEYNOTE-966研究验证过的化免联合方案在晚期iCCA治疗中初显锋芒,但极其有限的突变人群和极其有限的化免联合生存获益仍严重制约了总体患者的长期生存。
本项研究由复旦大学附属中山医院樊嘉院士团队高强教授、林健博士,联合临港实验室魏武研究员团队共同完成,结果发表在2023年7月的Cancer Discovery杂志上。该研究基于大量的组学数据,全面描绘了iCCA中可变剪接事件(alternative splicing events, ASEs)景观。并整合单细胞转录组测序、多色免疫组化和多因子检测等技术手段,从细胞系、类器官、小鼠模型以及临床样本等多个维度,深入探索了KRAS突变型iCCA中IL1RN剪接产生的新型炎症检查点的功能及具体作用机制。这为KRAS突变型iCCA或其他肿瘤有效干预措施的开发及制定提供了坚实的理论基础。
值得一提的是:早在2021年底,同样是樊嘉院士团队高强教授课题组,与其他合作者共同在期刊Cancer Cell发表了题为“Proteogenomic characterization identifies clinically relevant subgroups of intrahepatic cholangiocarcinoma”的研究论文。该研究基于来自262例肝内胆管癌患者癌组织的基因组、转录组、蛋白质组和磷酸化蛋白质组等多组学数据,绘制了肝内胆管癌的多维分子图谱,为肝内胆管癌的发生发展机制、分子分型、预后监测和个性化治疗策略提供了新思路。研究发现,TP53、KRAS、FGFR2、IDH1/2、BAP1突变(融合)是肝内胆管癌的主要驱动基因变异,并对这些变异所影响的蛋白基因组精细特征改变进行了逐一研究。其中KRAS突变可导致炎症-感染和ECM-粘着斑通路相关蛋白上调。
肿瘤免疫治疗领域科学家陈列平教授曾经说过:“肿瘤免疫的基础研究能做多好,决定了肿瘤免疫治疗能走多远”。笔者对这句话深以为然:肝内胆管癌未来的治疗突破方向在精准靶向治疗及免疫治疗,而该治疗领域的发展和突破同样依赖于基础研究对发病机制的深入探索。基于iCCA研究领域以本研究为代表的高水平研究成果不断涌现,我们有理由相信:虽然iCCA治疗之路仍然道阻且长,但行则将至、未来可期。
泛读
Immune checkpoint inhibitors in hepatocellular carcinoma: emerging challenges in clinical practice
肝细胞癌免疫检查点抑制剂:临床实践中的新挑战

文献引用:Pinter M, Scheiner B, Pinato DJ. Immune checkpoint inhibitors in hepatocellular carcinoma: emerging challenges in clinical practice. Lancet Gastroenterol Hepatol. 2023 Aug;8(8):760-770. [PMID: 37327807. doi: 10.1016/S2468-1253(23)00147-4]
期刊:Lancet Gastroenterol Hepatol(IF=35.7)
文献类型:综述,免疫治疗
AZGP1 activation by lenvatinib suppresses intrahepatic cholangiocarcinoma epithelial-mesenchymal transition through the TGF-β1/Smad3 pathway
lenvatinib激活AZGP1通过TGF-β1/Smad3途径抑制肝内胆管癌上皮-间质转化Circ-RAPGEF5通过稳定SAE1促进SUMOylation促进肝内胆管癌的进展

文献引用:Deng L, et al. Cell Death Dis. 2023 Sep 5;14(9):590. [doi: 10.1038/s41419-023-06092-5. PMID: 37669935]
期刊:Cell Death Disease(IF= 9.0)
文献类型:基础研究
Methyltransferase like 3 inhibition limits intrahepatic cholangiocarcinoma metabolic reprogramming and potentiates the efficacy of chemotherapy
甲基转移酶样3抑制限制肝内胆管癌代谢重编程并增强化疗的疗效

文献引用:Gao J, et al. Oncogene. 2023 Aug;42(33):2507-2520. [doi: 10.1038/s41388-023-02760-0. PMID: 37420030.]
期刊:Oncogene(IF= 8.0)
文献类型:基础研究,化疗
The roles of epigenetic regulation in cholangiocarcinogenesis
表观遗传调控在胆管癌发生中的作用

文献引用:Zhong B, et al. Biomed Pharmacother. 2023 Oct;166:115290. [doi: 10.1016/j.biopha.2023.115290. PMID: 37557012.]
期刊:Biomed Pharmacother(IF= 7.5 )
文献类型:基础研究
Case Report: Camrelizumab combined with gemcitabine and oxaliplatin in the treatment of advanced intrahepatic cholangiocarcinoma: a case report and literature review
病例报告:卡瑞丽珠单抗联合吉西他滨、奥沙利铂治疗晚期肝内胆管癌1例报告及文献复习

文献引用:Zhang Z, et al. Front Immunol. 2023 Aug 21;14:1230261. [doi: 10.3389/fimmu.2023.1230261. PMID: 37671157.]
期刊:Frontiers in Immunology(IF= 7.3)
文献类型:病例报告,免疫联合化疗
Lacking Immunotherapy Biomarkers for Biliary Tract Cancer: A Comprehensive Systematic Literature Review and Meta-Analysis
胆道癌缺乏免疫治疗生物标志物:一项全面系统的文献综述和荟萃分析

文献引用:Frega G, et al. Cells. 2023 Aug 19;12(16):2098. doi: 10.3390/cells12162098. [PMID: 37626908; PMCID: PMC10453268.]
期刊:Cells(IF=6.0)
文献类型:综述,诊断
Efficacy, safety, and prognostic factors of PD-1 inhibitors combined with lenvatinib and Gemox chemotherapy as first-line treatment in advanced intrahepatic cholangiocarcinoma: a multicenter real-world study
PD-1抑制剂联合lenvatinib和Gemox化疗作为晚期肝内胆管癌一线治疗的疗效、安全性和预后因素:一项多中心现实世界研究

文献引用:Zhu C, et al. Cancer Immunol Immunother. 2023 Sep;72(9):2949-2960. [doi: 10.1007/s00262-023-03466-8. PMID: 37247023;]
期刊:Cancer Immunol Immunother(IF=5.8)
文献类型:真实世界研究,免疫联合化疗
责任编辑:Marie
排版编辑:Mia











 苏公网安备32059002004080号
苏公网安备32059002004080号


