
钟贻洪, 杨倩, 刘周, 等. 磁共振成像平扫和扩散加权成像预测脑转移瘤的价值[J]. 中华肿瘤杂志, 2021, 43(4):466-471.
DOI: 10.3760/cma.j.cn112152-20190313-00153.
目的
探讨磁共振成像(MRI)平扫和扩散加权成像(DWI)预测脑转移瘤的临床价值。
方法
回顾性分析2016年6月至2018年12月就诊于中国医学科学院肿瘤医院深圳医院、经增强MRI检查和临床诊断为脑转移瘤和非脑转移瘤患者的MRI平扫的影像学表现,对比分析105例脑转移瘤(转移组)和103例非脑转移瘤(非转移组)患者的常规T1加权成像(T1WI)、T2加权成像(T2WI)、T2液体衰减反转恢复(T2WI/FLAIR)、DWI和表观扩散系数(ADC)值。
结果
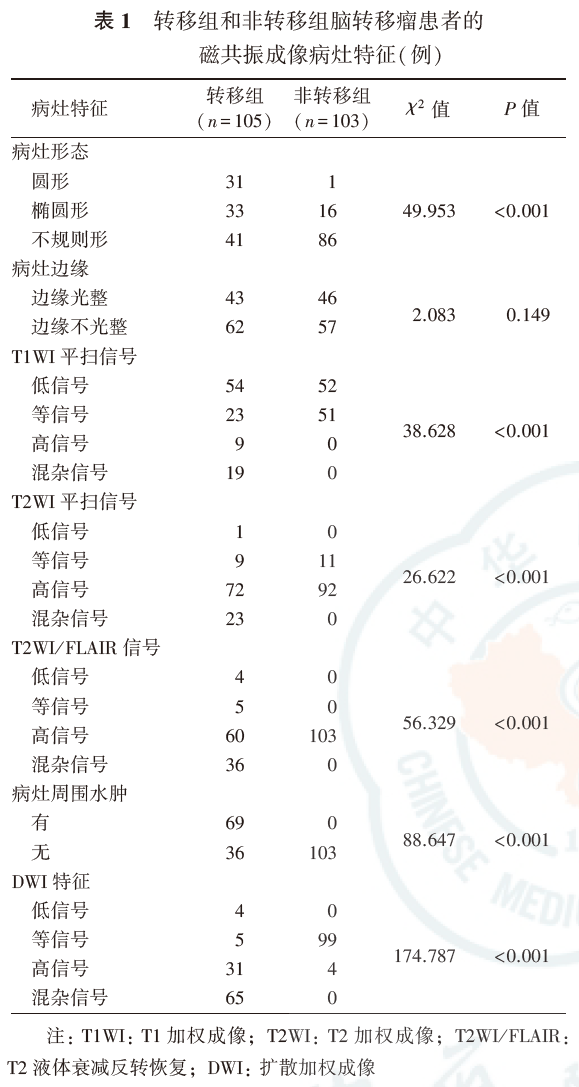
转移组患者中T1WI低信号、等信号、高信号和混杂信号分别为54、23、9和19例,非转移组患者中T1WI低信号和等信号分别为52和51例,差异有统计学意义(P<0.001)。转移组中T2WI低信号、等信号、高信号和混杂信号分别为1、9、72和23例,非转移组中T2WI等信号和高信号分别为11和92例,差异有统计学意义(P<0.001)。转移组中DWI低信号、高信号和混杂信号分别为4、31、65例;非转移组中DWI高信号4例,其余均呈等信号,差异有统计学意义(P<0.001)。转移组中T2WI/FLAIR低信号、等信号、高信号和混杂信号分别为4、5、60和36例,非转移组中T2WI/FLAIR均为高信号,差异有统计学意义(P<0.001)。转移组患者病灶周围伴水肿69例,高于非转移组(0例),差异有统计学意义(P<0.001)。转移组患者的ADC值为(0.919±0.019)×10-3 mm2/s,低于非转移组[(1.098±0.012)×10-3 mm2/s,P<0.05]。
结论
对于伴有原发恶性肿瘤病史的患者,脑转移瘤与非转移瘤患者MRI平扫中的T1WI、T2WI、DWI和T2WI/FLAIR信号差异明显,混杂信号、病灶周围水肿和DWI扩散受限有助于诊断脑转移瘤,以上参数联合应用可以提高预测脑转移瘤的诊断效能,必要时需进一步行MRI增强扫描以明确诊断。
【关键词】脑转移肿瘤; 磁共振成像; 原发恶性肿瘤; 弥散加权成像
脑转移瘤是指原发于其他部位的恶性肿瘤转移至脑内,其发病率约占脑内肿瘤的20%。恶性肿瘤患者一旦出现脑转移,预后极差,如果不加临床干预,其自然病程仅为1~3个月。提高对脑转移瘤的早期诊断认识、制定合理的治疗方案,对延长患者生存有十分重要的意义。目前,磁共振成像(magnetic resonance imaging, MRI)增强检查是诊断脑转移瘤的可靠手段,但因部分患者伴重度肾功能不全、少数患者高敏体质、部分基层医院条件限制或部分临床医师认识不足等原因,未能进行增强MRI检查,造成部分脑转移瘤患者漏诊。本研究中,我们分析了脑转移瘤和非脑转移瘤患者MRI平扫的信号特征,总结了对预测脑转移瘤有价值的MRI征象,以期为临床诊断提供参考。


一、临床资料
回顾性分析2016年6月至2018年12月于中国医学科学院肿瘤医院深圳医院行MRI头颅平扫+增强检查、具有原发恶性肿瘤病史患者的影像学资料。入组标准:(1)具有原发颅外恶性肿瘤病史,不包括头颈恶性肿瘤颅内侵犯患者;(2)脑转移瘤未行放、化疗;(3)脑内病灶长径为0.3~2.5 cm。排除标准:(1)既往已经确诊脑转移瘤经过治疗后的患者;(2)脑内病灶<0.3 cm或>2.5 cm:病灶过小难于测量感兴趣区(region of interest, ROI);病灶过大易出血、坏死,信号混杂,导致测量误差偏大。原发肿瘤包括肺癌140例,乳腺癌36例,胃癌5例,肝癌2例,食管癌9例,结肠癌4例,直肠癌1例,胸膜间皮瘤1例,肾癌3例,胰腺癌1例,宫颈癌2例,卵巢癌1例,甲状腺癌1例,扁桃体癌1例,腮腺黏液表皮样癌1例。非脑转移瘤(非转移组)诊断中,缺血灶81例,脱髓鞘病变22例。
二、诊断标准和检查方法
1.脑转移瘤的诊断标准:
(1)患者具有原发恶性肿瘤病史;(2)MRI增强呈多发结节状强化;(3)对患者密切临床随访,根据随访结果综合判断。
2.检查方法:
本研究采用Siemens MAGNETOM Avanto 1.5T和GE Discovery MRI750 3.0T超导型磁共振扫描,头颅正交线圈。常规横断位T1加权像(T1 weighted image, T1WI)、横断位或矢状位T2加权像(T2 weighted image, T2WI)、T2液体衰减反转恢复(fluid attenuated inversion recovery,T2WI/FLAIR)、扩散加权成像(diffusion weighted imaging, DWI)序列扫描及T1WI压脂增强扫描。参数设置如下:T1WI回波时间(echo time, TE)为4.76 ms,重复时间(repetition time, TR)为346 ms,层厚5.0 mm,间隔1.0 mm,矩阵256×192;T2WI TE为9 ms,TR为4410 ms,层厚5.0 mm,间隔1.0 mm,矩阵256×192;T2/FLAIR序列TE为92 ms,TR为5050 ms,反转时间为1813 ms,层厚5.0 mm,间隔1.0 mm,矩阵320×240;DWI TE为105.3 ms,TR为4700 ms,层厚5.0 mm,间隔1.0 mm,矩阵192×192,扩散敏感因子为0和1000 s/mm2,采用本研究中核磁共振机器的扩散图像分析软件获取病变表观扩散系数(apparent diffussion coefficient, ADC)值。平扫结束后行T1WI增强扫描,造影剂为钆喷酸葡胺,使用剂量为0.15 mmol/kg,流速2 ml/s。
3.图像分析及数据处理:
图像由2位工作10年以上、有丰富经验的放射医师进行评估,如有异议则讨论达成一致。当病灶为多发时,选取其中最大者为分析对象,评估内容为T1WI、T2WI、T2/FLAIR、DWI表现和ADC值。结合常规MRI平扫及增强扫描图像,分别在脑转移瘤和非脑转移瘤病灶选定ROI,ROI面积为2~4 mm2,测量ADC值,每个病灶测量3次,取平均值。
三、统计学方法
采用SPSS 20.0软件进行统计学分析。呈正态分布的计量资料比较采用t检验,计数资料采用χ2检验,采用受试者工作特征(receiver operating characteristic, ROC)曲线分析鉴别脑转移瘤(转移组)与非转移组之间的最佳临界值。检验水准α=0.05。


1.MRI增强和平扫对脑转移瘤病灶的检出率:
208例患者中,男108例,女100例;年龄27~82岁,中位年龄57岁。转移组105例共485个病灶,增强MRI扫描共检出485个病灶,病灶检出率为100%;MRI平扫共检出423个病灶,漏诊62个病灶,病灶检出率为87.2%。
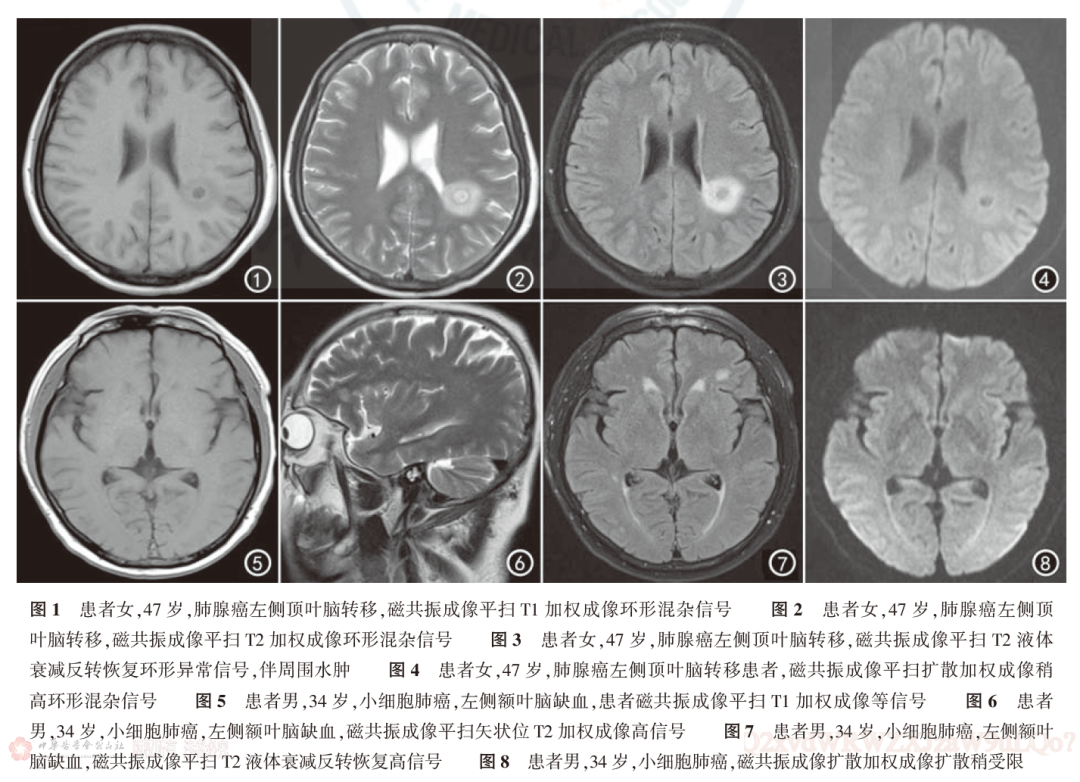
2.转移组和非转移组病灶形态特征:
105例转移组患者中,T1WI平扫信号混杂信号19例,其中环形混杂信号16例(图1);T2WI平扫信号混杂信号23例,其中环形混杂信号19例(图2);T2/FLAIR信号混杂信号36例,其中环形混杂信号33例(图3);病灶周围水肿69例(图3);DWI混杂信号65例,其中环形混杂信号65例(图4)。103例非转移组患者中,T1WI平扫信号等信号51例(图5),T2WI平扫信号高信号92例(图6),T2/FLAIR信号高信号103例(图7),病灶周围均无水肿,DWI等信号99例(图8)。转移组与非转移组患者的MRI病灶边缘差异无统计学意义(P>0.05),病灶形态、T1WI平扫信号、T2WI平扫信号、T2WI/FLAIR信号、病灶周围水肿和DWI特征差异均有统计学意义(均P<0.001,表1)。
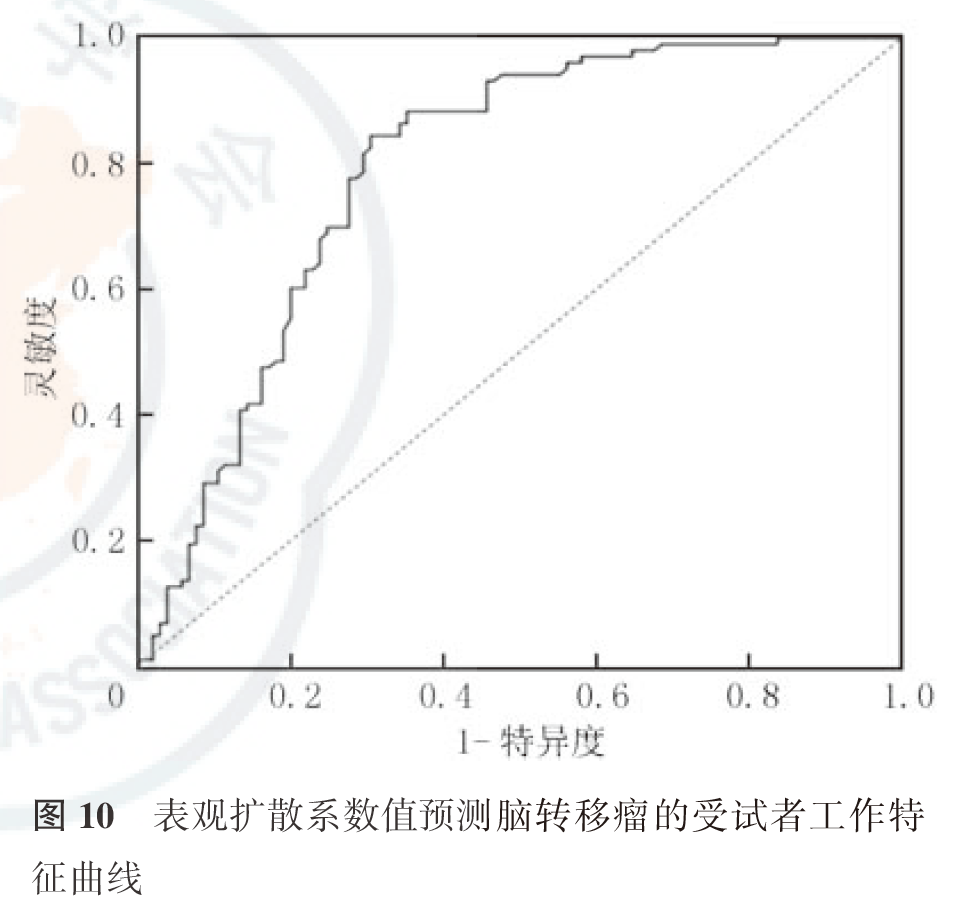
3.ADC值和ROC曲线:
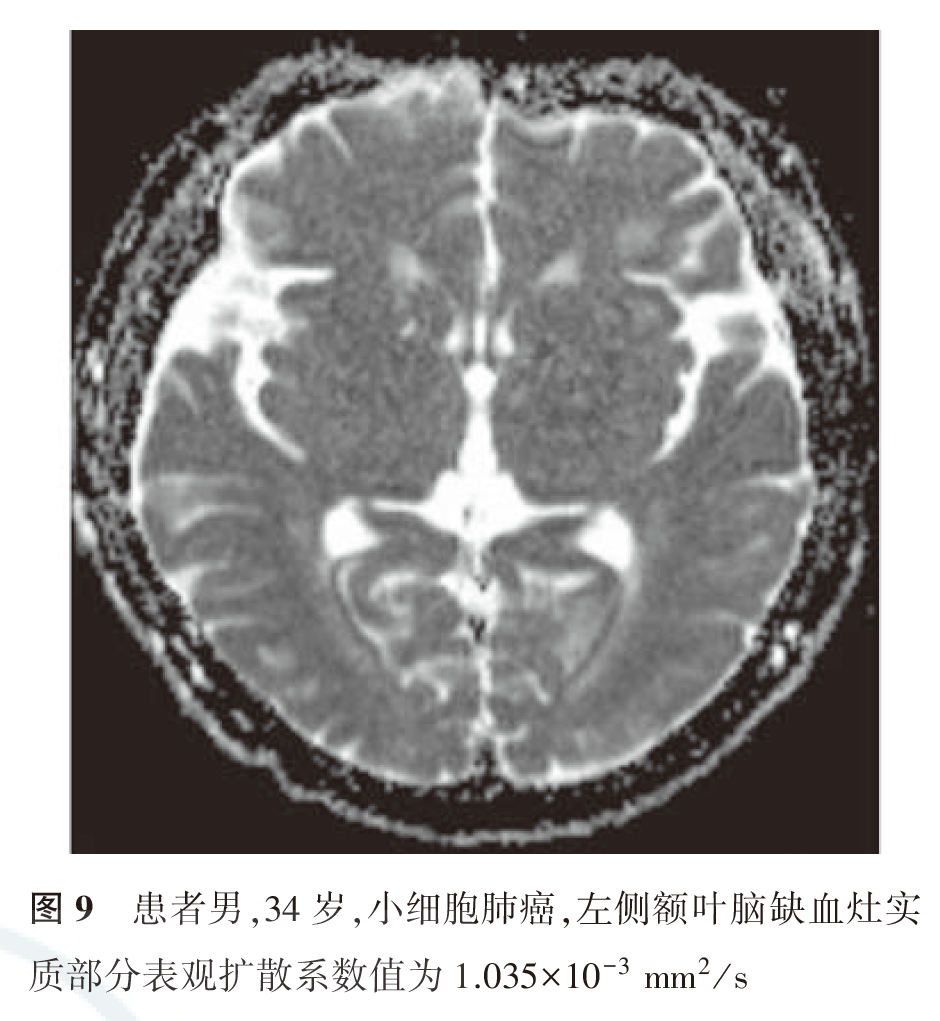
105例转移组患者的ADC值为(0.919±0.019)×10-3 mm2/s,103例非转移组患者的ADC值为(1.098±0.012)×10-3 mm2/s(图9),差异有统计学意义(χ2=-7.88,P<0.05)。ADC值鉴别诊断脑转移瘤和非脑转移瘤的ROC曲线见图10。ADC值为0.837×10-3 mm2/s时,其鉴别脑转移瘤和非脑移瘤的灵敏度为83.7%,特异度为69.2%,ROC曲线下面积为0.786(图10)。


MRI有多序列、多参数、高组织分辨率以及无电离辐射的特点,对脑转移瘤的诊断具有明显优势。MRI新技术、新序列的应用提高了微转移灶的检出率。MRI增强扫描能够明确脑转移瘤的部位、形态、数目、大小及内部结构等,且无骨伪影的干扰,被认为是目前诊断脑转移瘤的最佳成像方法,但MRI平扫的信号特点不明显,临床上易忽视。
本研究中,105例脑转移瘤组患者MRI平扫显示,T1WI呈低信号54例,T2WI呈高信号72例,这主要是由于相比正常脑白质,肿瘤细胞含水量相对多,因此呈现T1WI低信号、T2WI高信号,但T1WI呈混杂信号19例、高信号9例,T2WI呈混杂信号23例,这可能与肿瘤合并坏死、囊变、瘤内出血等因素有关。非转移组中,病变一般无囊变、坏死、出血等情况,信号多较均匀。转移组T1WI和T2WI表现为混杂信号的患者(分别为19例和23例)明显多于非转移组(均为0)。T2WI/FLAIR序列是自由水信号为0的极重T2WI,既有T2WI检出病灶的灵敏度,又有抑制脑脊液和脑灰白质的作用,有效减轻脑脊液在常规T2WI呈高信号所致的部分容积效应和伪影。本研究中,T2WI/FLAIR序列能较好地发现病灶,与相关研究结果一致。T2WI/FLAIR序列具有更高的灵敏度,能清晰显示肿瘤边界以明确肿瘤的大小,提高肿瘤病灶的检出率,鉴别瘤体及水肿区,提高脑转移瘤的确诊率。本研究中,转移组T2/FLAIR高信号60例,混杂信号36例;而非转移组全部呈T2/FLAIR高信号,因此,T2/FLAIR高信号并不能肯定为脑转移瘤,但当病灶表现为混杂信号时,尤其环形混杂信号,必须警惕脑转移瘤的可能。DWI是从细胞微观状态来研究病变,是无创检测体内水分子自由扩散运动的成像方法。水分子的ADC值是由分子的黏度、细胞膜的渗透性、组织的方向、阻碍水分子运动的结构决定的。DWI信号强度及其ADC值与组织的细胞密度有关,在富细胞组织,如生长活跃的肿瘤中,由于细胞密度增加,细胞间隙减少及细胞内结构的改变,导致水分子活动明显受限,造成DWI信号升高,ADC值降低。脑转移瘤血供丰富,肿瘤生长迅速,常由于缺血而出现囊变、坏死,其主要成分为坏死肿瘤组织碎屑及浆液,水分子运动相对自由,同时脑转移瘤在相对较短时间内快速生长,压迫瘤周组织形成环状致密带,即瘤周细胞排列紧密以及毛细血管床较明显受压迫引起局部组织的缺血等,在DWI上环内呈低信号,而环壁为肿瘤组织呈高信号,因此,DWI呈环形高信号。本研究中,脑转移瘤在DWI上病灶实质弥散受限呈高信号,坏死囊变部分无弥散受限表现为低信号;非脑转移瘤在DWI上未见扩散受限呈等信号。有研究显示,脑结核瘤与脑转移瘤ADC值有显著差异,DWI和ADC值有助于鉴别脑结核瘤和脑转移瘤。但也有研究显示,脑结核与脑转移瘤和胶质瘤的ADC值无明显差异。因此,目前对于DWI和ADC值鉴别脑转移瘤与非脑转移瘤的特异性仍有争议。本研究显示,脑转移瘤与非脑转移瘤患者的ADC值有差异。分析ADC值鉴别诊断转移瘤和非转移瘤的ROC曲线,结果显示,ADC值的临界值为0.837×10-3 mm2/s时,其鉴别脑转移瘤和非脑移瘤的灵敏度为83.7%,特异度为69.2%。
脑转移瘤瘤周水肿的典型表现为小病灶、大水肿,水肿呈明显指状分布,这是因为脑灰质细胞结构紧密,脑白质细胞结构相对松弛,同时,瘤周水肿发生与肿瘤破坏血脑屏障和脑组织结构密切相关。有研究显示,瘤体迅速膨胀性生长后,无静脉瓣的大脑引流静脉受压迫,发生引流受阻而产生继发性水肿。有研究显示,瘤周水肿程度与转移灶大小及发生部位有关,而与原发病灶强化形式及肿瘤的组织学类型无关。但也有研究显示,不同原发肿瘤脑转移瘤瘤周水肿程度亦不相同。因此,瘤周水肿的程度与原发肿瘤类型是否有相关性,目前意见尚不统一。本研究结果显示,病灶周围水肿比例在脑转移瘤和非脑转移瘤间差异有统计学意义。但脑转移瘤周围水肿形式多样,缺乏特征性,在本研究中,我们未对肿瘤原发类型与瘤周水肿的关系进行分析总结。
本研究存在不足之处。对于非脑转移瘤病例种类因肿瘤医院专科特点,有关炎症、感染、中毒、代谢性疾病类型比较少,难免存在偏倚;由于ROI采用人工手绘,这在一定程度上导致肿瘤ADC值可能出现测量误差;脑转移瘤的诊断是综合性的,本研究中,我们仅分析了常规MRI序列及DWI提示诊断的价值,后续研究尚需更大数据进一步统计分析。
总之,对于有原发恶性肿瘤病史的患者,脑转移瘤与非转移瘤在MRI平扫T1WI、T2WI、T2WI/FLAIR及DWI系列上信号特征有明显差异,尤其当T1WI、T2WI、T2WI/FLAIR上出现混杂信号、DWI扩散受限和瘤周水肿时,提示脑转移瘤可能,必须进一步增强MRI扫描明确诊断。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate












 苏公网安备 32059002004080号
苏公网安备 32059002004080号


