
朱闻捷, 朱豪华, 刘雨桃, 等. 程序性死亡蛋白1/程序性死亡蛋白配体1抑制剂治疗晚期非小细胞肺癌的疗效及疗效和预后预测标志物的真实世界研究[J]. 中华肿瘤杂志, 2022, 44(5):416-424.
DOI: 10.3760/cma.j.cn112152-20210709-00504.
目的
探讨程序性死亡蛋白1(PD-1)/程序性死亡蛋白配体1(PD-L1)抑制剂治疗晚期非小细胞肺癌(NSCLC)的疗效,并探索疗效和预后预测的标志物。
方法
2016年1月至2019年12月,在中国医学科学院肿瘤医院接受PD-1/PD-L1抑制剂单药治疗或PD-1/PD-L1抑制剂联合其他全身药物治疗的晚期转移性NSCLC患者174例,收集患者的人口学、临床病理及生存资料,评估疗效并进行生存分析,主要终点为无进展生存时间(PFS),次要终点包括客观缓解率(ORR)、疾病控制率(DCR)及总生存时间(OS)。
结果
174例患者接受PD-1/PD-L1抑制剂治疗后ORR为28.7%,DCR为79.3%。23例(13.2%)出现免疫相关不良反应。脑转移、治疗线数、治疗模式与晚期转移性NSCLC患者免疫治疗的客观疗效有关(均P<0.05)。中位随访18.8个月,174例患者的中位PFS为10.5个月,中位OS未达到,2年生存率为63.0%。病理类型与晚期转移性NSCLC患者免疫治疗的PFS有关(P=0.028),性别、年龄、脑转移、自身免疫性疾病与OS有关(均P<0.05)。中性粒细胞与淋巴细胞比值(NLR)预测晚期转移性NSCLC免疫治疗客观疗效的受试者工作特性曲线分析显示,免疫治疗前NLR(NLRC0)、第1周期免疫治疗后NLR(NLRC1)和ΔNLR的曲线下面积分别为0.600、0.706和0.628。多因素logistic回归分析显示,NLRC1为晚期转移性NSCLC免疫治疗客观疗效的独立影响因素(OR=0.161,95%CI为0.062~0.422),与单药免疫治疗相比,联合治疗疗效更优(OR=0.395,95%CI为0.174~0.896),不合并脑转移者免疫治疗疗效较好(OR=0.291,95%CI为0.095~0.887)。多因素Cox回归分析显示,NLRC1为晚期转移性NSCLC免疫治疗后PFS的独立影响因素(HR=0.480,95%CI为0.303~0.759),性别(HR=0.399,95%CI为0.161~0.991,P=0.048)、年龄(HR=0.356,95%CI为0.170~0.745,P=0.006)为晚期转移性NSCLC免疫治疗后OS的独立影响因素。
结论
晚期转移性NSCLC患者接受PD-1/PD-L1抑制剂治疗安全、有效,高龄患者仍可从免疫治疗中获益,合并脑转移者免疫治疗有效率下降。较早应用免疫治疗、免疫联合治疗可提高疗效,且不增加治疗相关不良反应。NLRC1可早期预测晚期转移性NSCLC免疫治疗的疗效和PFS。<75岁的男性患者免疫治疗后可能有望改善OS。
【关键词】癌,非小细胞肺;程序性死亡蛋白1/程序性死亡蛋白配体1抑制剂;中性粒细胞与淋巴细胞比值;疗效;不良反应;预后
程序性死亡蛋白1(programmed death-1, PD-1)是在经抗原刺激的T细胞表面表达的Ⅰ型跨膜蛋白,其配体为程序性死亡蛋白配体1(programmed death-ligand 1, PD-L1),正常细胞、免疫细胞及肿瘤细胞表面均可表达。PD-1与配体PD-L1的结合使T细胞活性下降,从而调节适应性免疫反应,维持免疫稳态。有研究证实,肿瘤细胞可通过过表达PD-L1来逃避机体免疫系统的监视与杀伤。免疫检查点抑制剂(immune checkpoint inhibitor, ICI)是近年来新兴的肿瘤治疗药物,其中PD-1/PD-L1抑制剂通过与PD-1或PD-L1特异性结合阻断PD-1和PD-L1的相互作用,从而上调机体抗肿瘤免疫反应。近年在晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)中开展的多项全球多中心随机对照研究证实,无论是单用还是与其他治疗方法联合使用,ICI均可为患者带来远期生存获益,成为晚期NSCLC治疗领域的突破性进展。尽管PD-1/PD-L1抑制剂可使一部分晚期NSCLC患者实现长期生存,但也有一些患者在用药初期即出现进展甚至超进展,因此有必要找寻可靠的生物标志物来筛选可能从ICI治疗获益的人群。PD-L1表达水平是现阶段预测ICI治疗效果较好的标志物,但在不同研究中其预测价值存在差异。肿瘤突变负荷(tumor mutation burden, TMB)可能是肺癌单药免疫治疗效果的潜在标志物,但其筛选能力尚未得到充分证实。外周血中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)反映了机体免疫系统状态,有研究提示,NLR可能是晚期NSCLC免疫治疗临床结局的预测因子,高NLR患者接受免疫治疗的有效率更低,预后更差。NLR检测方便、快捷、价廉、可动态监测,值得进一步探索其临床应用价值。在本研究中,我们对接受PD-1/PD-L1抑制剂治疗的晚期转移性NSCLC患者开展真实世界回顾性分析,以明确免疫治疗对晚期NSCLC的实际临床疗效,探索PD-1/PD-L1抑制剂的临床疗效和预后预测标志物,并分析NLR对晚期NSCLC免疫治疗临床结局的预测价值。


1.病例选择:
纳入标准:(1)通过临床、影像学、病理学检查确诊为晚期转移性NSCLC;(2)接受PD-1/PD-L1抑制剂单药治疗,或PD-1/PD-L1抑制剂联合其他全身药物治疗(如抗血管生成药物、化疗、靶向治疗);(3)年龄≥18岁。2016年1月至2019年12月中国医学科学院肿瘤医院收治的符合纳入标准的晚期转移性NSCLC患者174例,男129例,女45例,年龄34~85岁,中位年龄为62岁。
2.临床病理信息采集:
通过查阅电子病历收集患者的性别、年龄、民族、基础疾病(高血压、糖尿病、心脑血管疾病、肝病、自身免疫性疾病等)、家族史、个人史、初诊肿瘤病理类型及分期、既往治疗史、免疫治疗前体重指数(body mass index, BMI)、PD-L1表达水平、TMB水平、PD-1/PD-L1抑制剂类型及剂量、治疗线数、治疗模式、最佳疗效、治疗开始及疾病进展时间、免疫相关不良反应(immune-related adverse event, irAE)的发生情况、处理方式及转归等资料。收集患者免疫治疗前基线(免疫治疗前2周内,C0)和第1周期免疫治疗后(免疫治疗后2~3周,C1)血常规检查中性粒细胞和淋巴细胞计数数据,计算NLR和ΔNLR。ΔNLR=NLRC1-NLRC0。
3.疗效评价与不良反应评估:
在基线及每2个治疗周期时,患者进行影像学及血液学检查,根据实体瘤免疫治疗疗效评价标准(immune response evaluation criteria in solid tumors, iRECIST)进行疗效评价,以抗肿瘤治疗的最佳疗效作为客观疗效,分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD)。根据医师建议的频率对患者的irAE发生情况进行评估。
4.随访:
通过电话或邮件对患者定期进行随访,末次随访时间为2021年1月31日,中位随访时间为18.8个月。失访17例,失访率为9.8%。失访病例均记录其末次随访时间,并在后续生存分析中设为截尾值。
5.研究终点:
研究的主要终点为无进展生存时间(progression-free survival, PFS),定义为免疫治疗开始至疾病进展或任何原因所致死亡的时间。次要终点包括客观缓解率(objective response rate, ORR)、疾病控制率(disease control rate, DCR)及总生存时间(overall survival, OS),OS定义为免疫治疗开始至任何原因所致死亡的时间。
6.统计学方法:
应用SPSS 19.0软件进行统计分析。计数资料的组间比较采用χ2检验或Fisher精确检验。以客观疗效为因变量,将客观疗效分为治疗有效(CR+PR+SD)和治疗无效(PD)两个水平,采用单因素或多因素logistic回归模型评估临床病理因素与免疫治疗客观疗效的关系。生存分析采用Kaplan-Meier方法,组间生存率比较采用Log rank检验,采用多因素Cox比例风险模型回归分析明确晚期NSCLC免疫治疗的预后预测因素。采用受试者工作特征(receiver operator characteristic, ROC)曲线分析计算曲线下面积(area under the curve, AUC),以评估NLRC1、NLRC0和ΔNLR预测免疫治疗客观疗效的能力,通过最大约登指数确定最佳界值。显著性检验均为双侧检验,检验水准α=0.05。


一、晚期转移性NSCLC患者的基线情况
174例患者中,BMI<18.5 kg/m2 10例,18.6~23.9 kg/m2 83例,≥24.0 kg/m2 81例;伴有高血压47例,糖尿病31例,肝病10例,自身免疫性疾病3例;有吸烟史104例,有家族史44例。病理类型为鳞癌72例,腺癌91例,其他或不详11例。美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体能状态评分为0分82例,1分81例,2分11例。19例有脑转移。44.3%(77/174)的患者在转移性疾病阶段接受至少3线治疗。
二、免疫治疗情况
1.免疫治疗药物:
帕博利珠单抗、信迪利单抗和纳武利尤单抗为使用最多的药物。81例患者使用帕博利珠单抗,200 mg或2 mg/kg静脉滴注,每3周1次。30例患者使用信迪利单抗,200 mg静脉滴注,每3周1次。24例患者使用纳武利尤单抗,240 mg或3 mg/kg静脉滴注,每2周1次。此外,使用卡瑞利珠单抗18例,特瑞普利单抗15例,替雷利珠单抗6例。
2.治疗线数与治疗模式:
54例患者一线即行免疫治疗,64例患者二线开始免疫治疗,56例患者在三线及以后才开始免疫治疗。5例患者在免疫治疗进展后,穿插使用其他治疗手段,然后再次使用免疫治疗。73例患者接受单药免疫治疗,76例患者行免疫治疗联合化疗,6例患者行免疫治疗联合抗血管生成治疗,19例患者行免疫治疗联合化疗和抗血管生成治疗。
三、免疫治疗的客观疗效与不良反应
免疫治疗后,174例患者中,CR 1例,PR 49例,SD 88例,PD 36例。ORR为28.7%,DCR为79.3%。23例(13.2%)出现irAE,其中19例为免疫性肺炎,2例为免疫相关性甲状腺功能减退,1例为免疫相关性肾上腺皮质功能减退,1例为反应性皮肤毛细血管增生症。6例为3级及以上irAE。7例出现irAE后终止免疫治疗,11例接受激素治疗。23例患者的irAE经过对症支持治疗后均缓解。
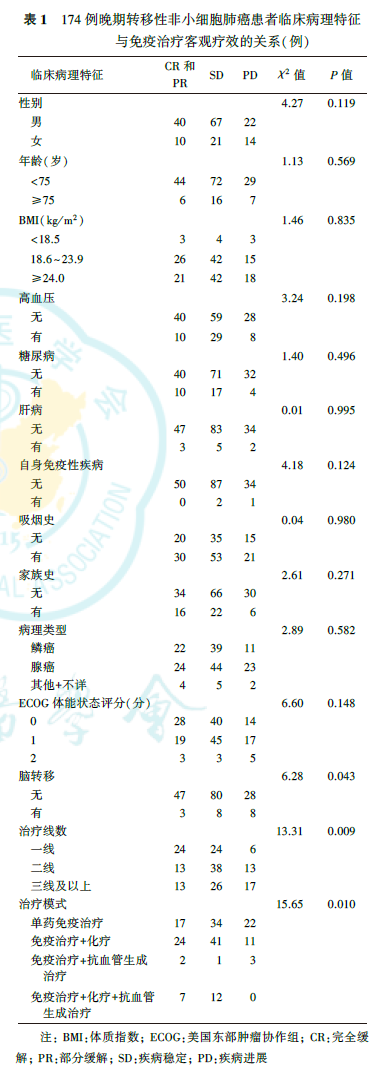
四、临床病理特征与免疫治疗客观疗效的关系
由表1可见,脑转移、治疗线数、治疗模式与晚期转移性NSCLC患者免疫治疗的客观疗效有关(均P<0.05)。免疫治疗前不合并脑转移者ORR为30.3%(47/155),DCR为81.9%(127/155),优于合并脑转移者[ORR为15.8%(3/19),DCR为57.9%(11/19);P=0.043]。一线接受免疫治疗者ORR为44.4%(24/54),DCR为88.8%(48/54),优于二线接受免疫治疗者[ORR为20.3%(13/64),DCR为79.7%(51/64)]、三线及以上接受免疫治疗者[ORR为23.3%(13/56),DCR为69.6%(39/56);P=0.009]。单药免疫治疗者ORR为23.3%(17/73),DCR为69.9%(51/73);免疫治疗联合化疗者ORR为31.6%(24/76),DCR为85.5%(65/76);免疫治疗联合抗血管生成治疗者ORR为33.3%(2/6),DCR为50.0%(3/6);免疫治疗联合化疗加抗血管生成治疗者ORR为36.8%(7/19),DCR为100.0%(19/19),不同治疗模式患者间差异有统计学意义(P=0.010)。而单药免疫治疗、免疫治疗联合化疗、免疫治疗联合抗血管生成治疗、免疫治疗联合化疗加抗血管生成治疗患者的irAE发生率分别为11.0%(8/73)、16.7%(1/6)、14.5%(11/76)、15.8%(3/19),差异无统计学意义(χ2=0.60,P=0.896)。
五、临床病理特征与免疫治疗预后的关系
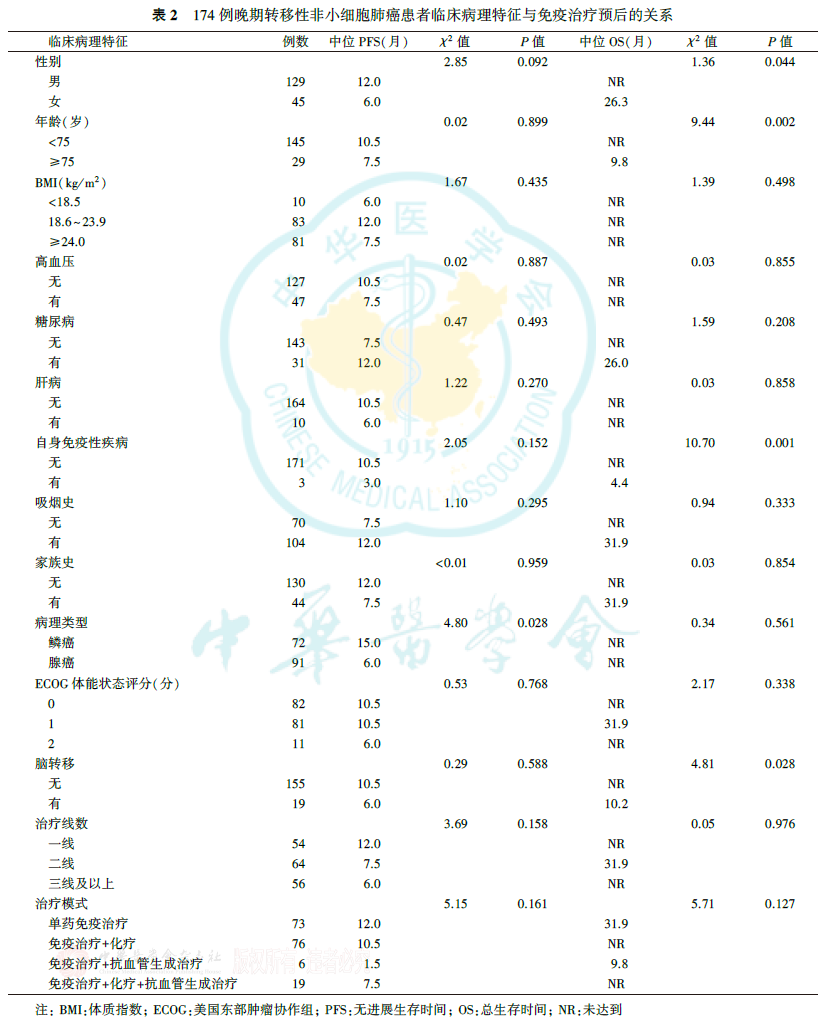
中位随访18.8个月,174例患者中有98例最终出现疾病进展事件,55例死亡,中位PFS为10.5个月,中位OS未达到,2年生存率为63.0%。
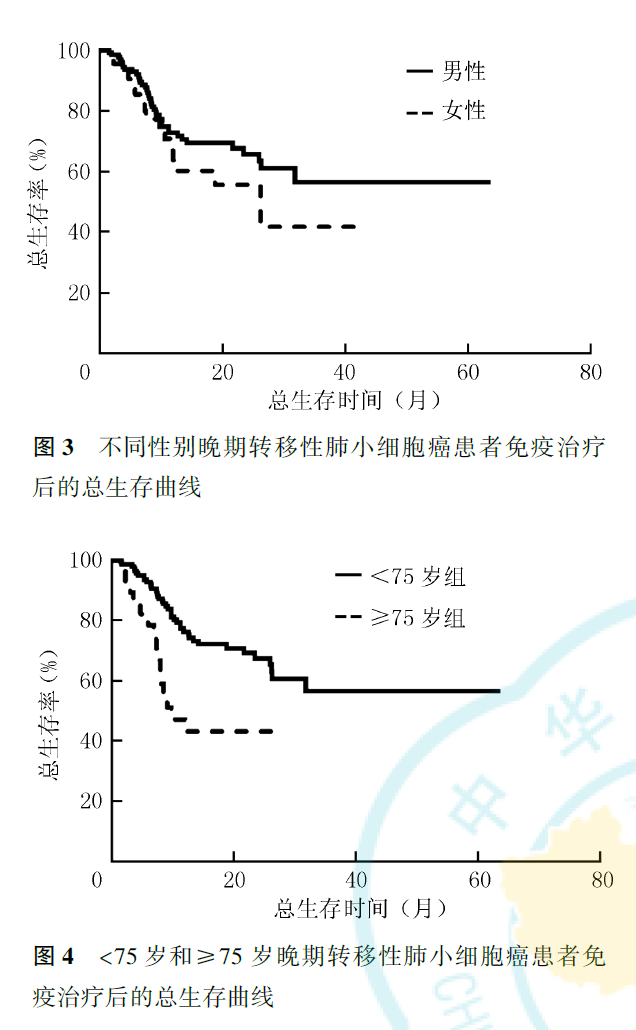
由表2可见,病理类型与晚期转移性NSCLC患者的PFS有关,鳞癌患者的PFS优于腺癌患者(P=0.028),但鳞癌患者和腺癌患者的OS差异无统计学意义(P=0.561)。性别、年龄、脑转移、自身免疫性疾病与晚期转移性NSCLC患者的OS有关(均P<0.05)。
六、免疫治疗疗效和预后的预测标志物
由于本组174例患者中有154例患者未行PD-L1表达或TMB水平检测,因此未能分析PD-L1和TMB对晚期转移性NSCLC免疫治疗疗效和预后的预测价值。
1.NLR与免疫治疗客观疗效的关系:
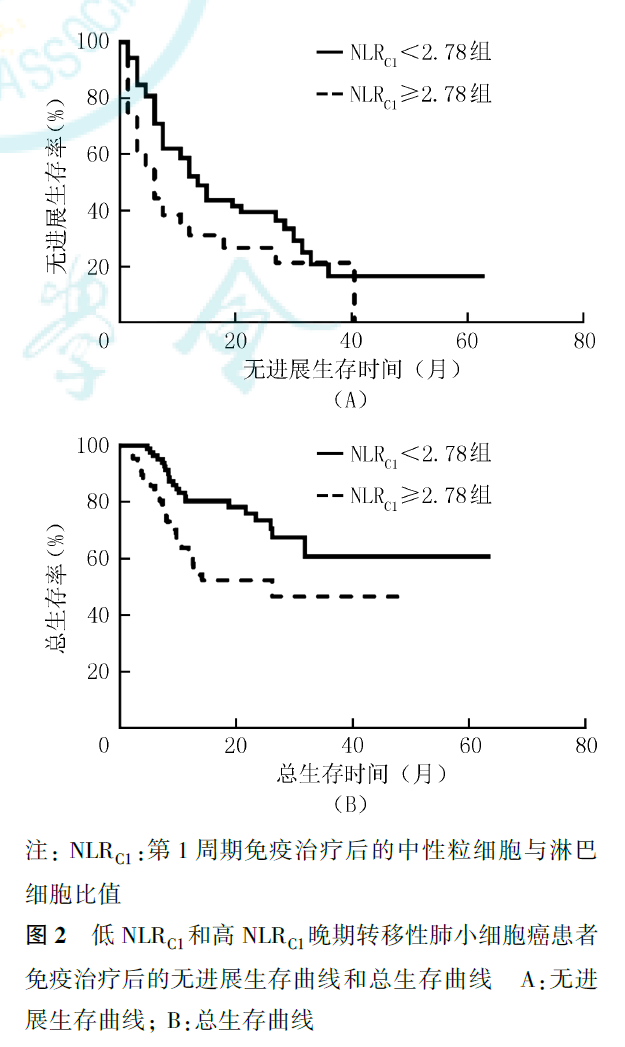
ROC曲线分析显示,NLRC0、NLRC1和ΔNLR预测晚期转移性NSCLC免疫治疗客观疗效的AUC分别为0.600、0.706和0.628,提示NLRC1的预测能力最优,其最佳界值为2.78(图1)。将连续变量NLRC1转换为分类变量,并纳入多因素logistic回归分析,结果显示,校正性别、年龄、病理类型、吸烟史、基础疾病、BMI、脑转移、治疗线数、治疗模式等因素后,NLRC1为晚期转移性NSCLC免疫治疗客观疗效的独立影响因素(OR=0.161,95%CI为0.062~0.422,P<0.001),低NLRC1(<2.78)提示免疫治疗客观疗效更好。此外,与单药免疫治疗相比,联合治疗疗效更优(OR=0.395,95%CI为0.174~0.896,P=0.026),不合并脑转移者免疫治疗疗效较好(OR=0.291,95%CI为0.095~0.887,P=0.030)。
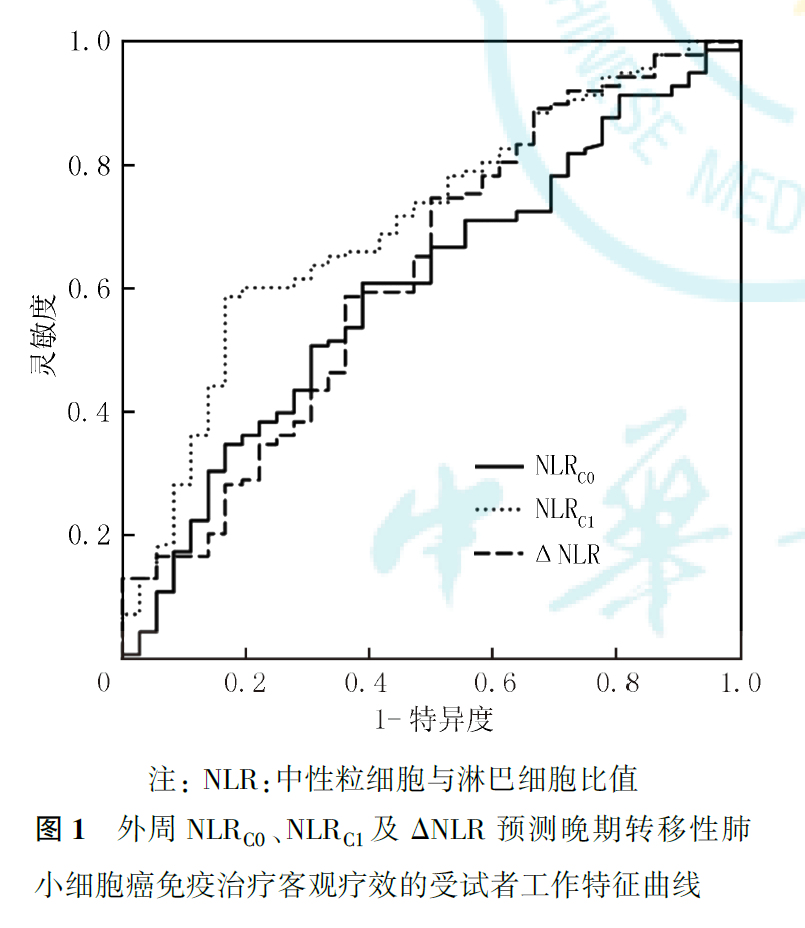
按照治疗模式进行分层分析显示,在单药免疫治疗亚组患者中,NLRC0、NLRC1和ΔNLR预测晚期转移性NSCLC免疫治疗客观疗效的AUC分别为0.562、0.748和0.724,提示NLRC1疗效预测能力最佳。多因素logistic回归分析显示,NLRC1为晚期转移性NSCLC单药免疫治疗客观疗效的独立预测因素(OR=0.090,95%CI为0.019~0.431,P=0.003),NLRC1(<2.78)较低的患者免疫治疗疗效更好。在免疫治疗联合化疗亚组中,NLRC0、NLRC1和ΔNLR预测晚期转移性NSCLC免疫治疗客观疗效的AUC分别为0.569、0.629和0.541,多因素logistic回归分析未见NLRC0、NLRC1和ΔNLR对疗效有预测价值(NLRC0:OR=0.250,95%CI为0.061~1.031,P=0.055;NLRC1:OR=0.292,95%CI为0.077~1.107,P=0.070;ΔNLR:OR=0.614,95%CI为0.168~2.238,P=0.460)。因免疫治疗联合抗血管生成治疗亚组和免疫治疗联合化疗加抗血管生成治疗亚组例数过少,故未行亚组分析。
2.NLR与免疫治疗后患者预后的关系:
多因素Cox回归分析显示,NLRC1为晚期转移性NSCLC免疫治疗后PFS的独立影响因素(HR=0.480,95%CI为0.303~0.759,P=0.002;图2),NLRC1较低(<2.78)的患者免疫治疗后疾病进展风险更小。但NLRC1并非晚期转移性NSCLC免疫治疗后OS的独立影响因素(P=0.127,图2)。性别(HR=0.399,95%CI为0.161~0.991,P=0.048)、年龄(HR=0.356,95%CI为0.170~0.745,P=0.006)为晚期转移性NSCLC免疫治疗后OS的独立影响因素,<75岁的男性患者能获得更长的OS(图3、图4)。
按照治疗模式进行分层分析显示,在单药免疫治疗亚组患者中,NLRC1为晚期转移性NSCLC免疫治疗后PFS(HR=0.386,95%CI为0.196~0.761,P=0.006)和OS(HR=0.417,95%CI为0.194~0.900,P=0.026)的独立影响因素。在免疫治疗联合化疗亚组患者中,治疗线数(HR=0.516,95%CI为0.274~0.971,P=0.040)和性别(HR=0.386,95%CI为0.180~0.826,P=0.014)为晚期转移性NSCLC免疫治疗后PFS的独立影响因素,性别(HR=0.266,95%CI为0.101~0.700,P=0.007)和年龄(HR=0.212,95%CI为0.067~0.678,P=0.009)为晚期转移性NSCLC免疫治疗后OS的独立影响因素,但未见NLR有预后预测价值(PFS:HR=0.615,95%CI为0.329~1.149,P=0.127;OS:HR=0.522,95%CI为0.216~1.262,P=0.149)。


近年来,PD-1/PD-L1抑制剂在多种恶性肿瘤的治疗中取得了令人瞩目的效果,其应用也从晚期转移性肿瘤逐渐向围手术期推广。在晚期NSCLC的治疗中,随着一系列全球多中心随机对照试验(randomized controlled trial, RCT)结果的问世,PD-1/PD-L1抑制剂突破了化学治疗时代的瓶颈,实现了患者5年生存率的提高,成为晚期NSCLC治疗的里程碑。然而,由于临床研究对入组患者的条件限制,往往使研究人群不能完全代表临床上的实际患者群体,因此有必要开展真实世界研究,以明确免疫治疗在实际临床应用、尤其是一些未被临床试验覆盖的特殊人群中的疗效和安全性,从而为制定临床决策提供现实依据。
本研究纳入了174例接受单药免疫治疗或免疫治疗联合其他药物治疗的转移性NSCLC患者,包括高龄、多线治疗后、脑转移患者,结果显示,ORR为28.7%,DCR为79.3%,中位PFS为10.5个月,中位OS未达到,2年OS率为63.0%,明显优于以往发表的临床试验数据,甚至优于晚期肺癌一线免疫联合治疗的生存数据(中位PFS为6.4~9.0个月,中位OS为14.0~22.0个月)。既往的真实世界研究显示,晚期肺癌患者单药免疫治疗的中位PFS为1.8~8.3个月,中位OS为7.9~24.3个月。一项147例晚期肺癌患者的回顾性研究显示,免疫治疗联合化疗的中位PFS为15.5个月,2年OS率为81.0%。本研究结果优于以往RCT数据的原因主要有两个方面:第一,男性、吸烟者、鳞癌患者在本研究中所占的比例较高,分别占74.1%、59.8%和41.4%,而这些因素均与免疫治疗预后有关;第二,本研究中的患者大多NLRC1较低。
真实世界研究的另一个重要目的是探讨临床试验中占比较少的特殊人群的治疗情况。本研究显示,≥75岁的高龄患者接受免疫治疗的近期疗效和irAE发生率与非高龄患者相近。KEYNOTE-010、KEYNOTE-024和KEYNOTE-042研究显示,对于≥75岁的NSCLC患者,与化疗相比,帕博利珠单抗可改善PD-L1阳性患者的OS,且不良反应发生率明显下降,3级及以上irAE发生率为9.4%,获益程度与整体人群一致。本研究及既往研究结果提示,与非高龄患者相比,高龄患者接受免疫治疗同样安全、有效。晚期NSCLC中另一部分需要特别关注的是脑转移患者。一项纳入255例合并脑转移NSCLC患者(39.2%为活动性脑转移,14.3%为无症状脑转移)的回顾性研究显示,合并脑转移患者免疫治疗的有效率比不合并脑转移患者略下降(分别为20.6%和22.7%),PFS和OS缩短,但多因素分析显示脑转移不是患者预后的独立影响因素。本研究显示,与无脑转移患者相比,合并脑转移的晚期肺癌免疫治疗有效率降低,但是否合并脑转移并非晚期肺癌免疫治疗的独立预后因素。关于NSCLC脑转移免疫治疗的疗效,既往临床研究的结论并不一致,因此对于合并脑转移患者的免疫治疗效果以及局部放疗最佳介入时机均需开展前瞻性研究进一步探讨。
我们分别从开始免疫治疗时的线数以及免疫治疗模式两方面就免疫治疗相关因素对疗效的影响进行了分析。结果显示,一线即接受免疫治疗的患者有效率更高,PFS也有延长趋势,提示晚期转移性NSCLC越早开始免疫治疗,效果越好,但开始免疫治疗时的线数对于OS无明显影响,这与全身治疗的一般临床规律一致。在治疗模式方面,治疗模式是免疫治疗近期疗效的独立预测因素,但不是患者预后的独立影响因素;联合治疗较单药免疫治疗有效率更高,其中免疫治疗联合化疗加抗血管生成治疗这种强强联合模式疗效最好,这与IMpower150研究结果一致。其实关于免疫治疗联合化疗与单药免疫治疗孰优孰劣,一直缺乏前瞻性头对头比较的RCT证据。在2020年美国临床肿瘤学会年会上,Pathak等报道了一项纳入10项RCT研究的荟萃分析(n=7218)结果,对于PD-L1低表达、高表达或者阴性NSCLC患者,免疫治疗联合化疗的ORR均优于单药免疫治疗,但是两种治疗模式的预后无明显差异。国内一项针对NSCLC患者的回顾性研究(n=325)则显示,无论PD-L1表达情况和治疗线数如何,免疫治疗联合化疗的ORR、DCR、远期生存均优于单药治疗,且并不增加irAE发生风险。综合来看,晚期NSCLC免疫治疗联合化疗较单药免疫治疗似乎更有优势,但是在PD-L1≥50%患者的一线治疗中,免疫联合治疗是否一定优于单药免疫治疗,仍需开展前瞻性研究进一步验证。
自从进入免疫治疗时代,寻找可靠的疗效预测生物标志物一直是该领域的热点。目前,已有很多关于PD-L1表达和TMB对免疫治疗疗效预测价值的相关临床研究。虽然PD-L1应用最广泛,但是我们也能看到ICI治疗PD-L1阴性患者有一定的有效率这一现象,可见PD-L1表达是一个相对而不是绝对的疗效预测指标。另外,PD-L1表达的时空异质性较强,受各种治疗手段影响其波动较大,不适合进行动态监测,因此其实际临床应用受到限制。TMB目前面临的问题则是检测平台的多样性和划分标准的不一致,使得不同研究的数据结果无法进行直接比较,因此尚难以就TMB对免疫治疗疗效的预测价值达成共识。与PD-L1和TMB不同,NLR则反映了机体的系统免疫状态。一项纳武利尤单抗治疗175例晚期NSCLC患者的研究显示,基线NLR≥5的患者预后较差,且基线NLR为PFS和OS的独立影响因素。国内另一项回顾性研究显示,基线NLR、乳酸脱氢酶及预后营养指数均可预测NSCLC免疫治疗的临床结局。另有研究发现,免疫治疗后6周NLR升高>20%的NSCLC患者,至进展时间及OS显著缩短。NLR升高本质上反映了机体炎症反应亢进、抗肿瘤细胞免疫反应受抑。在本研究中,我们进一步按照不同治疗模式进行了分层分析,单药免疫治疗亚组结果与整体人群一致,NLRC1对晚期NSCLC单药免疫治疗后的疗效和PFS有预测价值,但免疫治疗联合化疗亚组未显示NLR有疗效和预后预测价值。这与PD-L1表达对免疫治疗疗效预测的特点是一致的,也提示NLR作为免疫治疗疗效预测标志物需在特定治疗情景下进行应用。
值得注意的是,既往有少量研究探索了肺癌免疫治疗不同节点NLR的动态变化。Nakaya等报道,纳武利尤单抗治疗1个周期后,NLR升高的NSCLC患者PFS和OS明显缩短,而基线NLR与NSCLC患者的预后无关。另一项小样本研究(n=19)显示,免疫治疗1个周期后NLR升高>30%的NSCLC患者至治疗失败时间显著缩短。上述证据提示,免疫治疗早期的NLR变化可能是疾病进展的潜在预测标志物。在本研究中,我们希望明确免疫治疗早期(早于首次临床疗效评估)NLR对晚期NSCLC免疫治疗疗效的预测能力,因此选取了基线和1个周期治疗后这两个时间节点的NLR,结果显示,NLRC1较NLRC0和ΔNLR的预测效能更好,也是晚期NSCLC免疫治疗后PFS的独立影响因素。但由于本研究为回顾性研究,样本量有限,且PD-L1和TMB数据不完整,无法对NLR的预测价值进行横向对比,需要在前瞻性研究中进一步对该指标在晚期NSCLC免疫治疗疗效预测中的价值进行评估。
总之,晚期转移性NSCLC患者接受PD-1/PD-L1抑制剂治疗有效、安全,高龄患者仍可从免疫治疗中获益,合并脑转移者免疫治疗有效率下降。较早应用免疫治疗、免疫联合治疗可提高疗效,且不增加治疗相关毒性。NLRC1可早期预测晚期转移性NSCLC患者免疫治疗的疗效,是PFS的独立影响因素。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate












 苏公网安备 32059002004080号
苏公网安备 32059002004080号


