
翻译:方雨露a;审校:史钟b
a中国科学院大学附属肿瘤医院-温州医科大学联合培养硕士研究生;b中国科学院大学附属肿瘤医院结直肠内科
引用此文:Luis A Diaz Jr, et al. Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study. Lancet Oncol
. 2022 May;23(5):659-670. doi: 10.1016/S1470-2045(22)00197-8.
摘要
背景
在新诊断的微卫星高度不稳定或错配修复缺陷的转移性结直肠癌患者中,与化疗相比,帕博利珠单抗已显示出无进展生存期的改善。然而,在这些患者中,治疗对总生存期的影响尚不清楚。在这里,我们报告了Keynote-177研究的最终总体生存分析的结果。
方法
这项随机、开放标签的3期研究在23个国家的193个学术医疗中心和医院进行。我们招募了年龄18岁以上,东部合作肿瘤组体力状况(ECOG评分)为0或1,且既往未经治疗的微卫星高度不稳定或错配修复缺陷的转移性结直肠癌患者。使用交互式语音响应系统或集成网络响应系统将患者以4人为1个区组随机分配(1:1)至每3周静脉注射帕博利珠单抗 200 mg,或研究者选择的化疗方案:静脉注射 mFOLFOX6(奥沙利铂 85 mg/m2,d1;亚叶酸钙400 mg/m2 d1;氟尿嘧啶 400 mg/m2第1天推注,然后每天1200 mg/m2连续输注2天,d1-2)或静脉注射FOLFIRI(伊立替康 180 mg/m2,d1;亚叶酸钙400 mg/m2,d1;氟尿嘧啶 400 mg/m2在第1天推注,然后每天1200 mg/m2连续输注2天,d1-2),每2周一次,联合或不联合每2周1次静脉注射贝伐单抗5 mg/kg,或每周静脉注射西妥昔单抗(首剂400 mg/m2,然后每次250 mg/m2)。接受化疗的患者在疾病进展后,可以交叉到帕博利珠单抗组治疗至最多35个周期。共同主要终点是意向治疗(ITT)人群中的总生存期和无进展生存期。KEYNOTE-177在ClinicalTrials.gov注册,NCT02563002,且不再招募患者。
结果
在2016年2月11日至2018年2月19日期间,共筛选了852名患者,其中307名(36%)被随机分配接受帕博利珠单抗(n = 153)或化疗(n = 154)。93 名(60%)患者从化疗交叉到抗PD-1或抗PD-L1 治疗(56名患者接受研究中的帕博利珠单抗,37名患者接受研究外治疗)。在最终分析中(中位随访 44.5个月,IQR:39.7-49.8),帕博利珠单抗组未达到中位OS( NR;95% CI:49.2-NR)vs 化疗组中位OS 36.7个月(27.6–NR)( 风险比HR = 0.74;95% CI:0.53-1.03;p = 0.036)。由于未达到统计显著性所需的预设值α= 0.025,因此未能证明帕博利珠单抗对比化疗在OS方面的优势。在这次更新的分析中,帕博利珠单抗组中位PFS为 16.5个月(95% CI:5.4-38.1),而化疗组为8.2个月(6.1-10.2)( HR = 0.59, 95% CI:0.45-0.79)。帕博利珠单抗组153名患者中有33名(22%)发生3级以上的治疗相关不良事件,而化疗组143名患者中有95名(66%)发生。帕博利珠单抗相关的3级以上常见不良事件包括丙氨酸氨基转移酶升高、结肠炎、腹泻和疲劳,各有3名(2%)患者出现。化疗相关的有中性粒细胞计数减少(24 名[17%]患者)、中性粒细胞缺乏(22[15%])、腹泻(14[10%])和疲劳(13[9%])。帕博利珠单抗组25例(16%)患者和化疗组41例(29%)患者发生了研究治疗导致的严重不良事件。没有发生帕博利珠单抗相关的死亡;1例肠穿孔死亡归因于化疗。
结论
在这项更新的分析中,尽管与化疗相比,帕博利珠单抗继续显示出持久的抗肿瘤活性和更少的治疗相关不良事件,但两个治疗组之间的OS没有显著差异。这些发现支持帕博利珠单抗作为微卫星高度不稳定性或错配修复缺陷转移性结直肠癌患者的有效一线治疗。
引言
所有转移性结直肠癌中大约有4%-5%存在错配修复缺陷。错配修复缺陷的肿瘤不能修复某些类别的突变,导致肿瘤具有高突变负荷和微卫星不稳定性。
在微卫星高度不稳定性或错配修复缺陷的转移性结直肠癌患者中,用帕博利珠单抗或纳武利尤单抗阻断PD-1为化疗耐药的转移性结直肠癌提供了一种有效的治疗选择。使用抗PD-1治疗药物帕博利珠单抗或纳武利尤单抗为先前接受过治疗的微卫星高度不稳定性或错配修复缺陷的转移性结直肠癌患者带来了持久的抗肿瘤活性,因此美国食品和药物管理局(FDA)于2017年批准这些疗法用于这类患者。在之前未经治疗的微卫星高度不稳定或错配修复缺陷的转移性结直肠癌患者中,帕博利珠单抗对比标准化疗的KEYNOTE-177这项随机、3期研究的初步数据显示,作为一线治疗,帕博利珠单抗改善了无进展生存期,并改善了与健康相关的生活质量(QOL)。这些数据支持FDA(2020年6月)和欧洲药品管理局(EMA;2021年1月)批准帕博利珠单抗用于微卫星高度不稳定或错配修复缺陷转移性结直肠癌患者的一线治疗。目前的指南建议对被诊断为转移性结直肠癌的患者进行微卫星稳定性或错配修复缺陷状态的检测。基于免疫治疗的方案尚未显示出对pMMR或微卫星稳定的转移性结直肠癌患者临床疗效的确凿证据。
据我们所知,KEYNOTE-177研究是第一项显示PD-1阻断剂在一线治疗微卫星高度不稳定或错配修复缺陷转移性结直肠癌患者中的临床获益的随机研究。在KEYNOTE-177的结果公布之前,化疗联用或不联用靶向治疗是新诊断的转移性结直肠癌患者的标准治疗方案,无论分子基因分型。这种标准方法是以氟尿嘧啶为基础的化疗方案,如FOLFOX(氟尿嘧啶、奥沙利铂和亚叶酸钙),FOLFIRI(氟尿嘧啶、伊立替康和亚叶酸钙)联用或不联用抗EGFR或抗VEGF治疗,以及FOLFOXIRI(氟尿嘧啶、奥沙利铂和伊立替康)联用或不联用抗VEGF治疗。
在此,我们报道了3期KEYNOTE-177研究最终分析中观察到的总生存数据,这是一项一线帕博利珠单抗对比化疗(联用或不联用抗EGFR或抗VEGF治疗)治疗微卫星高度不稳定或错配修复缺陷的转移性结直肠癌的研究。
方法
研究设计和参与者
KEYNOTE-177是一项国际的、随机、开放标签、3期研究:帕博利珠单抗对比化疗治疗之前未经治疗的微卫星高度不稳定或错配修复缺陷的转移性结直肠癌患者。这项研究在23个国家的193个学术医疗中心和医院进行(附录pp 2-6)。符合条件的患者年龄至少18岁,当地确诊为微卫星高度不稳定性或错配修复缺陷的IV期结直肠癌,当地研究人员或放射学评估具有符合RECIST(版本1.1)标准的可测量病灶,ECOG评分为0或1,以及器官功能正常。患者必须具备正常的血液学功能(中性粒细胞绝对数≥1500/μL,血小板计数≥100000/μL,血红蛋白≥9 g/dL或≥5.6mmol/L)、肾功能(肌酐浓度≤1.5×正常上限[ULN]或如果肌酐浓度>1.5×ULN的情况下肌酐清除率≥60 m L/min)和肝功能(定义为总胆红素浓度≤1.5×ULN或总胆红素浓度>1.5×ULN的情况下直接胆红素浓度≤ULN,;血清丙氨酸和天冬氨酸氨基转移酶浓度≤2.5×ULN,若为肝转移瘤患者,则≤5.0×ULN,白蛋白浓度≥2.5g/dL)。以下患者不符合条件:IV期结直肠癌既往接受过系统治疗(尽管允许患者在随机前至少6个月前接受过针对结直肠癌的辅助治疗)、过去2年内患有需要系统治疗的活动性自身免疫性疾病、随机前至少7天确诊免疫缺陷病或接受系统类固醇治疗或其他免疫抑制治疗。议定书和所有修正案均由每个参与机构的适当机构审查委员会或道德委员会批准。所有患者都签署了书面的知情同意。
随机化和盲法
治疗分组和随机是集中进行的,使用交互式语音响应系统或集成网络响应系统(Almac临床技术公司,宾夕法尼亚州苏德顿,美国)以4人为一个区组将所有患者随机分配(1:1)。没有分层。研究药物的随机分配时间表由研究赞助商生成,并在交互式语音应答系统中实施。患者、调查人员和现场工作人员在研究治疗中没有设盲。
流程
患者接受帕博利珠单抗200 mg每3周静脉注射或研究者选择的化疗方案(至少在随机前3天选择),每2周静脉注射mFOLFOX6(奥沙利铂85 mg/m2,第1天;亚叶酸钙400 mg/m2,第1天;氟尿嘧啶400 mg/m2,第1天;第1~2天,1200 mg/m2,连用2d);或静脉注射FOLFIRI(伊立替康180 mg/m2,第1天;亚叶酸钙400 mg/m2,第1天;氟尿嘧啶400 mg/m2,第1天,连续输注2天,第1-2天),每2周,联用或不联用贝伐单抗2周1次(第1天5 mg/kg)或西妥昔单抗(第1周400 mg/m2,此后每周250 mg/m2),如之前报道的使用方法。所有化疗药物、贝伐单抗和西妥昔单抗的剂量调整仅允许在毒性反应的基础上进行,并且必须遵循当地的指南。可以停用奥沙利铂以预防神经病变,必须在使用亚叶酸钙和氟尿嘧啶12个周期后恢复。如方案所描述,帕博利珠单抗可以中断或停药以处理不良事件,但不允许减量。
治疗应持续到出现疾病进展、不可接受的毒性反应、疾病或医生或患者决定退出,或完成最多35个周期的帕博利珠单抗治疗后(一个周期定义为3周的治疗)。标准化疗用药的周期不受限制。随机分配到化疗组的患者在经过盲态的独立中心审查确认疾病进展后,可以交叉接受最多35个周期的帕博利珠单抗治疗。错配修复或微卫星不稳定状态由当地评估,通过MLH1、MSH2、MSH6或PMS2错配修复蛋白的免疫组织化学分析或基于三到五个肿瘤微卫星位点的聚合酶链式反应分析。当通过聚合酶链式反应检测到被分析的肿瘤中至少有两个等位基因移码突变时,或者在免疫组织化学检测到的四个错配修复蛋白中至少有一个缺失的情况下,肿瘤被归类为微卫星高度不稳定。通过胸部、腹部、盆腔CT来获得肿瘤成像。MRI可用于颅脑成像,或者用于有CT禁忌症的患者。根据RECIST(1.1版),在第9周和此后每9周,由盲态的独立中心审查评估肿瘤反应。在随访期间,每9周评估一次生存情况。在整个研究过程中和停止治疗后30天(严重不良事件以及和帕博利珠单抗相关的事件为90天)评估不良事件,并根据国家癌症研究所不良事件通用术语标准(4.0版)进行分级。实验室分析,包括凝血酶原时间和活化的部分凝血活酶凝血时间,在筛查期间(在第一次研究治疗前10天内)进行。妊娠试验(如果适用,通过血清β-人绒毛膜促性腺激素),血液学分析(红细胞压积,血红蛋白浓度,血小板计数,白细胞计数,中性粒细胞和淋巴细胞绝对计数)和化学分析(白蛋白,碱性磷酸酶,乳酸脱氢酶,丙氨酸和天冬氨酸氨基转移酶,碳酸氢钠或二氧化碳,钙,氯化物,肌酐,葡萄糖,钾,钠,总胆红素,氮,以及尿素氮或尿素浓度)每2周进行一次,在相应的研究治疗前72小时内进行。每4周进行一次尿液分析(比重、尿蛋白、糖尿和血尿,以及镜检)和其他实验室检查(促甲状腺激素、总或游离三碘甲腺原氨酸和游离甲状腺激素浓度),在相应的研究治疗前72小时内进行。第1周及之后每8周检测一次血清肿瘤标志物。在停止研究治疗时和30天的随访时重复这些分析。其他研究和治疗细节见研究方案(附录)。
结局
在意向治疗(ITT)人群中,两个主要终点是中心审查的RECIST(1.1版)无进展生存期(定义为从随机化到第一次疾病进展或因任何原因死亡的时间)和总生存期(从随机化到因任何原因死亡的时间)。次要终点是ITT人群中中心审查的RECIST(1.1版)客观缓解率(ORR;完全和部分缓解的患者的比例)以及所有接受治疗的患者的安全性和耐受性。探索性终点包括无进展生存率2(从随机化到下一线治疗后任何原因导致的进展或死亡时间)、使用Nishino及其同事描述的免疫相关RECIST标准通过中心审查得出的无进展生存期、通过中心审查得出的RECIST(1.1版)缓解持续时间(从首次完全或部分缓解到首次疾病进展或因任何原因导致死亡的时间)以及与健康相关的生活质量(之前已报告)。方案中包含了一份完整的探索性终点列表(附录)。
统计分析
该方案规定了两次中期分析和一次最终分析。采用Maurer和Bretz的图示法严格控制1类错误,单侧α为2.5%。使用Lan-DeMets-O'Brien α分解函数确定成组序贯边界,以控制1类错误。
研究方案规定在第二次中期分析后12个月开展OS最终分析,比较帕博利珠单抗与化疗的优效性,在单侧α=1.25%、OS的风险比(HR)为0.62时计算所需样本量约为300。通过图表和分析方法检验OS的成比例风险假设。如果曲线不平行,则进行支持性分析,包括计算考虑不成比例的风险效应后的限制性平均生存时间。研究允许化疗组病人接受帕博利珠单抗交叉治疗,因此实际把握度可能低于计划。进一步基于等级结构保留失效时间模型及两阶段模型开展敏感性分析,分析交叉治疗作用下的调整OS,但未计算p值。由于第二次中期分析(PFS的最终分析)结果已证实了帕博利珠单抗组相对于化疗组PFS的优效性,最初分配给PFS的α传递至OS,权重为0.99,即第二次中期分析后12个月,帕博利珠单抗相对于化疗的OS优效性检验界值为单侧α=0.025,预计出现140个结局事件。帕博利珠单抗与标准化疗的PFS和OS采用log-rank检验,并基于Cox回归模型估计HR,采用Kaplan-Meier方法估计不同时点PFS和OS率。
ORR分析仅在PFS和OS无效假设被拒绝的情况下进行。没有基线后评估的患者被定义为不可评估。由于最终分析是在最后一位患者随机分配后至少3年完成的,因此报告了36个月时间点的事后生存和反应评估。在单侧α为2.5%,ORR值为19%的情况下,该研究中帕博利珠单抗与化疗相比优效的把握度为92%。
在ITT人群中评估OS、PFS、ORR和缓解持续时间。安全性分析包括随机分配并接受至少一剂研究治疗的所有患者。用于总体生存分析的预先指定的亚组类别包括年龄、地理区域、复发与新诊断的癌症、BRAF突变状态(野生型与BRAFV600E突变)、原发肿瘤的部位、肝或肺转移与其他转移以及手术患者与非手术患者。事后分析亚组包括性别、ECOG体力状况和KRAS或NRAS突变状态。在所有亚组中比较帕博利珠单抗与标准治疗的死亡HR用COX比例回归模型计算,用Efron的方法处理,以治疗为协变量。以治疗、年龄、性别、ECOG体力状况评分、地理区域、复发对比新诊断肿瘤、BRAF、KRAS或NRAS全部野生型对比BRAFV600E、BRAF、KRAS或NRAS全部野生型对比KRAS或NRAS突变、原发肿瘤部位、上述因素与治疗组的交互作用为协变量,计算交互作用双侧p值。正式的统计分析并没有预先指定不同亚组的总生存期,均报告名义p值。
完整的统计分析计划可在方案中获得。所有统计分析采用SAS(9.4版)软件。这项研究注册在ClinicalTrials.gov,NCT02563002。
资金来源的作用
这项研究的资助者参与了研究设计、数据解释和本报告的撰写,并维护了研究数据库。
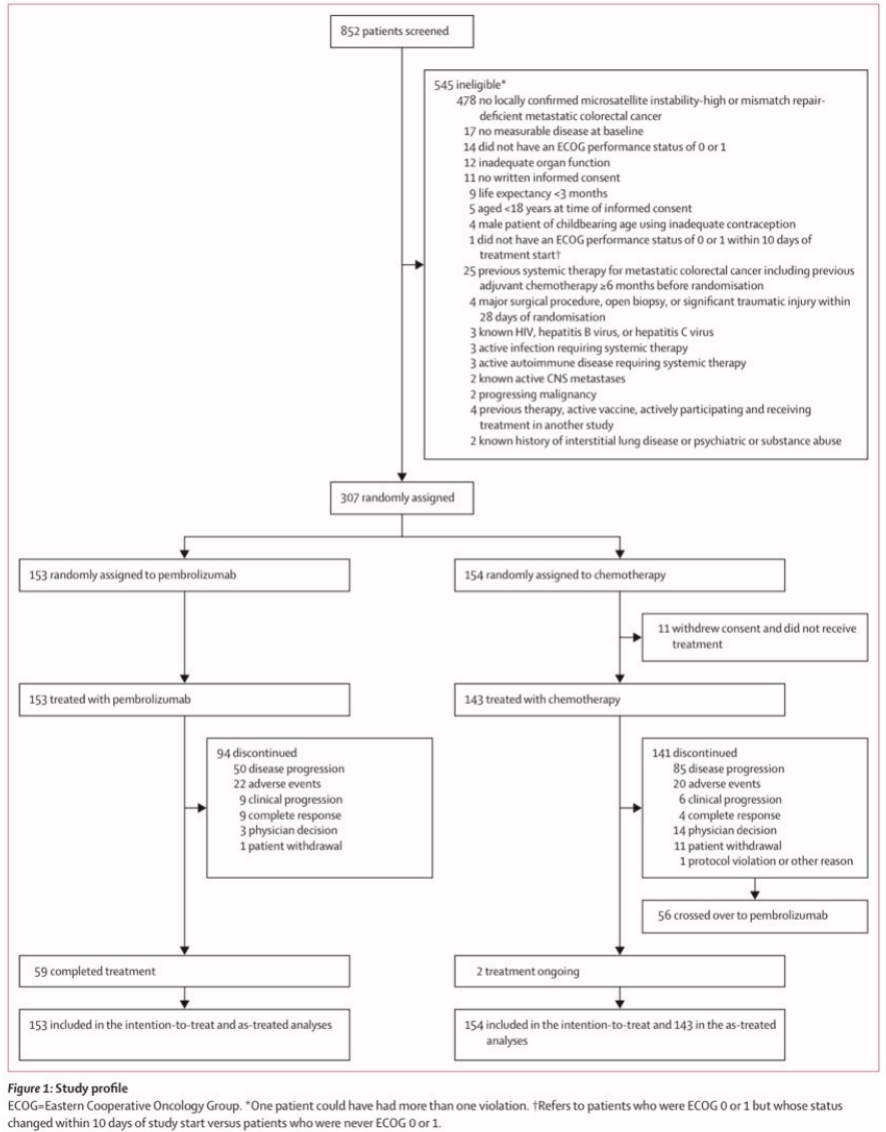
图1 研究概述
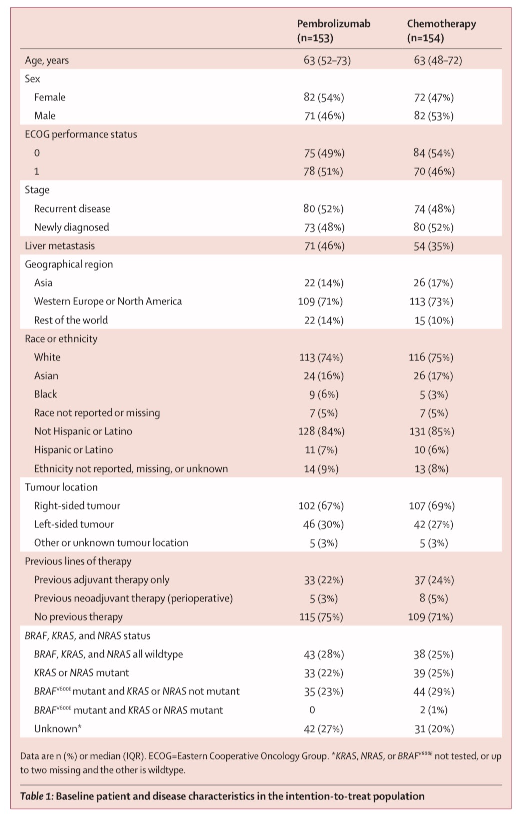
表1:ITT人群的基线患者和疾病特征
结果
这项研究筛选了852名患者,其中545名(64%)不符合纳入标准或符合排除标准,因此不符合入选条件(图1)。在2016年2月11日至2018年2月19日期间,307名患者被随机分配到接受帕博利珠单抗(n=153)或化疗(n=154)。人口统计特征和参与者基线特征先前已报道过7,并且总体上在治疗组之间很好地平衡。简而言之,患者的中位年龄为63岁(IQR50-73),209例(68%)患有右半结肠肿瘤,125例(41%)有肝转移,72例(24%)患有KRAS突变或NRAS突变肿瘤,81例(26%)患有BRAFV600E突变肿瘤(表1)。在数据截止点(2021年2月19日),从随机化开始的中位时间为44.5个月(IQR 39.7-49.8)。在最终分析中,帕博利珠单抗组有59名患者(20%)按方案完成了35个疗程;帕博利珠单抗组没有患者,化疗组有2名患者仍在接受一线治疗。
296名患者接受了至少一剂研究药物治疗:包括帕博利珠单抗组全部153人,化疗组154人中143人(93%)。帕博利珠单抗组和化疗组的中位治疗暴露时间分别为11.1个月(IQR 2.8-23.8)和5.7个月(2.7-11.2)。在ITT人群中,帕博利珠单抗组153名患者中的52名(34%)和化疗组154名患者中的121名(79%)接受了后续的抗癌治疗,其中包括56名(36%)的化疗组患者交叉至帕博利珠单抗治疗(附录p7)。在最终分析中,与化疗(中位数36.7个月[27.6-NR])相比,帕博利珠单抗(中位数未达到[NR;95%可信区间49.2-NR])的总生存期未达到优效性所需的单侧α边界0.025(HR0.74[0.53-1.03];p=0.036;图2)。307例患者中有140例(46%)死亡:帕博利珠单抗组153例患者中有62例(41%)死亡,化疗组154例患者中有78例(51%)死亡(图2)。在一项事后分析中,帕博利珠单抗组36个月总生存率估计为61.4%(95%可信区间53.2–68.6),化疗组为50.3%(42.0–58.0)。在数据截止时,154名患者中有56名(36%)在进展后从化疗组交叉至帕博利珠单抗组,另有37名(24%)在研究外接受了抗PD-1或抗PD-L1治疗,加起来ITT人群中共有93名(60%)(附录P7)。交叉人群包括11名分配至化疗组但在治疗前退出的患者中的6名(54%)。由于比例风险假设被违反,我们计算了经过36个月的随访后的估算总体受限平均生存时间,帕博利珠单抗组为26.6个月(95%可信区间24.4-28.7),而化疗组为25.0月(22.8-27.1),相差1.6个月(-1.4-4.6)。通过保秩结构失效时间模型进行预设的灵敏度分析来调整交叉效应,显示总生存期的HR为0.66(0.42–1.04),通过删失逆概率加权,总生存期的HR为0.77(0.44–1.38)。总生存期在大多数预设的和事后分析亚组中基本一致(图3)。
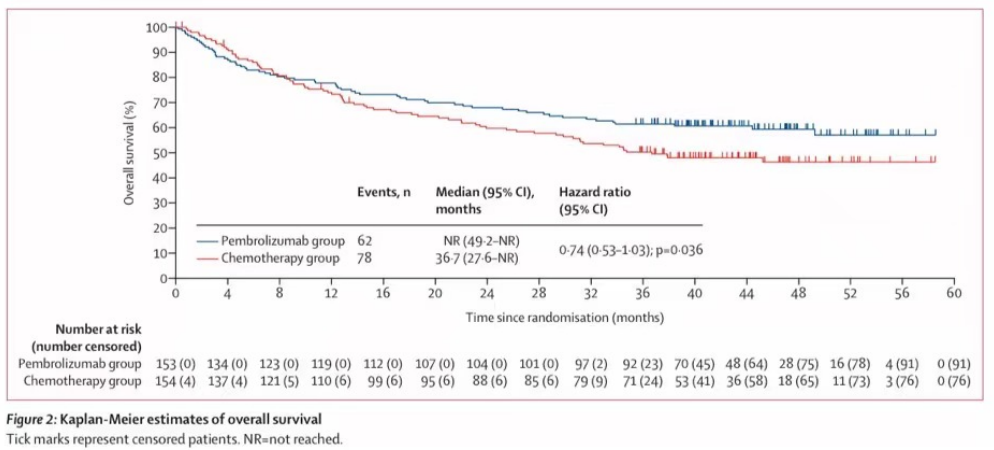
图2:kaplan-Meier 估算的总生存期
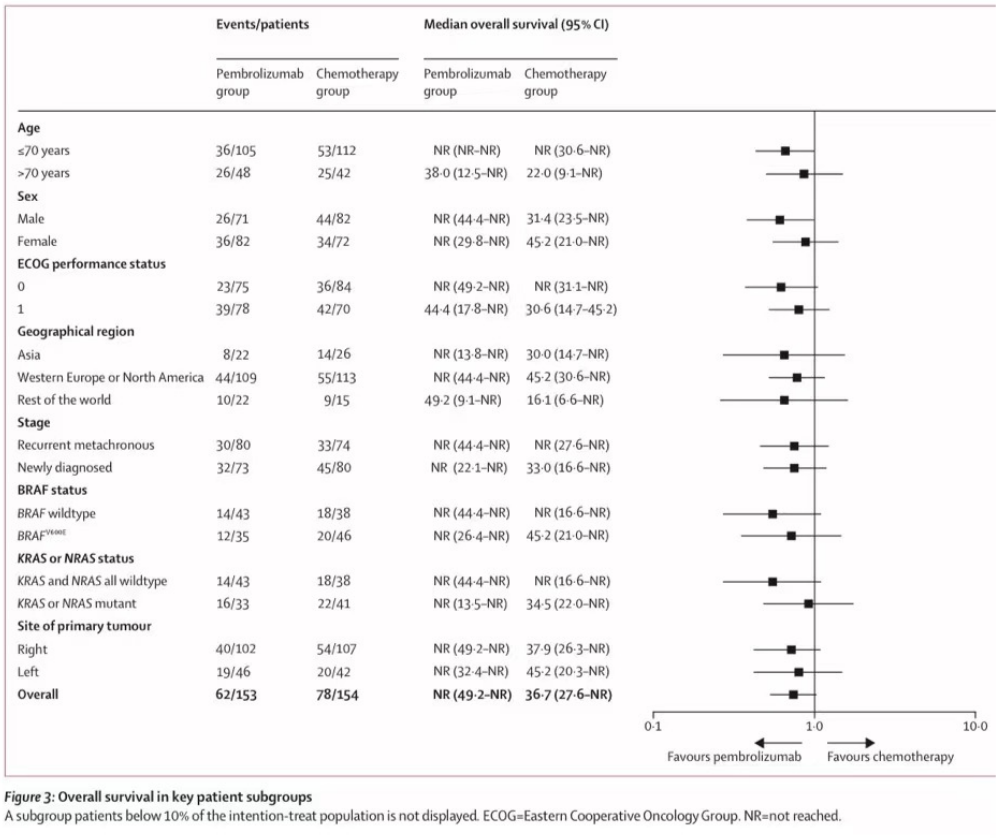
图3:关键亚组的总生存期
帕博利珠单抗与化疗相比,在第二次中期分析中达到了无进展生存率的优效性标准。同样,在最终分析中,帕博利珠单抗的中位无进展生存期(16.5个月[95%CI 5.4-38.1])长于化疗组(8.2个月[6.1-10.2]);然而,由于优效性在第二次中期分析中已达到,在最终分析中并未进行正式检验(HR 0.59[95%CI 0.45-0.79])。203名患者(66%)有疾病进展事件或死亡:帕博利珠单抗组153名患者中86名(56%),化疗组154名患者中117名(76%)。帕博利珠单抗的36个月无进展生存率估计为42.3%(95%置信区间34.0-50.4),而化疗为11.1%(6.1-17.9%)(事后分析)。帕博利珠单抗的无进展生存期2(从随机到下一线治疗进展的时间)(中位数54·0个月[95%CI 44.4-NR])长于化疗(中位数24.9个月[16.6~32.6];HR 0.61[95%CI 0.44~0.83];p=0.0008;图4A)。163名患者(53%)在下一线治疗中出现进展或死亡:帕博利珠单抗组153名患者中68名(44%),化疗组154名患者中95名(62%)。在一项事后分析中,帕博利珠单抗组估计的36个月无进展生存率2为60%(95%CI 51.3~66.8%),而化疗组为39%(30.6%~46.3%)。帕博利珠单抗组中的84例(55%)和化疗组中的117例(76%)患者中,免疫相关RECIST标准判定的中位无进展生存期分别为帕博利珠单抗21.9个月(95%可信区间9.1~41.7)和化疗8.6个月(6.3~10.6个月)。
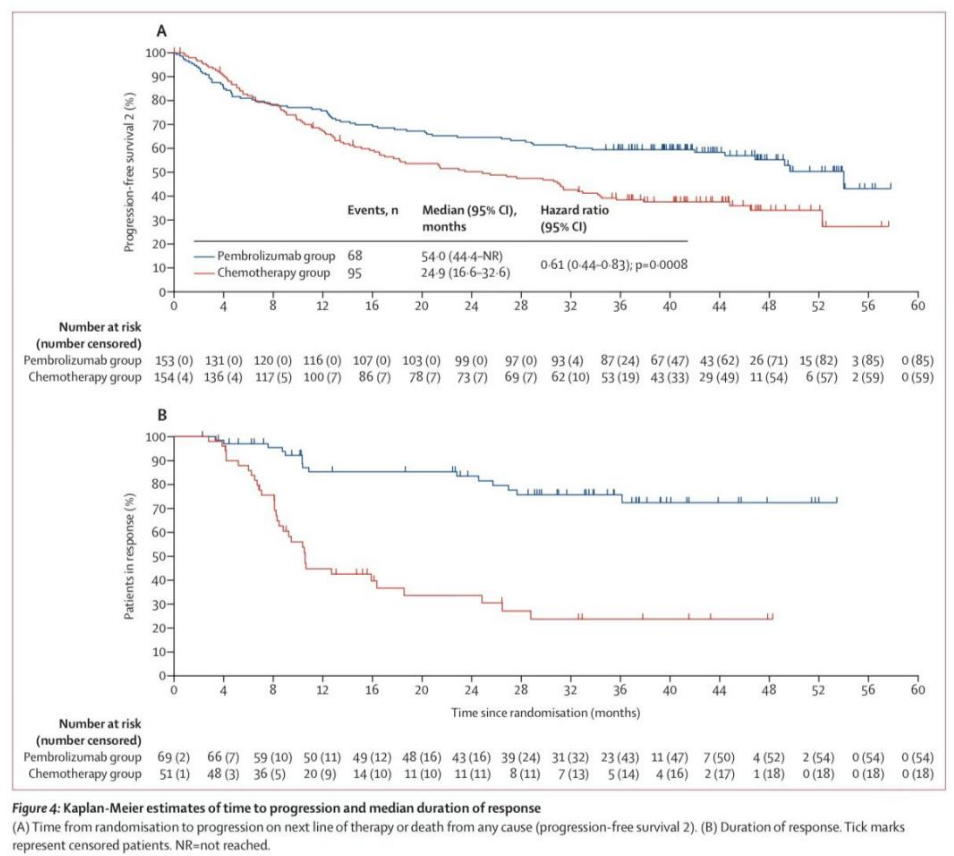
图4:kaplan-Meier 估算的至进展时间和中位缓解持续时间
153例患者中69例(45%[95%置信区间37-53])对帕博利珠单抗有客观缓解,而154例化疗患者中51例(33%[26-41])有客观缓解(附录p8)。在最终分析中,帕博利珠单抗有20例(13%)完全缓解,而化疗有6例(4%),而在先前的中期分析中观察到有17例(11%)和6例(4%)完全缓解。与化疗组10.6月(8.1-28.8)相比,帕博利珠单抗的中位缓解持续时间(IQR 36·1-NR)未达到。36个月后,帕博利珠单抗组76%(95%置信区间62-85)的患者持续有效,而化疗组患者持续有效的比例为24%(12-38)(事后分析;附录第8页)。
在33名患者中发生了重要的方案偏差(帕博利珠单抗组的153名患者中有17名患者[11%],化疗组的143名患者中有16名患者[10%]),其中包括与研究停止治疗标准相关的偏差(5名[3%]接受帕博利珠单抗治疗的患者和1名[1%]接受化疗的患者),与纳入和排除标准相关的的偏差(1名[1%]接受帕博利珠单抗治疗的患者和1名[1%]接受化疗的患者),以及安全事件报告或安全随访方面的偏差(10名[7%]接受帕博利珠单抗治疗的患者和14名[9%]接受化疗的患者)。这些患者也纳入了分析。
讨论
在随机、3期KEYNOTE-177研究的最终分析中,帕博利珠单抗对比化疗治疗微卫星高度不稳定或错配修复缺陷的转移性结直肠癌的总体生存期没有显著性差异。
在第二次中期分析中观察到的帕博利珠单抗与化疗相比的无进展生存获益在最终分析中也被发现,与化疗组相比,帕博利珠单抗组36个月存活和无进展的患者比例更高。正如在之前的中期分析中所观察到的,无进展生存期的Kaplan-Meier曲线在最初有交叉,该交叉可能反映了原发性耐药、pMMR及微卫星稳定疾病的误诊以及假性进展等混合因素,之后我们看到了帕博利珠单抗优于化疗的曲线分离,表明帕博利珠单抗具有长期获益。帕博利珠单抗组的缓解时间持续更久,且与化疗相比,帕博利珠单抗组的完全和部分缓解率更高。这些数据支持FDA和EMA批准帕博利珠单抗作为微卫星高度不稳定或错配修复缺陷的转移性结直肠癌患者的一线治疗。
帕博利珠单抗未取得显著性的总体生存获益可能与KEYNOTE-177的交叉设计有关。在最终分析中,只有两名患者仍在接受化疗,154名随机分配到化疗组的患者中,有56名(36%)达到了交叉标准,并接受了帕博利珠单抗治疗。此外,37名患者(24%)接受了研究外抗PD-1或抗PD-L1治疗,有效交叉率为60%。这种高的交叉率可能有助于提高化疗组的总生存期。这一人群还包括最初被分配接受化疗但拒绝接受治疗的11名患者中的6名(55%),他们改用研究外的抗PD1治疗。
这项研究的几个潜在局限性可能影响了结果,例如在随机分组之前患者当地检测错配修复缺陷或微卫星高度不稳定状态的结果并未被中心审查。该方案允许的化疗方案和靶向药物的差异可能导致接受标准化疗治疗组的不同结果。此外,RECIST(1.1版)评估可能没有考虑假性进展。最后,本研究中总体交叉率较高,在随后接受抗PD-1或抗PD-L1治疗的患者中有24%是在研究之外接受的,这可能影响了解释总体生存结果的效力。
在之前的一项研究中,以一线氟尿嘧啶为基础的治疗方案,联用或不联用抗EGFR或抗VEGF治疗,对于错配修复缺陷型转移性结直肠癌患者的总生存期中位数为13.6个月。在本研究中调整交叉后,与本研究中的化疗相比,帕博利珠单抗对总生存期的HR仍然显示出获益,尽管95%的CI仍然超过1.0。当比例风险假设被违反时,进行的补充性受限平均生存时间分析也有利于帕博利珠单抗,再次表明帕博利珠单抗与化疗相比有生存获益。这一生存益处在大多数预先设定的亚组中大体一致。然而,这项研究并没有解决亚组之间的任何差异,包括RAS或BRAF突变患者之间的差异,如跨越1.0的宽置信区间所示。总的来说,这些数据为PD-1抑制剂在微卫星高度不稳定或错配修复缺陷转移性结直肠癌一线治疗中的获益提供了证据。多项目前进行的研究正在测试在PD-1或PD-L1抑制剂的基础上增加化疗或CTLA-4抑制剂对微卫星高度不稳定或错配修复缺陷转移性结直肠癌患者的益处,包括COMMIT(NCT02997228)、CA209-8HW(NCT04008030)和MK-1308A-008(NCT04895722)研究。
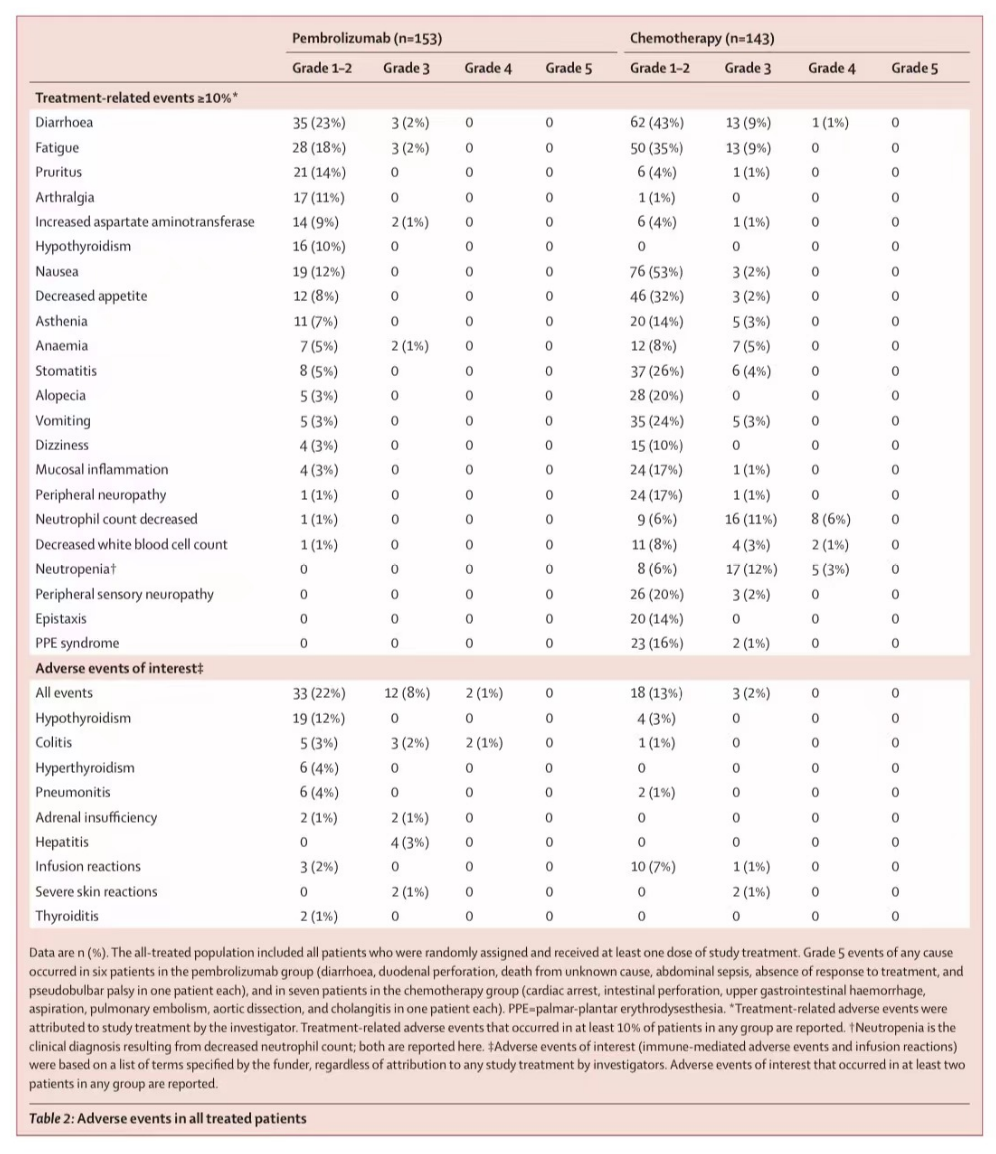
表2:所有接受治疗患者中的不良事件
在最终分析中观察到的显著更长的无进展生存期和持久缓解支持了最初看到的帕博利珠单抗与化疗相比的无进展生存期的获益。此外,与化疗相比,帕博利珠单抗的许多客观缓解程度更深且更持久。在中期分析后的另外12个月的随访中,接受帕博利珠单抗客观有效的患者的比例从44%改善到最终分析时的45%,而接受化疗的患者比例为33%(与第二次中期分析没有变化),同时,帕博利珠单抗组缓解时间没有达到,而化疗组为10.6个月。对两组接受后续治疗的患者从随机化到下一线治疗进展或因任何原因死亡的时间(无进展生存期2)的分析表明,使用帕博利珠单抗的患者的无进展生存期2至少是化疗的两倍,这表明帕博利珠单抗在这些患者的一线治疗中提供了最大的获益。这种改善不太可能是由于免疫治疗相关的假性进展,因为假性进展的大量发生会降低疗效,鉴于这批患者可能会停止治疗。此外,如前所述,与化疗相比,帕博利珠单抗单药治疗给微卫星高度不稳或错配修复缺陷的转移性结直肠癌患者带来了有临床意义的健康相关的生活质量改善。
在最终分析中观察到的安全性数据特征与先前在初步分析中发表的一致,也与在多种肿瘤类型中使用帕博利珠单抗观察到的一致。接受化疗的患者发生 任何原因的、治疗相关不良事件、3级以上治疗相关不良事件的比例较高,接受帕博利珠单抗的患者报告免疫相关不良事件和输液反应的比例较高。
尽管帕博利珠单抗没有总体的生存获益,但这些数据支持了先前的发现,即帕博利珠单抗单药一线治疗在微卫星高度不稳定或错配修复缺陷转移性结直肠癌患者中提供了持久的抗肿瘤获益,包括无进展生存期更长,达到客观缓解和完全缓解的患者比例更高,与治疗相关的不良事件相比化疗更少。
专家简介
方雨露
中国科学院大学附属肿瘤医院-温州医科大学联合培养硕士研究生
史钟
中国科学院大学附属肿瘤医院结直肠内科 副主任医师 硕士生导师
临床医学&肿瘤学博士(浙江大学-美国Baylor医学院联合培养)
浙江省抗癌协会肿瘤内科专业委员会,青年委员
中国老年学及老年医学学会转化医学分会,委员
广东省自然科学基金评审专家库成员
主要从事消化道肿瘤的临床诊治及基础研究,主持国家自然科学青年基金、浙江省自然科学基金项目及浙江省医药卫生科技计划项目等多项研究课题,并发表多篇相关论文。













 苏公网安备 32059002004080号
苏公网安备 32059002004080号


